エチレングリコールエーテル類には,実験動物における生殖発生毒性や血液毒性が報告されている.本被験物質の構造類似物であるエチレングリコールモノメチルエーテルやエチレングリコールモノエチルエーテルにおいては,精巣重量の低下やパキーテン期精母細胞を中心とした精子形成障害の起こることが報告されており1),マウスではエチレングリコールモノブチルエーテルやエチレングリコールモノフェニルエーテルにおいて妊娠率の低下が報告されている2).また,エチレングリコールモノブチルエーテルでは1腹児数の低下が報告されている2).
今回,雌雄のSprague-Dawley系[Crj:CD(SD)IGS,SPF]ラットを用いて,2-(1-メチルエトキシ)エタノールの生殖毒性について検討した.ラットには交配前2週間および交配期間ならびに雄では交配終了後剖検前日まで,雌では妊娠期間を通して哺育3日まで,2-(1-メチルエトキシ)エタノールの0,8,30および125 mg/kgを強制経口投与した.試験結果は以下の様に要約される.
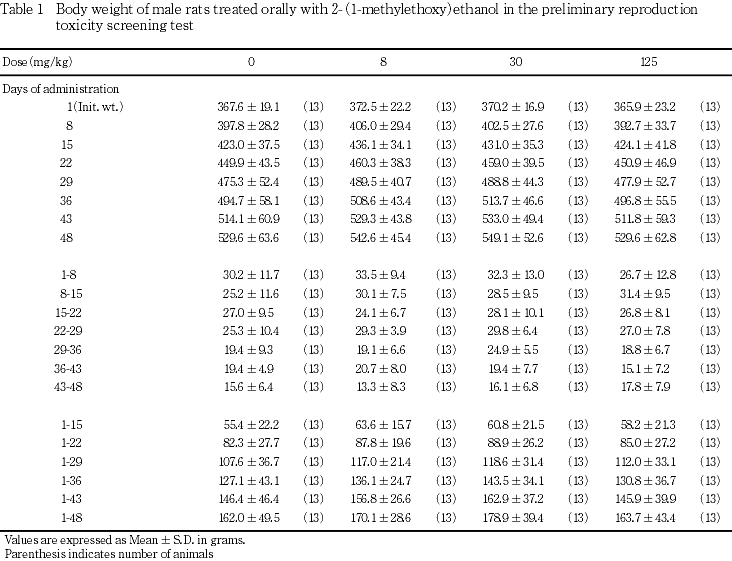
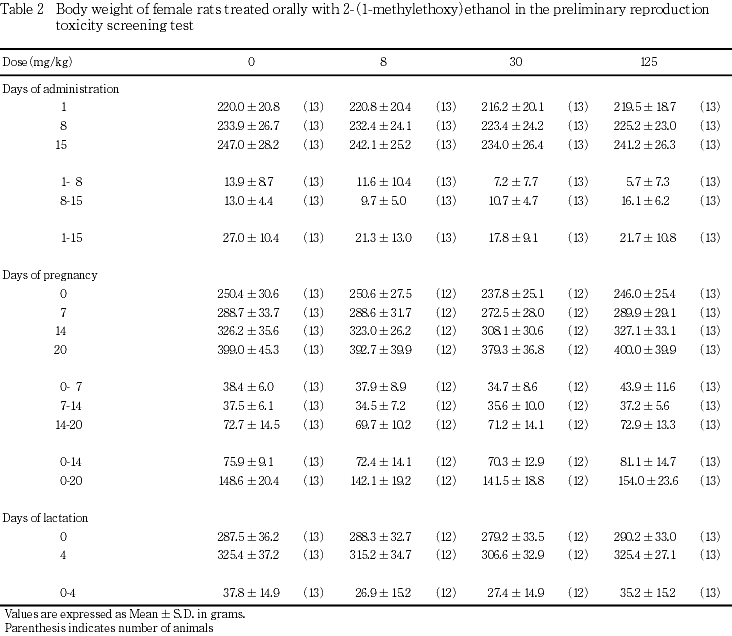
出生児の生存および体重には,2-(1-メチルエトキシ)エタノール投与の影響は認められなかった.
投与検体は,必要量の2-(1-メチルエトキシ)エタノールを秤量し,媒体である日局注射用水(製造番号:9912ST,光製薬(株))で溶解した後,段階希釈して調製した.調製した検体は冷蔵下で暗所に保存し,被験物質の0.05および40.0 w/v%の調製検体の冷蔵下での8日間の安定性が確認されていることから,調製後1週間以内に使用した.試験中に調製した各濃度の投与検体には,所定濃度の2-(1-メチルエトキシ)エタノールが含有されていることを確認した.
動物は,照明12時間(7時〜19時点灯),換気回数約15回/時,許容温度21.0〜25.0 ℃,許容湿度40〜75 %に制御された飼育室で,金属製金網床ケージに1匹ずつ(交配時は2匹/ケージ)収容し,固型飼料(CE-2,日本クレア(株))および水道水(秦野市水道局給水)を自由に摂取させて飼育した.ただし,妊娠14日(交尾確認日=妊娠0日)以降は紙パルプ製チップ(ペパークリーン,日本エスエルシー(株))を入れたプラスチック製ラット用繁殖ケージに個別に収容した.
各用量の投与は,雄に対しては交配前2週間,交配期間(最長2週間)を通して剖検前日まで(総投与回数48回),雌に対しては交配前2週間および交配期間(最長2週間),さらに交尾した雌では妊娠期間を通して哺育3日(分娩日=哺育0日)まで(投与回数41〜47回),交尾は認められたものの,分娩のみられなかった雌は妊娠25日相当日まで(投与回数43〜44回)とし,1日1回,9時から12時の間にラット用胃管を用いて強制的に経口投与した.投与容量は体重1 kg当たり5 mLとし,最新の測定日の体重を基に算出した.
雌雄とも全例について飼育期間中,毎日1回以上,投与期間中は投与前後の毎日2回以上観察した.
B. 体重測定
雄では全例について投与1(投与初日),8,15,22,29,36,43日および解剖日に,雌は全例について投与1,8,15日に測定し,交配までに期間を要した雌では投与22日にも体重を測定した.また,交尾を確認した雌では妊娠0,7,14および20日に,分娩した雌では,哺育0および4日に体重を測定した.さらに,交尾が認められなかった雌は投与36,43および50日ならびに解剖日に体重を測定した.
C. 摂餌量測定
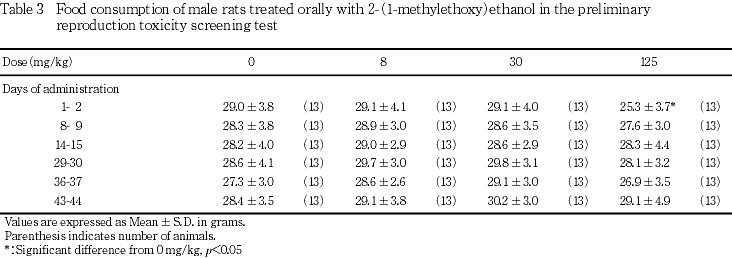
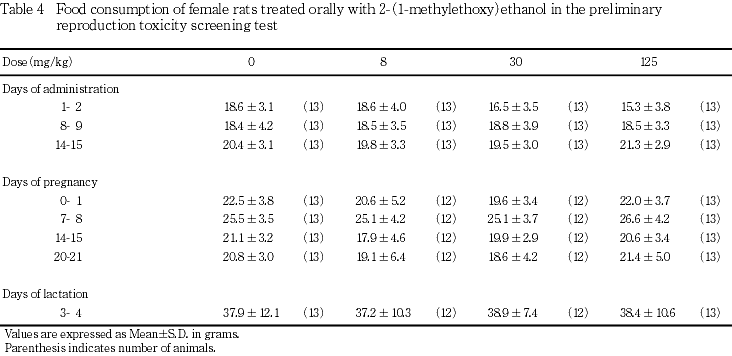
投与期間中(交配期間を除く)週1回,体重測定日と同じ日に給餌量を測定し,その翌日に残餌量を測定し,1日の摂餌量を算出した.なお,投与15日は交配の開始日であるため前日からの摂餌量を算出した.交尾が確認された雌では妊娠0,7,14および20日,分娩した雌では哺育3日の翌日までの摂餌量を測定した.
D. 性周期
全例の雌について予備飼育期間中に引き続いて投与開始日以降も,毎日,交尾成立日まで継続して腟垢標本を作製した.膣垢像より性周期を観察し,平均発情日数を算出した.
E. 交配
交配は,投与15日の夕方から最長2週間,同群内の雌雄について1対1で同居させて行った.交尾の確認は,毎朝,腟垢標本中の精子の存在あるいは腟栓の確認により行い,交尾が確認された雌は,その日を妊娠0日と起算して雄から分離し,個別に飼育した.交配の結果から,各群について交尾率((交尾確認動物数/交配動物数)× 100),受胎率((受胎動物数/交尾確認動物数)× 100),同居開始日から交尾までに要した日数およびその間に回帰した発情期の回数を求めた.
F. 分娩・哺育状態の観察
交尾を確認した雌は,全例を自然分娩させた.分娩状態が直接観察できた動物についてはその状態を観察し,直接観察できなかった動物についても,分娩後の徴候から分娩困難や遅延などの分娩障害の有無を判断して記録した.分娩の確認は,午前9時から11時の間に行い,この時間帯に分娩が終了していることを確認した動物については,その日を分娩日と規定した.午前11時を過ぎてから分娩を終了した動物は翌日を分娩日とした.分娩を確認した全例について妊娠期間(妊娠0日から分娩日までの日数)を算出し,出産率((生児出産雌数/受胎動物数)× 100)を各群について求めた.分娩後は哺育状態を毎日観察した.
G. 剖検・病理組織学検査
雄動物は,投与48日の翌日に,致死量のペントバルビタールナトリウム麻酔下で放血・致死させて剖検し,器官,組織の肉眼的観察を行った.その際,脾臓,精巣および精巣上体の重量を測定した.また,脾臓,前立腺腹葉および凝固線を含む精嚢は0.1 Mリン酸緩衝10 %ホルマリン溶液に,精巣および精巣上体はブアン液に固定した.このうち,高用量群および対照群の精巣および精巣上体は,常法に従ってパラフィン切片とし,ヘマトキシリン-エオジン染色を行って,病理組織学検査を実施した.
雌動物のうち,分娩した雌は哺育4日に,交尾はしたが分娩しなかった雌は妊娠26日相当日にそれぞれ致死量のペントバルビタールナトリウム麻酔下で放血・致死させて剖検した.その際,脾臓,卵巣および子宮・膣を摘出し,脾臓については重量を測定した.また,卵巣については実体顕微鏡下で妊娠黄体数を,子宮については着床数を数え,着床率((着床数/妊娠黄体数)× 100)を算出した.また,脾臓,卵巣,子宮および腟は0.1 Mリン酸緩衝10 %ホルマリン溶液に固定し,卵巣については高用量群および対照群について病理組織学検査を実施した.また,雌雄とも,剖検時に異常の認められた器官についても0.1 Mリン酸緩衝10 %ホルマリン溶液に固定し,病理組織学検査を実施した.
哺育0日に産児数(生児 + 死亡児)を調べて,分娩率((産児数/着床痕数)× 100)および生児出産率((出産生児数/着床痕数)× 100)を求めた.また,産児は外表奇形の有無を検査した.
哺育0日以降は死亡児数を毎日調べ,出生率((出産生児数/産児数)× 100)および新生児の4日の生存率((哺育4日の生児数/哺育0日の生児数)× 100)を求めた.観察可能な死亡児は剖検し,異常の有無および内部器官の肉眼的観察を行うとともに,0.1 Mリン酸緩衝10 %ホルマリン溶液に固定した.
B. 体重
哺育0および4日に個体別に体重を測定した.
C. 剖検
出生児は哺育4日に全例をエーテル吸入により致死させて剖検し,外表および内部器官の肉眼的観察を実施した.
一般状態の変化として,初回投与日の投与後約4時間後から赤色尿が観察され,翌朝の投与前までに125 mg/kg投与群の雄の7例,雌の全例および30 mg/kg投与群の雌の1例に認められたが,投与2日以降に血尿は観察されなかった.この他に,8 mg/kg投与群の雌の1例に両前肢の脱毛が観察された.

雌では,30 mg/kg投与群において腺胃粘膜に限局的な肥厚あるいは右肺に黒色斑が各1例,8 mg/kg投与群の1例に局所的な脱毛が観察された.
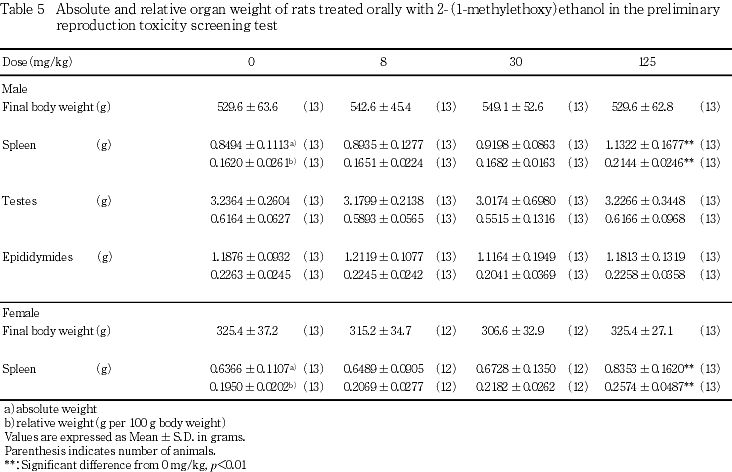
雌では,125 mg/kg投与群および対照群の卵巣に異常は認められなかった.また,剖検時に病変が認められた胃および肺ならびに皮膚の脱毛部に組織学的な異常所見は認められなかった.
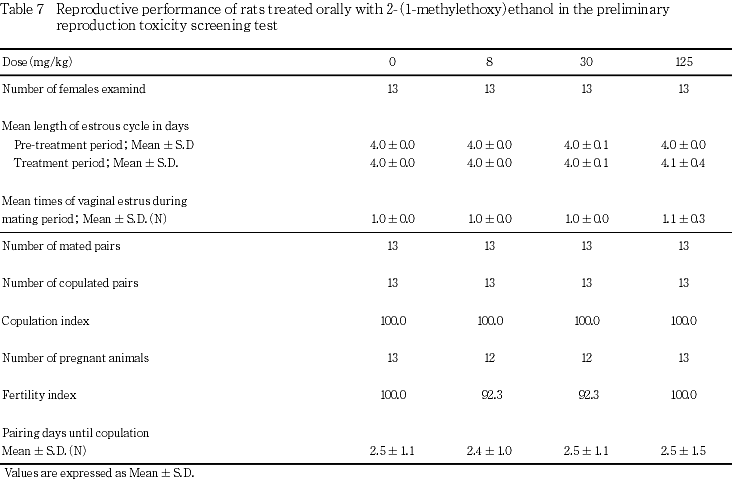
出産率には被験物質投与の影響を示唆する変化はみられなかった.
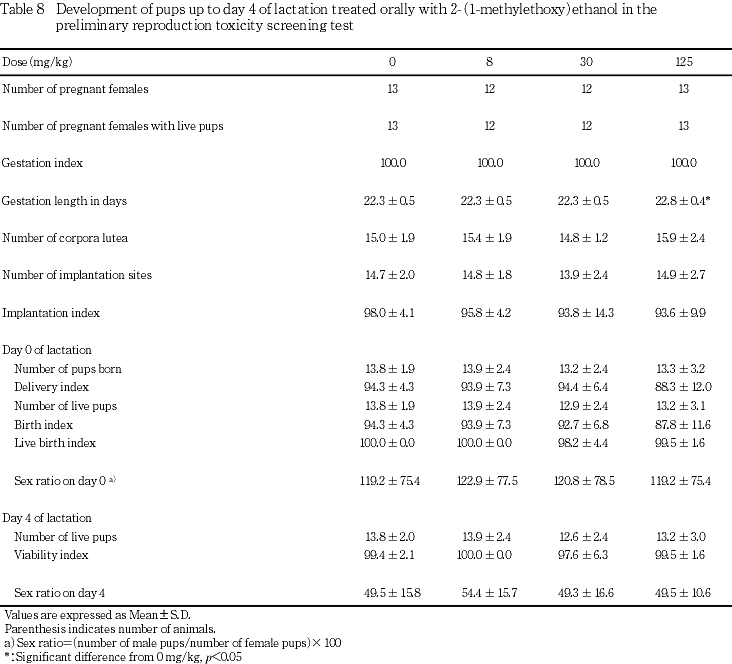
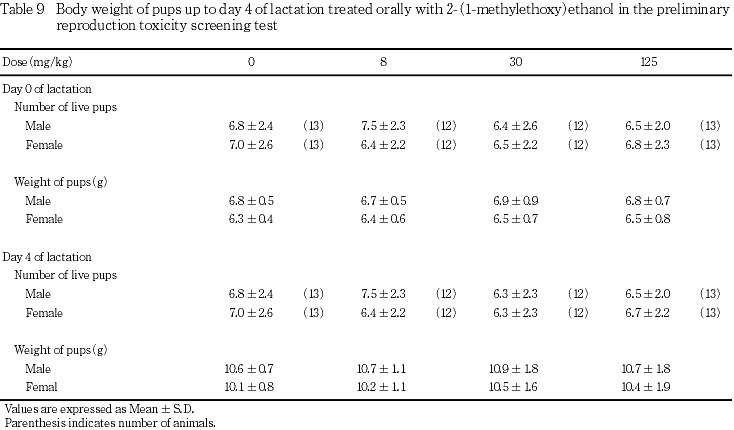
8および30 mg/kg投与群において矮小児が各1例認められたが,いずれも哺育4日まで生存し,剖検においても異常は認められなかった.
30 mg/kg投与群において死亡児が散見され,1例では短尾が観察されたが,125 mg/kg投与群の生存児の観察では同様の異常は認められないこと,また,予備試験において実施した250 mg/kgまでの被験物質投与において異常児は認められていないことから,自然発生的な異常と判断された.この他の死亡児についておこなった剖検では異常は認められなかった.
その結果,雌雄ともに,一般状態の変化として雄の125 mg/kg投与群,雌の30 mg/kg以上の投与群において,初回投与後約4時間後から翌朝にかけて赤色尿が観察された.赤色尿は本試験における投与量を設定する目的で実施した予備試験の雄の125 mg/kg以上の投与群,雌の62.5 mg/kg以上の投与群でも観察され,本被験物質の28日間反復経口投与毒性試験3)の500 mg/kg投与群においても認められている.反復投与毒性試験の初回投与後に行われた尿検査では潜血反応がみられ,投与期間終了時の血液学検査では,赤血球数,ヘモグロビン濃度,ヘマトクリット値の低下がみられている.また,血尿は本被験物質のラットにおける吸入曝露による毒性試験においても認められており被験物質の投与による影響と考えられる4).反復投与毒性試験の血液学検査において投与期間終了時には,用量依存的に赤血球数,血色素濃度ならびに平均赤血球血色素濃度の低下等の貧血状態が認められ,網状赤血球比率の増加が認められている.さらに,投与期間終了時の解剖において脾臓ではヘモジデリンの沈着が認められ,肝臓や脾臓などでは髄外造血が起こっていた.5種のエチレングリコールのモノアルキルエーテルにおける溶血作用について検討したWernerらの報告によれば5),ブチルエーテルやノルマルプロピルエーテルとならんで,本試験の被験物質である2-(1-メチルエトキシ)エタノール(別名エチレングリコールイソプロピルエーテル)では,赤血球数ならびにヘモグロビン濃度の低下が最初の観察時期である投与1週間目には著明に認められており,その時期に合わせて網状赤血球の増加がみられる.さらに,エチレングリコールモノブチルエーテルにおいても溶血性貧血が認められており6, 7),この物質においてはその酸化代謝物であるエチレングリコールモノブチルエーテルに溶血作用の主体があることが,in vivoあるいはin vitro的手法によって明らかになっている8-11).Millerらによれば,本被験物質の主要な排泄は尿中に起こり,尿中代謝物は主にイソプロポキシアセテートならびにそのグリシン抱合体であることがあきらかになっていることから12),本試験の被験物質である2-(1-メチルエトキシ)エタノールが酸化による代謝をうけ,他のエチレングリコールモノアルキルエーテルと同様の機序で溶血性貧血を起こし,血色素尿を示した可能性が高い.
雌雄ともに125 mg/kgの2-(1-メチルエトキシ)エタノール投与により脾臓の重量が増加し,雄の剖検では脾臓の腫大も観察され,病理検査では髄外造血および褐色色素の沈着が認められた.溶血性疾患では脾臓重量の増加や髄外造血が認められることが知られている.本試験において観察された脾臓重量の増加や髄外造血も2-(1-メチルエトキシ)エタノールの投与による溶血が原因と考えられる.
本試験においては,雌の性周期,雌雄の交尾,受胎能および妊娠期間に被験物質投与の影響を示唆する変化は認められず,また,出生児の生存,体重ならびに形態観察においても,被験物質投与の影響を示唆する変化は認められなかった.
本被験物質の類似物質であるエチレングリコールモノメチルエーテル,エチレングルコールモノエチルエーテル,エチレングリコールモノメチルエーテルアセテート,エチレングルコールモノエチルエーテルアセテート,ジエチレングリコールジメチルエーテルならびにジエチレングリコールモノエチルエーテルにおいては精巣毒性あるいは不妊といった生殖毒性が引き起こされることがすでに報告されており13),CD-1マウスで連続交配試験を実施した結果,エチレングリコールモノブチルエーテルやエチレングリコールモノフェニルエーテルにおいても妊娠率の低下がみられ,エチレングリコールモノブチルエーテルでは高用量群で1腹児数の低下が認められている14).一方,精巣重量の低下はエチレングリコールやプロピレングリコール,プロピレングリコールモノメチルエーテル,ジエチレングリコールモノエチルエーテルでは認められないことも知られている15, 16).長野らによるマウスでの検討によれば,エチレングリコールモノアルキルエーテルの精巣毒性はアルキル基の種類によって異なり,分子量が大きくなるほど弱くなった17).この精巣重量の低下は精子形成障害によるものであり,この精子形成障害はパキテン期精子細胞に最も強く起こることが明かになっている18).長野らによれば,この精子形成障害は細胞分裂に対する障害によるものと推定されているほか17),エチレングリコールモノメチルエーテルによる精巣毒性が,カルシウムブロッカーであるベラパミルによって軽減するとする報告や19),エチレングリコールモノメチルエーテルを投与された動物の精巣中の亜鉛量が減少するとした報告等がみられる20).
ラットにおいてピラゾールにより代謝阻害を起こさせた状況では,エチレングリコールモノメチルエーテルによる精巣毒性が減弱することが明らかになっており,精巣毒性はその主要尿中代謝物であるエチレングリコールモノメチルエーテルアセテートによるものであることが示唆されている21).エチレングリコールモノメチルエーテルアセテート,エチレングリコールモノエチルエーテルアセテートならびにエチレングリコールモノブチルエーテルアセテートを用いたin vitroの検討でも,これらの物質によるパキテン期細胞の直接の障害性ならびに分子量による毒性の差が再現されている22).前述の通り,本被験物質の主要な尿中代謝物はエチレングリコールイソプロピルエーテルアセテートならびにそのグリシン抱合体であることから12),本被験物質がエチレングリコールモノエチルエーテルの水素1個がメチル基に置換されたものであることを考えると,本被験物質が精巣毒性を示す可能性は充分あると考えられた.
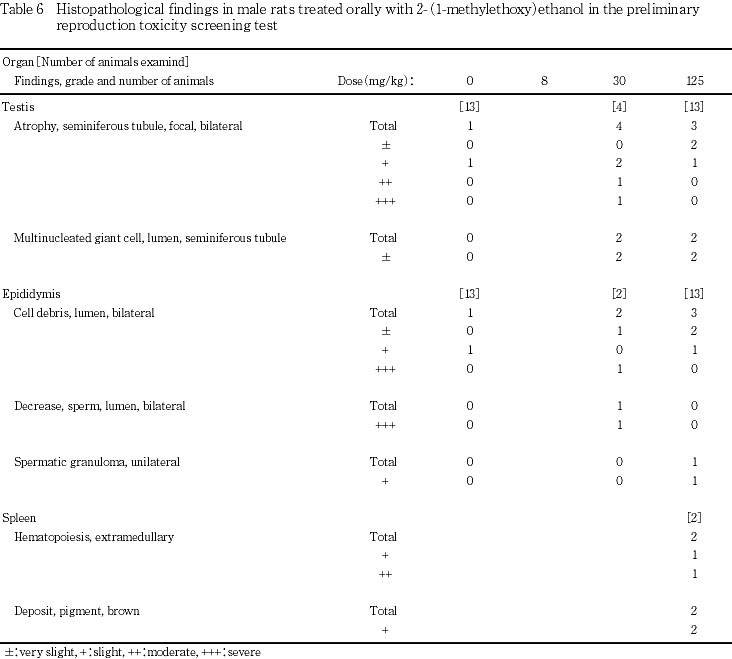
本被験物質については,これらの情報から,予備試験において雄ラットに125,250および500 mg/kgを2週間にわたって投与し,精巣の病理組織学検査を実施したが,異常は認められていない.また,本試験においても125 mg/kgまでの投与量では,交配成績,生殖器ならびに副生殖器についての病理組織学検査を実施したが,いずれも異常を認めなかった.30 mg/kg投与群の4例に精巣の両側性の小型化が認められ,そのうちの2例では精巣上体に両側性の小型化が認められたが,125 mg/kg投与群においては変化がみられず,精巣ならびに精巣上体重量,交尾率および受胎率には変化が認められていない.以上の結果から,2-(1-メチルエトキシ)エタノールにおいては生殖毒性は認められないものと判断した.
一方,エチレングリコールモノメチルエーテルには,精巣毒性とともに胎児毒性があることが知られており,長野らはICR系マウスにおいて妊娠7日から14日に投与するとき23),生存胎児数の減少,外脳症ならびに四肢奇形,肋骨ならびに中軸骨格系の異常,化骨の遅延を報告している.また,エチレングリコールモノメチルエーテルやエチレングリコールジメチルエーテル,エチレングリコールモノエチルエーテルやその主な代謝物であるエチレングリコールモノエチルエーテルアセテートなどにおいては,催奇形性が認められ13),さらに,胎齢9.5日からの全胚培養法を用い,エチレングリコールモノメチルエーテル,エチレングリコールモノエチルエーテル,エチレングリコールモノブチルエーテル,エチレングリコールモノメチルエーテルアセテート,エチレングリコールモノエチルエーテルアセテートならびにエチレングリコールモノブチルエーテルアセテートの6化合物について行なわれた検討では24),アセテート化合物の胎児毒性はエーテル化合物のそれよりも強く,また鎖が長くなるほど弱くなることが,明らかになっている.
本被験物質の予備試験において妊娠ラットに62.5,125あるいは250 mg/kgを妊娠期間を通して投与し,分娩ならびに児の観察を行なったが,異常は発見されていない.また,本試験において8,30ならびに125 mg/kgのいずれの投与群にも,発生毒性はみられていない.
以上の結果から,本試験条件下における2-(1-メチルエトキシ)エタノールの親動物に対する無作用量は,雄に対しては30 mg/kg/day,雌に対しては8 mg/kg/day,ただし親動物の生殖能力に対する無作用量は125 mg/kg/dayと考えられ,出生児に対する無作用量は125 mg/kg/dayと考えられた.
| 1) | P. M. D. Foster, D. M. Creasy, J. R. Foster, et. al, Toxicol. Appl. Pharmacol., 69, 385(1983). |
| 2) | R. E. Morrissey, J. C. Lamb IV, R. W. Morris, et al, Fundam. Appl. Toxicol., 13, 747(1989). |
| 3) | 高島宏昌,佐藤昌子,渡辺千朗ら,化学物質毒性試験報告書,10, 117(2003). |
| 4) | J. H. E. Arts, P. G. J. Reuzel, R. A. Woutersen, et al, Inhal. Toxicol., 4, 43(1992). |
| 5) | H. W. Werner, C. Z. Nawrocki, J. L. Mitchell, et al, J. Ind. Hyg. Toxicol., 25, 374(1943). |
| 6) | C. P. Carpenter, U. C. Pozzani, C. S. Weil, et al, Arch. Ind. Health, 14, 114(1956). |
| 7) | B. I. Ghanayem, S. M. Ward, P. C. Blair, et al, Toxicol. Appl. Pharmacol., 106, 341(1990). |
| 8) | F. G. Bartnik, A. K. Reddy, G. Klecak, et al, Fundam. Appl. Toxicol., 8, 59(1987). |
| 9) | B. I. Ghanayem, Biochem. Pharmacol., 38, 1679(1989). |
| 10) | B. I. Ghanayem, L. T. Burka, H. B. Matthews, J. Pharmacol. Exp. Ther., 242, 222(1987). |
| 11) | B. I. Ghanayem, L. T. Burka, H. B. Matthews, Chem. -Biol. Interact., 70, 339(1989). |
| 12) | R. R. Miller, Drug Metab. Rev., 18, 1(1987). |
| 13) | B. D. Hardin, Toxicology, 27, 91(1983). |
| 14) | R. E. Morrissey, J. C. Lamb IV, R. W. Morris, et al, Fundam. Appl. Toxicol., 13, 747(1989). |
| 15) | H. J. Morris, A. A. Nelson, H. O. Calvery, J. Pharmacol. Exp. Ther., 74, 880(1941). |
| 16) | R. R. Miller, J. A. Ayres, L. L. Calhoun, et al, Toxicol. Appl. Pharmacol., 61, 368(1981). |
| 17) | 長野嘉介,中山栄基,小谷野道子ら,産業医学,21, 29(1979). |
| 18) | D. Anderson, M. H. Brinkworth, P. C. Jenkinson, et al, Teratog., Carcinog. Mutag., 7, 141(1987). |
| 19) | B. I. Ghanayem, R. E. Chapin, Exp. Mol. Pathol., 52, 279(1990). |
| 20) | P. M. D. Foster, D. M. Creasy, J. R. Foster, et al, Toxicol. Appl. Pharmacol., 69, 385(1983). |
| 21) | E. J. Moss, L. V. Thomas, M. W. Cook, et al, Toxicol. Appl. Pharmacol., 79, 480(1985). |
| 22) | P. M. D. Foster, S. C. Lloyd, D. M. Blackburn, Toxicology, 43, 17(1987). |
| 23) | K. Nagano, E. Nakayama, H. Oobayashi, et al, Toxicology, 20, 335(1981). |
| 24) | E. Giavini, M. L. Broccia, E. Menegola, et al, Toxicol. in Vitro., 7, 777(1993). |
| 連絡先 | |||
| 試験責任者: | 高島宏昌 | ||
| 試験担当者: | 渡辺千朗,立花滋博,丸茂秀樹,堀内伸二,稲田浩子,三枝克彦,安生孝子 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Hiromasa Takashima(Study director) Chiaki Watanabe, Shigehiro Tachibana, Hideki Marumo, Shinji Horiuchi, Hiroko Inada, Katsuhiko Saegusa, Takako Anjo | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||