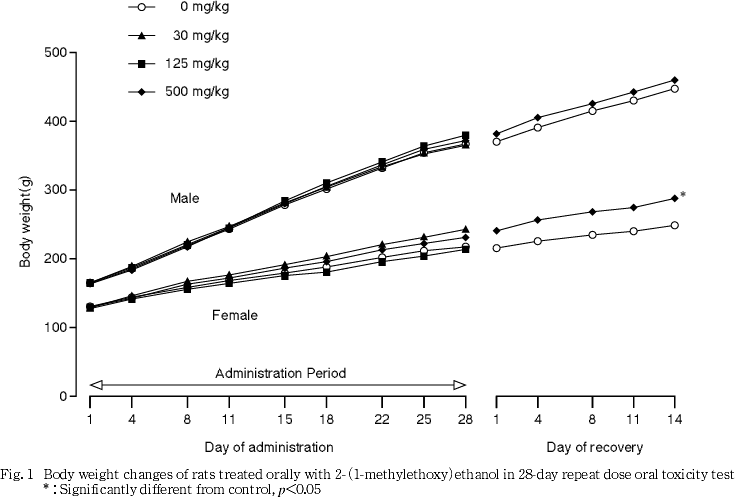
エチレングリコールエーテル類は,実験動物において血液毒性や生殖発生毒性を示す事が報告されており,例えばエチレングリコールモノブチルエーテル等では,一過性の溶血性貧血が起こり1, 2),その溶血作用の主体は酸化代謝物であることが知られている3-6).本被験物質においても,単回投与毒性試験や反復投与毒性試験の予備試験において,赤色尿が認められているが7),これも溶血作用を示唆する変化と考えられる.
一方,本被験物質の構造類似物であるエチレングリコールモノメチルエーテルやエチレングリコールモノエチルエーテルにおいては,精巣重量の低下やパキテン期精母細胞を中心とした精子形成障害の起こることが報告されている8).
今回,雌雄のSprague-Dawley系ラットを用いて,2-(1-メチルエトキシ)エタノールの28日間反復経口投与毒性試験を実施した.試験は雌雄とも4群構成とし1群には媒体である日局注射用水を,他の3群には2-(1-メチルエトキシ)エタノールを,それぞれ30,125および500 mg/kgの用量で28日間にわたり強制経口投与した.
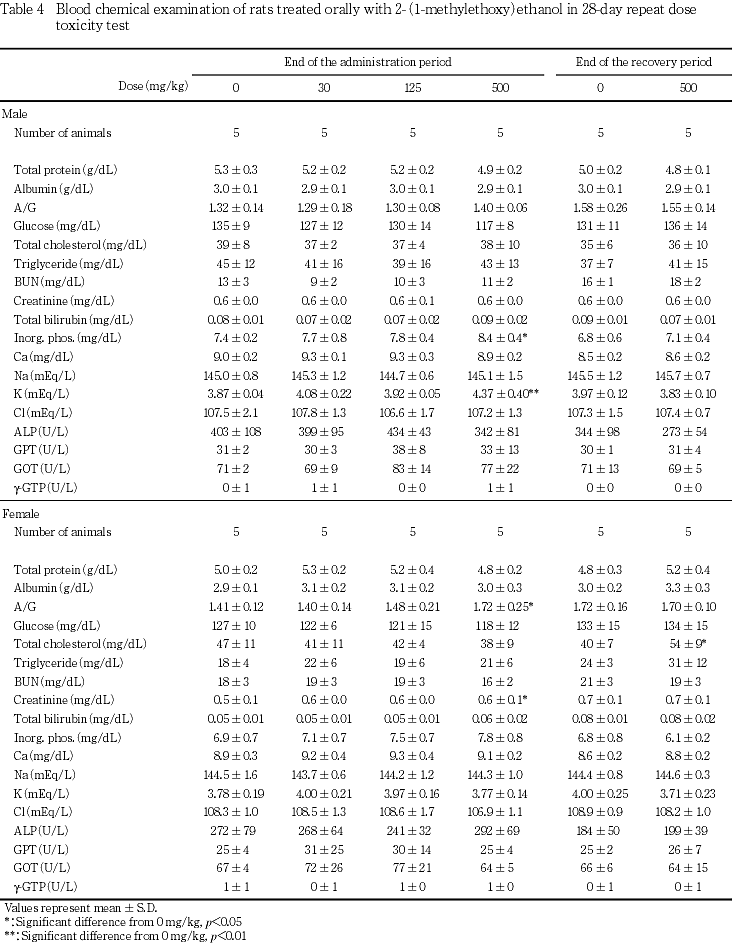
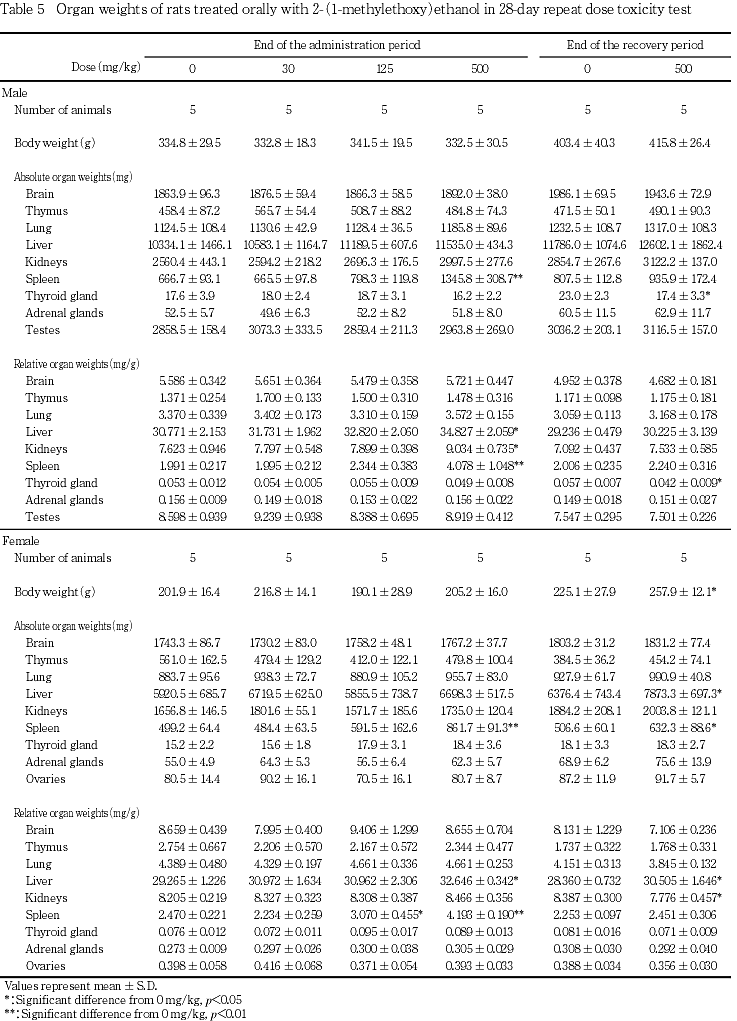
その結果,500 mg/kg投与群においては初回投与後血色素尿がみられ,投与終了時の血液検査の結果,雌雄とも125 mg/kg以上の投与群では貧血を呈した.また,肝臓や腎臓ならびに骨髄の病理組織学的検査の結果から,代償性に造血亢進が起こり,さらに骨髄像検査の結果から,骨髄における赤芽球系細胞の増加は30 mg/kg投与群においても起きているものと考えられた.また,2週間の回復試験によってこれらの変化は軽減することも明らかとなった.
以上の結果から,2-(1-メチルエトキシ)エタノールの無作用量は雌雄ともに30 mg/kg/dayを下回ると考えられた.
投与検体は,必要量の2-(1-メチルエトキシ)エタノールを秤量し,媒体である日局注射用水(製造番号:9912ST,光製薬(株))で5.0 w/v%溶液を調製した後,段階希釈して調製した.調製した検体は冷蔵下で暗所に保存し,被験物質の0.05および40.0 w/v%の調製検体の冷蔵下での8日間の安定性が確認されていることから,調製後1週間以内に使用した.試験中に調製した各濃度の投与検体には,所定濃度の2-(1-メチルエトキシ)エタノールが含有されていることを確認した.
動物は,照明12時間(7時〜19時点灯),換気回数約15回/時,許容温度21.0〜25.0 ℃,許容湿度40〜75 %に制御された飼育室で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2,日本クレア(株))および水道水(秦野市水道局給水)を自由に摂取させて飼育した.
なお,投与期間中の日数および週の表記法は,投与開始日および投与開始週をそれぞれ投与第1日および投与第1週とし,回復試験期間中の日数および週の表記法もこれに準じて回復第1日および回復第1週とした.
また,片側の大腿骨骨髄を用いて骨髄塗抹標本を作製し,骨髄像の観察を実施した.
 法,Rate),ALP活性(GSCC法),GOT活性(IFCC法),GPT活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),総ビリルビン濃度(Jendrassik/Grof法),無機リン濃度(モリブデン酸直接法)およびカルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(いずれもイオン電極法)を測定した.
法,Rate),ALP活性(GSCC法),GOT活性(IFCC法),GPT活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),総ビリルビン濃度(Jendrassik/Grof法),無機リン濃度(モリブデン酸直接法)およびカルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(いずれもイオン電極法)を測定した.

一方,投与期間終了週の検査では雄の30 mg/kg投与群で尿比重の減少がみられたが,尿量には変化がなく用量依存性の認められる変化でもなかったことから,偶発的な現象と考えた.また,回復期間終了週の検査では雌の500 mg/kg投与群で尿量の増加がみられたが,その程度は軽く尿比重にも差は認められないことから,やはり偶発所見と考えた.
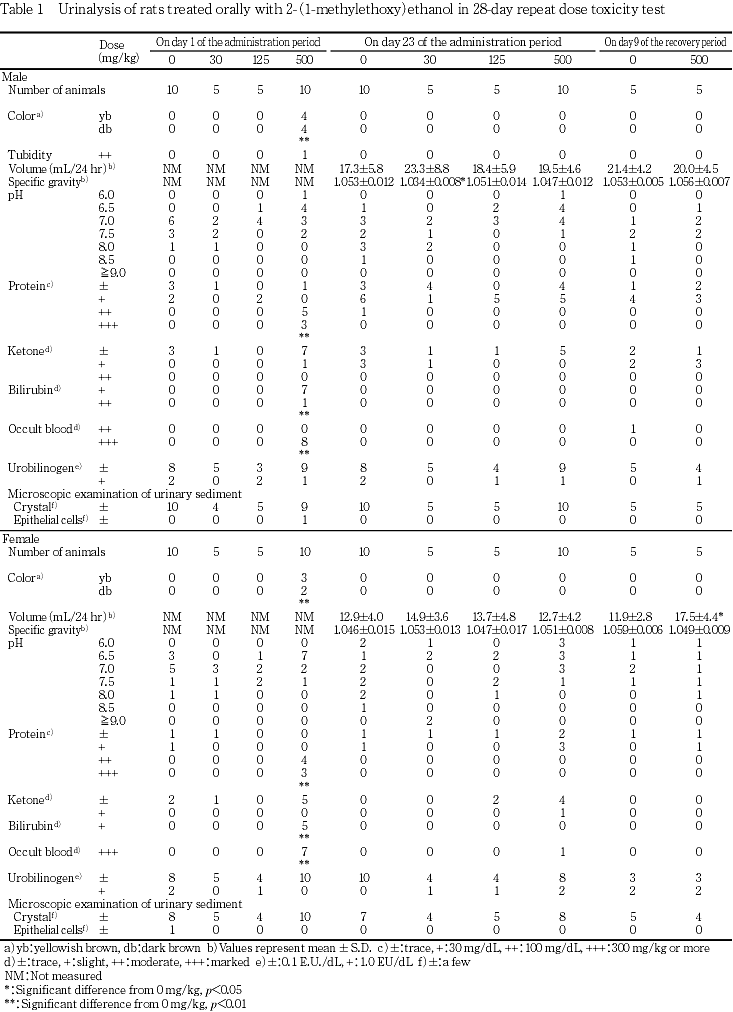
回復試験期間終了時の検査では,投与期間終了時の検査で認められた変化のうち平均赤血球容積および平均赤血球血色素量の増加が雌雄で,平均赤血球血色素濃度の低下が雄でそれぞれ認められた.一方,白血球数の増加が500 mg/kg投与群の雌でみられたが,投与期間終了時の検査では同様の変化は認められていないこと,雄にはこの傾向がみられないことから被験物質投与による影響ではないと考えた.
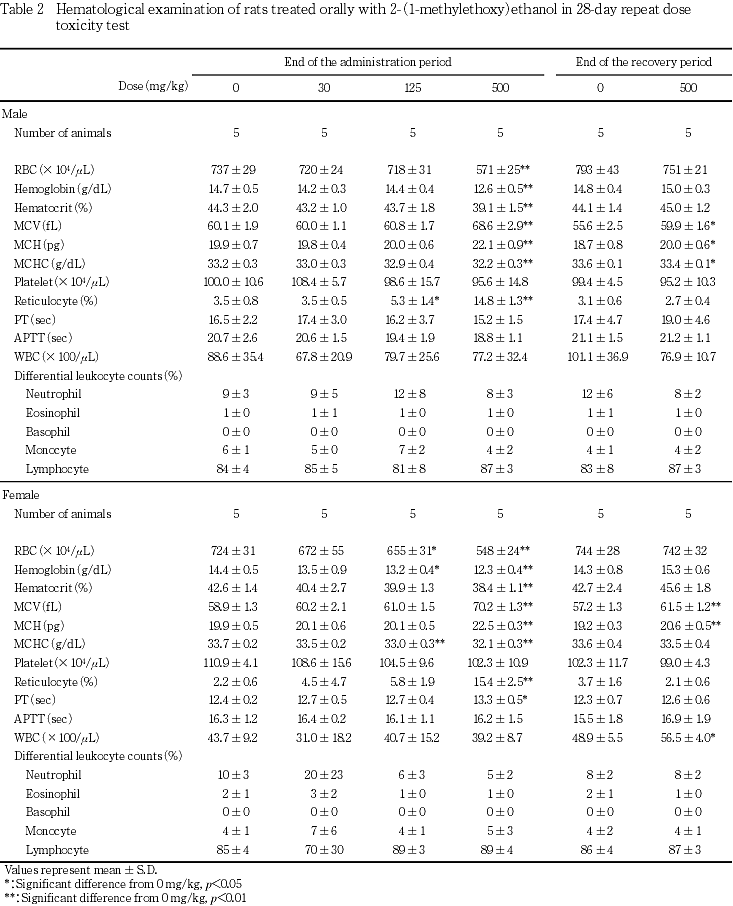
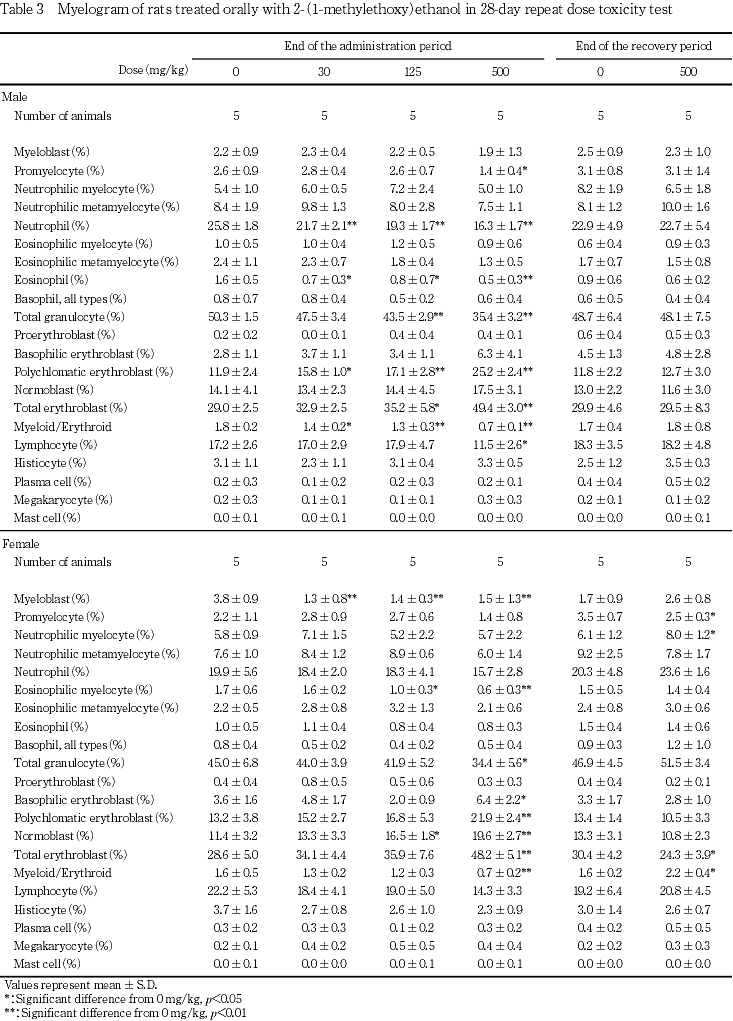
骨髄像所見では500 mg/kg投与群の雌雄で,赤血球系細胞の発現頻度が有意に増加し顆粒球系細胞の発現頻度は有意に低下した.即ち,雄では多染性赤芽球,雌では好塩基性赤芽球から正染性赤芽球までの赤芽球の発現頻度が有意に増加し,雄では前骨髄球,好中球,好酸球およびリンパ球の,雌では骨髄芽球および好酸性骨髄球の発現頻度が低下した.このため,骨髄球/赤芽球比は雌雄とも有意に低下した.125 mg/kg以下の投与群では500 mg/kg投与群に比較して程度は軽いものの,多くの項目で有意な変化がみられ,30 mg/kg投与群においてもなお,雄では多染性赤芽球の発現頻度の有意な増加ならびに好中球および好酸球の発現頻度の低下により,骨髄球/赤芽球比の低下がみられた.30 mg/kg投与群の雌においても骨髄芽球の発現頻度の低下は有意であった.一方,2週間の回復期間経過後にはこれらの変化は軽減し,雌において前骨髄球に低下が認められるものの,好中性骨髄球や骨髄球/赤芽球比の有意な増加や赤血球系細胞の発現頻度の有意な低下といった,投与終了時の検査でみられた変化とは逆の方向性を持った変化がみられたのみであった.
回復試験期間終了時の剖検では500 mg/kg投与群の雌で脾臓重量の有意な増加が絶対重量で認められたほか,肝臓重量の有意な増加も絶対重量ならびに相対重量の両者でみられた.一方,解剖時体重が有意に増加したため腎臓の相対重量には有意な低下がみられた.また,投与期間終了時にはみられなかった甲状腺重量の有意な低下が500 mg/kg投与群の雄で絶対重量,相対重量ともに認められたが,変化がみられたのは回復試験期間終了時のみであり被験物質の投与による影響とは考えられなかった.
脾臓では500 mg/kg投与群の雄の全例,雌の3例に腫大が,雄の1例,雌の3例に暗色化が認められた.また,500 mg/kg投与群の肝臓では雄の2例に腫大,雌の3例に黄色化がみられたほか,500 mg/kg投与群の雄3例に腎臓の腫大が観察された.
回復試験期間終了時解剖例
500 mg/kg投与群の雄の2例では脾臓に腫大が認められ,この2例は肝臓あるいは腎臓に腫大が観察された.その他,500 mg/kg投与群の雌の1例には肺門部付近の食道に黄色塊の付着がみられた.
脾臓では対照群を含む雌雄全例に髄外造血が観察されたが,125 mg/kg以上の投与群では造血が亢進しており,500 mg/kg投与群においてはその細胞数が明らかに増加していた.また,褐色色素の沈着は対照群および30 mg/kg投与群においては雄には観察されず,雌の両群各2例に認められるだけであったが,125 mg/kg以上の投与群においては雌雄ほぼ全例に観察され,雌では沈着した細胞数が明らかに増加していた.このため,雌雄全例の脾臓切片についてベルリン青染色を施し観察した結果,雌雄の125 mg/kg以上の投与群では対照群に比較して陽性顆粒が明らかに増加していたことから,褐色色素の増加はヘモジデリンの沈着によるものと判断した.
骨髄では30 mg/kg投与群および対照群の雌各1例,125 mg/kg投与群の雄2例,雌全例,500 mg/kg投与群の雌雄全例に赤芽球系細胞の造血亢進がみられ,500 mg/kg投与群では125 mg/kg投与群と比較して亢進の程度の強い例が多かった.
肝臓では500 mg/kg投与群の雄3例,雌2例に髄外造血が観察されたため,125および30 mg/kg投与群についても鏡検を行ったが,髄外造血は125 mg/kg以下の投与群には認められなかった.また,雌雄全例に門脈周囲性の脂肪化がみられたが,被験物質投与群と対照群との間に明らかな程度の差は認められなかった.その他,小肉芽腫が少数例に観察された.
腎臓では雄の500 mg/kg投与群および対照群の各1例に好酸性小体がみられた.また,雌雄両群には皮質に好塩基性尿細管,髄質あるいは乳頭部に鉱質沈着が観察されたが,両群間に頻度および程度の差は認められなかった.
その他,対照群の雌1例に閉鎖状態に陥る傾向のある卵胞の増加が認められた.その他の病理組織検査を実施した器官に異常所見は認められなかった.
回復試験期間終了時剖検例
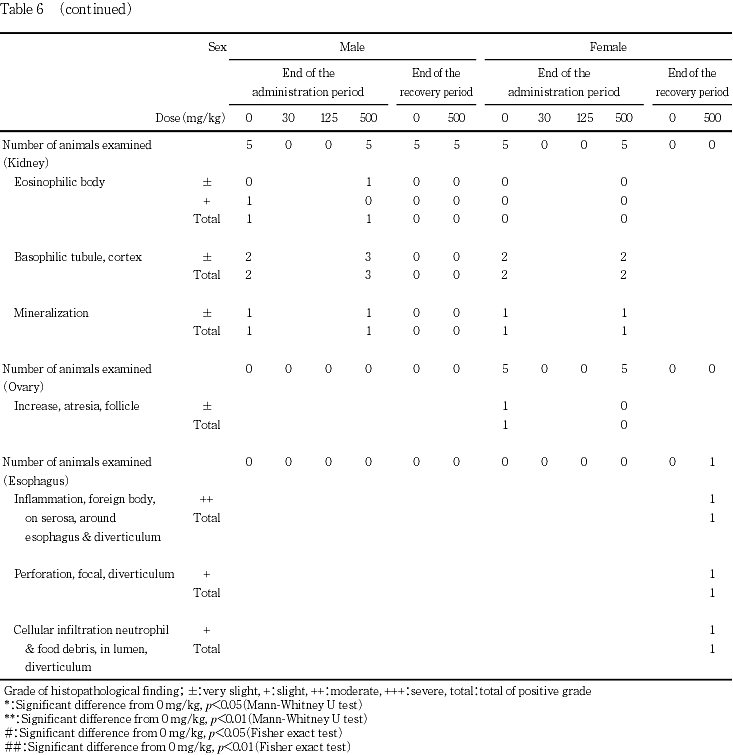
脾臓では雌雄全例に髄外造血が観察されたが,両群間に程度の差は認められなかった.また,褐色色素の沈着は対照群の雄3例,雌全例,500 mg/kg投与群の雌雄全例に観察され,500 mg/kg投与群では対照群に比較して沈着した細胞数の増加傾向が認められた.ベルリン青染色を実施し病理組織学検査を行った結果においても,雌雄の500 mg/kg投与群では対照群に比較して陽性顆粒がやや増加する傾向が認められた.しかし,回復期間終了時屠殺例におけるベルリン青陽性顆粒数は,投与期間終了時屠殺例と比較するとやや軽減する傾向が認められた.
骨髄では対照群の雌1例,500 mg/kg投与群の雌雄各4例に赤芽球系細胞の造血亢進がみられたが,回復期間終了時屠殺例は投与期間終了時屠殺例と比較して変化の程度の強い例が減少する傾向が認められた.
肝臓では対照群および500 mg/kg投与群に髄外造血は観察されなかった.また,雌雄全例に門脈周囲性の脂肪化がみられたが,両群間に明らかな程度の差は認められなかった.その他,小肉芽腫が少数例に観察された.
剖検時,肺門部付近の食道に黄色塊の付着が観察された例について病理組織学検査を行った結果,食道に隣接して食道に類似した構造を持つ嚢胞が観察された.この嚢胞は筋層は欠如していたものの,内腔面は扁平上皮細胞層で構成され,その外周を線維性結合組織が取り巻いていた.また,嚢胞の一部に穿孔がみられ,食道および嚢胞の外膜面には好中球,多核巨細胞,食物残渣を含む異物性炎症が,嚢胞内には食物残渣および好中球が観察された.これより,この嚢胞は先天性の食道憩室であると考えられ,憩室炎を起こし穿孔を伴ったものと判断した.同動物の一般状態には赤血尿以外の所見は認められず,体重の推移も他の動物に比較して差が認められない事も先天性である裏付けと考えられる.
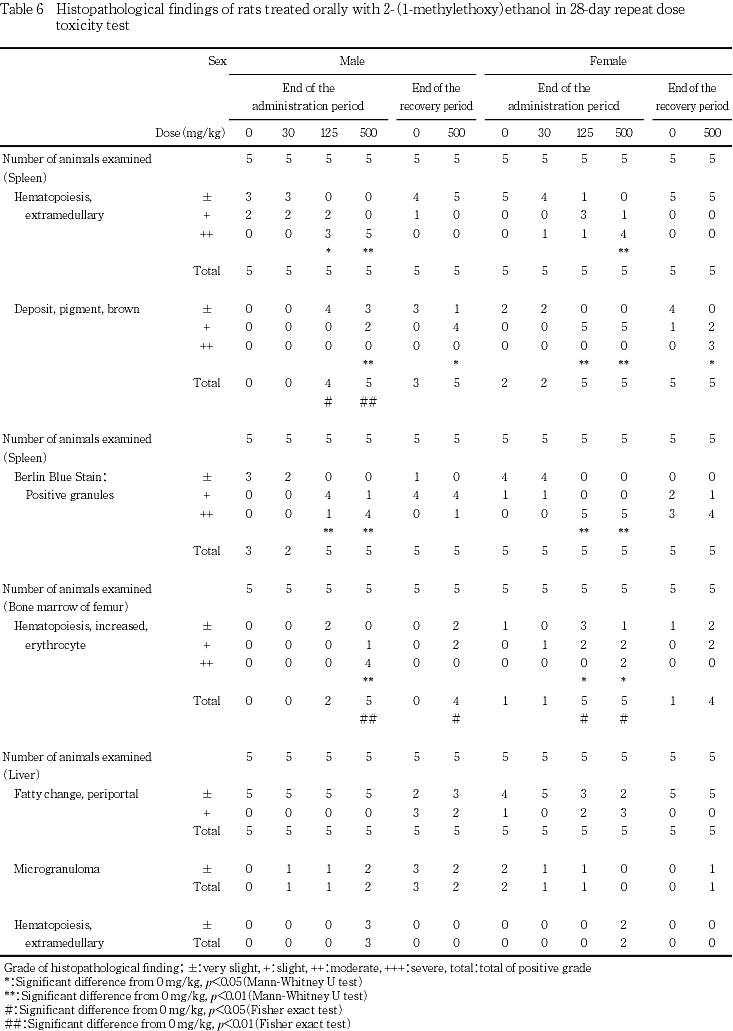
血液学検査において投与期間終了時には雄では500 mg/kg投与群で,雌では125 mg/kg以上の投与群で,用量依存的に赤血球数,血色素量ならびに平均赤血球血色素濃度の低下等の貧血像が認められ,雄の125 mg/kg以上の投与群ならびに雌の500 mg/kg投与群では網状赤血球比率の増加も認められている.また,一般状態や投与第1日の尿検査の結果,血色素尿が認められ,投与期間終了時の解剖において雄では500 mg/kg投与群,雌では125 mg/kg以上の投与群で脾臓重量の増加が認められた.以上の変化は組織学検査において125 mg/kg以上の投与群の脾臓でヘモジデリンの沈着ならびに髄外造血の亢進が認められたことからの説明が可能で,雌雄とも125 mg/kg以上の投与群においては被験物質の投与による貧血,ならびに,その原因としての溶血による血色素尿が関連していると考えられる.肝臓における髄外造血像や,投与期間終了時の剖検で認められた500 mg/kg投与群の雌雄における肝臓重量増加も脾臓と同じ機序により発生したものと考えられる.
骨髄においては雌の125 mg/kg以上の投与群,雄の500 mg/kg投与群で赤芽球系細胞が増加するなど造血亢進がみられ,500 mg/kg投与群では125 mg/kg投与群と比較して亢進の程度の強い例が多いことから,骨髄内の造血も亢進していることは明らかで,溶血性貧血に対する反応性造血亢進の像と判断される.これらの骨髄像所見のうち,多染性赤芽球の発現頻度の有意な増加や好中球および好酸球の発現頻度並びに骨髄球/赤芽球比の低下が雄で,骨髄芽球の発現頻度の低下が雌で,それぞれ30 mg/kg投与群においてもみられたことから,本被験物質の28日反復投与時の無作用量は30 mg/kgを下回ると判断される.
一方,14日間の回復期間によって骨髄像所見では明らかな回復傾向がみられ,雌において前骨髄球の低下が依然として認められるものの,その他の所見は消失するか,むしろ対照群を上回っていた.また,血液学検査においても平均赤血球容積および平均赤血球血色素量の増加が雌雄で,平均赤血球血色素濃度の低下が雄でそれぞれ認められるなど,幾つか項目に変化は残ったものの回復傾向が示唆された.器官重量では雌で脾臓ならびに肝臓の重量増加が認められたものの,雄では重量変化は消失していた.また,病理組織学検査では脾臓におけるヘモジデリンの沈着は対照群と高用量群の間にあった差が消失し,褐色色素の沈着も投与期間終了時屠殺例と比較すると軽減する傾向が認められている.さらに,骨髄においても投与期間終了時屠殺例と比較して変化の程度の強い例が減少する傾向が認められている.以上のことから,本被験物質による貧血とそれに対する骨髄内外の造血は,投与の中止によって回復傾向を示すことが明らかとなった.
血色素尿は本被験物質のラットにおける吸入曝露による毒性試験においても認められており9),この試験においては血色素尿の他,血中ビリルビン濃度の増加や脾臓重量の増加,髄外造血像や褐色色素の沈着等,本試験で認められた所見と共通あるいは関連すると考えられる所見が多くみられている.また,本被験物質の構造類似物である2-ブトキシエタノール(別名:エチレングリコールモノブチルエーテル)においても溶血性貧血が認められており1, 2),2-ブトキシエタノールにおいてはその酸化代謝物であるブトキシ酢酸に溶血作用の主体があることが,in vivoあるいはin vitro的手法によって明らかになっている3-6).一方,Millerらによれば,本被験物質の主要な排泄は尿中に起こり,尿中代謝物は主にイソプロポキシアセテートならびにそのグリシン抱合体であることがあきらかになっていることから10),本被験物質である2-(1-メチルエトキシ)エタノールが酸化による代謝をうけ,これと同様の機序で溶血性貧血を起こす可能性は高いと考えられる.本被験物質による血色素尿は投与第1日のみにみられたが,この傾向は本被験物質の簡易生殖毒性試験においても認められたものである11).貧血以外の500 mg/kg投与群でみられた変化では,雌で回復試験期間中の体重が高値を示し,摂餌量も回復第1日に有意な増加がみられたが,この増加の原因はあきらかではなかった.また,投与期間終了時に雄で無機リンならびにカリウム濃度の有意な増加が認められたが,無機リンについては血中カルシウムの,カリウムについては血中ナトリウムの濃度には全く影響が認められないことならびに雌には認められない変化であることから,被験物質投与の影響ではないと判断した.また,雌では回復試験期間終了時には総コレステロール濃度の増加がみられたが,投与終了時には認められない変化であること,雄にはみられない変化であることから偶発的な有意差と考えられた.
一方,500 mg/kg投与群の雌では投与期間終了時にA/G比ならびにクレアチニン濃度の有意な増加がそれぞれみられたがこれらの原因は不明である.
腎臓は重量増加が500 mg/kg投与群の雌において認められた.本被験物質のマウスの吸入毒性試験では腎臓の間質性腎炎,硝子円柱や血液円柱の出現等がみられたとする報告があるが9),本試験の病理組織学検査の結果,なんら所見は認められないことから重量増加は偶発的な有意差であると判断した.
一方,本被験物質の類似物質であるエチレングリコールモノメチルエーテルやエチレングルコールモノエチルエーテル等においては,パキテン期精母細胞を中心とした精子形成障害等の精巣毒性の起こることが報告されており8),CD-1マウスで連続交配試験を実施した結果によれば,エチレングリコールモノブチルエーテルやエチレングリコールモノフェニルエーテルにおいても妊娠率の低下がみられ,エチレングリコールモノブチルエーテルでは高用量群で1腹児数の低下が認められている12).精巣重量の低下はエチレングリコールやプロピレングリコール,プロピレングリコールモノメチルエーテル,ジエチレングリコールモノエチルエーテルでは認められないことが明らかになっており13, 14),さらに,マウスでの検討によればエチレングリコールモノアルキルエーテルの精巣毒性はアルキル基の種類によって異なり,分子量が大きくなるほど弱くなることが報告されている15).また,本試験ならびに本被験物質の簡易生殖毒性試験における,精巣重量ならびに精巣の病理組織学所見からは,精巣毒性あるいは生殖毒性を疑わせる所見は認められなかった.
以上の結果から2-(1-メチルエトキシ)エタノールの28日間反復投与によって,溶血性貧血と造血亢進が起こり,これらの変化は投与の中止によって回復することが示された.また,無作用量は雌雄ともに30 mg/kg/dayを下回ると考えられた.
| 1) | C. P. Carpenter, U. C. Pozzani, C. S. Weil, et al, Arch. Ind. Health, 14, 114(1956). |
| 2) | B. I. Ghanayem, S. M. Ward, P. C. Blair, et al, Toxicol. Appl. Pharmacol., 106, 341(1990). |
| 3) | F. G. Bartnik, A. K. Reddy, G. Klecak, et al, Fundam. Appl. Toxicol., 8, 59(1987). |
| 4) | B. I. Ghanayem, Biochem. Pharmacol., 38, 1679(1989). |
| 5) | B. I. Ghanayem, L. T. Burka, H. B. Matthews, J. Pharmacol. Exp. Ther., 242, 222(1987). |
| 6) | B. I. Ghanayem, L. T. Burka, H. B. Matthews, Chem. -Biol. Interact., 70, 339(1989). |
| 7) | 高島宏昌,立花滋博,佐藤昌子ら,化学物質毒性試験報告書,10, 115(2003). |
| 8) | P. M. D. Foster, D. M. Creasy, J. R. Foster, et al, Toxicol. Appl. Pharmacol., 69, 385(1983). |
| 9) | J. H. E. Arts, P. G. J. Reuzel, R. A. Woutersen, et al, Inhal. Toxicol., 4, 43(1992). |
| 10) | R. R. Miller, Drug Metab. Rev., 18, 1(1987). |
| 11) | 高島宏昌,渡辺千朗,立花滋博ら,化学物質毒性試験報告書,10, 131(2003). |
| 12) | R. E. Morrissey, J. C. Lamb IV, R. W. Morris, et al, Fundam. Appl. Toxicol., 13, 747(1989). |
| 13) | H. J. Morris, A. A. Nelson, H. O. Calvery, J. Pharmacol. Exp. Ther., 74, 880(1941). |
| 14) | R. R. Miller, J. A. Ayres, L. L. Calhoun, et al, Toxicol. Appl. Pharmacol., 61, 368(1981). |
| 15) | 長野嘉介,中山栄基,小谷野道子ら,産業医学,21, 29(1979). |
| 連絡先 | |||
| 試験責任者: | 高島宏昌 | ||
| 試験担当者: | 佐藤昌子,渡辺千朗,丸茂秀樹,堀内伸二,稲田浩子,三枝克彦,安生孝子 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Hiromasa Takashima(Study director) Masako Sato, Chiaki Watanabe, Hideki Marumo, Shinji Horiuchi, Hiroko Inada, Katsuhiko Saegusa, Takako Anjo | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||