1,3,5-トリヒドロキシベンゼンのラットを用いる28日間反復経口投与毒性試験
Twenty-eight-day Repeat Dose Oral Toxicity Test of 1,3,5-Trihydroxybenzene in Rats
要約
1,3,5-トリヒドロキシベンゼンは,医薬品の原料,染料用カップリング剤,合成ゴム安定剤,タイヤ接着剤,ジアゾ系印刷等に使用されている化学物質である.本物質の毒性については,マウスの単回経口LD50値が報告1)されているが,毒性学的性質の詳細は明らかにされていない.
今回,1,3,5-トリヒドロキシベンゼンについて,SD系[Crj:CD(SD)IGS]ラットを用い,0(溶媒),30,100,300および1000 mg/kg用量で,28日間反復経口投与毒性試験を実施した.動物数は1群雌雄各6匹とし,投与期間終了後屠殺群の5群,ならびに14日間回復群として対照および1000 mg/kgの2群を設定した.
その結果,投与期間および回復期間を通じて,雌雄のいずれにも一般状態および摂餌量の変化は認められなかった.体重は,1000 mg/kg群の雄で増加抑制の傾向が認められた.尿検査では,1000 mg/kg群で雌雄に尿の褐色化,雌に比重の増加,pHの低下およびタンパクの減少が認められた.血液学および血液生化学検査では,300および1000 mg/kg群で雌にプロトロンビン時間の延長,1000 mg/kg群で雄にトリグリセライドおよび総ビリルビンの増加,雌にγ-GTPおよび総ビリルビンの増加,ならびにカリウムおよび塩素の減少が認められた.病理学検査では,1000 mg/kg群で雌に甲状腺の絶対および相対重量の増加傾向が認められ,病理組織学検査では雌雄に濾胞上皮の肥大が認められた.また,雄に肝臓の絶対および相対重量の増加,雌に肝臓の相対重量の増加が認められたが,病理組織学変化は認められなかった.
回復群では,これら被験物質の投与による変化は認められず,可逆的変化であることが確認された.
以上の結果から,1,3,5-トリヒドロキシベンゼンのラットへの28日間反復投与による主な毒性は,甲状腺および肝臓に対する影響で,腎臓に対する影響も認められた.無影響量は,雌雄とも300 mg/kg/dayと推定された.
方法
1. 被験物質
1,3,5-トリヒドロキシベンゼンは,融点218 ℃の白色粉末である.試験には,石原産業(株)(大阪)製造のもの(ロット番号OS-12074,純度 99.9 %,水分0.09 %)を入手し,冷暗(4 ℃)条件下で密栓保管し,使用した.被験物質の投与液は,局方オリブ油[宮澤薬品(株)製,ロット番号GG06]を溶媒として,所定の投与用量になるような濃度の懸濁液として調製し,使用時まで冷所(4 ℃)遮光下で密栓保管し,調製後8日以内に使用した.なお,保存条件下および投与形態での被験物質は安定であることを確認した.
2. 供試動物および飼育条件
動物は,SD系〔Crj:CD(SD)IGS〕ラットを,日本チャールス・リバー(株)(神奈川)より搬入,雄は5日,雌は6日間検疫を兼ねて試験環境に馴化させた後,5週齢で試験に供した.1群の動物数は雌雄各6匹とし,対照群および最高用量群については別に雌雄各6匹の14日間回復群を設けた.投与開始時の体重は雄で137-152 g,雌で128-144 gであった.ラットは,温度22〜23 ℃,湿度53〜63 %,換気回数10回以上/時,照明12時間(7時-19時)に制御した飼育室で,金網ケージに個体別に収容し,固型飼料[ラボMRストック,日本農産工業(株)]および水を自由摂取させて飼育した.
3. 投与量および投与方法
投与量設定試験として,1群雌雄各4匹のラットに,被験物質を0,100,250,500および1000 mg/kg/day用量で14日間反復経口投与した結果,1000 mg/kg群で雌雄に肝臓の相対重量の増加,雌に尿素窒素およびカルシウムの減少,ならびに総ビリルビンの増加が認められた.したがって,本試験における投与量は,1000 mg/kgを最高用量とし,以下300,100および30 mg/kgの4用量を設定した.投与方法は,投与液量を体重1 kg当たり5 mLとし,テフロン製胃ゾンデを装着した注射筒を用いて1日1回(午前中),28日間にわたって経口投与した.対照群には,局方オリブ油を同様に投与した.
4. 観察および検査
1) 一般状態観察
28日間の投与期間およびそれに続く14日間の回復期間を通じて,動物の生死,外観,行動等を毎日観察した.
2) 体重および摂餌量測定
体重は,投与期間中は1,4,8,11,15,18,22,25,28日,回復期間中は1,4,8,11および14日,ならびに屠殺日に測定した.摂餌量は,毎週1回(雄は投与3,10,17および24日,回復3,10日,雌は投与2,9,16および23日,回復2,9日),1日(24時間)の飼料消費量を測定した.
3) 尿検査
雄は投与27日および投与期間終了後11日,雌は投与26日および投与期間終了後10日に,動物を個体別に代謝ケージに収容して新鮮尿を採取し,pH,潜血,タンパク,糖,ケトン体,ビリルビン,ウロビリノーゲン(以上,試験紙法:マイルス・三共(株),マルティスティックス®)を,さらに約3時間の蓄尿により外観の観察,比重の測定(屈折計:エルマ光学(株))および沈渣(ケンブリッジケミカルプロダクト社,URI-CELL®液で染色)を検査した.
4) 血液学検査
採血は,投与期間および回復期間終了翌日にエーテル麻酔下で開腹して腹大動脈より行なった.動物は採血前日の午後5時から除餌し,水のみを給与した.採取した血液は3分割し,その一部は,EDTA-2Kで凝固防止処理し,多項目自動血球計数装置〔東亜医用電子(株),E- 4000〕により,赤血球数(電気抵抗検出方式),血色素量(ラウリル硫酸ナトリウム-ヘモグロビン法),ヘマトクリット値(パルス検出方式),平均赤血球容積(MCV),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC,以上計算値),白血球数および血小板数(以上,電気抵抗検出方式)を,また塗抹標本を作製して網状赤血球数(Brilliant cresyl blueで染色して鏡検)および白血球百分率(May-Giemsaで染色して鏡検)を測定した.また一部は,3.8 %クエン酸ナトリウム液で凝固阻止処理して血漿を分離し,血液凝固自動測定装置(アメルング社,KC-10A)により,プロトロンビン時間(PT,Quick一段法)および活性化部分トロンボプラスチン時間(APTT,エラジン酸活性化法)を測定した.
5) 血液生化学検査
採取した血液の一部から血清を分離し,生化学自動分析装置〔日本電子(株),JCA-BM8〕により,総タンパク(Biuret法),アルブミン(BCG法),A/G比(計算値),グルコース,トリグリセライド,総コレステロール(以上,酵素法),総ビリルビン(ジアゾ法),尿素窒素(Urease-UV法),クレアチニン(Jaffe'法),GOT,GPT,γ-GTP,ALP(以上,JSCC法),LDH(SFBC法),コリンエステラーゼ(BTC-DTNB法),カルシウム(OCPC法)および無機リン(酵素法)を,また電解質自動分析装置〔東亜電波工業(株),NAKL-132〕により,ナトリウム,カリウムおよび塩素を測定した.
6) 病理学検査
投与期間あるいは回復期間終了翌日の採血に続いて放血屠殺して剖検した.また,脳,心臓,胸腺,肝臓,腎臓,脾臓,副腎,精巣,精巣上体および卵巣を秤量(絶対重量)し,また対体重比(相対重量)を算出した.病理組織学検査は,採取した器官を10 %中性リン酸緩衝ホルマリン液(精巣および精巣上体のみブアン液で固定)固定後,対照群および1000 mg/kg群については,脳,下垂体,甲状腺(上皮小体を含む),胸腺,心臓,肺,肝臓,腎臓,脾臓,副腎,胃,膀胱,脊髄,坐骨神経,骨髄,さらに雄では精巣,精巣上体,精嚢,前立腺,雌では卵巣,子宮を検査した.また,1000 mg/kg群では雌雄で甲状腺に病理組織学的変化が認められたので,雌雄の甲状腺については30および100 mg/kg群ならびに回復群も検査した.その他,30 mg/kg群で雌の肉眼的異常部位を検査した.検査は,常法によりパラフィン切片を作製し,ヘマトキシリン・エオジン染色を施して鏡検した.また,沈着物を同定するため,対照群および1000 mg/kg群の雌雄全例の脾臓について鉄染色(ベルリンブルー染色),一部の雄の腎臓についてPAS染色を行った.
5. 統計解析
パラメトリックデータについては,Bartlettの分散検定を行い,分散が一様な場合は一元配置の分散分析を
行った.分散が一様でない場合およびノンパラメトリックデータはKruskal-Wallisの順位検定を行った.それらの結果,有意差を認めた場合,DunnettまたはSheff 群間で標本数が異なる場合)の方法により対照群に対する各群の比較検定を行った.カテゴリカルデータにはFisherの直接確率法を用いた.有意水準は,いずれの場合も5 %とした.
群間で標本数が異なる場合)の方法により対照群に対する各群の比較検定を行った.カテゴリカルデータにはFisherの直接確率法を用いた.有意水準は,いずれの場合も5 %とした.
結果
1. 死亡および一般状態
投与期間および回復期間中を通じて,雌雄のいずれにも一般状態の変化および死亡は認められなかった.
2. 体重(Fig. 1)
投与期間においては,1000 mg/kg群で雄の投与8日から終了日までの体重が対照群と比べて低値を示し,体重増加の抑制傾向が認められたが,統計学的に有意な変化ではなかった.雌では対照群と同様の体重推移が認められた.
回復期間においては,投与期間中に増加抑制の傾向が認められた1000 mg/kg群の雄の体重増加量は対照群を上回り,回復傾向が認められた.雌では対照群と同様の体重推移が認められた.

3. 摂餌量
投与期間において,雄ではいずれの被験物質投与群においても対照群と有意な差は認められなかった.雌では100 mg/kg群で投与4週で対照群に比べて有意な増加が認められたが,用量相関性のない変化であった.
回復期間において,雌雄とも対照群と有意な差は認められなかった.
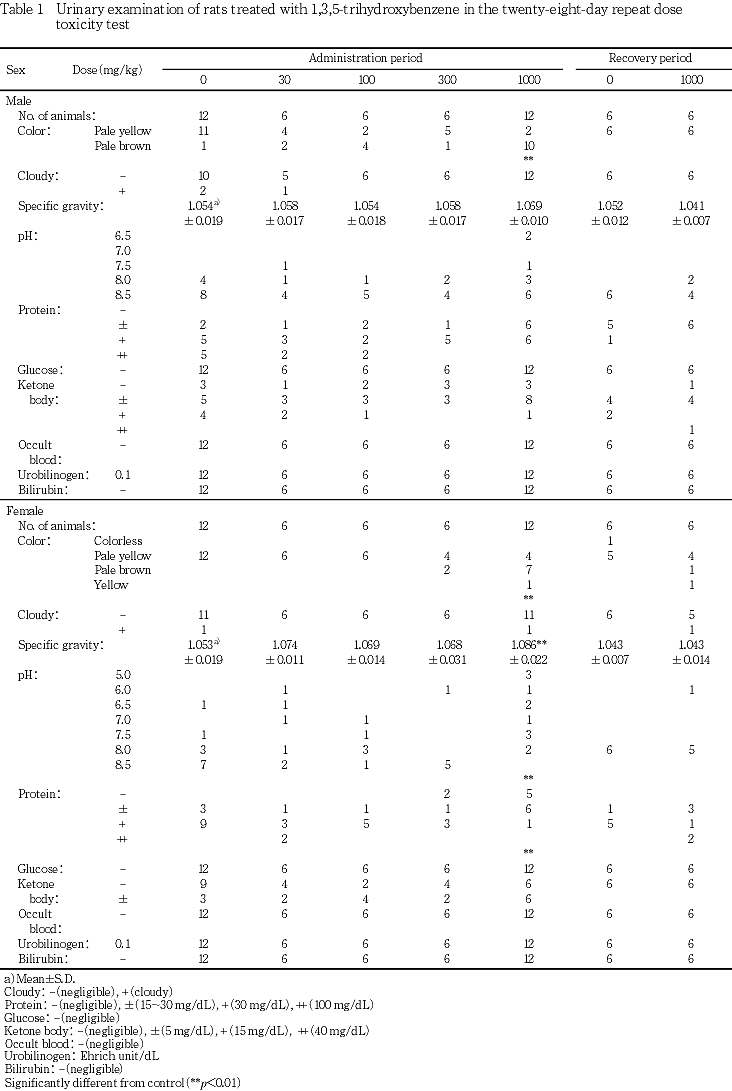
4. 尿所見(Table 1)
投与期間中の検査において,1000 mg/kg群で雌雄とも尿の褐色化,雌に比重の有意な増加,pHの低下およびタンパクの減少が認められた.
回復期間中の検査において,各検査項目に変化は認められなかった.
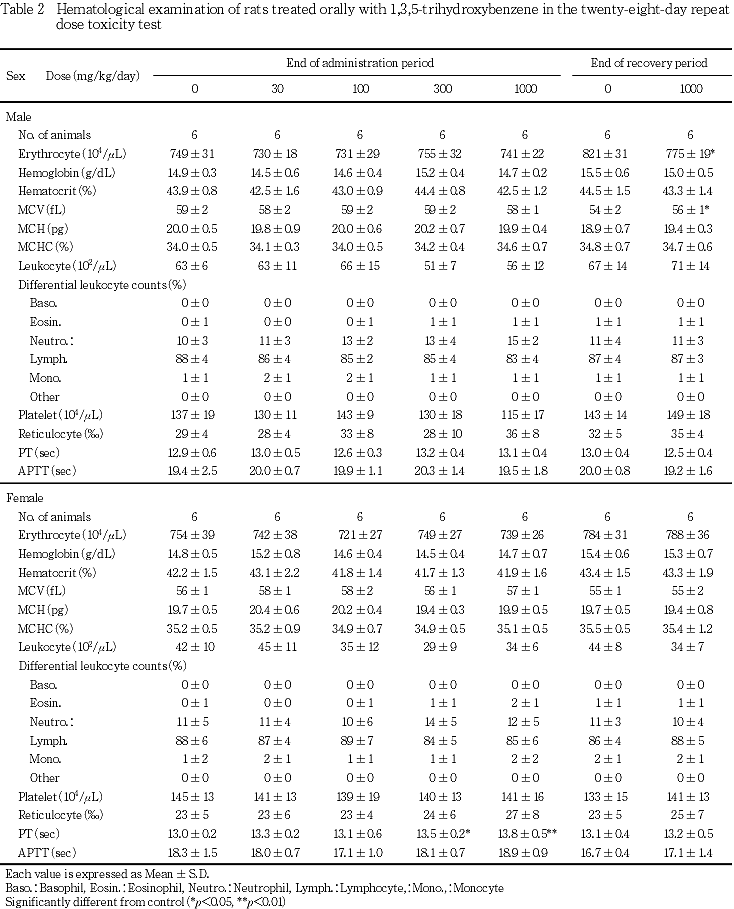
5. 血液学検査(Table 2)
投与期間終了時の検査において,雄では対照群と比べて有意な変化は認められなかった.雌では300 mg/kg以上の群でプロトロンビン時間の有意な延長が認められた.
回復期間終了時の検査において,1000 mg/kg群で雄に赤血球数の有意な減少および平均赤血球容積の有意な増加が認められた.雌では対照群と比べ有意な変化は認められなかった.
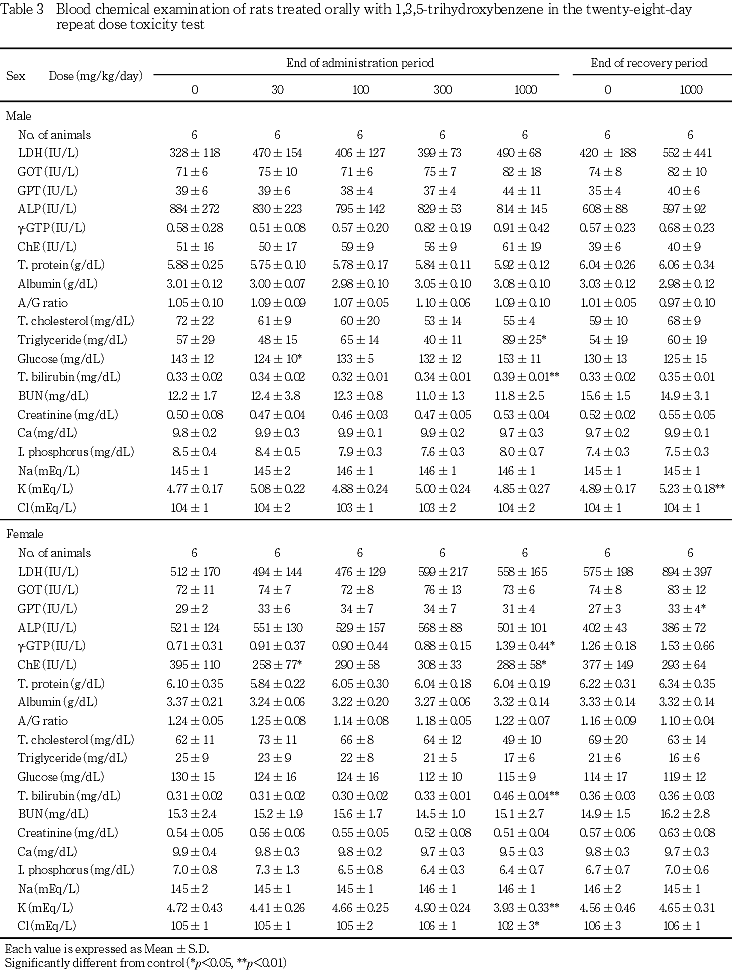
6. 血液生化学所見(Table 3)
投与期間終了時の検査において,1000 mg/kg群で雄にトリグリセライドおよび総ビリルビンの有意な増加,雌にγ-GTPおよび総ビリルビンの有意な増加,カリウムおよび塩素の有意な減少が認められた.なお,30および1000 mg/kg群で雌にコリンエステラーゼの有意な減少,30 mg/kg群の雄で血糖の有意な減少が認められたが,いずれも用量相関性のない変化であった.
回復期間終了時の検査において,1000 mg/kg群で雄にカリウムの有意な増加,雌にGPTの有意な増加が認められた.
7. 剖検
投与期間および回復期間終了時屠殺動物において,雌雄とも被験物質の投与に起因する変化は認められなかった.なお,被験物質の投与との関連性が認められない所見として,投与期間終了時屠殺動物では雄に肺の黒色点が対照群の1匹,雌では肺の黒色点が30 mg/kg群の1匹,卵巣の嚢胞が対照群および 1000 mg/kg群で各々1匹に認められた.
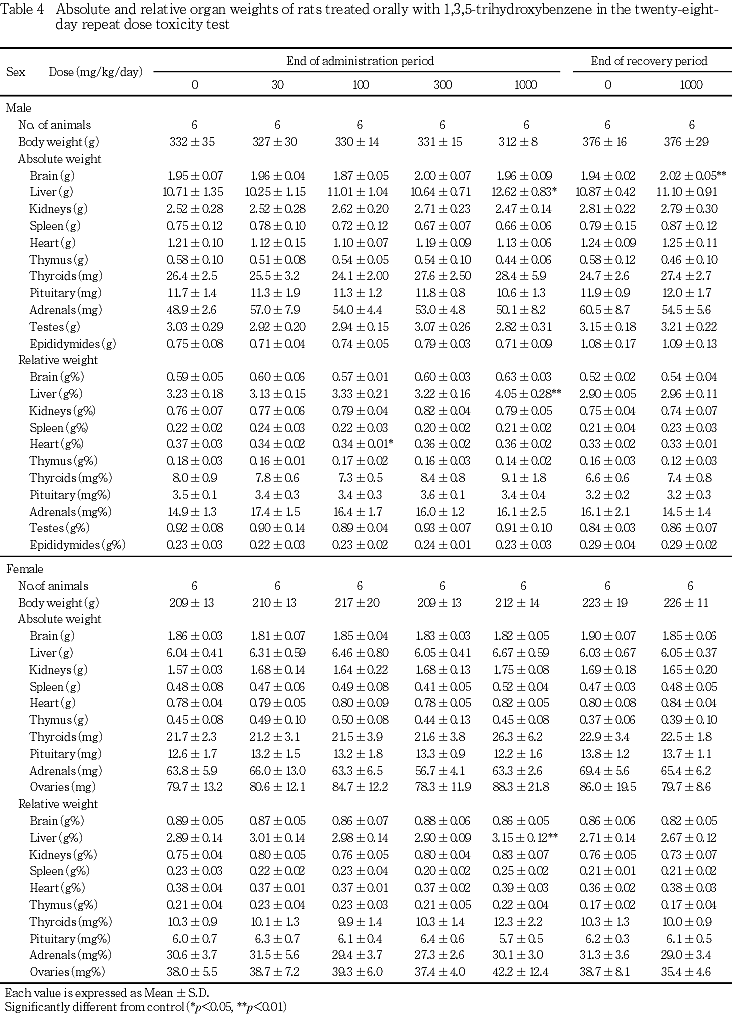
8. 器官重量(Table 4)
投与期間終了時屠殺動物において,1000 mg/kg群で雄に肝臓の絶対および相対重量の有意な増加,雌に肝臓の相対重量の有意な増加ならびに甲状腺の絶対および相対重量の増加傾向が認められた.なお,100 mg/kg群で雄に心臓の相対重量の有意な減少が認められたが,用量相関性のない変化であった.
回復期間終了時屠殺動物では,1000 mg/kg群で雄に脳の絶対重量の有意な増加が認められた.雌では変化は認められなかった.
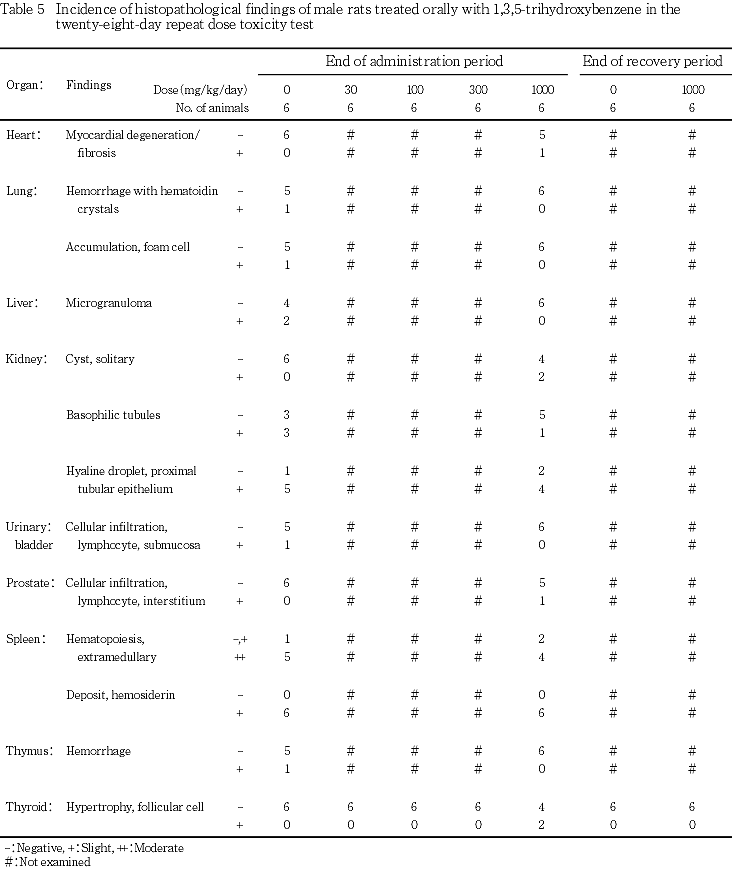
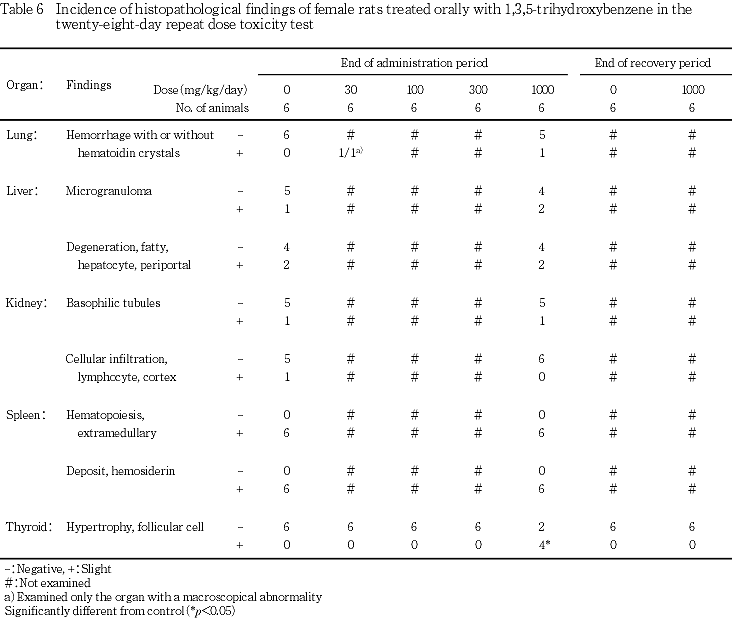
9. 病理組織学所見(Tables 5, 6)
投与期間終了時屠殺動物において,甲状腺の濾胞上皮の肥大が認められた.すなわち,対照群に比べて濾胞は小型化し,濾胞上皮の丈が高く,コロイドはやや減少する傾向にあった.この変化は,1000 mg/kg群で雄に6匹中2匹,雌に6匹中4匹に認められ,雌の発現率には対照群と比べて有意差が認められた.
回復期間終了時屠殺動物において,雌雄とも被験物質投与によると思われる変化は認められなかった.
以上の変化以外にも,投与期間終了時屠殺動物の検査した各器官に変化が認められたが,散発的あるいは用量依存性の認められない所見であった.
考察
1,3,5-トリヒドロキシベンゼンのラットへの28日間反復経口投与において,甲状腺,肝臓および腎臓に対する影響を示唆する変化が認められた.
甲状腺に対する影響としては,1000 mg/kg群で雌に絶対および相対重量の増加傾向が認められ,病理組織学検査では濾胞上皮の肥大が,雄では6匹中2匹に,雌では6匹中4匹に認められた.同様の変化はラットへの抗甲状腺物質の投与時に認められており,甲状腺機能の亢進像と解されている2).また,本被験物質の甲状腺に対する影響はBizerら3)も報告している.
肝臓に対する影響として,1000 mg/kg群で雄に絶対および相対重量の増加,雌に相対重量の増加が認められた.肝臓の重量変化に関連すると考えられる変化として,血液学検査では300および1000 mg/kg群で雌にプロトロンビン時間の延長,血液生化学検査では1000 mg/kg群で雄にトリグリセライドの増加,雌にγ-GTPの増加,雌雄に総ビリルビンの増加が認められた.しかしながら,いずれも背景データにおける正常値範囲内ないし僅かに越える変化であり,病理組織学的には変化が認められていないことから,本被験物質の肝臓に対する影響は軽度なものと判断された.
腎臓に対する影響については,病理組織学変化は認められなかったが,尿検査で1000 mg/kg群の雌雄に尿の濃縮による色調変化と考えられる褐色化,雌に比重の増加および尿の酸性化が認められた.また,血清カリウムおよび塩素濃度の減少も認められ,腎機能に対する影響がうかがわれた.一方,減少性である尿タンパクの変化は毒性学的意義は乏しいと判断された.
体重に対する影響については,統計学的有意差は認められなかったものの,1000 mg/kg群の雄の体重増加抑制傾向は,回復期間では逆に体重増加量が対照群を上回って回復傾向を示したことから,被験物質投与に起因した変化と考えられた.
回復群では,投与期間および投与期間終了時屠殺群に認められた変化は認められなかった.なお,雄に赤血球数の減少,平均赤血球容積および血清カリウムの増加,ならびに雌にGPTの増加が認められたが,いずれも背景データの正常値範囲内ないし僅かに超える変化であった.また,雄で脳の絶対重量に有意な増加が認められたが,相対重量には有意な差が認められない僅かな変化であった.これらの変化は,投与期間終了時屠殺動物には認められないことから,偶発的な変化と判断された.
このように,1000 mg/kg/dayでは明らかな毒性影響が認められた.300 mg/kg/dayではプロトロンビン時間の延長が認められたが,正常範囲内の変化であった.
以上の結果から,1,3,5-トリヒドロキシベンゼンのラットへの28日間反復投与による主な毒性は,甲状腺および肝臓に対する影響で,腎臓に対する影響も認められた.無影響量は雌雄とも300 mg/kg/dayと推定された.
文献
| 1) | R. J. Lewis, et al., RTECS, 2, 304(1980). |
| 2) | J. Hardisty, et al., "Pathology of the Fisher Rat", eds. by Boorman GA., et al. Academic Press., INC., San Diego, 1990, pp.520-522. |
| 3) | D. M. Bizer, et al., Nutr. Rep. Int., 36, 131(1987). |
| 連絡先 |
| 試験責任者: | 山本 譲 |
| 試験担当者: | 伊藤義彦,野田 篤,伊藤雅也,赤木 博,山口真樹子 |
| (財)畜産生物科学安全研究所 |
| 〒229-1132 神奈川県相模原市橋本台3-7-11 |
| Tel 042-762-2775 | Fax 042-762-7979 | |
| Correspondence |
| Authors: | Yuzuru Yamamoto(Study director)
Yoshihiko Ito, Atushi Noda,Masaya Ito,Hiroshi Akagi,Makiko Yamaguchi |
| Research Institute for Animal Science in Biochemistry and Toxicology |
| 3-7-11 Hashimotodai, Sagamihara-shi, Kanagawa,229-1132, Japan |
| Tel +81-042-762-2775 | Fax +81-042-762-7979 | |

 群間で標本数が異なる場合)の方法により対照群に対する各群の比較検定を行った.カテゴリカルデータにはFisherの直接確率法を用いた.有意水準は,いずれの場合も5 %とした.
群間で標本数が異なる場合)の方法により対照群に対する各群の比較検定を行った.カテゴリカルデータにはFisherの直接確率法を用いた.有意水準は,いずれの場合も5 %とした.






