一般状態の観察では,雌雄の640 mg/kg群で自発運動低下およびよろめき歩行が認められ,さらに雄で歩行困難が認められた.投与期間に観察された上述の症状は,回復期間には観察されず,症状の回復が認められた.なお,雌雄いずれの群にも死亡例は観察されなかった.
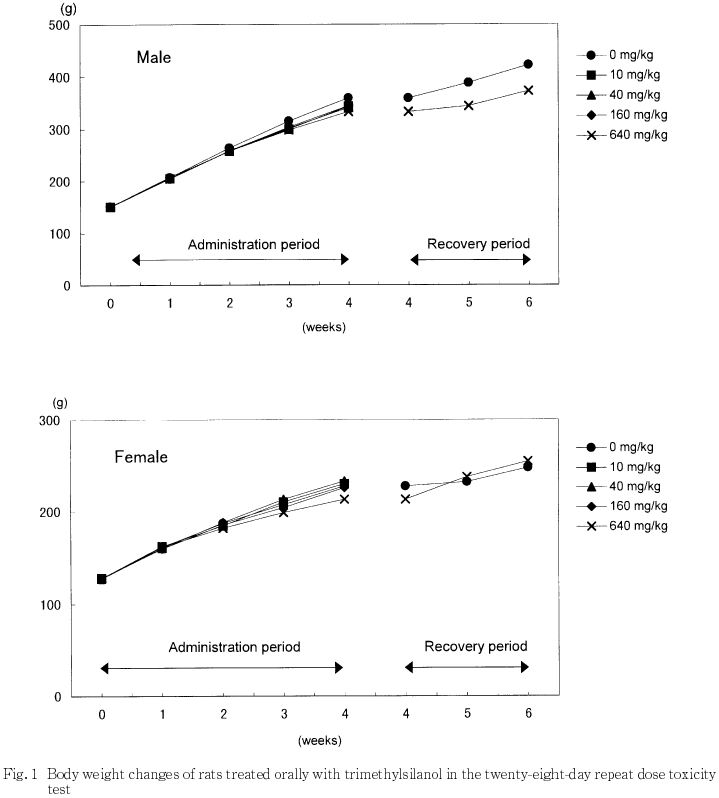
体重は雌雄の640 mg/kg群で低値傾向が認められた.摂餌量の測定では,雌雄とも変化は認められなかった.回復期間中は,雄の体重変化を除き回復が認められた.
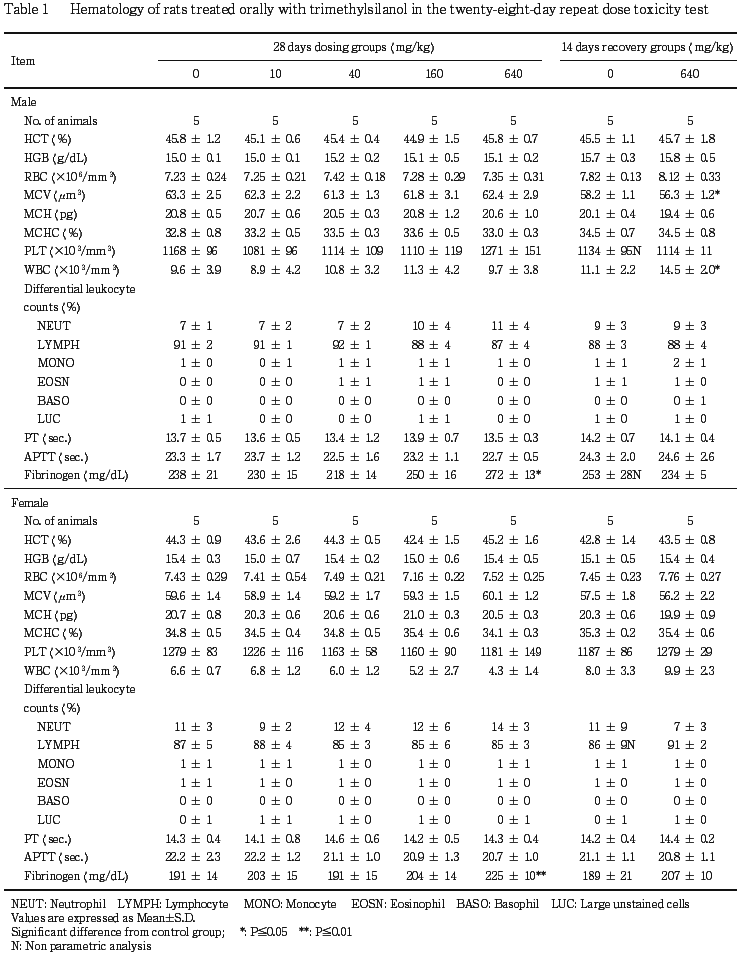
血液学検査では,雌雄とも被験物質投与と関連づけられる変化は認められなかった.
血液凝固能検査では,雌雄の640 mg/kg群でフィブリノーゲンの高値が認められたが,回復期間終了時には雌雄とも対照群と640 mg/kg群で差は認められなかった.
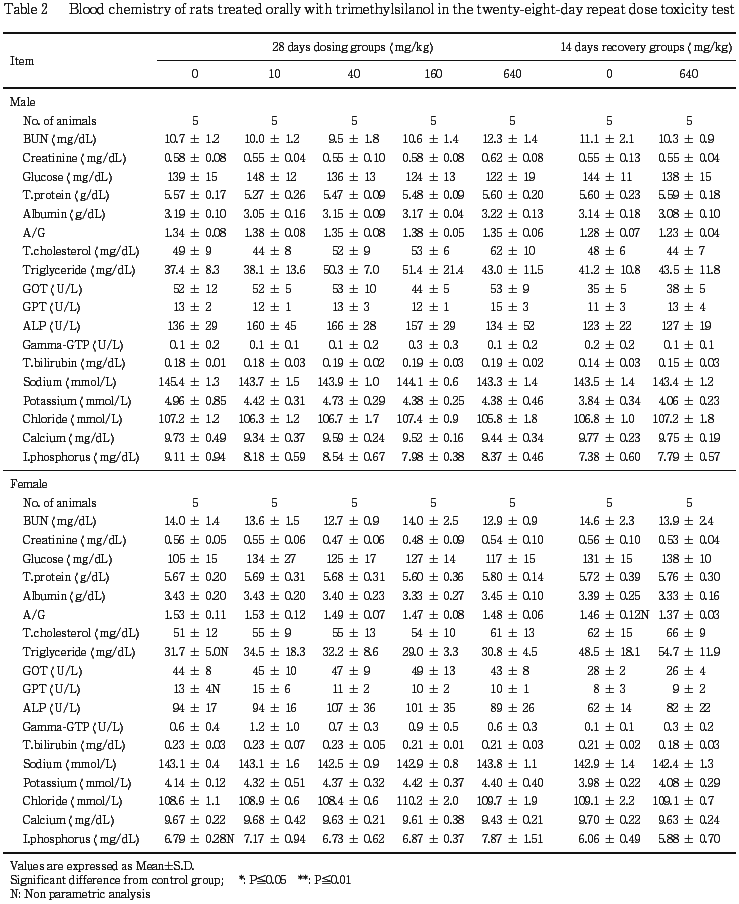
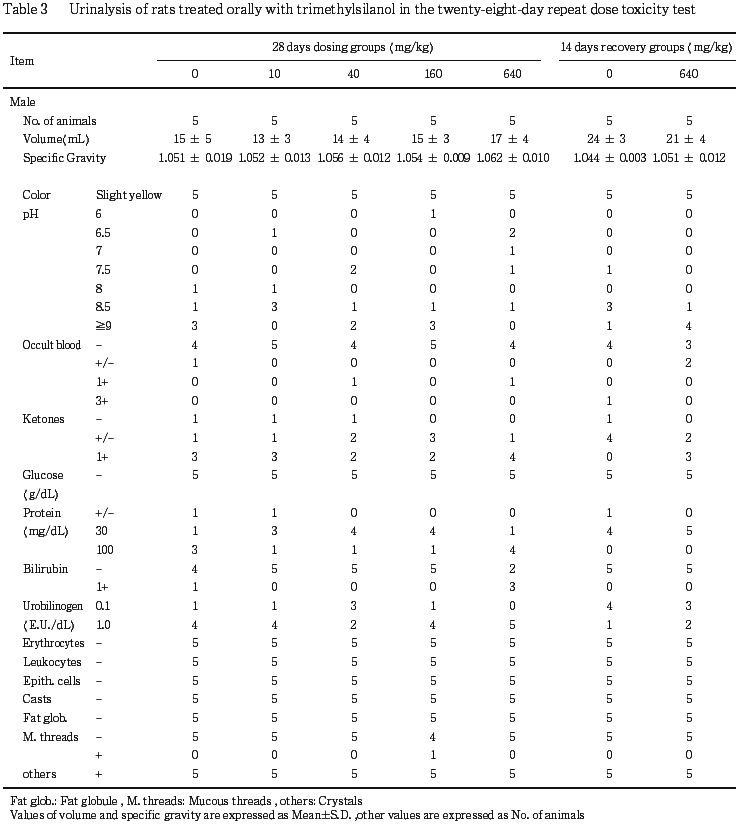
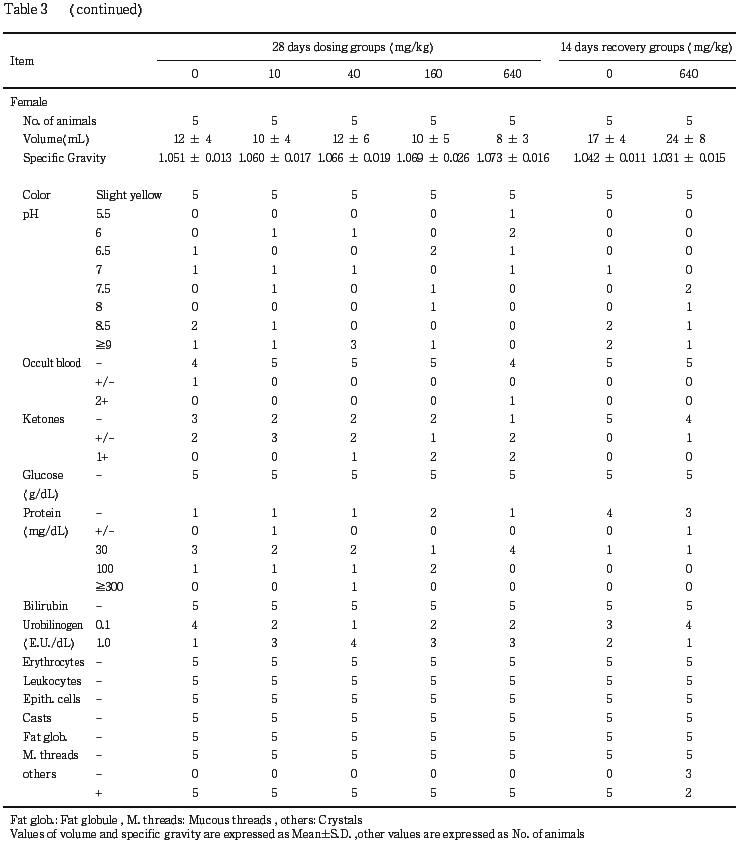
血液生化学および尿検査では,雌雄とも被験物質投与の影響は認められなかった.
器官重量測定では,雌の640 mg/kg群で胸腺実重量の低値および肝臓相対重量の高値が認められたが,回復期間終了時には,肝臓の変化を除き回復が認められた.
病理学検査の結果,被験物質投与の影響が示唆される病変は観察されなかった.
以上の結果から,トリメチルシラノールの無影響量(NOEL)は雌雄とも160 mg/kg/dayと判断された.
 ,Lot No. 702906,純度99.8 %,分子量90.20)は無色透明の液体で,沸点98〜99℃,融点-9.8℃の化合物である.被験物質は,使用時まで冷蔵,遮光,気密の条件下で保管された.なお,本ロットは投与期間中安定であることが確認された.
,Lot No. 702906,純度99.8 %,分子量90.20)は無色透明の液体で,沸点98〜99℃,融点-9.8℃の化合物である.被験物質は,使用時まで冷蔵,遮光,気密の条件下で保管された.なお,本ロットは投与期間中安定であることが確認された.
 から4週齢で購入した.動物を検収後,試験環境に9日間馴化させた後,6週齢で投与を開始した.動物はあらかじめ体重によって層別化し,無作為抽出法により各試験群を構成するように群分けした.投与開始時の体重は雄で142〜157 g,雌で 118〜135 gであった.
から4週齢で購入した.動物を検収後,試験環境に9日間馴化させた後,6週齢で投与を開始した.動物はあらかじめ体重によって層別化し,無作為抽出法により各試験群を構成するように群分けした.投与開始時の体重は雄で142〜157 g,雌で 118〜135 gであった.
 製造の放射線滅菌改良NIH公開ラット・マウス飼料および水道水を自由に摂取させた.飼育ケージは隔週1回,給餌器は週1回取り換えた.
製造の放射線滅菌改良NIH公開ラット・マウス飼料および水道水を自由に摂取させた.飼育ケージは隔週1回,給餌器は週1回取り換えた.
 )に溶解した.投与液の調製は毎日1回,投与前3時間以内に実施したが,投与液中の被験物質の安定性が確認されたため,投与11日以降調製を週1回に変更した.調製頻度の変更後,調製液は1日分毎に小分けをし,使用時まで冷蔵庫に保管した.
)に溶解した.投与液の調製は毎日1回,投与前3時間以内に実施したが,投与液中の被験物質の安定性が確認されたため,投与11日以降調製を週1回に変更した.調製頻度の変更後,調製液は1日分毎に小分けをし,使用時まで冷蔵庫に保管した.
 法),無機リン(モリブデン酸青法),ナトリウム(電極法),カリウム(電極法)および塩素(電極法)をEKTACHEM 700N(米国コダック社)で,クレアチニン(Jaff
法),無機リン(モリブデン酸青法),ナトリウム(電極法),カリウム(電極法)および塩素(電極法)をEKTACHEM 700N(米国コダック社)で,クレアチニン(Jaff 法),グルタミン酸オキザロ酢酸トランスアミナーゼ(GOT:IFCC法),グルタミン酸ピルビン酸トランスアミナーゼ(GPT:IFCC法),γ -グルタミルトランスペプチダーゼ(γ-GTP:Orlowski法)およびアルカリホスファターゼ(ALP:Bessey-Lowry改良法)をCentrifiChem ENCORE
法),グルタミン酸オキザロ酢酸トランスアミナーゼ(GOT:IFCC法),グルタミン酸ピルビン酸トランスアミナーゼ(GPT:IFCC法),γ -グルタミルトランスペプチダーゼ(γ-GTP:Orlowski法)およびアルカリホスファターゼ(ALP:Bessey-Lowry改良法)をCentrifiChem ENCORE (米国ベーカー社)で測定した.
(米国ベーカー社)で測定した.
 アタゴ)を用いて尿比重を測定した.また,尿を遠心分離後Sternheimer変法により沈渣を染色し,鏡検した.pH,潜血,ケトン体,糖,蛋白,ビリルビンおよびウロビリノーゲンについて,N-マルティスティックスSG試験紙(マイルス・三共
アタゴ)を用いて尿比重を測定した.また,尿を遠心分離後Sternheimer変法により沈渣を染色し,鏡検した.pH,潜血,ケトン体,糖,蛋白,ビリルビンおよびウロビリノーゲンについて,N-マルティスティックスSG試験紙(マイルス・三共 )およびCLINITEK 200(米国マイルス社)を用いて測定した.
)およびCLINITEK 200(米国マイルス社)を用いて測定した.
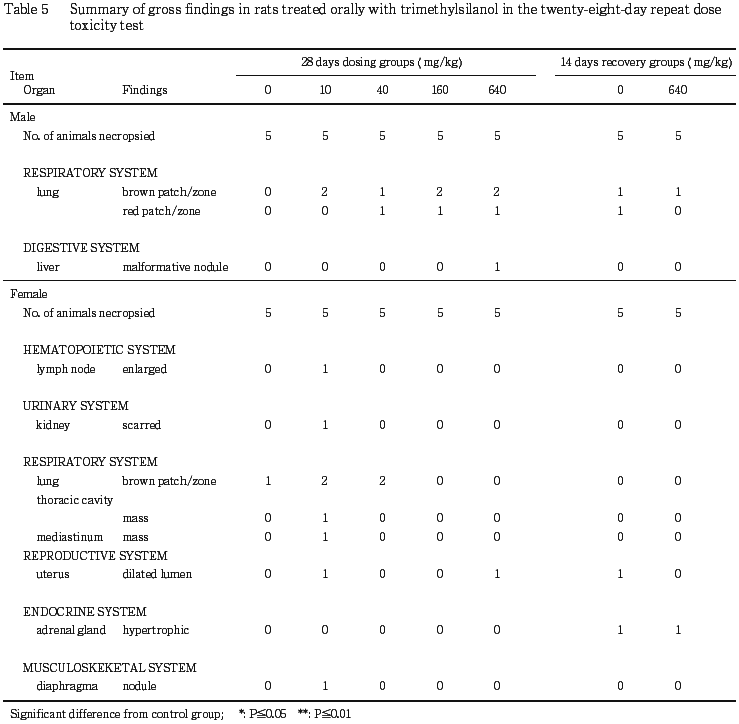
病理組織学検査は固定した器官・組織のうち,投与期間終了時に解剖した対照群および640 mg/kg群の胸腺,心臓,肝臓,脾臓,腎臓,副腎および骨髄(大腿骨)について検索した.なお,投与期間終了時の肉眼所見において,肺に褐色斑/区域および赤色斑/区域が雄の投与群で観察された.また,雌では対照群にも肺の褐色斑/区域が観察された.さらに,病理組織学検査の結果,雄では腎臓の好酸性小体が,対照群と比べ最高用量群で僅かに多く観察された.したがって,雌雄の肺,雄の腎臓についてその他の投与群および回復群の病理組織学検査を実施した.常法に従って薄切標本を作製し,ヘマトキシリン・エオジンで染色した後,鏡検した.上述の染色に加え,対照群および640 mg/kg群の腎臓について,a 2μグロブリン抗体による免疫組織化学染色を実施した.
雌の640 mg/kg群では,投与初日に軽度(±),投与3日に中等度(+)のよろめき歩行を示す例が認められ,さらに,投与2日に軽度(±),投与3日に中等度(+)の自発運動低下を示す例が認められた.よろめき歩行は,投与期間中ほぼ毎日観察され,投与21および28日には10例全例に観察された.自発運動低下は,投与期間中ほぼ毎日観察され,全例に観察された日も多かった.
なお,回復期間には,雌雄いずれの群にも症状は認められなかった.
雌では対照群に比較して,640 mg/kg群で投与4週間の体重増加量に低値傾向が認められたが,回復2週間の体重増加量には高値が認められた.

雌では,対照群と640 mg/kg群とでいずれの検査項目にも差が認められなかった.
雌では対照群に比較して,640 mg/kg群で胸腺重量の低値が認められた.
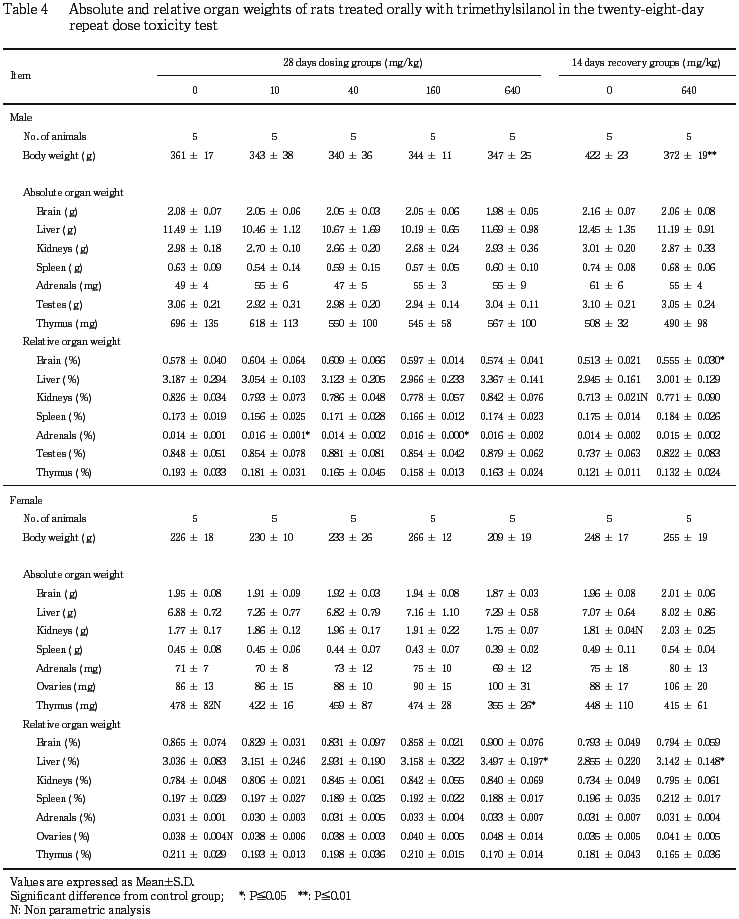
雌では対照群に比較して,640 mg/kg群で肝臓相対重量の高値が認められた.
雌では対照群に比較して,640 mg/kg群で肝臓相対重量の高値が認められた.

体重は,雄の640 mg/kg群で投与期間後半に低値傾向が認められ,回復期間においてもその差は縮まらず,回復は認められなかったものと判断された.また,雌の640 mg/kg群においても投与期間に低値傾向が認められたが,回復期間には回復が認められた.
摂餌量測定の結果,雌雄とも投与期間においては,被験物質投与による影響は認められなかった.なお,回復期間の雌の640 mg/kg群の高値は,体重高値に対応したものであった.
血液学検査の結果,投与期間終了時の検査では雌雄とも被験物質投与による影響は認められなかった.回復期間終了時に雄の640 mg/kg群でMCVが低値を示し,白血球数が高値を示したが,いずれも投与期間終了時には認められなかった変化であること,変化の程度も僅かであることから,被験物質投与による影響ではないと判断された.
血液凝固能検査の結果,雌雄の640 mg/kg群でフィブリノーゲンが高値を示したが,炎症性疾患やネフローゼなど高値を誘起する病変が認められないことから,本試験でのフィブリノーゲン高値の原因は明らかではない.
血液生化学および尿検査では,雌雄とも投与期間および回復期間を通じて群間で差は認められず,被験物質投与の影響はなかった.
器官重量測定では,雌の640 mg/kg群で被験物質投与に起因する変化と考えられる胸腺実重量の低値が認められたが,回復期間終了時には上述の変化は回復した.また,同群で肝臓相対重量の高値が認められたが,同器官の血液生化学および病理学検査では重量増加の要因となる変化または対応所見は認められなかった.しかしながら,肝臓相対重量の高値は回復期間終了時においても認められており,毒性学的意義は不明であるが被験物質投与による影響が示唆された.その他,回復期間終了時に雄の640 mg/kg群で脳相対重量の高値が認められたが,投与期間終了時には同群で認められなかった変化であり,被験物質投与による影響ではないと判断された.
病理学検査の結果,対照群と比較して投与群に明らかに多くみられた所見はなかった.なお,雄では腎臓の好酸性小体が対照群に比べて最高用量群でわずかに多く観察された.この腎臓の好酸性小体[外国では hyaline body の一種とされている3)]は,a 2μグロブリンの存在が証明されている4).雄のラットにD-リモネンや無鉛ガソリンなどの化学物質を投与すると近位尿細管内に好酸性小体が激増するといわれている5).本試験でも用量に対応して増加するようにもみられるが,統計学的に有意な増加や程度の増強は観察されていない.また,a 2μグロブリン抗体による免疫染色でも,被験物質投与群にみられた好酸性小体(エオジン好性小滴)は対照群と同様に陽性反応を示すことから被験物質投与の影響とは考えられなかった.
一方,投与期間終了時の肉眼所見において特に雄の投与群で多く発生した肺の褐色斑/区域は,直径1〜2 mm程度の褐色あるいは黒色調の小さな斑点が単一あるいは少数個観察されたものであり,組織学的には限局性の出血,その周囲間質への炎症細胞浸潤などで説明される変化と考えられた.これらの組織変化は,雌雄とも発生率および程度に群間の明確な差はみられなかったことから,被験物質投与による変化ではなく,自然発生的な変化と考えた.
その他に観察された所見も発生率および程度に用量相関性は認められずすべて自然発生性病変と考えられた.
以上の結果から,雌雄とも640 mg/kg群で被験物質投与の影響が明確に認められたことから,トリメチルシラノールの無影響量(NOEL)は160 mg/kg/dayと判断された.
| 1) | 佐野正樹, 岡山佳弘, 医薬安全性研究会会報, 32, 21, (1990). |
| 2) | M.Yoshida, J.J. Soc. comp. Stat., 1, 111,(1988). |
| 3) | 渡辺満利, "泌尿器系, 毒性病理学," 前川昭彦, 林裕造編, 地人書館, 1991, p. 229. |
| 4) | 伊東信行, "腎臓, 最新毒性病理学," 中山書店, 1994, p. 200. |
| 5) | C.L. Alden and C.H. Frith, "Urinary System, Handbook of toxicologic pathology," ed. by W.M. Haschek and C.G. Rousseaux, Academic Press, Inc., San Diego, 1991, pp. 340-342. |
| 連絡先 | |||
| 試験責任者: | 大庭耕輔 | ||
| 試験担当者: | 各務 進, 庄子明徳, 渡 修明, 小林和雄, 岩田 聖 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田郡福田町塩新田字荒浜582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | ||||
| Authors: | Kousuke Oba(Study director), Susumu Kakamu, Akinori Shoji, Nobuaki Watari, Kazuo Kobayashi, Hijiri Iwata | |||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-pyo Center) | ||||
| 582-2 Arahama, Shioshinden, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan | ||||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |||