メタクリル酸2,3-エポキシプロピルエステルの雄および雌マウスにおける最大耐量は,それぞれ750 mg/kg および1000 mg/kgであった.雄および雌マウスにそれぞれメタクリル酸2,3-エポキシプロピルエステルの最大耐量を投与し,投与後24,48および72時間に骨髄の塗抹標本を作製した.小核出現頻度(小核を有する幼若赤血球の比率)は,24時間群と比較し他の時間群では明らかな増加が認められた.また,赤血球中に占める幼若赤血球の比率を指標とした骨髄細胞の増殖抑制も認められた.これらの結果から,小核本試験での最高用量を雄雌それぞれ750および1000 mg/kgとし,標本作製時期をいずれも投与後48時間に決定した.
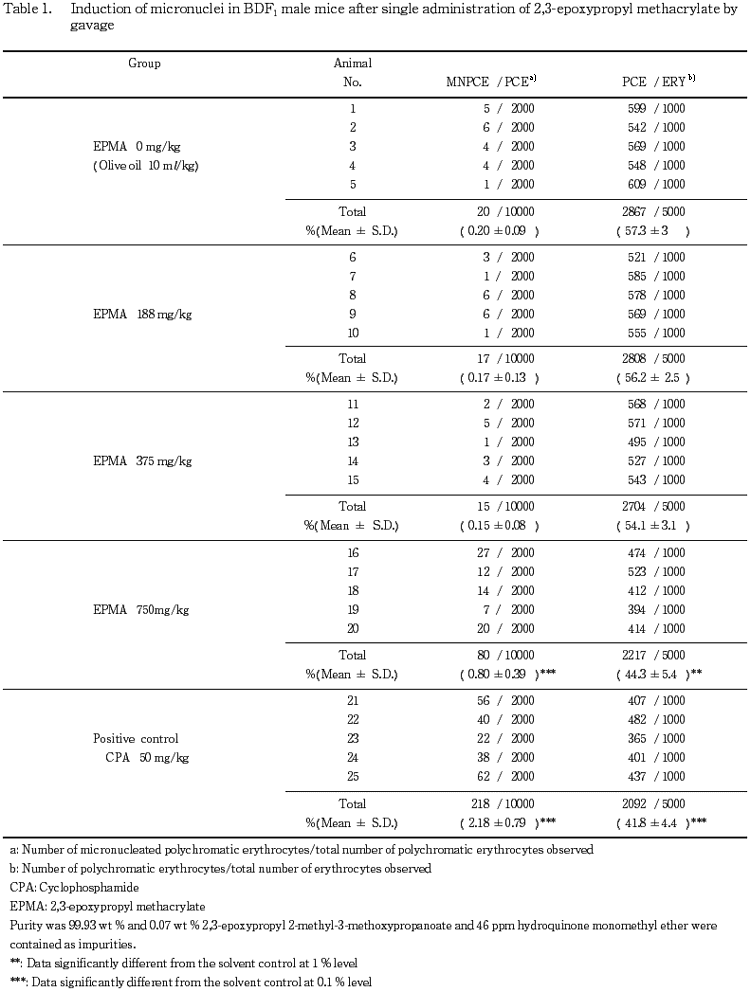
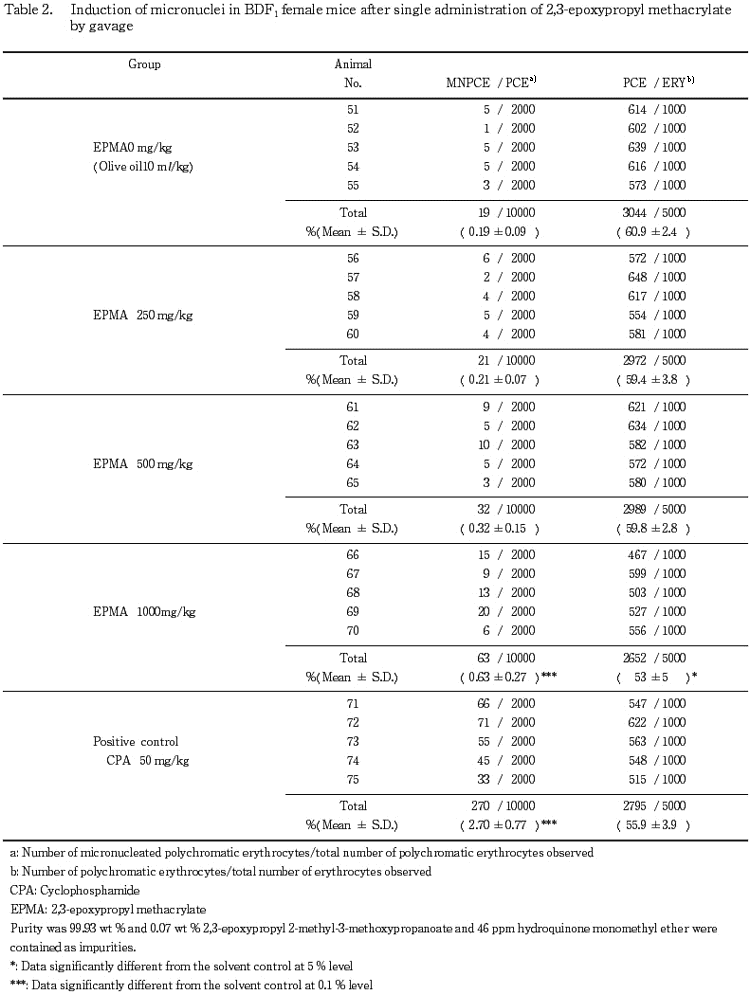
その結果,小核出現頻度は,雄雌いずれにおいても,メタクリル酸2,3-エポキシプロピルエステルの高用量群で,溶媒対照群と比較して統計学的に有意な増加が認められ,用量依存性も認められた.また,全赤血球中に占める幼若赤血球の比率は,雄雌ともにメタクリル酸2,3-エポキシプロピルエステルの高用量群において,溶媒対照群との間に有意な低下が認められた.
以上の結果より,本試験条件下では,メタクリル酸2,3-エポキシプロピルエステルは,Crj:BDF1雄および雌マウスの骨髄細胞において,染色体異常誘発作用あるいは紡錘体形成阻害作用を示し,さらに高用量において,骨髄細胞の増殖抑制作用も有するものと判定された.
動物は,床敷としてホワイト・フレーク(R)(CRJ)を入れたTPX樹脂製ケージ,CRJ)に1匹ずつ収容し,バリアーシステムの飼育室(設定温度:23±1℃,設定湿度:50〜65%,換気回数:約15回/時間,明暗サイクル:午前7時点灯,午後7時消灯)で,マウス繁殖用固型飼料(NMF)と水道水を自由に摂取させて飼育した.動物の群分けは自由群分け(無作為抽出)により行った.
被験物質の安定性は,試験終了後に日本油脂(株)において確認された.
骨髄標本はそれぞれの個体について,コード化した後,2名の観察者により観察した.1個体あたり2000個の幼若赤血球(polychromatic erythrocytes)を観察し,その中の小核を有するものの数を記録した.また赤血球を1個体あたり1000個観察し,そのなかの幼若赤血球の比率を調べて,骨髄細胞の増殖抑制の指標とした.
小核出現頻度に関しては,24時間群と比較し,48および72時間群では明らかな増加が認められた.また,雄の72時間群において,骨髄細胞の増殖抑制が強く認められたこと,および多くの化学物質で小核が投与後48時間以内に誘発されていることから,雄雌ともに小核本試験における標本作製時期を投与後48時間(陽性対照群においては24時間)に決定した.また,メタクリル酸2,3-エポキシプロピルエステルの750あるいは1000 mg/kg投与により,いずれの時間群においても,骨髄細胞の増殖抑制が認められたが,幼若赤血球の比率が10%まで低下しておらず,観察は可能であったことにより,小核本試験に用いるメタクリル酸2,3-エポキシプロピルエステルの最高用量を雄および雌について,それぞれ750,1000mg/kgと決定した.
雄雌ともに小核出現頻度は,Fisherの正確確率検定法(Bonferroni の補正)による有意差検定の結果,メタクリル酸2,3-エポキシプロピルエステルの高用量群において,溶媒対照群と比較して統計学的に有意な増加が認められた.さらに,Cochran-Armitageの傾向検定の結果においても,小核出現頻度はメタクリル酸2,3-エポキシプロピルエステルの用量に依存した有意な増加傾向が認められた.一方,CPAを50 mg/kg投与した陽性対照群での小核出現頻度も,雄雌ともに有意な増加がみられた.
赤血球中に占める幼若赤血球の比率は,メタクリル酸2,3-エポキシプロピルエステルの高用量群および雄マウスの陽性対照群において溶媒対照群との間で有意に低下した.
メタクリル酸2,3-エポキシプロピルエステルの変異原性について,Canterら8)は Ames 試験を行い,S9 mix無添加の条件下でTA100およびTA1535において,強い陽性の結果を得ている.また,von der Hudeら9)は,大腸菌を用いたSOS修復誘発試験でも用量依存性のある陽性の結果を得ている.さらに,本毒性調査事業で実施された培養細胞を用いる染色体異常試験において,メタクリル酸2,3-エポキシプロピルエステルはS9 mix無添加の連続処理において,用量依存的に構造異常を誘発することが認められている10).
今回の小核試験および他の変異原性試験の結果から,メタクリル酸2,3-エポキシプロピルエステルはマウス骨髄細胞DNAに作用して,染色体異常を誘発し,小核形成を用量依存的に誘発した可能性が考えられる.

| 1) | W. Schmid, Mutat. Res., 31, 9(1975). |
| 2) | W. Schmid, "Chemical Mutagens," Vol. 4, ed. by A. Hollaender, Plenum Press, N.Y., London, 1976, pp.76-78. |
| 3) | M. Hayashi, T. Sofuni, M. Ishidate, Jr., Mutat. Res., 120, 241(1983). |
| 4) | 林 真,"小核試験," サイエンティスト社,東京,1991, pp.44-55. |
| 5) | 吉村 功 編, "毒性・薬効データの統計解析," サイエンティスト社,東京,1987,pp.76-78. |
| 6) | 吉村 功,大橋靖雄 責任編集:"毒性試験講座14,毒性試験データの統計解析," 地人書館,東京, 1992,p.108. |
| 7) | 吉村 功 編, "毒性・薬効データの統計解析," サイエンティスト社,東京,1987,pp.67-69. |
| 8) | D.A. Canter, E. Zeiger, S. Haworth, T. Lawlor, K. Mortelmans, W. Speck, Mutat. Res., 172, 105(1986). |
| 9) | W. von der Hude, A. Seelbach, A. Basler, Mutat. Res., 231, 205(1990). |
| 10) | 秦野研究所,食薬セ研第8-188号(G-95-014), (1996). |
| 連絡先 | |||
| 試験責任者: | 澁谷 徹 | ||
| 試験担当者: | 堀谷尚古,原 巧,関野早苗 | ||
| Correspondence | |||
| Authors: | Tohru Shibuya(Study Director) Naoko Horiya, Takumi Hara, Sanae Sekino | ||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano-shi, Kanagawa 257 Japan | |||
| Tel:+81-463-82-4751 | FAX:+81-463-82-9627 | ||