アジピン酸ジブチルの
チャイニーズ・ハムスター培養細胞を用いる染色体異常試験
In Vitro Chromosomal Aberration Test of
Dibutyl adipate on Cultured Chinese Hamster Cells
要約
既存化学物質安全性点検に係る毒性調査事業の一環として,アジピン酸ジブチルの培養細胞に及ぼす細胞遺伝学的影響を評価するため,チャイニーズ・ハムスター培養細胞(CHL/IU)を用いて試験管内染色体異常試験を実施した.
連続処理(24および48時間),短時間処理(6時間)のS9 mix存在下では,10 mM(2.6 mg/ml)の濃度においても50%を明らかに越える増殖抑制が認められなかったため,2.6 mg/mlの濃度を最高処理濃度とした.一方,S9 mix 非存在下においては50%を越える増殖抑制濃度,すなわち0.046 mg/ml の濃度を最高処理濃度とした.最高処理濃度の 1/2 および1/4をそれぞれ中濃度,低濃度として設定した.連続処理として,S9 mix 非存在下における24時間および48時間連続処理,短時間処理としてS9 mix 存在下および非存在下で6時間処理(18時間の回復時間)後,標本を作製し,検鏡することにより染色体異常誘発性を検討した.
CHL/IU細胞を,24時間および48時間処理したすべての処理群において,染色体の構造異常や倍数性細胞の誘発作用は認められなかった.また,短時間処理のS9mix非存在下で6時間処理したすべての処理群において,構造異常や倍数性細胞の誘発作用は認められなかった.一方,S9 mix 存在下の低濃度群および中濃度群においては,構造異常の誘発作用が認められた.
以上の結果より,アジピン酸ジブチルは,上記の試験条件下で染色体異常を誘発すると結論した.
方法
1.使用した細胞
リサーチ・リソースバンク(JCRB)から入手(1988年2月,入手時:継代 4代,現在12代)したチャイニーズ・ハムスター由来のCHL/IU 細胞を,解凍後継代 10代以内で試験に用いた.
2.培養液の調製
培養には,牛胎児血清(FCS:JRH BIOSCIENCES)を 10% 添加したイーグル MEM 培養液(日水製薬(株))を用いた.
3.培養条件
2×10^4個のCHL/IU 細胞を,培養液5 mlを入れたディッシュ(径 6 cm,Corning)に播き,37℃のCO2インキュベーター (5% CO2 ) 内で培養した.連続処理では,細胞播種3日目に被験物質を加え,24時間および48時間処理した.また,短時間処理では,細胞播種3日目にS9 mix存在下および非存在下で6時間処理し,処理終了後,新鮮な培養液で,さらに18時間培養した.
4.被験物質
アジピン酸ジブチル(略号:DBA,CAS No.: 105-99-7,ロット番号:N-41001,大八化学工業(株)製造,(社)日本化学工業協会提供)は,無色透明液体で,水に難溶,アセトンおよびジメチルスルホキシド(DMSO)に可溶,凝固点-22℃,沸点145℃/4 mmHg,分子式 C14H26O4,分子量 258.40,純度 99.8%(不純物:不明)の物質である.被験物質原体は常温で安定(有効期限納入後3か月)であり,溶媒中(DMSO)では,2.3〜520 mg/ml の濃度範囲で4時間は安定であった.
5.被験物質の調製
被験物質の調製は,使用のつど行った.溶媒はDMSO(Sigma Chemical Co.)を用いた.原体を溶媒に溶解して原液を調製し,ついで原液を溶媒で順次希釈して所定の濃度の被験物質調製液を作製した.被験物質調製液は,すべての試験において培養液の 0.5% (v/v) になるように加えた.染色体異常試験に用いた被験物質調製液の濃度は,許容範囲内(溶媒中での平均含量が添加量の 90.0〜110%)の値であった.なお,濃度の記載について,純度換算は行わなかった.
6.細胞増殖抑制試験による処理濃度の決定
染色体異常試験に用いる被験物質の処理濃度を決定するため,被験物質の細胞増殖に及ぼす影響を調べた.被験物質の CHL/IU 細胞に対する増殖抑制作用は,単層培養細胞密度計(MonocellaterTM,オリンパス光学工業(株))を用いて各群の増殖度を計測し,被験物質処理群の溶媒対照群に対する細胞増殖の比をもって指標とした.
その結果,連続処理(48時間)および短時間処理(6時間)のS9 mix存在下では,2.6 mg/ml(10 mM)の濃度において,それぞれ47.0%および44.0%の増殖抑制が認められた.また,短時間処理の S9 mix 非存在下における50%の増殖抑制濃度を明らかに越える濃度(約60%の増殖抑制濃度)を,60%の増殖抑制濃度をはさむ2点の値より算出したところ 0.046 mg/mlであった(Fig. 1,2).
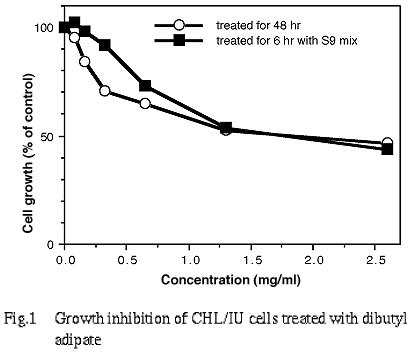
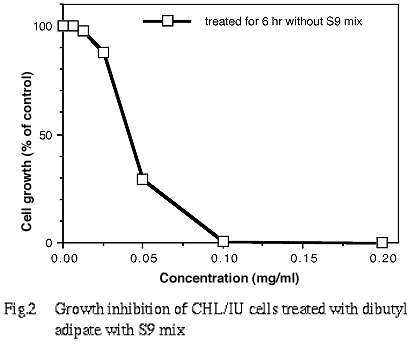
7.実験群の設定
細胞増殖抑制試験の結果より,染色体異常試験で用いる被験物質の高濃度群を,連続処理および短時間処理の S9 mix 存在下では 2.6 mg/ml,短時間処理の S9 mix 非存在下では 0.046 mg/ml とし,それぞれ高濃度群の 1/2 の濃度を中濃度,1/4 の濃度を低濃度とした.陽性対照物質として用いたマイトマイシン(MC,協和醗酵工業(株))およびシクロホスファミド(CPA,Sigma Chemical Co.)は,注射用水((株)大塚製薬工場)に溶解して調製した.それぞれ染色体異常を誘発することが知られている濃度を適用した.
8.染色体標本作製法
培養終了の 2時間前に,コルセミドを最終濃度が約 0.1 μg/ml になるように培養液に加えた.染色体標本の作製は常法に従って行った.スライド標本は各ディッシュにつき6枚作製した.作製した標本を3%ギムザ液で染色した.
9.染色体分析
作製したスライド標本のうち,1つのディッシュから得られた異なるスライドを,4名の観察者がそれぞれ処理条件が分からないようにコード化した状態で分析した.染色体の分析は,日本環境変異原学会,哺乳動物試験(MMS)分科会1)による分類法に基づいて行い,染色体型あるいは染色分体型のギャップ,切断,交換などの構造異常の有無と倍数性細胞(polyploid)の有無について観察した.また構造異常については, 1群 200個,倍数性細胞については 1群 800個の分裂中期細胞を分析することとした.
10.記録と判定
無処理対照,溶媒および陽性対照群と被験物質処理群についての分析結果は,観察した細胞数,構造異常の種類と数,倍数性細胞の数について集計し,各群の値を記録用紙に記入した.染色体異常を有する細胞の出現頻度について,フィッシャーの exact probability test 法により,溶媒対照群と被験物質処理群間および溶媒対照群と陽性対照群の有意差検定(p<0.05)を行った.被験物質の染色体異常誘発性についての判定は,石館ら2)の判定基準に従い,染色体異常を有する細胞の頻度が 5% 未満を陰性,5% 以上 10% 未満を疑陽性,10% 以上を陽性とした.
結果および考察
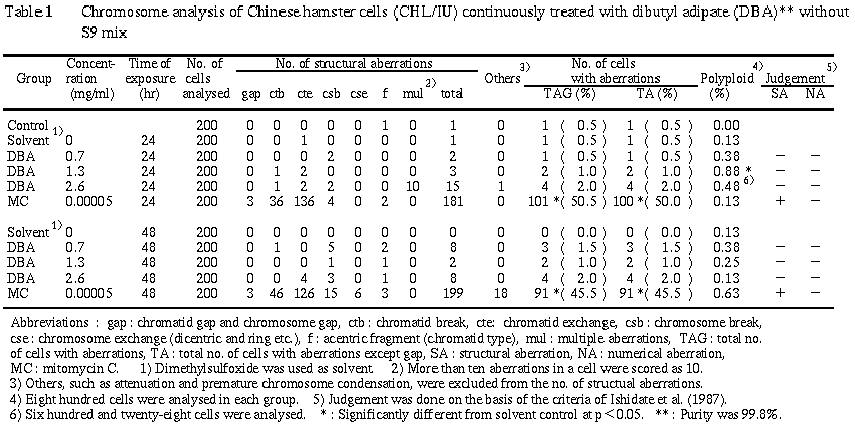
連続処理による染色体分析の結果を Table 1 に示した.
アジピン酸ジブチルを加えて24時間および48時間連続処理したすべての群で,染色体の構造異常および倍数性細胞の誘発は認められなかった.
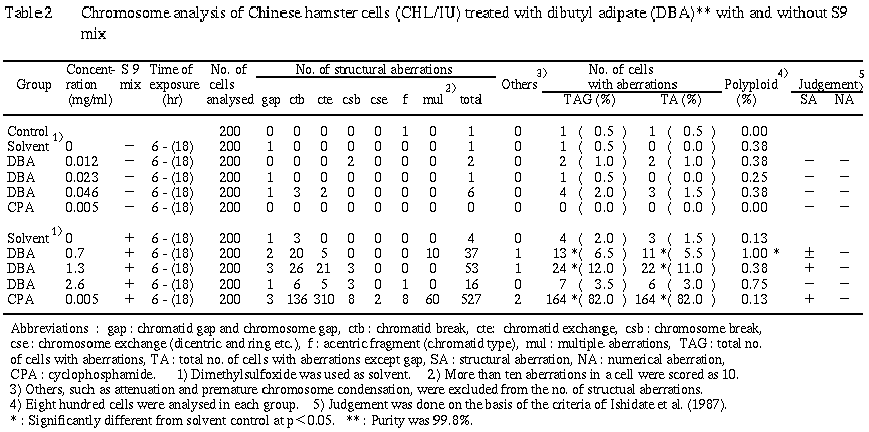
短時間処理による染色体分析の結果を Table 2に示した.
アジピン酸ジブチルを加えて S9 mix非存在下で6時間処理したすべての処理群で,染色体の構造異常および倍数性細胞の誘発作用は認められなかった.また,S9 mix存在下の低濃度群および中濃度群においては,観察した細胞のそれぞれ6.5%および12.0%(gapを含む)に,染色体の構造異常の誘発が認められた.一方,60%以上の増殖抑制を示す2.6 mg/mlの高濃度群では,分裂抑制もしくはその他の理由により染色体異常の増加は認められなかった.
従って,アジピン酸ジブチルは代謝されて活性化し,上記の試験条件下で,試験管内の CHL/IU 細胞に染色体異常を誘発すると結論した.
文献
| 1) | 日本環境変異原学会・哺乳動物試験分科会編, "化学物質による染色体異常アトラス," 朝倉書店, 東京, 1988. |
| 2) | 石館 基 監修, "〈改訂〉染色体異常試験データ集," エル・アイ・シー社, 東京, 1987. |
| 連絡先 |
| 試験責任者: | 田中憲穂 |
| 試験担当者: | 山影康次,若栗 忍,日下部博一,橋本恵子 |
| (財)食品薬品安全センター秦野研究所 |
| 〒257 神奈川県秦野市落合 729-5 |
| Tel 0463-82-4751 | Fax 0463-82-9627 | |
| Correspondence |
| Authors : | Noriho Tanaka ( Study director )
Kohji Yamakage, Shinobu Wakuri,Hirokazu Kusakabe, Keiko Hashimoto, |
| Hatano Research Institute, Food and Drug Safety Center |
| 729-5 Ochiai, Hadano, Kanagawa, 257, Japan |
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |




