N,N-ジメチルベンジルアミンの
細菌を用いる復帰突然変異試験
Reverse Mutation Test of N,N-Dimethylbenzylamine on Bacteria
要約
N,N-ジメチルベンジルアミンについて,細菌を用いる復帰突然変異試験を実施した.
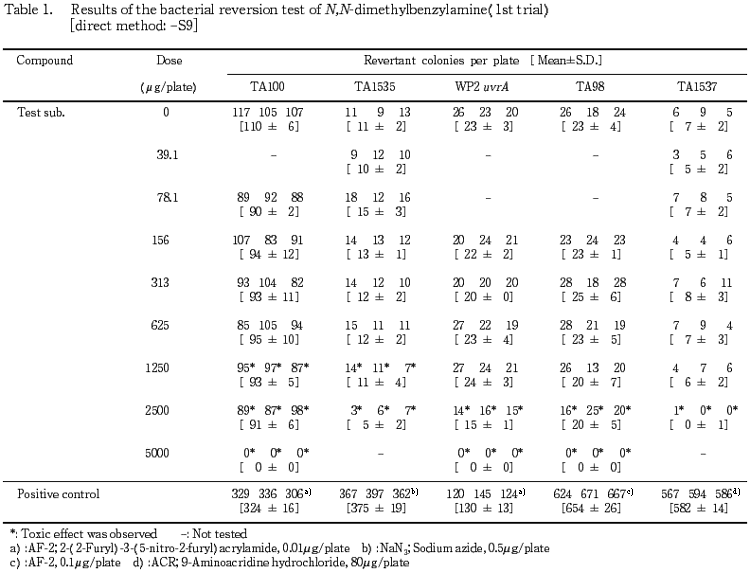
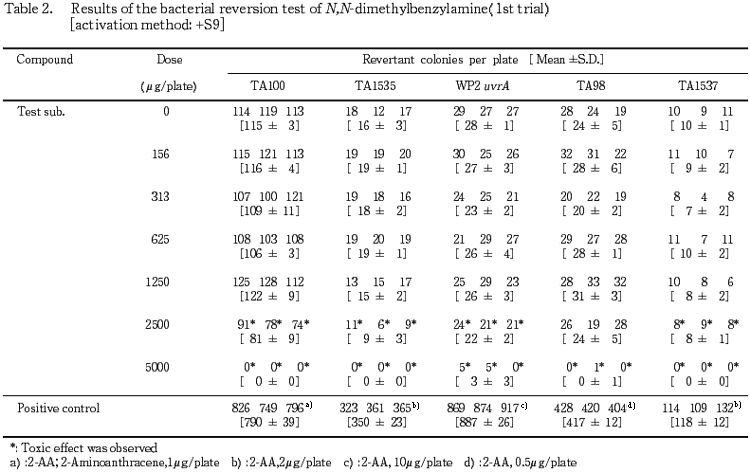
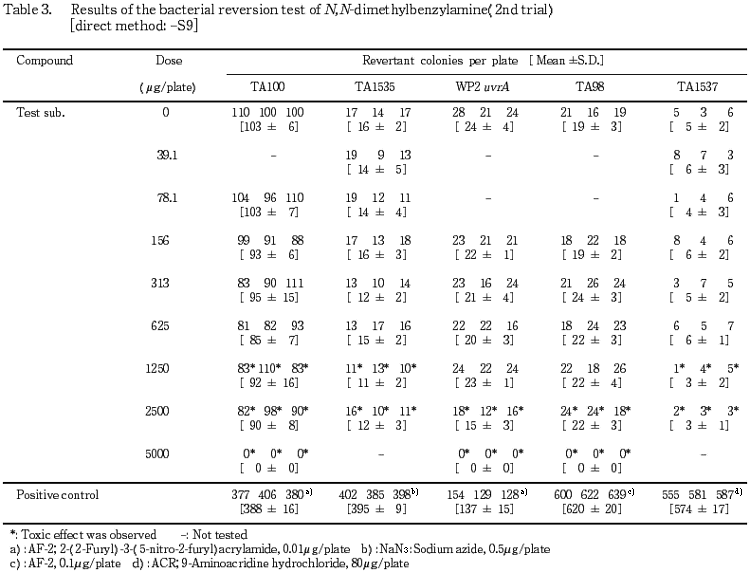
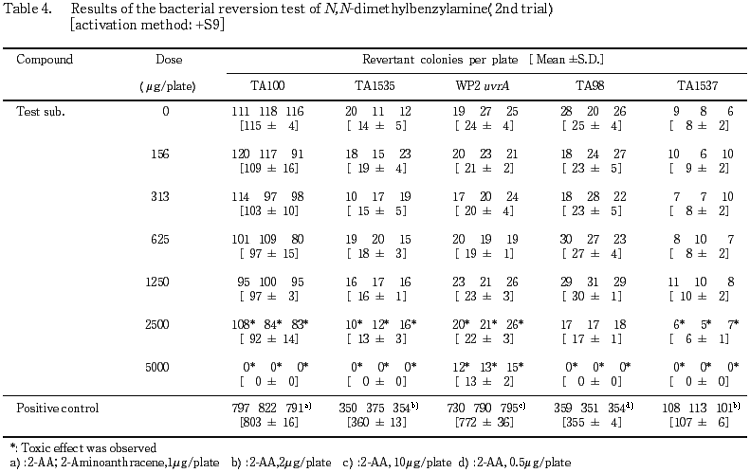
検定菌として,Salmonella typhimurium(TA100,TA98,TA1535,TA1537)およびEscherichia coli(WP2 uvrA)の5菌株を用い,用量設定試験の結果をもとに,本試験ではS9 mix無添加群のTA100で78.1〜5000 μg/plateの7用量,同群のTA1535およびTA1537で 39.1〜2500 μg/plateの7用量,同群のWP2 uvrAおよびTA98ならびにS9 mix添加群の各試験菌株でそれぞれ156〜5000 μg/plateの6用量で試験を実施した.
その結果,S9 mix無添加群および添加群のいずれにおいても,溶媒対照に比べ復帰突然変異コロニー数の明確な増加は認められなかった.
以上の結果より,本試験条件下ではN,N-ジメチルベンジルアミンは,変異原性を有しない(陰性)と結論した.
方法
1. 試験菌株
細菌を用いる復帰突然変異試験に広く使用されていることから,試験菌株としてヒスチジン要求性のSalmonella typhimurium TA100,TA98,TA1535およびTA1537 1)ならびにトリプトファン要求性のEscherichia coli WP2 uvrA 2)の5種類の菌株を選択した.
ネズミチフス菌は昭和58年9月9日にカリフォルニア大学のB.N.Ames教授から,また,大腸菌については昭和58年3月16日に国立衛生試験所から分与を受けた.平成7年9月5日に菌株の特性検査を実施し,本試験に用いた菌株が規定の特性を保持していることを確認した.各菌株の菌懸濁液はジメチルスルホキシド(DMSO:MERCK社)を添加した後,凍結保存用チューブに0.2 mlずつ分注した.これを液体窒素を用いて凍結し,超低温フリーザーに-80℃で保存した.
2. 培地の調製
1) 最少グルコース寒天平板培地(プレート)
日清製粉(株)製のテスメディアAN培地を購入し,試験に用いた.本プレートは,Vogel-Bonnerの最少培地Eを含む水溶液(0.02%硫酸マグネシウム・7水塩,0.2%クエン酸・1水塩,1%リン酸二カリウム・無水塩,0.192%リン酸一アンモニウム,0.066%水酸化ナトリウム 〔いずれも最終濃度〕)に2%のグルコース(和光純薬工業(株))と1.5%の寒天(UNIPATH社:No. 1)を加え,30 mlをシャーレに分注したものである.
2) トップアガー(軟寒天)
Bacto-agar(DIFCO社)0.6%を含む0.5%塩化ナトリウム水溶液10容量に対し,ネズミチフス菌を用いる試験の場合,0.5 mM L-ヒスチジン(関東化学(株))-0.5 mM D-ビオチン(関東化学(株))水溶液を1容量加え,大腸菌を用いる試験の場合,0.5 mM L-トリプトファン(関東化学(株))水溶液を同じく1容量加え用いた.
3. 前培養条件
内容量200 mlの円筒容器(ストレージボトル:Corning Costar社)に2.5%ニュートリエントブロス(UNIPATH社)溶液を25 ml分注し,これに融解した菌懸濁液を50 μl接種した.ウォーターバスシェーカー(MM-10:タイテック(株))を用い,37℃で8時間振盪(往復振盪:120回/分)培養し,試験に使用した.
4. S9 mix
製造後6ヵ月以内のキッコーマン(株)製S9 mixを試験に使用した.S9 mix中のS9は誘導剤としてフェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague-Dawley系雄ラットの肝臓から調製されたものである.S9 mixの組成を以下に示す.
| 成 分 | S9 mix 1 ml中の量 |
| S9 | 0.1 ml |
| MgCl2 | 8 μmol |
| KCl | 33 μmol |
| G-6-P | 5 μmol |
| NADPH | 4 μmol |
| NADH | 4 μmol |
| リン酸緩衝Na-液(pH 7.4) | 100 μmol |
| 精製水 | 残 量 |
5. 被験物質
被験物質のN,N-ジメチルベンジルアミン(ロット番号:50502,CAS No.:103-83-3)は分子式C9H13N,分子量135.23,純度99.93 wt%の液体である.広栄化学工業(株)から提供された被験物質を使用した.試験終了後,被験物質提供元において残余被験物質を分析した結果,安定性に問題はなかった.
6. 被験物質溶液の調製
DMSOに被験物質を溶解して調製原液とした.調製原液を使用溶媒を用いて順次所定濃度に希釈した後,直ちに処理を行った(用時調製).
7.試験用量の設定
4.88,19.5,78.1,313および1250 μg/プレートの用量を用いて予備的な試験を実施した.その結果,S9 mix無添加群のTA1535およびTA1537で1250 μg/プレートにおいて試験菌株に対する生育阻害作用が観察された.
従って,本試験においてはS9 mix無添加群のTA1535およびTA1537で2500 μg/プレート,同群の他の試験菌株ならびにS9 mix添加群の各試験菌株について5000 μg/プレートを最高用量とし,それぞれ6〜7用量(公比2)を設定した.
8. 陽性対照物質
陽性対照物質として下記に示した物質を使用した.これらの陽性対照物質は,DMSOを用いて溶解し,少量ずつ分注した後凍結保存(-20℃)した.
| 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド(AF-2:和光純薬工業(株)) |
| アジ化ナトリウム(NaN3:和光純薬工業(株)) |
| 9-アミノアクリジン(ACR:ALDRICH社) |
| 2-アミノアントラセン(2-AA:和光純薬工業(株)) |
9. 試験方法
Amesらの原法の改良法であるプレインキュベーション法 1)に準じて,S9 mix無添加群および添加群それぞれについて試験を実施した.試験管に,使用溶媒,被験物質溶液あるいは陽性対照物質溶液を100 μl,次いでS9 mix無添加群の場合,0.1 M ナトリウム・リン酸緩衝液(pH7.4)を500 μl,S9 mix添加群の場合,S9 mixを500 μlおよび試験菌液100 μlを加え,37℃で20分間振盪培養(プレインキュベーション)した.培養終了後,トップアガーを2 ml添加し,混合液をプレート上に重層した.37℃の条件で48時間各プレートを培養した後,被験物質の試験菌株に対する生育阻害作用を確認するため,実体顕微鏡(× 60)を用いてプレート上の試験菌株の生育状態を観察した.次いで,復帰突然変異により生じたコロニーを計数した.計測に際してはコロニーアナライザー(CA-11:システムサイエンス(株))を用いた.独立して試験を2回実施した.
10. 結果の解析
復帰突然変異コロニー数が溶媒対照のほぼ2倍以上に増加し,かつ,再現性あるいは被験物質の用量に依存性が認められた場合に,陽性と判定した.
なお,統計学的手法を用いた検定は実施しなかった.
結果および考察
1回目の試験結果をTable 1〜2に,2回目の試験結果をTable 3〜4に示した.S9 mix無添加群ならびに添加群のいずれも高用量群において,N,N-ジメチルベンジルアミン処理による生育阻害作用が観察された.また,復帰突然変異コロニー数については,S9 mix無添加群,S9 mix添加群とも溶媒対照と同等の値であり,明確な増加傾向は認められなかった.一方,陽性対照物質はそれぞれの試験菌株において,溶媒対照群の2倍以上の復帰突然変異コロニーを誘発した.なお,試験中析出等の特筆すべき変化は観察されなかった.以上の試験結果から,本試験条件下において,N,N-ジメチルベンジルアミンの微生物に対する遺伝子突然変異に関し,陰性と判定した.
文献
| 1) | D.M.Maron and B.N.Ames,Mutat.Res.,113,173(1983). |
| 2) | M.H.L.Green and W.J.Muriel,Mutat.Res.,38, 3(1976). |
| 連絡先 |
| 試験責任者: | 中嶋 圓 |
| 試験担当者: | 北沢倫世,藤原正孝,板倉真由実 |
| (財)食品農医薬品安全性評価センター |
| 〒437-12 静岡県磐田郡福田町塩新田字荒浜582-2 |
| Tel 0538-58-1266 | Fax 0538-58-1393 | |
| Correspondence |
| Authors: | Madoka Nakajima(Study director)
Michiyo Kitazawa,Masataka Fujiwara
Mayumi Itakura |
| Biosafety Research Center,Foods,Drugs and Pesticides(An-pyo Center)
|
| 582-2 Shioshinden Aza Arahama, Fukude-cho, Iwata-gun, Shizuoka, 437-12, Japan
|
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |




