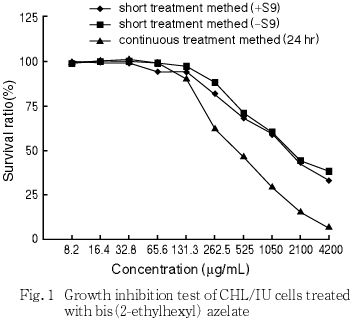
染色体異常試験に用いる濃度を決定するため,4200 μg/mL(10 mM相当)を最高濃度として細胞増殖抑制試験を行った結果,50 %細胞増殖抑制濃度は,短時間処理法のS9 mix添加では1859.0 μg/mL,S9 mix無添加では1555.5 μg/mLであった.一方,連続処理法(24時間)では534.2 μg/mLであった.このことから試験濃度は,短時間処理法のS9 mix添加および無添加では2400 μg/mL,連続処理法では600 μg/mLを最高濃度とし,公比2で5濃度設定した.また,媒体として無水エタノールを用いたため,無処置対照を設け,試験系に及ぼす無水エタノールの影響を検討した.
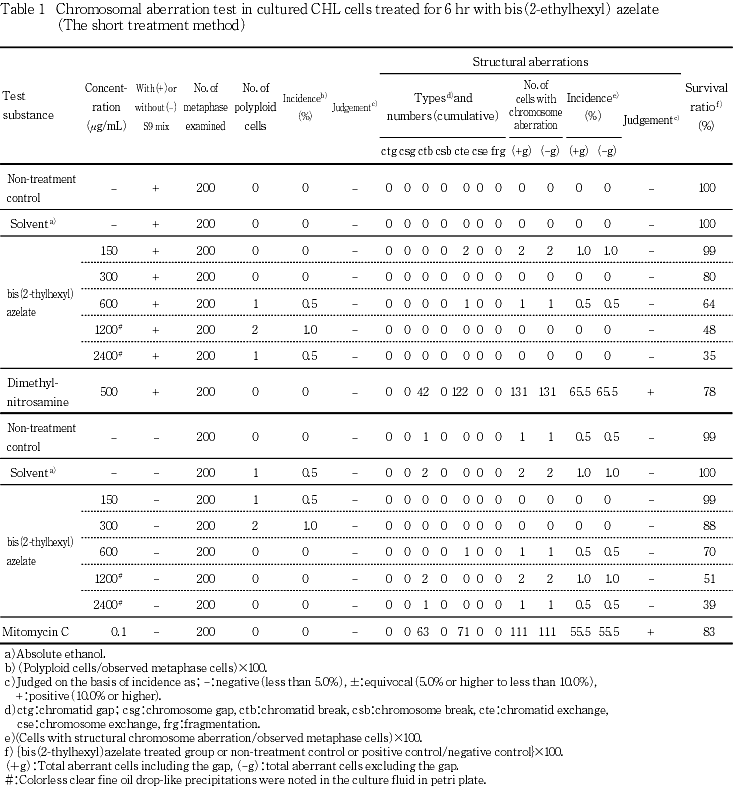
試験の結果,短時間処理法ならびに連続処理法のいずれの処理群においても,染色体の構造異常,倍数性細胞の誘発作用は認められなかった.また,媒体として用いた無水エタノールは無処置対照群と同様な値を示し,試験系に及ぼす影響は認められなかった.
以上の結果より,アゼライン酸ビス(2-エチルヘキシル)は,上記の試験条件下で染色体異常を誘発しない(陰性)と判定する.
被験物質は無水エタノール(ワコーケミカル)に用時溶解して最高濃度原液を調製し,その後,無水エタノールで順次希釈して所定の濃度の被験物質調製液を調製した.被験物質調製液は,すべての試験において培養液の1.0 vol%になるように加えた.なお,純度換算は,製法上純粋なものができないことから行わなかった.
実験終了後,残余被験物質を分析した結果,安定性に問題はなかった.
短時間処理法では,細胞播種3日後に被験物質を加え,S9 mix添加および無添加で6時間処理し,処理終了後,新鮮な培養液でさらに18時間培養した.また,連続処理法では,細胞播種3日後に被験物質を加え,24時間処理した.
その結果,50 %細胞増殖抑制濃度は,短時間処理法のS9 mix添加では1859.0 μg/mL,S9 mix無添加では1555.5 μg/mLであった.一方,連続処理法(24時間)では534.2 μg/mLであった(Fig.1).

陽性対照として,短時間処理法のS9 mix添加には,ジメチルニトロサミン(DMN,和光純薬工業)を500 μg/mL,S9 mix無添加には,マイトマイシンC(MMC,協和醗酵工業)を0.1 μg/mL,連続処理法には,MMCを0.05 μg/mLの濃度で用いた.
いずれの処理群も,各濃度3枚のディッシュに処理し,2枚を染色体標本作製,1枚を細胞増殖計測用に用いた.
なお,構造異常はギャップのみを有する細胞を含めない(-gap)場合について判定した.
また,統計学的手法を用いた検定は実施しなかった.
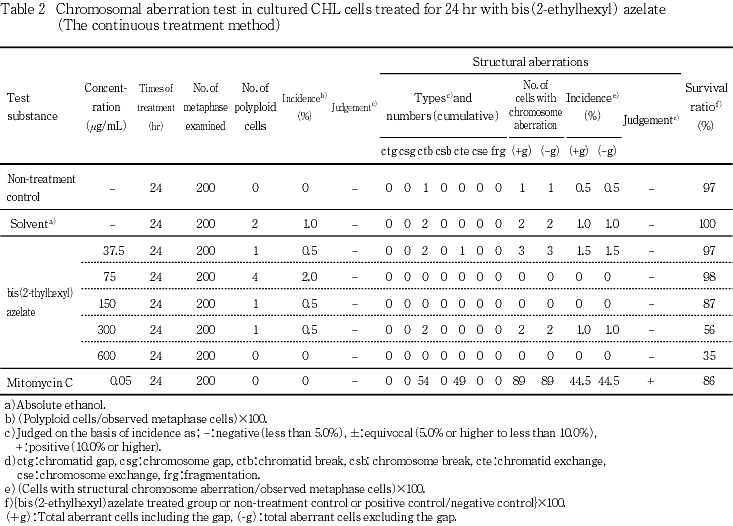
連続処理法による試験結果をTable 2に示した.アゼライン酸ビス(2-エチルヘキシル)を24時間連続処理した群においても,染色体の構造異常および数的異常の誘発性は認められなかった.また,陽性対照のMMC処理では,いずれの処理群とも染色体構造異常の顕著な誘発が認められた.
短時間処理法および連続処理法とも,媒体として用いた無水エタノールは,無処置対照群と同様な結果を示し,試験系に及ぼす影響は認められなかった.
以上の結果から,アゼライン酸ビス(2-エチルヘキシル)は本試験条件下において,染色体異常誘発性はない(陰性)と判定する.
| 1) | 日本環境変異原学会・哺乳動物試験分科会(編):「化学物質による染色体異常アトラス」朝倉書店,東京(1988)pp.16-37. |
| 2) | 石館 基(監修):「〈改定〉 染色体異常試験データー集」エル・アイ・シー,東京(1987). |
| 連絡先 | |||
| 試験責任者: | 三輪芳久 | ||
| 試験担当者: | 小林梨沙 | ||
| (株)日本バイオリサーチセンター 羽島研究所 | |||
| 〒501-6251 岐阜県羽島市福寿町間島6-104 | |||
| Tel 058-392-6222 | Fax 058-392-1284 | ||
| Correspondence | ||||
| Authors: | Yoshihisa Miwa(Study director) Risa Kobayashi | |||
| Nihon Bioresearch Inc. | ||||
| 104, 6-chome, Majima, Fukuju-cho, Hashima, Gifu, 501-6251, Japan. | ||||
| Tel +81-58-392-6222 | Fax +81-58-392-1284 | |||