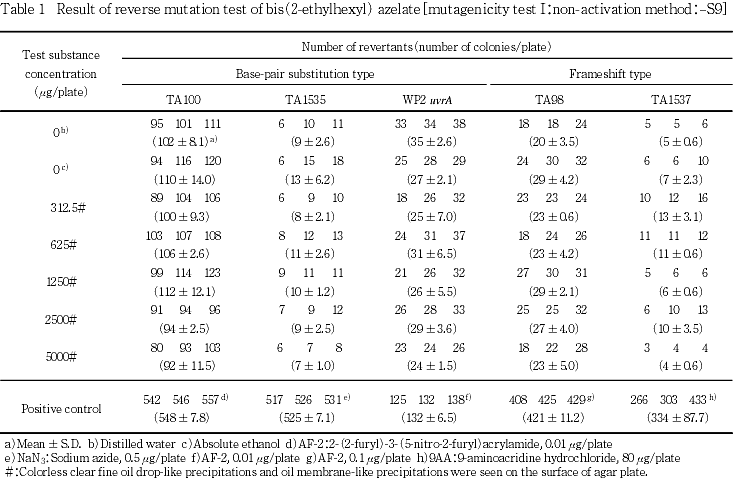
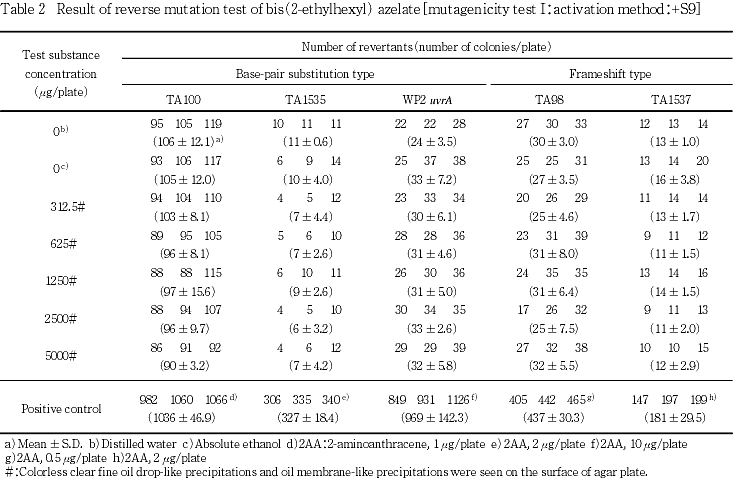
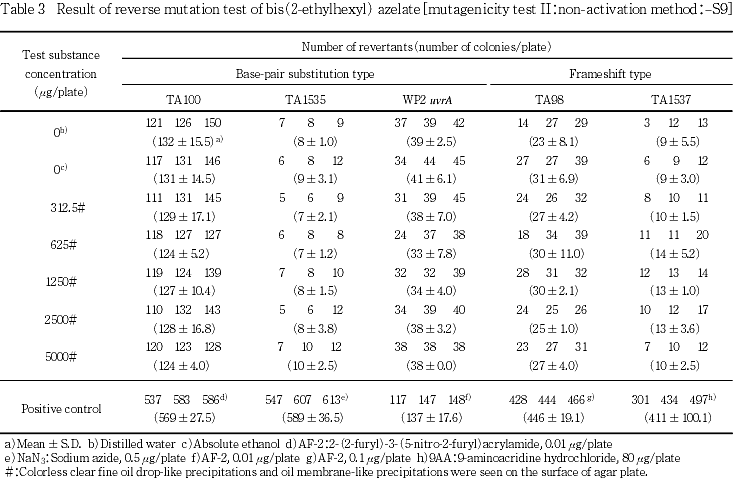
用量設定試験の結果をもとに,本試験ではS9 mix無添加および添加の場合とも,いずれの菌株も312.5〜5000 μg/plateを公比2で5濃度を設定した.
2回の本試験の結果,S9 mix無添加のおよび添加のいずれの濃度においても,復帰変異コロニー数が溶媒対照値の2倍以上に増加しなかった.
以上の結果から,アゼライン酸ビス(2-エチルヘキシル)は本試験系において変異原性を有しないもの(陰性)と結論する.
被験物質は無水エタノール(ワコーケミカル)に用時溶解して最高濃度原液を調製し,その後,無水エタノールで順次希釈して所定の濃度の被験物質調製液を調製した.なお,純度換算は,製法上純粋なものができないことから行わなかった.
実験終了後,残余被験物質を分析した結果,安定性に問題はなかった.
| 2AA | : | 2-アミノアントラセン(SIGMA) |
| NaN3 | : | アジ化ナトリウム(ナカライテスク) |
| 9AA | : | 9-アミノアクリジン(ナカライテスク) |
| AF-2 | : | 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド(和光純薬工業) |
試験に際して,L字型試験管にニュートリエントブロス(Oxoid Nutrient Broth No.2)溶液を10 mL分注し,これに凍結保存した菌懸濁液を融解して20 μLを接種した.37 ℃で8時間振盪培養した後,濁度計を用いて濁度を測定し,濁度と生菌数の換算式から1 mLあたり生菌数が1×109以上であることを確認した.
 )を購入し,使用した.なお,培地1 Lあたりの組成は下記のとおりである.
)を購入し,使用した.なお,培地1 Lあたりの組成は下記のとおりである.
| 硫酸マグネシウム・七水塩 | 0.2 g |
| クエン酸・一水塩 | 2 g |
| リン酸水素二カリウム | 10 g |
| リン酸一アンモニウム | 1.92 g |
| 水酸化ナトリウム | 0.66 g |
| グルコース | 20 g |
| 寒天 | 15 g |
 ,オリエンタル酵母工業)を注射用水で溶解して,使用直前にS9 を加えて調製した.
,オリエンタル酵母工業)を注射用水で溶解して,使用直前にS9 を加えて調製した.
S9 mix 1 mLあたりの組成は下記のとおりである.
| S9 | 0.1 mL |
| 塩化マグネシウム六水塩 | 8 μmol |
| 塩化カリウム | 33 μmol |
| D-グルコース6-リン酸 | 5 μmol |
| β-NADPH | 4 μmol |
| β-NADH | 4 μmol |
| Na-リン酸緩衝液(pH7.4) | 100 μmol |
| 注射用水 | 残量 |
 被験物質調製液,媒体対照(無水エタノール),陰性対照(注射用水)0.05 mL,または陽性対照0.1 mL,
被験物質調製液,媒体対照(無水エタノール),陰性対照(注射用水)0.05 mL,または陽性対照0.1 mL, 0.1 mol/L Na-リン酸緩衝液(pH7.4)0.5 mL(S9 mix無添加),またはS9 mix 0.5 mL (S9 mix添加),
0.1 mol/L Na-リン酸緩衝液(pH7.4)0.5 mL(S9 mix無添加),またはS9 mix 0.5 mL (S9 mix添加),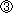 菌懸濁液0.1 mLの順に加え,37 ℃で20分間振盪培養した.その後,45℃に保温したトップアガー2 mLを加え混和し,最少グルコース寒天平板培地上に播き広げ,トップアガーが凝固した後,プレートを転倒して37 ℃で48時間培養した.
菌懸濁液0.1 mLの順に加え,37 ℃で20分間振盪培養した.その後,45℃に保温したトップアガー2 mLを加え混和し,最少グルコース寒天平板培地上に播き広げ,トップアガーが凝固した後,プレートを転倒して37 ℃で48時間培養した.
培養終了後,被験物質による菌の生育阻害を調べるため,実体顕微鏡(×100)を用いて菌の生育状態を観察した.また,目視により被験物質の析出の有無を確認した.復帰変異コロニー数は,自動コロニーカウンターにより計測した.用量設定試験は各濃度につき1枚のプレートを使用した.本試験は各濃度につき3枚のプレートを使用し,再現性を確認するため2回実施した.
S9 mix無添加および添加の場合とも,すべての濃度において無色透明の微細な油滴状の析出物および油膜状の析出物が認められた.
なお,S9 mix無添加および添加において陽性対照が各菌株に誘発した復帰変異コロニー数は,各菌株の媒体対照の復帰変異コロニー数と比較して,明らかに2倍以上に増加し,陽性結果を示した.また,媒体として用いた無水エタノールの復帰変異コロニー数は,いずれの菌株も陰性対照(注射用水)における値と同様であり,試験系に及ぼす影響は認められなかった.
以上の結果から,アゼライン酸ビス(2-エチルヘキシル)は本試験条件下において,変異原性を有しないもの(陰性)と判定する.

| 1) | Maron DM, Ames BN: Revised methods for the Salmonella mutagenicity test. Mutation Res, 113: 173-215(1983). |
| 2) | Green MHL, Muriel WJ: Mutagen testing using trp+ reversion in Escherichia coli. Mutation Res, 38, 3-32(1976). |
| 連絡先 | |||
| 試験責任者: | 三輪芳久 | ||
| 試験担当者: | 永澤佳子,小林梨沙 | ||
| (株)日本バイオリサーチセンター 羽島研究所 | |||
| 〒501-6251 岐阜県羽島市福寿町間島6-104 | |||
| Tel 058-392-6222 | Fax 058-392-1284 | ||
| Correspondence | ||||
| Authors: | Yoshihisa Miwa(Study director) Yoshiko Nagasawa,Risa Kobayashi | |||
| Nihon Bioresearch Inc. | ||||
| 104, 6-chome, Majima, Fukuju-cho, Hashima, Gifu, 501-6251, Japan. | ||||
| Tel +81-58-392-6222 | Fax +81-58-392-1284 | |||