アゼライン酸ビス(2-エチルヘキシル)のラットを用いる反復経口投与毒性・
生殖発生毒性併合試験
Combined Repeat Dose and Reproductive/Developmental Toxicity Screening Test
of Bis(2-ethylhexyl) azelate by Oral Administration in Rats
要約
アゼライン酸ビス(2-エチルヘキシル)は,溶剤・界面活性剤,化学合成原料あるいは合成潤滑油として用いられている化合物である1).本化学物質に関しては,ラットおよびウサギを用いた急性毒性試験が実施されているが,反復投与毒性あるいは生殖発生毒性に関する情報は乏しい.今回,OECDによる既存化学物質安全性点検に係る毒性調査の一環として,アゼライン酸ビス(2-エチルヘキシル)の親動物に対する反復投与の影響ならびに新生児の生存性,発育および形態を含む生殖発生に及ぼす影響ついて検討するために,同化合物の反復投与毒性・生殖発生毒性併合試験を行った.すなわち,アゼライン酸ビス(2-エチルヘキシル)の0(媒体対照,コーン油),100,300および1000 mg/kgをSprague-Dawley系[Crj:CD(SD)IGS]ラットの雌雄(各13匹/群)に,10週齢から2週間経口投与し,2週間を限度として交配させた.雄は交配期間終了後2週間を経過した後,剖検した.雌は交配後,自然分娩させ,4日間出生児を哺育させ,出生児を哺育4日に剖検した後,哺育5日に剖検した.また,分娩しなかった雌は妊娠26日相当日に剖検した.この間,雌雄動物に対して剖検の前日まで投与を継続し,一般状態を観察し,詳細な症状観察を行うとともに体重および摂餌量を算定し,剖検前日に神経学的検査を実施した.これらに加えて雌動物は性周期を観察した.さらに親動物は,分娩および泌乳を含む繁殖能力を観察し,出生児は哺育4日までの発育を観察した.親動物の剖検では血液学検査,血液生化学検査および病理学検査を実施した.結果は,以下のように要約される.
1.反復投与毒性
雌雄ともに死亡ならびに瀕死屠殺例はなかった.被験物質投与に起因した一般状態の変化は認められず,詳細な症状観察で得られたスコアには対照群と被験物質投与群との間で差は認められなかった.また,最終投与後に実施した神経学的検査においても異常を認める動物もなかった.
雄の1000 mg/kg投与群において,投与期間末期に体重増加抑制が認められたが,摂餌量には投与の影響は認められなかった.雄の300 mg/kg以下の投与群および雌では体重増加および摂餌量のいずれに対しても被験物質投与の影響は認められなかった.
剖検時の検査では,雌雄ともに血液学検査成績に投与の影響は認められなかったが,血液生化学検査においてA/G比の軽度な増加が1000 mg/kg投与群において雌雄ともに認められた.また,雌では総タンパク濃度およびカルシウム濃度の低下も認められた.また,肝臓および腎臓の重量あるいは相対重量が雌雄ともに増加した.さらに,雄の病理組織学検査において肝細胞の小葉中心性肥大および門脈周囲における脂肪化の程度の減弱が1000 mg/kg投与群で認められた.300 mg/kg以下の投与群では,雌雄ともに剖検時に実施した上記検査成績に被験物質投与の影響は認められなかった.
2.生殖発生毒性
1000 mg/kg投与群では,投与開始後に性周期の型が変化した例の頻度が増加の傾向を示し,性周期の間隔が対照群と比較して延長した.1000 mg/kg投与群では,着床数,産児数および出産生児数の少ない動物も散見されたが,これらの値ならびにそれに基づいて算出された着床率,分娩率,生児出産率および出生率のいずれにも対照群との間で有意差は認められなかった.交尾率,受胎率,交尾までの平均発情回帰回数および平均同居日数に投与の影響は認められず,分娩および哺育状態にも被験物質投与に起因した異常は認められなかった.さらに,妊娠動物の全例が生児を出産した.哺育4日における生存児数,哺育0日および4日における性比ならびに新生児の4日の生存率に被験物質投与の影響は認められなかった.また,出生児の体重には投与の影響は認められず,投与に起因すると考えられる形態異常も認められなかった.
以上の試験成績から,本試験条件下におけるアゼライン酸ビス(2-エチルヘキシル)の無作用量は,雌雄ともに300 mg/kg/dayであり,生殖発生毒性に関しては,雄では1000 mg/kg/day,雌では300 mg/kg/dayであると推定された.また,出生児に関しては1000 mg/kg/dayであると推定された.
方法
1.被験物質および投与検体の調製法
本試験に使用した被験物質のアゼライン酸ビス(2-エチルヘキシル)は,大八化学工業(大阪)より提供を受けたもの(ロット番号:N-31101)で,純度は77.2 %で,不純物として,グルタル酸ビス2-エチルヘキシル(2.2 %),アジピン酸ビス2-エチルヘキシル(2.4 %),ピメリン酸ビス2-エチルヘキシル(2.8 %),スベリン酸ビス2-エチルヘキシル(3.8 %),セバシン酸ビス2-エチルヘキシル(3.3 %),1-,9-ノナメチレンジカルボン酸ビス2-エチルヘキシル(5.3 %),1-,10-デカメチレンジカルボン酸ビス2-エチルヘキシル(0.6 %),1-,11-ウンデカメチレンジカルボン酸ビス2-エチルヘキシル(0.3 %)を含む.被験物質は入手後,使用時まで密封して室温で保管し,被験物質の試験期間中の安定性を,残余入手物質を提供元で再分析することにより確認した.
被験物質は水に不溶であることから,投与検体の調製には媒体としてコーン油(ロット番号:V2E7069,ナカライテスク)を選択し,被験物質の純度補正を行わずに,必要量の被験物質を秤量し,いずれの用量においても投与液量が5 mL/kg体重になるように各濃度の投与検体を調製した.投与検体の安定性については,室温・遮光条件下における8日間の安定性を確認しているので,1週間に1回以上の頻度で調製し,室温・遮光条件下で保管して調製後7日以内に使用した.投与検体中に含まれる被験物質の含量は秦野研究所において確認した.
2.使用動物および飼育方法
試験には,日本チャールス・リバー厚木飼育センター生産のSprague-Dawley系[Crj:CD(SD)IGS, SPF]ラットを使用した.雌雄動物は7週齢で購入し,入荷日を含む6日間,検疫と馴化を兼ねて飼育し,その間毎日一般状態を観察して異常が認められなかった動物を,さらに2週間予備飼育した.この間,雄は一般状態を観察し,雌は一般状態を観察するとともに性周期を観察した.雌雄とも投与開始前日に体重を測定し,体重別層化無作為抽出法により群分けした.雌動物については,群分け日まで発情を回帰している動物を選択して群分けに用いた.
各動物は,許容温湿度各21.0〜25.0℃,および40.0〜75.0 %,換気回数約15回/時間,照明12時間(7-19時点灯)にそれぞれ制御された飼育室で,金属製金網床ケージに個別に収容し,固型飼料(CE-2,日本クレア)および飲料水(水道水,秦野市水道局給水)を自由に摂取させて飼育した.妊娠18日(腟栓あるいは精子発見日=妊娠0日)以後の母動物は,ラット用プラスチック製繁殖ケージに収容し,哺育5日(哺育0日=分娩日)まで紙パルプ製チップ(ペパークリーン,日本エスエルシー)を床敷として供給して飼育した.
3.投与量の設定および投与方法
本試験における投与量は,本試験に先立ち実施した予備試験の結果に基づいて決定した.すなわち,本化学物質を用いる単回経口投与毒性試験2)の予備試験において,2500 mg/kgを投与しても死亡が認められなかったことから,本試験の予備試験ではOECD化学物質試験法ガイドラインに定められている限度量の1000 mg/kgを高用量に設定し,以下公比約3で減じて中用量に300 mg/kgを,低用量に100 mg/kgを設定して,本試験と同系統のラット各群雌雄各5匹に2週間反復経口投与した.対照群の雌雄には,媒体(コーン油5 mL/kg)を同様に投与し,一般状態,体重推移および摂餌量を被験物質投与群と比較した.各群の動物は,最終投与翌日にペントバルビタールナトリウム麻酔下で,放血致死させて剖検し,器官重量を測定した.その結果,雌雄ともに1000 mg/kgを14日間反復投与しても死亡は認められず,一般状態および体重増加にも異常は認められなかった.剖検では1000 mg/kg投与群において肝臓の腫大が認められ,肝臓の重量が増加した.こうした変化は300 mg/kg以下の投与群では認められなかったことから,本試験における投与量は,予備試験と同様とし,高用量には1000 mg/kgを設定し,以下公比約3で減じて中用量には300 mg/kgを,低用量には100 mg/kgを設定した.
各用量の投与検体は,雄に対しては交配前2週間から最長2週間の交配期間を経て剖検前日に至るまでの連続42日間,また,雌に対しては交配前2週間,交尾までの交配期間,妊娠期間および哺育4日まで,交尾したが分娩しない雌は妊娠25日相当日まで,それぞれ毎日1回,一定時刻の間(9時〜13時)に,ラット用胃管を用いて経口投与した.投与に際しては,投与前に投与検体を再度混和してから使用した.また,各動物の投与液量(5 mL/kg)は,雌雄とも最近時の体重をもとに,個体別に算出した.
4.観察および検査
1) 一般状態観察
雌雄とも,全例について飼育期間中毎日1回以上観察した.投与期間中の動物については,投与前および投与終了後に観察した.観察された症状は,いずれも速やかな回復が期待されないものであったことから,断続的観察は行わなかった.
2) 詳細な症状観察
交配期間中にある雌雄,および妊娠18日以降にある雌動物を除き,雌雄の全例について群分け日,投与7,14,21,28,35および42日の13時〜16時にスコアリング法による詳細な症状観察を行った.詳細な症状観察では,ケージ越しでの観察を約20秒間行い,ケージから取り出す際に外表を観察し,作業台上での観察を約20秒間行った.さらに,作業台上で,姿勢・体位,探索行動,身づくろい,発声,挙尾反応,歩行,常同行動,奇妙な行動,振戦,痙攣,立毛,眼裂および呼吸数を観察した.
3) 神経学的検査
雄は,投与42日の詳細な症状の観察後に各群の動物番号の若い順に5例を選び,また,雌動物は,哺育4日に各群の投与期間が近接した5匹を選び,プライエル反応,瞳孔反射,痛覚,後肢引込み反射,眼瞼(瞬目)反射,正向反射を検査した.
4) 体重
雌雄の全例について体重を測定した.測定は,雄は全例について,投与1(投与開始日),7,14,21,28,35,42日および解剖日に測定した.雌は全例について,投与1,7,14,21日に測定し,交尾確認後は,妊娠0,7,14,20日に,分娩後は哺育0,4日および解剖日に測定した.分娩の認められなかった例は剖検日に測定した.これらのうち,投与21日の体重ならびに分娩しなかった例の剖検時体重は,測定対象が限られていることから評価の対象から除外した.また,1000 mg/kg投与群の雌の1例は,交配期間中,交尾が確認されることはなかったにもかかわらず,投与38日に分娩が認められた.本例は,妊娠日による投与液量を変更しなかったことから,試験条件が異なる動物と判断された.このため,本例に関わるデータのうち,交尾率および受胎率を除き,交配開始以後の期間の全成績を評価の対象から除外することとした.
5) 摂餌量
雌雄の全例について投与1〜2,7〜8および14〜15日に摂餌量を測定した.これらの他に,雄では投与29〜30,35〜36および41〜42日に測定した.雌では,交尾確認後の妊娠0〜1,7〜8,14〜15,20〜21日に,分娩後の哺育3〜4日に測定した.
6) 性周期
全例について群分け日までの性周期観察に引き続き,交尾確認日まで,腟スメア標本を作製して観察し,細胞構成から,発情期,発情前期および発情休止期に分類した.これらの分類に基づき,性周期の型を,4日間隔で発情を回帰するものを4日周期,5日間隔で発情を回帰するものを5日周期,4〜5日間隔で発情を回帰するものを4および5日周期,それ以外を不正周期に分類し,投与開始後性周期の型が変化した動物の頻度を群毎に算出するとともに,投与開始前後の各期間について,平均発情回帰日数(個体毎の発情期から次回発情期までの日数の平均)を群毎に算出した.
7) 交配
雌雄ともに2週間投与後(投与15日)の12週齢から,交尾を確認するまで,2週間を限度として同群内の雌雄を1:1で連日同居させた.この間,毎朝,腟スメア中の精子,あるいは腟栓の有無を確認し,これらのうちのいずれかが確認された雌動物は,その日を妊娠0日と起算して雄から分離し,個別に飼育した.交配結果から,各群について交尾率〔(交尾動物数/交配動物数)×100,%〕を求め,剖検時に子宮に着床痕の確認された雌動物を受胎動物として受胎率〔(受胎動物数/交尾動物数)×100,%〕を算出した.また,同居開始日から交尾確認日までの日数およびその間に回帰した発情期の回数も求めた.
8) 分娩・哺育観察
各群とも,交尾した雌は,全例を自然分娩させて哺育させた.分娩の確認は,妊娠21日から分娩が確認されるまで,妊娠25日を限度として毎日行い,11時までに分娩が完了した例についてその日を哺育0日とした.分娩状態を直接観察できた例については,異常の有無を断続的に観察し,直接観察ができなかった例については,分娩前後の一般状態および産児の状態から異常の有無を判断した.妊娠25日相当日までに分娩が確認されない動物は翌日剖検し,子宮に着床痕の認められなかった例を不妊と判定した.
分娩を確認した全例について妊娠期間(妊娠0日〜分娩日の日数)を算定し,出産率〔(生児出産雌数/受胎動物数)×100,%〕を各群について求めた.また,哺育1日から毎日,哺育状態を観察し,哺育5日の剖検において数えられた着床数および妊娠黄体数から着床率〔(着床数/妊娠黄体数)×100,%〕を算出した.
出生児は,哺育0日に,雌雄別に産児数(生存児+死亡児)を調べ,分娩率〔(産児数/着床痕数)×100,%〕,生児出産率〔(出産生児数/着床痕数)×100,%〕および出生率〔(出産生児数/産児数)×100,%〕を算出した.生存児については外表奇形の有無を観察した.翌日(哺育1日)から哺育4日まで毎日一般状態を観察し,生児数と死亡児数を雌雄別に数えて新生児の4日の生存率〔(哺育4日の生児数/哺育0日の生児数)×100,%〕を算出した.生存児については,哺育0および4日に個別の体重を測定し,各腹ごとに雌雄別の平均値を算出するとともに哺育0および4日における性比〔(哺育0あるいは4日雄生児数/哺育0あるいは4日雌生児数)×100〕を算出した.
9) 剖検
(1) 雄
投与42日に絶食を開始し,その18〜24時間後にペントバルビタールナトリウム麻酔下で腹部後大静脈から抗凝固剤としてクエン酸ナトリウムを用いて血液を採取し,プロトロンビン時間および活性部分トロンボプラスチン時間の測定に用いた.次いで,腹部後大静脈から抗凝固剤としてEDTA-2 Kを用いて採血し,その他の血液学検査に用いた.さらに,腹部後大静脈から抗凝固剤としてヘパリンを用いて採血し,血液生化学検査に用いた.動物は,採血終了後に放血致死させ解剖し,器官・組織の肉眼観察を行った.また,全例について,脳,下垂体,脊髄,甲状腺および上皮小体,心臓,気管,肺(気管支を含む),肝臓,腎臓,胸腺,脾臓,副腎,胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,膀胱,下顎リンパ節,腸間膜リンパ節,坐骨神経,大腿骨および骨髄,精巣,精巣上体,前立腺腹葉,凝固腺を含む精嚢,病変部を採取し,脳,心臓,胸腺,肝臓,腎臓,脾臓,副腎,精巣および精巣上体の重量を測定し,相対重量を算出した.
採取した器官および組織のうち,精巣ならびに精巣上体はブアン液(長期保存は0.1Mリン酸緩衝10 %ホルマリン溶液を使用)に固定し,その他は0.1Mリン酸緩衝10 %ホルマリン溶液に固定して保存した.肺は,摘出前に0.1Mリン酸緩衝10 %ホルマリン溶液を注入してから固定・保存した.
(2) 雌
交尾したが分娩しなかった例は妊娠25日相当日に,また,分娩した例は哺育4日に絶食を開始し,いずれも絶食開始18〜24時間後にペントバルビタールナトリウム麻酔下で雄と同様に採血後,放血致死させ解剖し,器官・組織の肉眼観察を行った.また,全例について脳,下垂体,脊髄,甲状腺および上皮小体,心臓,気管,肺(気管支を含む),肝臓,腎臓,胸腺,脾臓,副腎,胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,膀胱,下顎リンパ節,腸間膜リンパ節,坐骨神経,大腿骨および骨髄,卵巣,子宮,腟,病変部を採取し,脳,心臓,胸腺,肝臓,腎臓,脾臓,副腎の重量を測定し,相対重量を算出した.子宮については着床数を数え,分娩した雌の卵巣については実体顕微鏡下で妊娠黄体数を数えた後,いずれも0.1Mリン酸緩衝10 %ホルマリン溶液に固定して保存した.肺は雄と同様に注入固定を行った.
(3) 出生児
死亡児は発見後速やかに剖検し,0.1Mリン酸緩衝10 %ホルマリン溶液に固定して保存した.生存児は全例を哺育4日にエーテル吸入により致死させ,剖検した.
10) 血液学検査
プロトロンビン時間および活性部分トロンボプラスチン時間は全自動血液凝固測定装置(CA-1000,東亜医用電子)を用いて光散乱法によって測定した.また,血液自動分析装置(CELL-DYN3500SL,ダイナボット)を用いて電気抵抗法により赤血球数(RBC),平均赤血球容積(MCV)ならびに血小板数を測定し,血色素量は吸光度法により測定し,白血球数はフローサイトメトリー・レーザー光散乱法あるいは電気抵抗法で,白血球分類はフローサイトメトリー・レーザー光散乱法で測定した.さらに,RBC,MCVあるいは血色素量からヘマトクリット値,平均赤血球血色素濃度(MCHC)あるいは平均赤血球血色素量(MCH)を算出した.
11) 血液生化学検査
遠心方式生化学自動分析装置(COBAS-FARA,ロシュ・ダイアグノスティックス)を用い,総蛋白濃度はビウレット法で,アルブミン濃度はBCG法で,尿素窒素濃度(BUN)は,ウレアーゼGl.DH法で,クレアチニン濃度はJaff 法で,ブドウ糖濃度はグルコキナーゼG6PDH法で,総コレステロール濃度はCOD・DHAOS法で,トリグリセライド濃度はGPO・HAOS(グリセリン消去)法で,アルカリフォスファターゼ活性(ALP)はGSCC法で,ALT(GPT),AST(GOT)ASTおよびγ-GTP活性はIFCC法で,総ビリルビン濃度はアゾビリルビン変法で,無機リン濃度はモリブデン酸直接法で,カルシウム濃度はOCPC法で測定し,A/G比は算出した.また,全自動電解質分析装置(EA05,A&T)を用い,イオン電極法によって,ナトリウム,カリウムおよび塩素の各濃度を測定した.
法で,ブドウ糖濃度はグルコキナーゼG6PDH法で,総コレステロール濃度はCOD・DHAOS法で,トリグリセライド濃度はGPO・HAOS(グリセリン消去)法で,アルカリフォスファターゼ活性(ALP)はGSCC法で,ALT(GPT),AST(GOT)ASTおよびγ-GTP活性はIFCC法で,総ビリルビン濃度はアゾビリルビン変法で,無機リン濃度はモリブデン酸直接法で,カルシウム濃度はOCPC法で測定し,A/G比は算出した.また,全自動電解質分析装置(EA05,A&T)を用い,イオン電極法によって,ナトリウム,カリウムおよび塩素の各濃度を測定した.
12) 病理組織学検査
固定・保存器官のうち,卵巣,精巣および精巣上体は全例について常法に従ってパラフィン切片とし,ヘマトキシリン−エオジン染色を行って病理組織標本を作製し,病理組織学検査を実施した.その他の固定・保存器官については,雄は対照群5例および1000 mg/kg投与群5例,雌は不妊例を除く対照群5例および1000 mg/kg投与群5例を動物番号の若い順に選定し,標本を作製して検査した.また,1000 mg/kg投与群において重量および相対重量が有意な高値を示した雌雄の肝臓および腎臓については,100 mg/kgおよび300 mg/kg投与群についても組織学検査を実施した.これらの動物における腎臓および肝臓以外の器官,ならびにその他の動物については,被験物質投与によると推定される異常が認められなかったので,標本を作製しなかった.病変部については全て標本を作製して病理組織学検査を実施したので,1000 mg/kg投与群における雄の肝臓の観察例数は12となった.なお,骨髄および甲状腺の検査に際して,これらの組織標本とともに観察される大腿骨および上皮小体の検査は実施しなかった.
5.統計解析
性周期の変化した動物の頻度,交尾率,受胎率ならびに出生児の形態異常の出現頻度についてはFisherの直接確率検定を行った.病理組織学検査所見では,グレード分けをしたデータは,Mann-WhitneyのU検定により,陽性グレードの合計値はFisherの直接確率片側検定により対照群と被験物質投与群との間の有意差検定を行った.その他のデータは多重比較検定を行った.すなわち,個体ごとに得られた値,あるいはlitterごとの平均値を1標本として,先ずBartlett法により各群の分散の一様性について検定を行った.分散が一様である場合には,一元配置型の分散分析を行い,群間に有意性が認められる場合は,Dunnett法により多重比較を行った.一方,いずれかの群で分散が0となる場合および分散が一様でない場合には,Kruskal-Wallisの順位検定を行い,群間に有意性が認められる場合には,Dunnett型の検定法により多重比較を行った.有意水準はいずれも5 %とした.
結果
1.反復投与毒性
1) 死亡および一般状態
雌雄ともに死亡例はなく,瀕死例もなかった.
一般状態については,雄では,1000 mg/kg投与群の1例に投与42日に貧毛/脱毛が認められた他に,いずれの投与群においても異常は認められなかった.雌では,分娩するまでの期間は,投与1〜6日に,1000 mg/kg投与群の1例が貧毛/脱毛を示した他に,いずれの投与群においても異常は認められなかった.分娩後は,貧毛/脱毛が対照群および100 mg/kg投与群の各1例に認められた.また,被毛汚染が,分娩状態が不良であった100 mg/kg投与群および300 mg/kg投与群の各1例に分娩日から観察された.100 mg/kg投与群の例は,全出生児が死亡して2日後の哺育3日には症状が認められなくなった.一方,300 mg/kg投与群の例は削痩を伴い,剖検までこれらの変化が継続して観察された.これらの他に,300 mg/kg投与群では,哺育4日から削痩を認め,剖検日には被毛汚染を認める例もあった.300 mg/kg投与群において交尾したが不妊であった1例には,投与39日から剖検まで皮下腫瘤が認められた.1000 mg/kg投与群では,分娩後に異常を認める例はなかった.
2) 詳細な症状観察結果
雌雄ともに,いずれの時期においても対照群と被験物質投与群との間で各観察項目のスコアに有意差は認められなかった.
3) 神経学的検査結果
雌雄ともに,いずれの投与群においても検査結果に異常は認められなかった.
4) 体重(Fig. 1,2)
雄では,300 mg/kg以下の投与群については,いずれの時期においても体重,増加量および累積増加量に対照群と比較して有意差は認められなかった.1000 mg/kg投与群では,体重ならびに投与28日までの増加量および累積増加量については対照群との間に有意差が認められなかったが,それ以降の投与28〜35日および35〜42日の増加量ならびに投与42日までの累積増加量は対照群と比べて有意(p<0.05,p<0.01)に低い値を示した.
雌では,いずれの時期においても体重,増加量および累積増加量には対照群と被験物質各投与群との間で有意差を認めなかった.
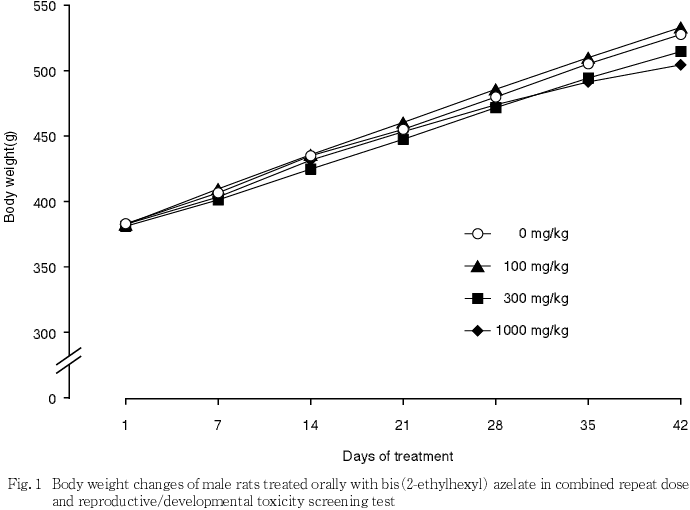
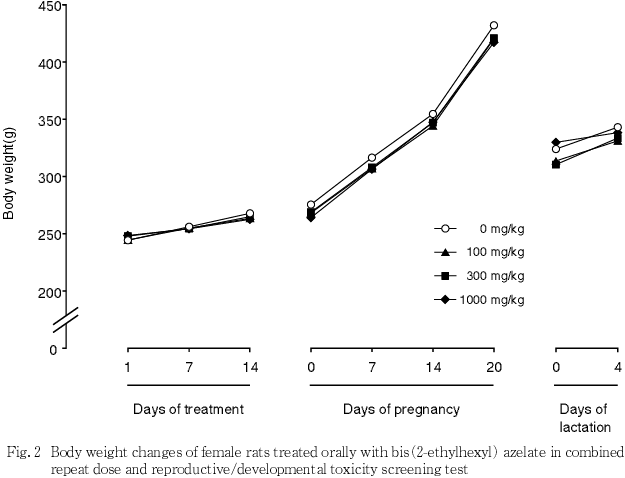
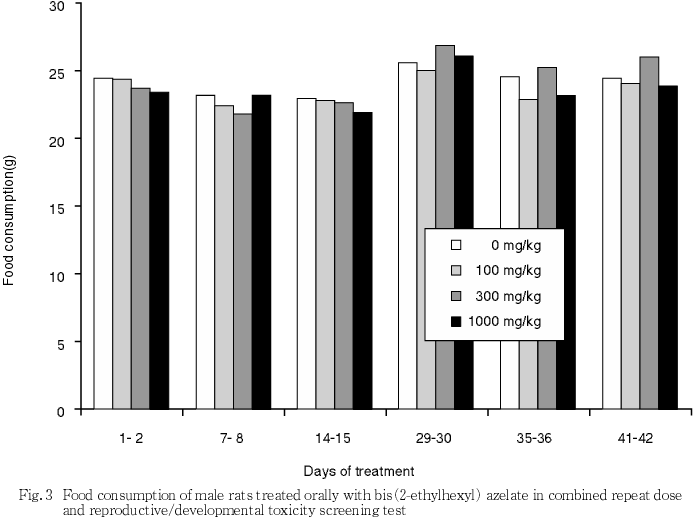
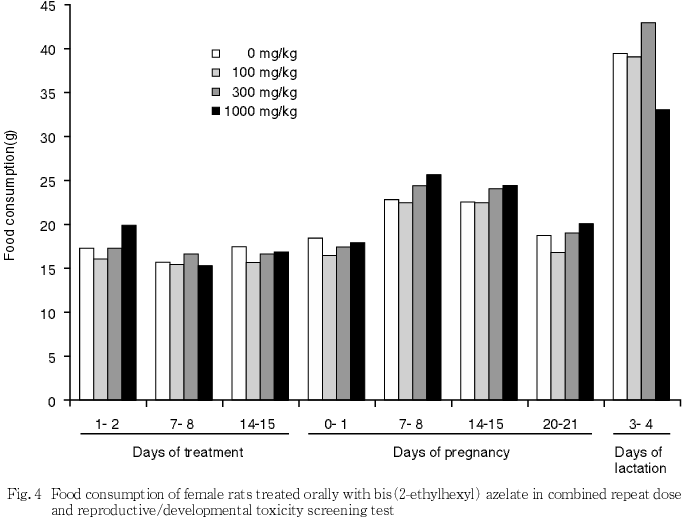
5) 摂餌量(Fig. 3,4)
雌雄ともにいずれの時期も対照群と被験物質投与との間で有意差は認められなかった.
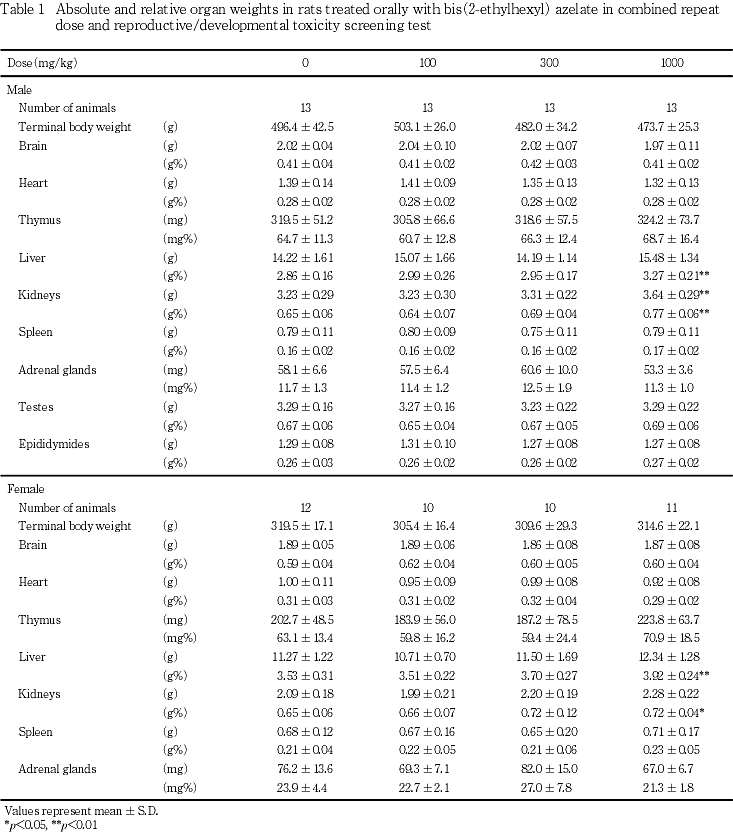
6) 器官重量(Table 1)
雌雄ともに300 mg/kg以下の投与群では,対照群と比較して重量あるいは相対重量に有意差が認められる器官はなかった.1000 mg/kg投与群の雄では,腎臓の重量および相対重量ならびに肝臓の相対重量が対照群と比較して有意(p<0.01)な高値を示した.また,雌では腎臓および肝臓の相対重量が対照群と比較して有意(p<0.05,p<0.01)な高値を示した.その他の器官の重量および相対重量については,雌雄ともに対照群との間に有意差は認められなかった.
7) 血液学検査所見(Table 2)
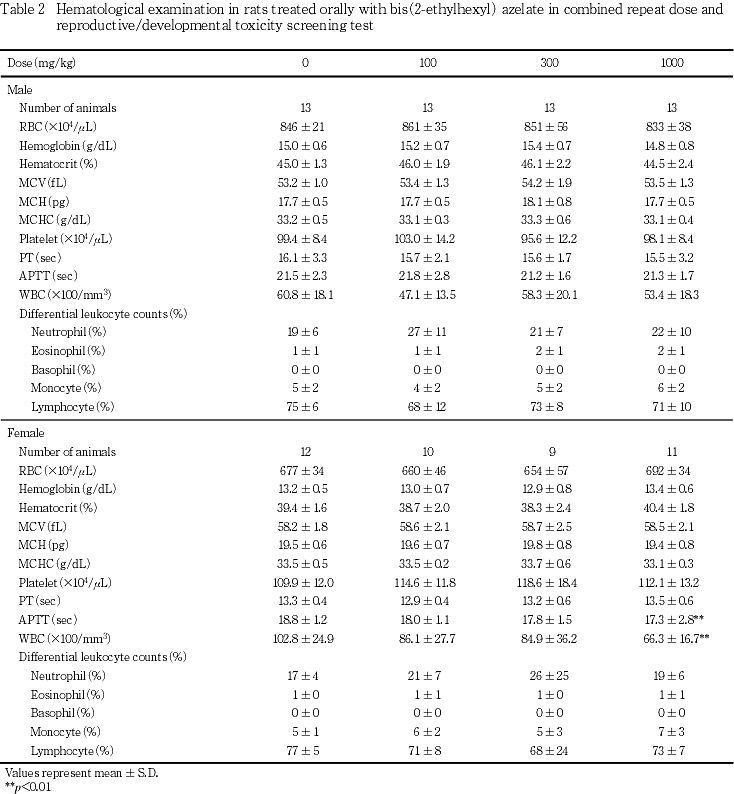
雄ではいずれの検査項目においても対照群と被験物質投与群との間に有意差は認められなかった.
雌では,300 mg/kg以下の投与群では,対照群との間に有意差を認めた検査項目はなかったが,1000 mg/kg投与群では,対照群と比較して白血球数が有意(p<0.01)に減少し,APTTが有意(p<0.01)に短縮した.その他の検査項目については対照群との間で有意差は認められなかった.また,分娩後の一般状態に異常が認められた100 mg/kg投与群の1例および300 mg/kg投与群の2例の検査結果に著しい変化は認められなかった.
8) 血液生化学検査所見(Table 3)
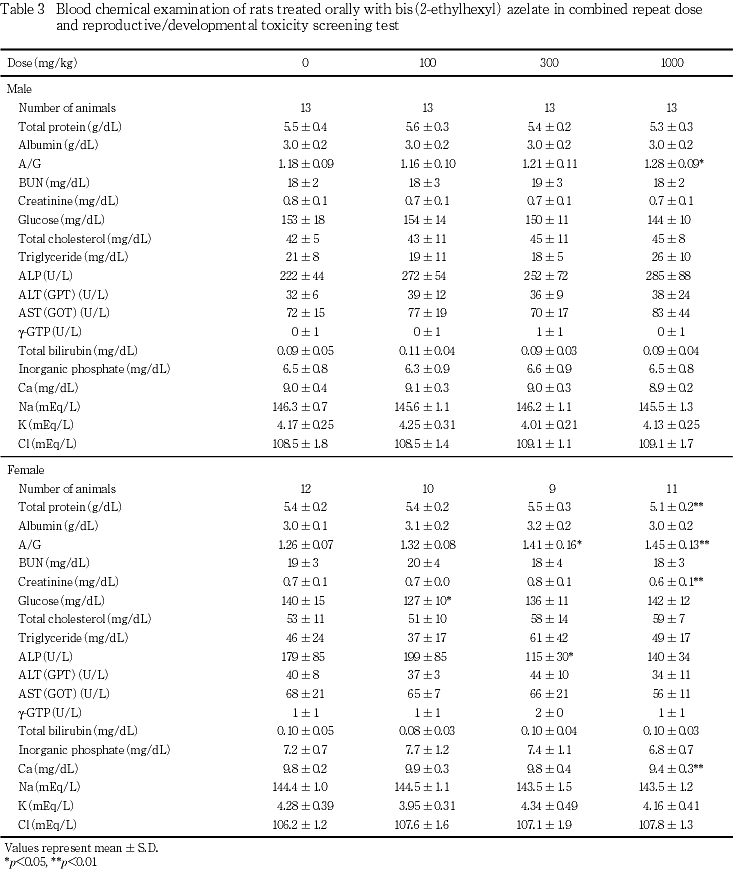
雄では,300 mg/kg以下の投与群では,対照群との間に有意差の認められた検査項目はなかった.1000 mg/kg投与群では,対照群と比較してA/G比が有意(p<0.05)な高値を示した.また,1000 mg/kg投与群では,ALT(GPT)活性およびAST(GOT)活性が,それぞれ114 U/Lおよび221 U/Lと高値を示す例があったが,対照群との間に有意差は認められなかった.その他の検査項目についても対照群との間で有意差は認められなった.
雌では,100 mg/kg投与群において,ブドウ糖濃度が対照群と比較して有意(p<0.05)な低値を示した.300 mg/kg投与群では,A/G比が対照群と比較して増加し(p<0.05),アルカリフォスファターゼ活性が低値を示した(p<0.05).1000 mg/kg投与群においてもA/G比が対照群と比較して有意(p<0.01)に増加したが,総蛋白濃度の有意(p<0.01)な減少を伴っていた.また,1000 mg/kg投与群では,クレアチニン濃度およびカルシウム濃度が対照群と比較して有意(p<0.01)に減少した.分娩後の一般状態に異常が認められた100 mg/kg投与群の1例および300 mg/kg投与群の2例のうち,300 mg/kg投与群の1例の血漿には乳びが認められたことから測定値は参考データとし,評価の対象から除外した.その他の2例については検査結果に顕著な変化は認められなかった.
9) 剖検所見
雄では,対照群および300 mg/kg投与群の動物に異常は認められなかった.100 mg/kg投与群では,肝臓の淡色調が1例に認められた.1000 mg/kg投与群では10例に肝臓の暗色調が認められ,そのうちの1例には腫大も観察された.また,両前肢皮膚の貧毛/脱毛が1例に認められた.
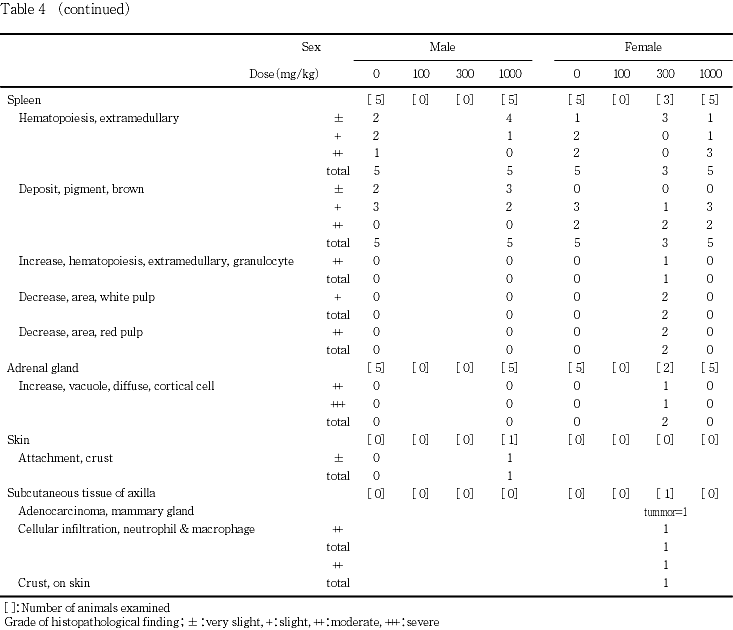
雌では,対照群では,1例の右側腎臓に腎盂の拡張が観察された.100 mg/kg投与群では,分娩状態が不良で全出生児が死亡した例の胸腺に小型化が認められた.また,不妊であった例の子宮には内腔の拡張が認められた.300 mg/kg投与群では,哺育状態の不良が認められた例および分娩状態が不良でその後全出生児が死亡した例に,鼻あるいは会陰部周囲被毛の褐色汚染が認められ,腎臓の淡色調,副腎の腫大ならびに胸腺および脾臓の小型化が観察された.これらのうち,全出生児が死亡した例では,腎臓表面の粗造化も認められた.胸腺の小型化は,一般状態に変化が認められなかった1例にも観察された.これらの例の他に,不妊であった1例の腋窩皮下に,表皮に痂皮形成を伴った腫瘤が認められ,この例の脾臓には腫大が認められた.1000 mg/kg投与群に異常は認められなかった.
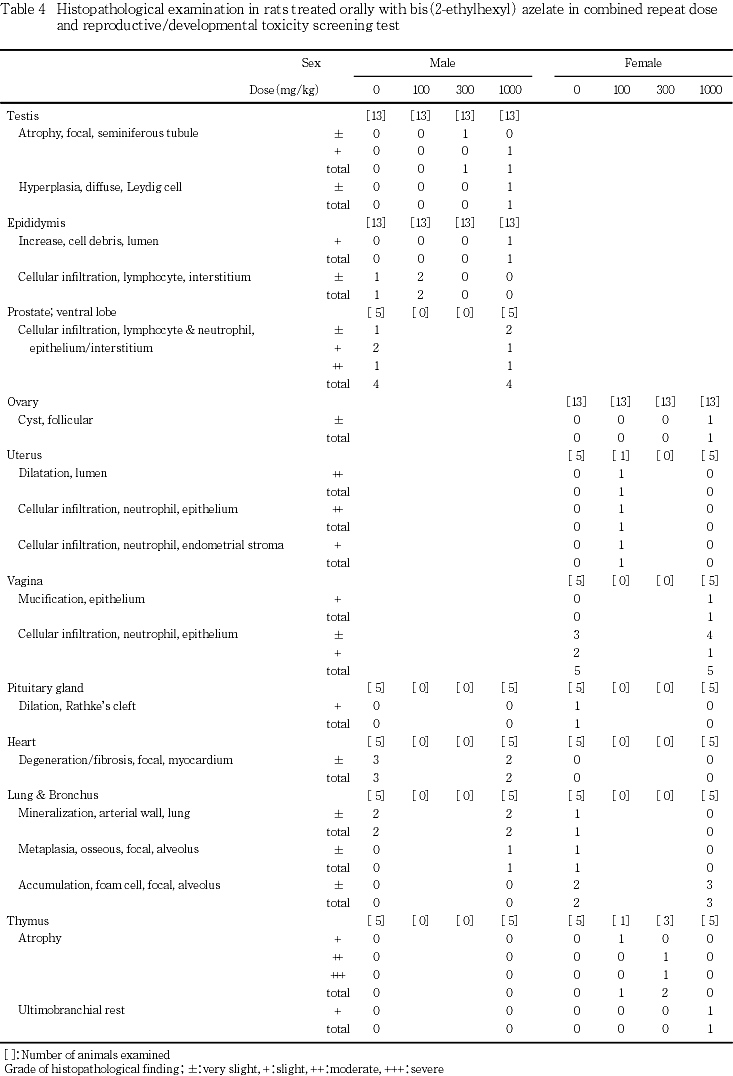
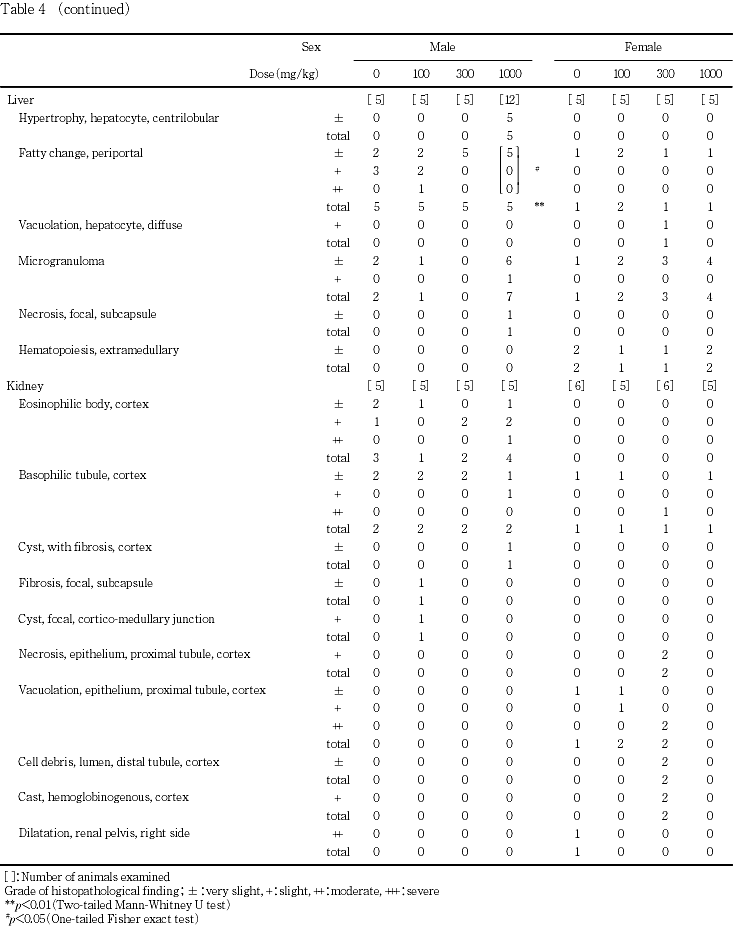
10) 病理組織学検査所見(Table 4)
雄では精巣,精巣上体,前立腺腹葉,心臓,肺(気管支を含む),肝臓,腎臓,脾臓に所見が認められた.これらのうち,重量変化の認められた肝臓では,小葉中心性肝細胞肥大が1000 mg/kg投与群の12例中5例に認められた.程度および頻度には対照群との間に有意差は認められなかったが,対照群を含めて300 mg/kg以下の投与群に同様の所見は認められなかった.また,300 mg/kg以下の投与群の全例に認められた門脈周囲性の脂肪化が,1000 mg/kg投与群では減弱して,ごく軽度な脂肪化が12例中5例のみに観察され,頻度および程度ともに対照群との間に有意差が認められた(p<0.05,p<0.01).その他の所見については頻度および程度には対照群と被験物質投与群の間で有意差は認められなかった.腎臓にも重量変化が認められたが,対照群との間に有意差の認められる所見はいずれの投与群においても認められなかった.その他の器官で観察された変化についても対照群との間に有意差は認められなかった.剖検時に1000 mg/kg投与群に観察された両前肢脱毛/貧毛部の皮膚には,ごく軽度な痂皮の付着が観察された.
雌では,卵巣,子宮,腟,下垂体,肺(気管支を含む),胸腺,肝臓,腎臓,脾臓および副腎に所見が認められたが,重量変化の認められた肝臓および腎臓を含めて対照群との間に有意差を認める所見はなかった.剖検時に300 mg/kg投与群の不妊例に認められた皮下腫瘤は,好中球およびマクロファージの浸潤ならびに表皮の痂皮を伴う乳腺の腺癌と診断された.
2.生殖発生毒性
1) 性周期所見(Table 5)
投与開始後に性周期の型が変化した動物の割合が1000 mg/kg投与群において増加する傾向が認められ,平均発情回帰日数が対照群と比較して有意(p<0.05)に延長した.300 mg/kg以下の投与群では性周期に投与の影響は認められなかった.
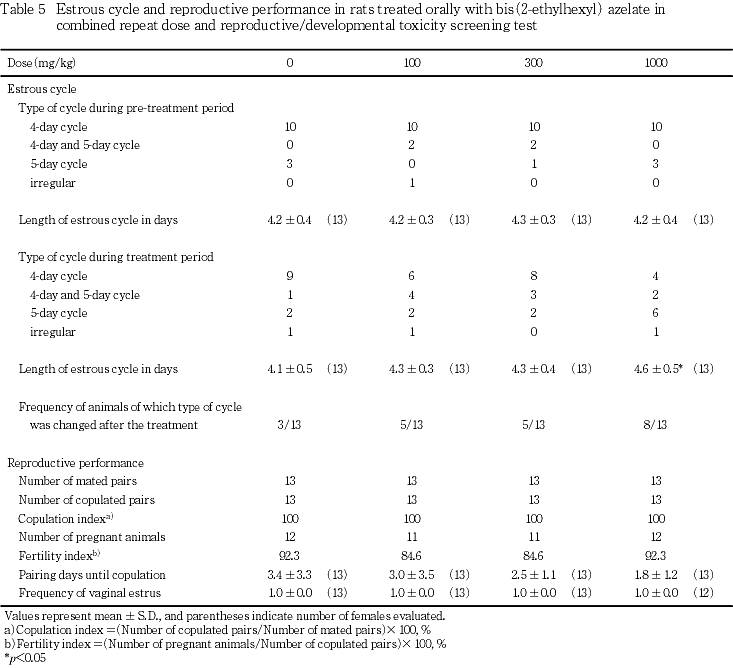
2) 交配成績(Table 5)
いずれの投与群においても全例が交尾した.対照群を含む各群に1〜2例の不妊動物が認められたが,受胎率に対照群と被験物質各投与群との間で有意差は認められなかった.交尾までの同居期間は被験物質投与群において短縮する傾向が認められたが,対照群との間で有意差は認められず,いずれの動物も同居開始後,初回の発情期に交尾した.
3) 分娩および哺育所見
妊娠動物の全例が生児を出産した.分娩の直接観察が可能であったのは,対照群の12例中2例,100 mg/kgおよび300 mg/kg投与群の11例中1例であり,1000 mg/kg投与群では12例が分娩したが,直接観察が可能であった例はなかった.これら分娩を直接観察した例には分娩状態の異常は認められなかった.一方,直接観察できなかった例のうち100 mg/kg投与群および300 mg/kg投与群の各1例に分娩状態の不良と判断される所見が認められた.すなわち,100 mg/kg投与群の例は,分娩が終了したにもかかわらず,胎盤が切断されていない産児がケージ内に散乱し,母動物の腟から出血が認められた.また,300 mg/kg投与群の例も同様に産児を集めず,胎盤が処理されず,また,母動物の腟から出血が認められた.これら2例は,哺育状態も不良となり,哺育1日あるいは2日までに全出生児が死亡した.300 mg/kg投与群では,分娩状態に異常は認められなかった1例において,哺育4日における出生児の体重が同群の他の腹と比較して著しく低く,また,これら出生児の剖検では,外表および内臓諸器官に異常は認められなかったが,全例の胃内に乳汁の貯留が認められなかったことから,本例には哺育状態の不良があったものと判断された.1000 mg/kg投与群では,生存産児が1匹のみであった例において哺育3日から4日までの間,母動物の乳頭に突出不良が認められ,また,哺育4日における出生児の剖検においても削痩および脱水が認められたことから,哺育状態の不良があったものと判断された.対照群の動物の分娩状態および哺育状態に異常は認められなかった.また,妊娠期間には対照群と被験物質投与群との間で有意差は認められなかった.
4) 黄体数および着床数(Table 6)
被験物質各投与群の黄体数は対照群と同様の値であった.着床数については,1000 mg/kg投与群において数が少なく,着床率の低い例が認められたが,対照群と被験物質各投与群の間で着床数および着床率に有意差は認められなかった.
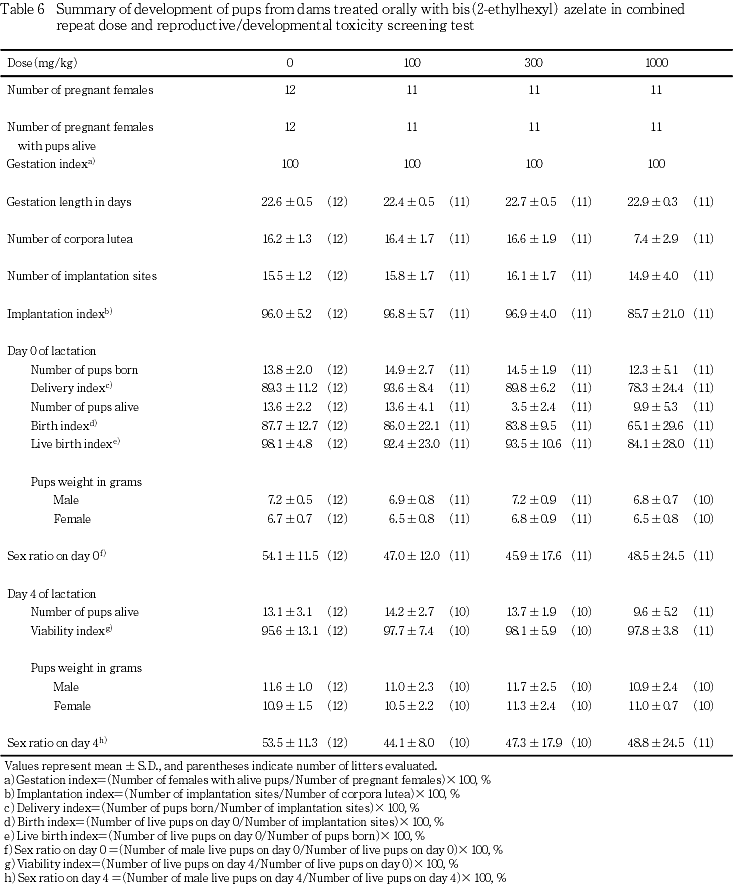
5) 出生児所見(Table 6)
いずれの投与群の動物も行動を含む一般状態に異常は認められなかった.母動物に哺育状態の不良が認められた100 mg/kgおよび300 mg/kg投与群の各1腹が,それぞれ哺育1日および2日に全出生児が死亡したが,これらの投与群については産児数,分娩率,生存産児数,生児出産率,出生率,新生児生存率のいずれにも対照群との間で有意差は認められなかった.1000 mg/kg投与群では,着床数が少なかった例の他に,産児数が少なかった例があり,さらに産児数は通常数えられるのと同様の値であったが生存産児数の少ない例もあった.このために,分娩率および生児出産率が低値を示す例が認められた.しかし,対照群と比較して,産児数,分娩率,生児出産率および出生率に有意差は認められず,新生児生存率は対照群と同様の値であった.また,哺育0日および哺育4日における性比にも対照群と被験物質各投与群との間で有意差は認められなかった.
体重については,雌雄ともにいずれの時期も対照群と被験物質各投与群との間で有意差は認められなかった.
生存産児の形態観察(表には示さず)では, 100 mg/kg投与群において分娩状態の不良が認められた例の雄生存産児の1例に両側後肢の内側回転が観察された他に異常は観察されなかった.死亡児の観察ならびに哺育4日における剖検では,いずれの動物にも異常は観察されなかった.
考察
1.反復投与毒性
雌雄ともに1000 mg/kgまでのアゼライン酸ビス(2-エチルヘキシル)を連日経口投与しても死亡する例は認められず,毎週実施したスコアリングによる詳細な症状観察においても投与の影響は認められなかった.さらに,最終投与後に実施した神経学的検査においても異常は認められなかったことから,1000 mg/kgまでのアゼライン酸ビス(2-エチルヘキシル)に明瞭な神経毒性はないものと考えられた.1000 mg/kg投与群において雌雄動物に貧毛/脱毛が認められたが,少数例であり,雌では100 mg/kg投与群においても1例に認められ,用量に依存した変化ではなかったことから,偶発的な変化であると考えられる.また,100 mg/kgおよび300 mg/kg投与群の雌動物において,分娩後に被毛汚染や削痩など一般状態の不良を認める例があったが,1000 mg/kg投与群では類似した変化が認められなかったことから,被験物質投与に起因した変化ではないと判断された.これらのことから,1000 mg/kg までのアゼライン酸ビス(2-エチルヘキシル)は雌雄いずれに対しても一般状態に影響を及ぼさないと考えられた.
体重増加に関しては,雄に対して1000 mg/kgを反復投与することにより,投与末期に増加抑制が認められたが,雌では,投与の影響は認められなかった.摂餌量については雌雄いずれにおいても被験物質投与の影響は認められなかった.
雄の剖検では,1000 mg/kg投与群において肝臓の相対重量が増加し,腎臓の重量および相対重量がともに増加した.肝臓重量の増加は,予備試験において1000 mg/kg投与により認められている変化であり,腎臓は実測値の増加も認められていることから,被験物質投与により惹起された変化であると考えられる.これらの器官の病理組織学検査では,腎臓には被験物質投与に起因すると考えられる変化は認められなかったが,肝臓に小葉中心性の肝細胞肥大および門脈周囲性の脂肪化の減弱が認められた.小葉中心性の肝細胞肥大は対照群との間に有意差は認められなかったが,1000 mg/kg投与群においてのみ認められた変化であり,門脈周囲性の脂肪化の減弱は対照群との間に有意差の認められた所見であることから,いずれも被験物質投与により惹起された変化であると考えられる.1000 mg/kg投与群では,血液生化学検査においてA/G比の増加が認められた.アルブミン濃度は対照群と同様のレベルであったことから,1000 mg/kg投与群では,アルブミン以外の血漿タンパク質濃度の軽度な低下があったものと推測される.血液学検査成績には被験物質投与の影響はいずれの投与群においても認められなかった.
雌の剖検においても,雄と同様に1000 mg/kg投与群において肝臓および腎臓の相対重量が増加し,被験物質投与による影響であると考えられた.また,血液生化学検査では総タンパク質濃度が低下してA/G比が増加した.アルブミン濃度には投与の影響が認められなかったことから,雄と同様に,1000 mg/kgの反復投与によりアルブミン以外の血漿タンパク質濃度が低下したことにより増加したものと推測される.A/G比の増加は,300 mg/kg投与群の雌においても認められた.しかし,300 mg/kg投与群では,1000 mg/kg投与群とは異なり,総タンパク濃度およびアルブミン濃度がむしろ増加の傾向を示していたことから,A/G比の増加はアルブミン濃度の上昇によるものであると判断された.さらに,300 mg/kg投与群の雄には同様の変化が認められていないことから,300 mg/kg投与群の雌におけるA/G比の増加に被験物質投与が関与している可能性は乏しいと考えられる.100 mg/kg投与群におけるブドウ糖濃度の低下および300 mg/kg投与群におけるアルカリフォスファターゼ活性の低下は,これらの投与群の雌にのみ認められた軽度な変化であることから偶発的な変化であると考えられる.
1000 mg/kg投与群の雌では,血液生化学検査においてカルシウム濃度が僅かであるが有意に低下した.1000 mg/kg投与群では,総タンパク質濃度が低下していたことから,血漿タンパク質に結合して循環しているカルシウム濃度が低下したことによる変化である可能性が考えられ,被験物質投与による影響であると考えられる.これらの他に,1000 mg/kg投与群ではクレアチニン濃度の低下も認められた.しかし,その他の検査においてクレアチニン濃度の低下を伴うような所見は認められなかったことから,クレアチニン濃度の低下は偶発的変化であると考えられる.
1000 mg/kg投与群の雌の白血球数が減少した.病理組織学検査では造血あるいは免疫系の組織に異常は観察されなかったこと,ならびにいずれの投与群も白血球数の変動幅が大きいことから,白血球の産生に対する障害あるいは白血球の破壊亢進によるものではないと考えられる.雌では,分娩から剖検までの期間が短く,また,盛んに泌乳が行われている時期に剖検を行うことから,哺育児数により泌乳量が異なり,それぞれの生理的条件も異なっている.1000 mg/kg投与群では,対照群との間に有意差はなかったが,哺育4日における生存児数が少ない例がやや多かったことから,被験物質投与による影響より,むしろ哺育条件などの違いに起因した偶発的変化である可能性が考えられる.血液学検査では活性部分トロンボプラスチン時間も短縮した.しかし,雄にはこうした変化は認められなかったこと,およびプロトロンビン時間には変化は認められなかったことから,偶発的変化であると考えられる.
2.生殖発生毒性
平均発情回帰日数が1000 mg/kg投与群において軽度に延長した.また,投与開始後に性周期の型が変化する例にも増加の傾向が認められ,変化した例はいずれも発情回帰日数が延長していたことから,被験物質投与の影響が疑われる.300 mg/kg以下の投与群については,投与開始後に性周期が変化してもその変化に一定の傾向が認められず,平均発情回帰日数にも対照群との間に有意差は認められなかったことから,被験物質投与の影響はなかったものと考えられる.
交配成績については,各群に1〜2例の不妊動物が認められたが,受胎率に被験物質投与の影響は認められず,対照群を含む全ての動物が初回の発情で交尾した.また哺育5日に数えた妊娠黄体数にも対照群と被験物質投与群との間で差は認められなかったことから,1000 mg/kgまでのアゼライン酸ビス(2-エチルヘキシル)は排卵,交尾,受胎および着床に影響を及ぼさないと考えられた.
分娩状態の不良ならびにそれによると考えられる全出生児の死亡が100 mg/kgおよび300 mg/kg投与群に,また,哺育状態の不良が300 mg/kg投与群および1000 mg/kg投与群にそれぞれ1例ずつ認められた.1000 mg/kg投与群における例は,生存産児数が1と著しく少なく,出生児による吸乳刺激が少なかったことに起因した変化であると考えられる.妊娠期間および出産率についても対照群と被験物質投与群との間で有意差は認められなかったことから,1000 mg/kgまでのアゼライン酸ビス(2-エチルヘキシル)は分娩および哺育に影響を及ぼさないと考えられる.
1000 mg/kg投与群では分娩率および生児出産率が低値を示す例があった.しかし,対照群でも分娩率の低い例があり,これらの値に対照群との間で有意差は認められていない.また,着床数の少なかった例と交尾した雄動物の生殖器官に異常は認められていない.さらに,これらの値の低下した原因が,着床数の減少によるもの,産児数の減少によるもの,あるいは生存産児数の少なかった例と,個体によって異なっていることから,分娩率および生児出産率の低下傾向は偶発的変化である可能性が高い.
出生児の生存性,体重増加にみられた発育,ならびに性比に被験物質投与の影響は認められなかった.
出生児の形態観察では,100 mg/kg投与群において,1例に外表奇形が観察されたが,300 mg/kgおよび1000 mg/kg投与群では,いずれの時期の形態観察においても異常は認められなかったことから,自然発生によるもので,被験物質投与による形態変化ではないと考えられる.
3.無作用量
以上の試験成績から,本試験条件下におけるでは,アゼライン酸ビス(2-エチルヘキシル)の無作用量は,反復投与毒性に関しては,雌雄いずれにおいても1000 mg/kg投与群において,A/G比の増加ならびに肝臓および腎臓重量あるいはそれらの相対重量の増加が認められたことから,雌雄ともに300 mg/kg/dayと判断された.生殖発生毒性に関しては,1000 mg/kg/dayの投与により,雌において交配前における性周期の間隔が対照群と比較して延長したことから,300 mg/kg/dayであると判断された.雄ならびに出生児に関しては1000 mg/kg/dayを投与しても被験物質投与に起因した影響が認められなかったことから1000 mg/kg/dayであると判断された.
文献
| 1) | 化学物質データベース.Kis-NET,番号2603,国立環境研究所(2003). |
| 2) | 代田眞理子ら:アゼライン酸ビス(2-エチルヘキシル)のラットを用いる単回経口投与毒性試験.化学物質毒性試験報告,11:293-294(2004). |
| 連絡先 |
| 試験責任者: | 代田眞理子 |
| 試験担当者: | 渡辺千朗 |
| (財)食品薬品安全センター秦野研究所 |
| 〒257-8523 神奈川県秦野市落合729-5 |
| Tel 0463-82-4751 | Fax 0463-82-9627 | |
| Correspondence |
| Authors: | Mariko Shirota(Study director)
Chiaki Watanabe |
| Hatano Research Institute, Food and Drug Safety Center |
| 729-5 Ochiai, Hadano-shi, Kanagawa 257-8523, Japan |
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |

 法で,ブドウ糖濃度はグルコキナーゼG6PDH法で,総コレステロール濃度はCOD・DHAOS法で,トリグリセライド濃度はGPO・HAOS(グリセリン消去)法で,アルカリフォスファターゼ活性(ALP)はGSCC法で,ALT(GPT),AST(GOT)ASTおよびγ-GTP活性はIFCC法で,総ビリルビン濃度はアゾビリルビン変法で,無機リン濃度はモリブデン酸直接法で,カルシウム濃度はOCPC法で測定し,A/G比は算出した.また,全自動電解質分析装置(EA05,A&T)を用い,イオン電極法によって,ナトリウム,カリウムおよび塩素の各濃度を測定した.
法で,ブドウ糖濃度はグルコキナーゼG6PDH法で,総コレステロール濃度はCOD・DHAOS法で,トリグリセライド濃度はGPO・HAOS(グリセリン消去)法で,アルカリフォスファターゼ活性(ALP)はGSCC法で,ALT(GPT),AST(GOT)ASTおよびγ-GTP活性はIFCC法で,総ビリルビン濃度はアゾビリルビン変法で,無機リン濃度はモリブデン酸直接法で,カルシウム濃度はOCPC法で測定し,A/G比は算出した.また,全自動電解質分析装置(EA05,A&T)を用い,イオン電極法によって,ナトリウム,カリウムおよび塩素の各濃度を測定した.











