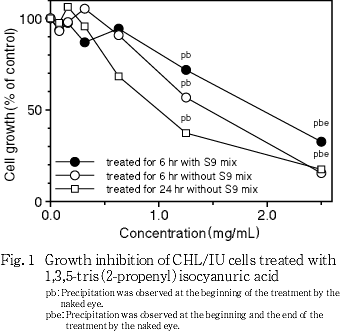
S9 mix非存在下および存在下で短時間処理(6時間処理後 18時間の回復時間)において,50 %増殖抑制濃度はそれぞれ1.5 mg/mLおよび2.0 mg/mLとなった.また,連続処理(24時間処理)した場合,50 %増殖抑制濃度は1.0 mg/mLとなった.
したがって,染色体異常試験では,短時間処理では,2.5 mg/mL(10 mM)を最高処理濃度とし,公比2で5濃度を設定した.また,S9 mix存在下で短時間処理した場合,構造異常および倍数性細胞共に誘発されるという報告があることから,濃度設定を変更し,5濃度(0.50,1.0,1.5,2.0,2.5 mg/mL)を設定し,再試験を行った.連続処理では,2.0 mg/mLを最高処理濃度とし,公比2で5濃度を設定した.
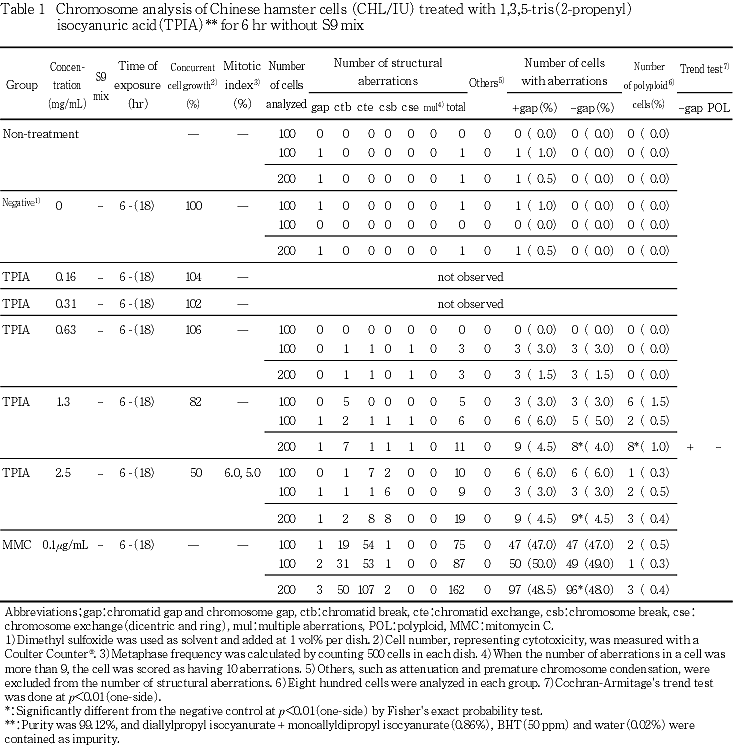
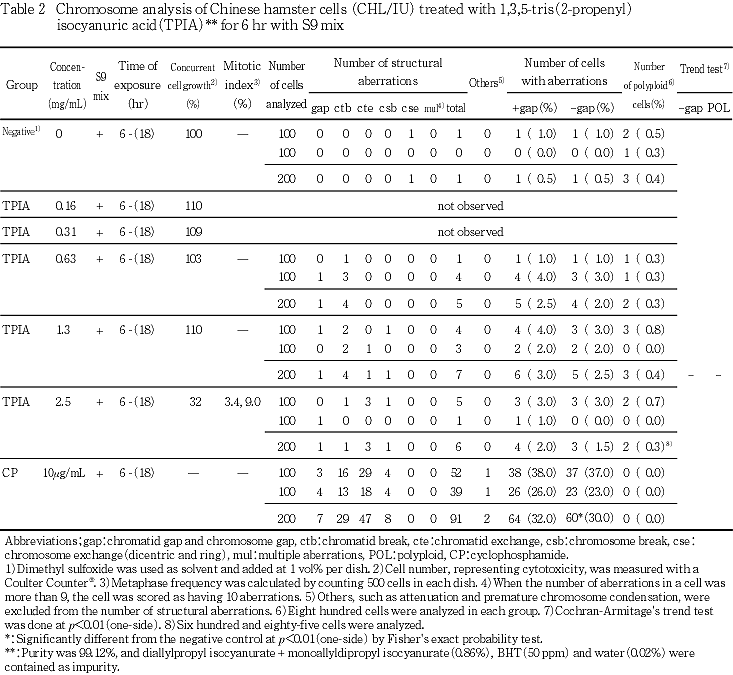
細胞増殖率および分裂指数より,短時間処理では,0.63,1.3,2.5 mg/mLについて,S9 mix存在下で短時間処理した2回目の試験では1.5,2.0,2.5 mg/mLについて,連続処理では,0.25,0.5,1.0 mg/mLについて染色体分析を行った.
染色体分析の結果,S9 mix非存在下で短時間処理した場合,1.3 mg/mL(中濃度群)および2.5 mg/mL(高濃度群)で染色体構造異常の有意な増加が認められた(4.0 %および4.5 %)が.その出現率が低頻度であることから,生物学的には陰性であると判断した.また,倍数性細胞については,S9 mix非存在下で短時間処理した1.3 mg/mL(中濃度群)において有意な増加が認められたが,その出現率が1.0 %と低かったことから陰性であると判定した.
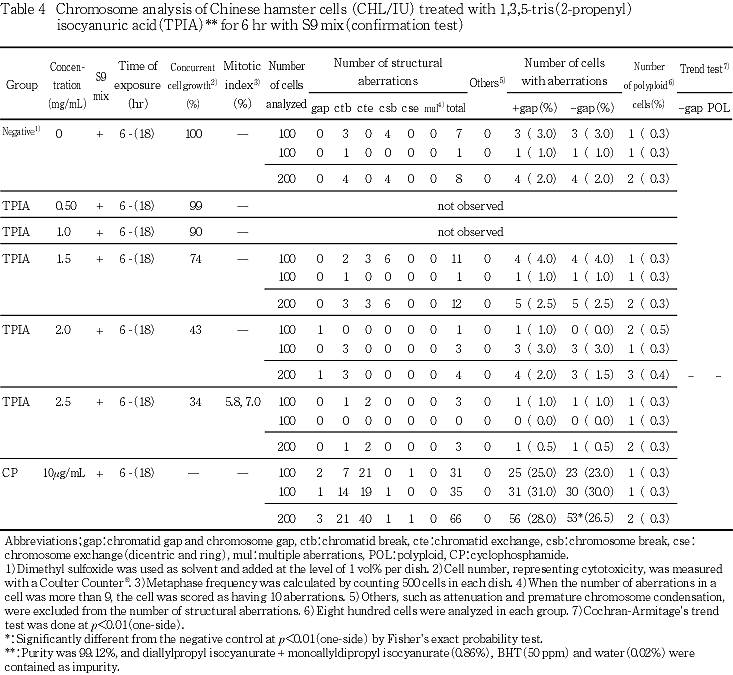
S9 mix存在下で短時間処理した場合には,構造異常および倍数性細胞の誘発についてはいずれの処理群でも有意な増加は認められなかった.また,濃度を変えて行った2回目の試験でも,いずれの処理群においても,構造異常を有する細胞および倍数性細胞の統計学的な有意差を認められなかった.
連続処理では,いずれの処理群においても,構造異常および倍数性細胞の誘発は認められなかった.
以上の結果より,本試験条件下で1,3,5-トリス(2-プロペニル)イソシアヌル酸は,染色体異常を誘発しない(陰性)と結論した.
その結果, S9 mix非存在下および存在下で短時間処理した場合,50 %細胞増殖抑制濃度はそれぞれ1.5 mg/mLおよび2.0 mg/mLとなった.また,連続処理における50 %細胞増殖抑制濃度は1.0 mg/mLとなった(Fig. 1).

また,陽性対照物質として用いたマイトマイシンC(MMC,協和醗酵工業)およびシクロホスファミド(CP,Sigma Chemical)は,日局注射用水(大塚製薬工場)に溶解して調製した.それぞれ染色体異常を誘発することが知られている濃度を適用した.
染色体異常試験において,溶媒対照群と処理群では1濃度あたり2枚のディッシュを用いた.このうちの2枚は染色体標本を作製し,それぞれの一部を用いてコールターカウンターにより細胞増殖率を測定した.無処理対照群および陽性対照群については細胞増殖率測定は行わなかった.
作製したスライド標本のうち,1つのディッシュから得られた異なるスライドを,4名の観察者がそれぞれ処理条件が分からないようにコード化した状態で分析した.染色体の分析は,日本環境変異原学会・哺乳動物試験研究会(MMS)1)による分類法に基づいて行い,染色体型あるいは染色分体型のギャップ,切断,交換などの構造異常の有無と倍数性細胞(polyploid)の有無について観察した.また構造異常については1群200個,倍数性細胞については1群800個の分裂中期細胞を分析した.
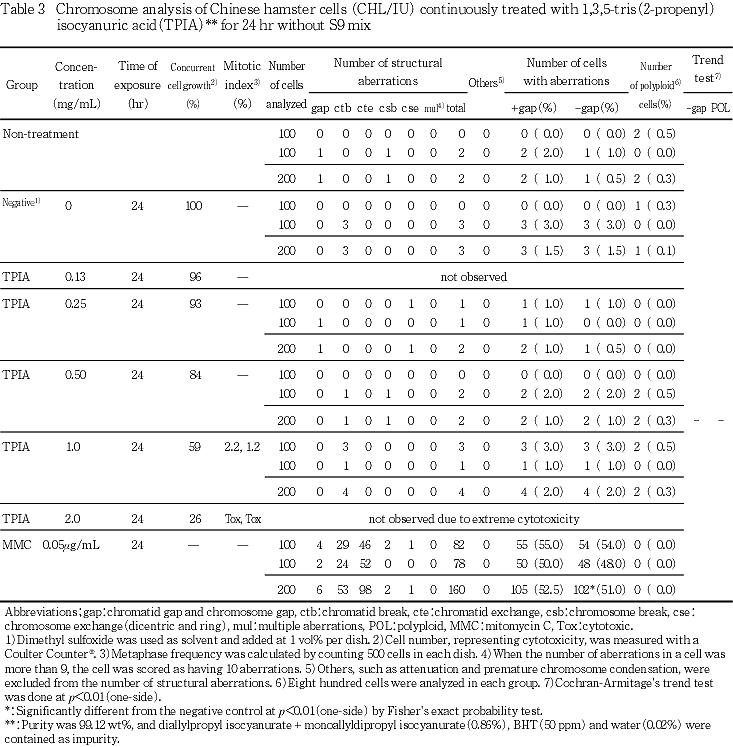
24時間連続処理においては,いずれの処理群においても染色体の構造異常および倍数性細胞の誘発は認められなかった(Table 3).
陽性対照物質として用いたMMCは,S9 mix非存在下で短時間処理および24時間連続処理した場合において染色体の構造異常を誘発し(Table 1,2),CPはS9 mix存在下で短時間処理した場合において染色体の構造異常を誘発した(Table 3).これらの陽性対照物質の結果より,本実験系の成立が確認された.
なお,被験物質は,S9 mix 存在下で短時間処理した場合,染色体の構造異常および倍数性細胞を誘発することが報告されている4).このことから,当該試験ではS9 mix 存在下での短時間処理を2回実施したが,いずれも陰性の結果となった.祖父尼4)のデータでは,出現率にばらつきはあったが,再現性のある陽性結果が得られていた.試験に使用した細胞や試験条件および処理濃度にほとんど差がないことから,これらの差違が何に起因するかは不明であるが,試験に使用した被験物質の不純物が影響した可能性も考えられた.
また,被験物質は,細菌を用いる復帰変異試験で陰性の結果が得られている5).また,関連物質である1,3,5-トリス(3,5-ジ-tert-ブチル-4-ヒドロキシベンジル)イソシアヌル酸については,当該試験と並行して実施した染色体異常試験で,構造異常に関して陰性,倍数性細胞誘発に関しては陽性の結果が得られている5).
以上の結果より,1,3,5-トリス(2-プロペニル)イソシアヌル酸は,本試験条件下でCHL/IU細胞に染色体異常を誘発しないと結論した.
| 1) | 日本環境変異原学会・哺乳動物試験分科会(編):「化学物質による染色体異常アトラス」朝倉書店,東京 (1988)pp. 16-37. |
| 2) | 吉村 功(編):「毒性・薬効データの統計解析,事例研究によるアプローチ」サイエンティスト,東京 (1987)pp. 76-78. |
| 3) | 吉村 功,大橋靖夫(編):「毒性試験講座14,毒性試験データの統計解析」地人書館,東京 (1992)pp. 218-223. |
| 4) | 祖父尼俊雄(監修):「染色体異常試験データ集」改定1998年版,エル・アイ・シー,東京 (1999)pp. 449-500. |
| 5) | 原 巧 ら:1,3,5-トリス (2-プロペニル) イソシアヌル酸の細菌を用いる復帰変異試験.化学物質毒性試験報告,11:472-476(2004). |
| 連絡先 | |||
| 試験責任者: | 田中憲穂 | ||
| 試験担当者: | 山影康次,高橋俊孝,若栗 忍, 中川ゆづき,橋本恵子,三枝克彦, 加藤初美 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Noriho Tanaka(Study director) Kohji Yamakage, Toshitaka Takahashi, Shinobu Wakuri, Yuzuki Nakagawa, Keiko Hashimoto, Katsuhiko Saegusa, Hatsumi Kato | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||