8週齢のSprague-Dawley系雌雄ラットに,交配期間および雌動物においては妊娠・哺育期間を通じて約6週間,p-tert-ブチルフェノールの,20,60および200 mg/kg/dayを経口投与し,F0動物およびF1産児に対する影響を調査して大要次の結果を得た.
また, 200 mg/kg投与群においては血漿アルブミン濃度が軽度ではあるが減少し,それに伴って血漿総タンパクも減少していた.雄動物の血液および病理検査においては何ら異常は認められなかった.
8週齢のSprague-Dawley系ラットの各群雌雄5匹に,p-tert-ブチルフェノールの0,250,500および1000 mg/kgを2週間経口投与し,毒性症状の観察および体重測定を行なった.その結果,1000 mg/kg投与群の雌動物2匹,雄動物1匹が死亡し,生存動物においては,体重の増加抑制ならびに呼吸困難症状を伴う異常呼吸音が3匹の雌動物に観察された.500 mg/kg投与群においても,1000 mg/kg投与群において認められたものと同様の異常呼吸音を発する動物が投与の進行と共に増加し,投与終了時には雌雄それぞれ3匹に観察された.以上の結果より,これらの投与量は最大耐量を超えると判断した.250 mg/kg投与群においても,対照群と比較して有意な体重変化は認められなかったが,1匹の雌動物より異常呼吸音が聴かれた.500および1000 mg/kg投与群においては,異常呼吸音を発する動物の数は投与の進行と共に増加したことより,また,本試験の投与期間は予備試験より長いことを考慮すると,250 mg/kgも最大耐量を僅かに凌駕すると考え,本試験における高用量には 200 mg/kg/dayを使用することとした.中用量および低用量には,それぞれ60および20 mg/kg/dayを用いることとした.
試験期間中毎日観察し,必要に応じて観察頻度を増やした.
B. 体重
投与期間中週 1回(雄:投与1,8,15,22,29,36,42日,雌:投与1,8,15日)交尾した雌については,妊娠0,7,14,20日に,さらに分娩した雌では,分娩後0および4日(哺育0および4日)ならびに解剖日に測定した.
C. 飼料消費量
体重測定日と同じ日に給餌器中の飼料重量を測定し,測定日間の飼料消費量を算出した.交配期間中の飼料消費量は測定しなかった.交尾成立雌については,妊娠 0-7,7-14,14-20日および分娩した雌では,哺育0-4日の飼料消費量を測定した.
D. 交配
投与 15日の夕方から最長2週間,同一投与量群の雌雄動物を1対1で同居させた.交尾の確認は,毎朝,腟内の交尾栓および腟垢中の精子の存在を調べることにより行ない,交尾が確認された雌については,その日を妊娠0日として起算し,雄から分離して個別に飼育した.
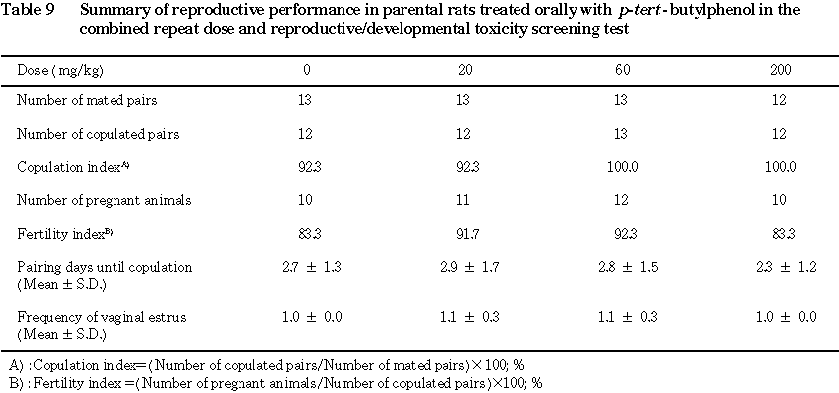
交配結果および妊娠の成否より,各投与群における,交尾率[ (交尾動物数/同居動物数)×100],受胎率[(受胎動物数/交尾動物数)×100],同居開始日から交尾確認日までの日数および雌の発情回帰回数を求めた.
E. 分娩
交尾の成立した雌動物は自然分娩させた.分娩状況を観察できた動物については,異常の有無を記録した.分娩が直接観察できなかった動物についても,分娩後の徴候から分娩障害の有無を判断し,個別に記録した.
分娩の確認は,午前 9時〜11時に行ない,分娩が完了していることが確認できた個体については,その日を分娩日(哺育0日)とした.
分娩の完了が確認された動物について妊娠期間 (妊娠0日〜分娩日の日数)を計算し,各投与群の平均妊娠期間および出産率[(生児出産雌数/妊娠雌数)×100]を求めた.
F. 雄動物の血液,血液生化学および病理検査
(1) 血液検査
最終投与日の翌日 (投与43日相当日),ネンブタール麻酔下に腹部後大静脈より,抗凝固剤としてEDTAを用いて採血し,赤血球数(RBC),白血球数 (WBC),血色素量(Hb),平均赤血球容積(MCV),ヘマトクリット値(Ht),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC)ならびに血小板数を多項目血液自動測定機(Coulter Counter Model S-PLUS IV)により測定し,白血球百分比をWright-Giemsa染色を行い光学顕微鏡下で観察して算出した.
(2) 血液生化学検査
血液検査のための採血に引き続き,抗凝固剤にヘパリンを用いて採血し,血漿を分離して遠心方式生化学自動分析装置 (COBAS-FARA)およびNa-K-ClアナライザーIT-3型を用い,総蛋白濃度(ビウレット法),アルブミン濃度(BCG法),総コレステロール濃度(COD・DAOS法),ブドウ糖濃度(グルコキナーゼ・G6PDH法),尿素窒素濃度(ウレアーゼ・G1.DH法),クレアチニン濃度(Jaffe法),アルカリフォスファターゼ活性 (p-ニトロフェニルリン酸基質法),GOT活性(SSCC法),GPT活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットSシリーズ),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミルーP-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(電量滴定法)ならびにA/G比(計算)について分析した.
(3) 剖検,器官重量および病理組織検査
血液検査のための採血に引き続いて,動物をペントバルビタール深麻酔下に放血,致死させて剖検した.肝臓,腎臓,胸腺,精巣および精巣上体については重量を測定した.また,胸腺,肝臓,腎臓,副腎,脳,心臓,脾臓,膀胱および肉眼的に異常の認められた器官は 10%ホルマリンで固定し,精巣ならびに精巣上体はブアン液で固定し,そのうち対照群および高用量投与群についてはヘマトキシリン・エオジン染色を施した後に病理組織検査を行なった.
G. 雌動物の剖検,器官重量および病理組織検査
分娩した雌動物は哺育 4日に,交尾したが分娩しなかった雌は妊娠25日相当日に,それぞれネンブタール深麻酔下に放血,致死させ,剖検した.妊,不妊に拘わらず,全ての動物の卵巣および子宮を摘出し,子宮についてはSalewski法1)を応用して着床痕を染色して着床数を確認した.卵巣は実体顕微鏡下で妊娠黄体数を数えた後,ブアン液に固定して保存した.不妊動物の卵巣については,病理組織検査を行なった.また,全ての動物について胸腺,肝臓および腎臓の重量を測定した.これらの器官および脳,心臓,脾臓,副腎,膀胱,子宮および剖検時に異常を認めた器官は10%ホルマリンに固定し,そのうち,高用量投与群および対照群についてはヘマトキシリン・エオジン染色を施した後に,病理組織検査を行なった.
哺育 0日に産児数(生存児+死亡児)を数え,分娩率[(産児数/着床痕数)×100]および産児生存率[(生存産児数/着床痕数)×100]を求めた.また,産児の性別を調べ,外形異常の有無を観察した.性比は,産児数に対する雄産児数の比として算出した.また,哺育0日の生存率[(生存産児数/産児数)×100]および新生児の4日の生存率[(哺育4日の生存産児数/哺育0日の生存産児数)×100]を求めた.死亡児は剖検し,胸腔および腹腔内の器官を除去した後,エタノールに固定して保存した.
B. 体重測定
哺育 0日および4日に各腹雌雄別に合計体重を測定し,産児平均体重を計算した.
C. 剖検
哺育 4日にエーテルを用いて安楽死させ,剖検した.胸腔および腹腔内の器官は摘出し,各腹毎に10%ホルマリンに固定して保存した.屍体は,各腹毎にエタノールに固定して保存した.
 法3)により対照群と各被験物質投与群との間で平均値の差の検定を行なった.分散が均一でなかった場合は,Kruskal-Wallis4)の順位検定を行ない,群間に有意性が認められた場合に対照群と各被験物質投与群との差についてDunnett型2)あるいはScheff
法3)により対照群と各被験物質投与群との間で平均値の差の検定を行なった.分散が均一でなかった場合は,Kruskal-Wallis4)の順位検定を行ない,群間に有意性が認められた場合に対照群と各被験物質投与群との差についてDunnett型2)あるいはScheff 型3)の検定を行なった.病理組織検査所見中,対照群,処理群の両方に共通してみられ,処理群で頻度・程度が増加している所見については,Wilcoxonの順位和検定法により,対照群と処理群の差に関する有意差検定を行なった.有意水準は,5%および1%とした.
型3)の検定を行なった.病理組織検査所見中,対照群,処理群の両方に共通してみられ,処理群で頻度・程度が増加している所見については,Wilcoxonの順位和検定法により,対照群と処理群の差に関する有意差検定を行なった.有意水準は,5%および1%とした.
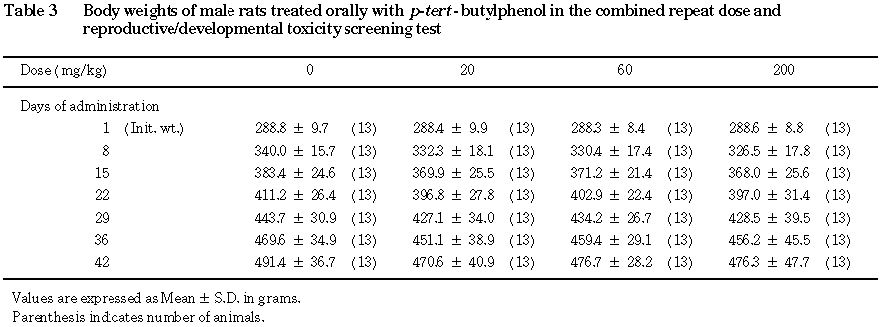
投与期間のいずれの時期においても,被験物質投与の影響は認められなかった.
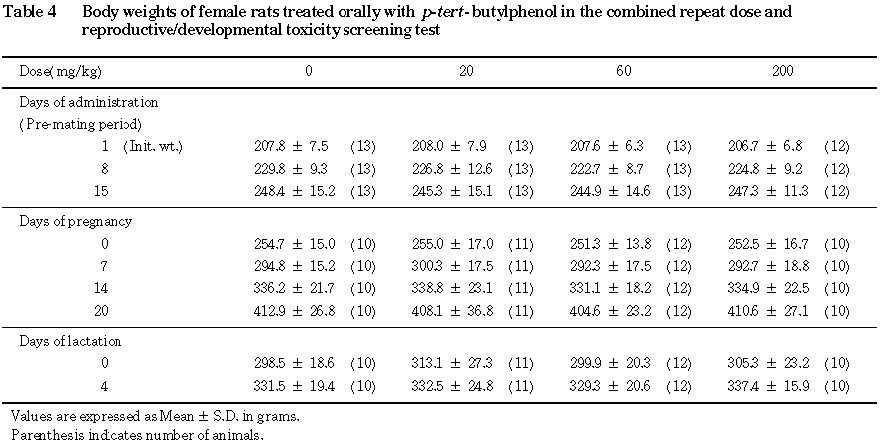
B. 雌動物(Fig. 4,Table 4)
交配開始前期間より妊娠期間を通して,いずれの投与群においても被験物質投与の影響は認められなかった.しかし, 20 mg/kg投与群の哺育期間中4日間の体重増加量が,対照群に比較して有意(p<0.05)に減少していた.この変化は,主として3匹の母動物に由来するものであり,また,60あるいは200 mg/kg投与群に同様の変化がみられていないことから,偶発的変化と考えられる.
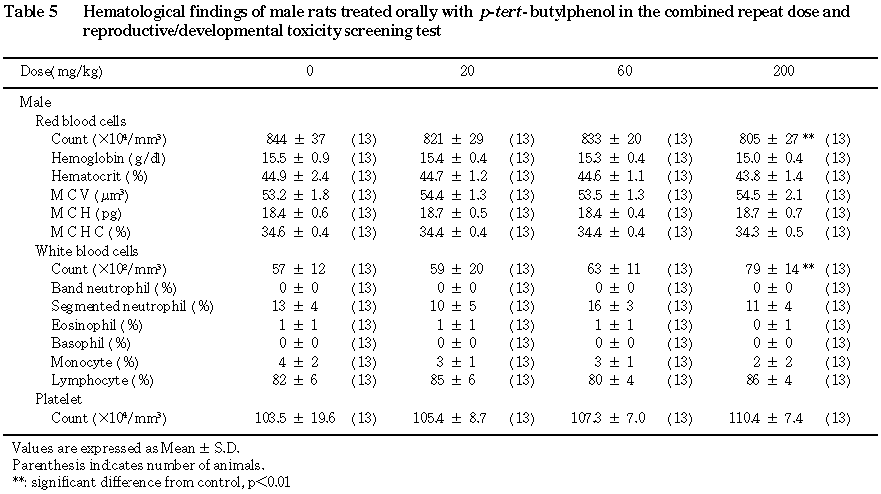
(1) 血液検査(Table 5)
200 mg/kg投与群において,赤血球数が統計学的に有意(p<0.01)に減少し,白血球数が統計的に有意 (p<0.01)に増加していた.当研究所における14週齢雄ラットを用いた過去5試験の赤血球数の平均値は,768〜838×10^4/mm^3であり,白血球数の平均値は83〜133×10^2/mm^3であった.これら背景データに比較すると,上記変化はいずれも軽度であり,毒性学的に意味のある変化ではなかった.
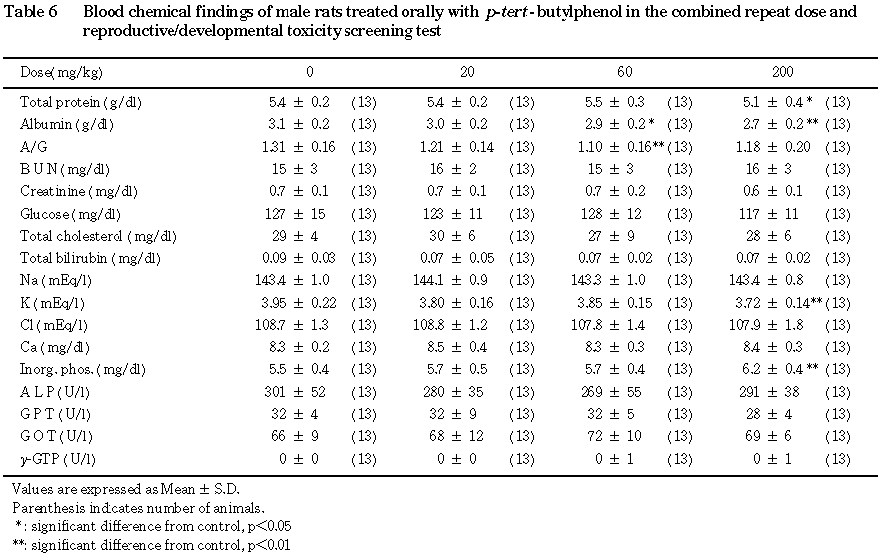
(2) 血液生化学検査(Table 6)
60および200 mg/kg投与群においてアルブミン濃度が有意(p<0.05あるいはp<0.01)に減少していた.しかし 60 mg/kg投与群における変化は極めて軽微であり,正常範囲の値であった.また,200 mg/kg投与群においては総蛋白量が有意(p<0.05)に減少し,A/G比は被験物質投与群において減少傾向にあり,60 mg/kg投与群においては有意(p<0.01)に減少していた.
一方,カリウム濃度は 200 mg/kg投与群において有意(p<0.01)に減少していたが,正常範囲の値であった.また,リン濃度が200 mg/kg投与群において僅かではあるが有意(p<0.01)に増加していた.



(3) 剖検
被験物質投与に起因したと考えられる異常所見は認められなかった.
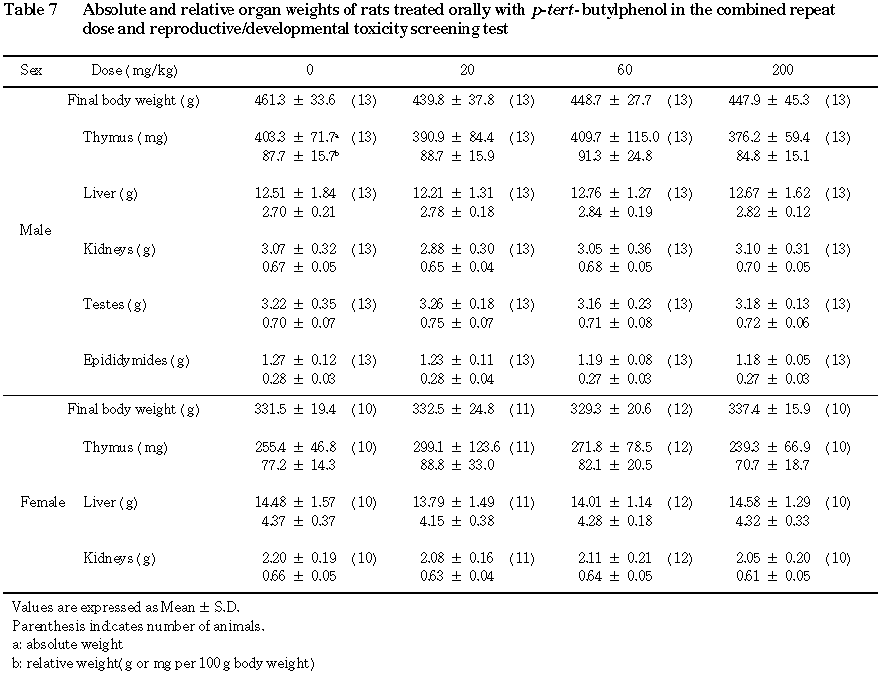
(4) 器官重量(Table 7)
いずれの器官の実重量および比重量においても,統計的に有意な変化は認められなかった.
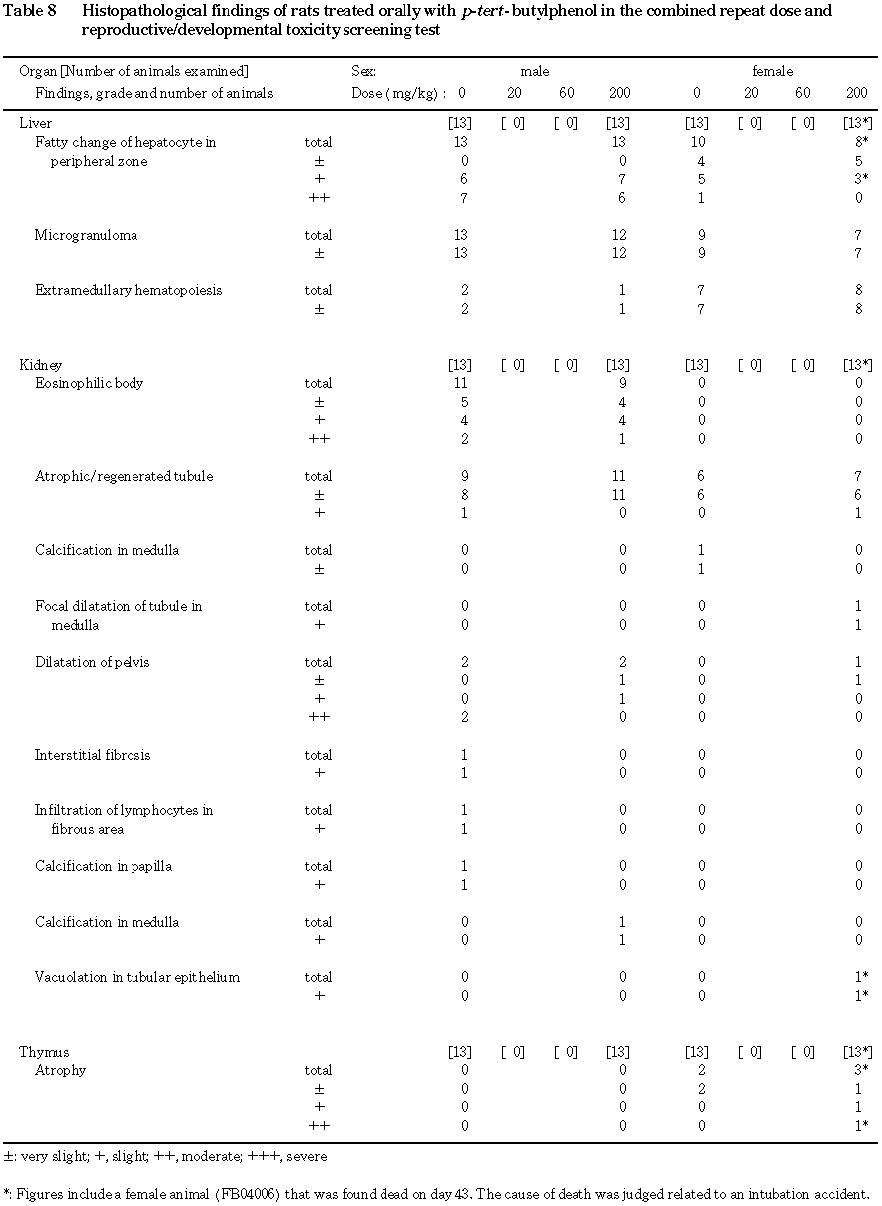
(5) 病理組織検査(Table 8)
各器官における観察所見の概要を以下に示す.
(胸腺)
異常所見は認められなかった.
(肝臓)
対照群および 200 mg/kg投与群に,小葉周辺性の肝細胞脂肪化,小肉芽腫および髄外造血がみられたが,両群間に頻度および程度の差はみられなかった.
(腎臓)
対照群および 200 mg/kg投与群に,eosinophilic body,萎縮あるいは再生尿細管,腎盂の拡張がみられたが,両群間に頻度および程度の差はなかった.その他,200 mg/kg投与群の1例に髄質の石灰沈着が認められた.
(副腎)
異常所見は認められなかった.
(脳)
異常所見は認められなかった.
(心臓)
異常所見は認められなかった.
(脾臓)
対照群および 200 mg/kg投与群に髄外造血巣および色素沈着がみられたが,両群間に頻度および程度の差はなかった.
(精巣)
200 mg/kg投与群の1例の精細管内に,多核巨細胞がみられた.
(精巣上体)
対照群および 200 mg/kg投与群にリンパ球の浸潤がみられたが,両群間に頻度および程度の差はみられなかった.
B. 雌動物
(1) 剖検所見
先の「死亡動物」の項で述べたように,哺育期間中に死亡発見された 200 mg/kg投与群の1匹の動物において,肺の充血あるいは鬱血を示す変化が認められた.
(2) 器官重量(Table 7)
統計的に有意な変化はみられなかった.
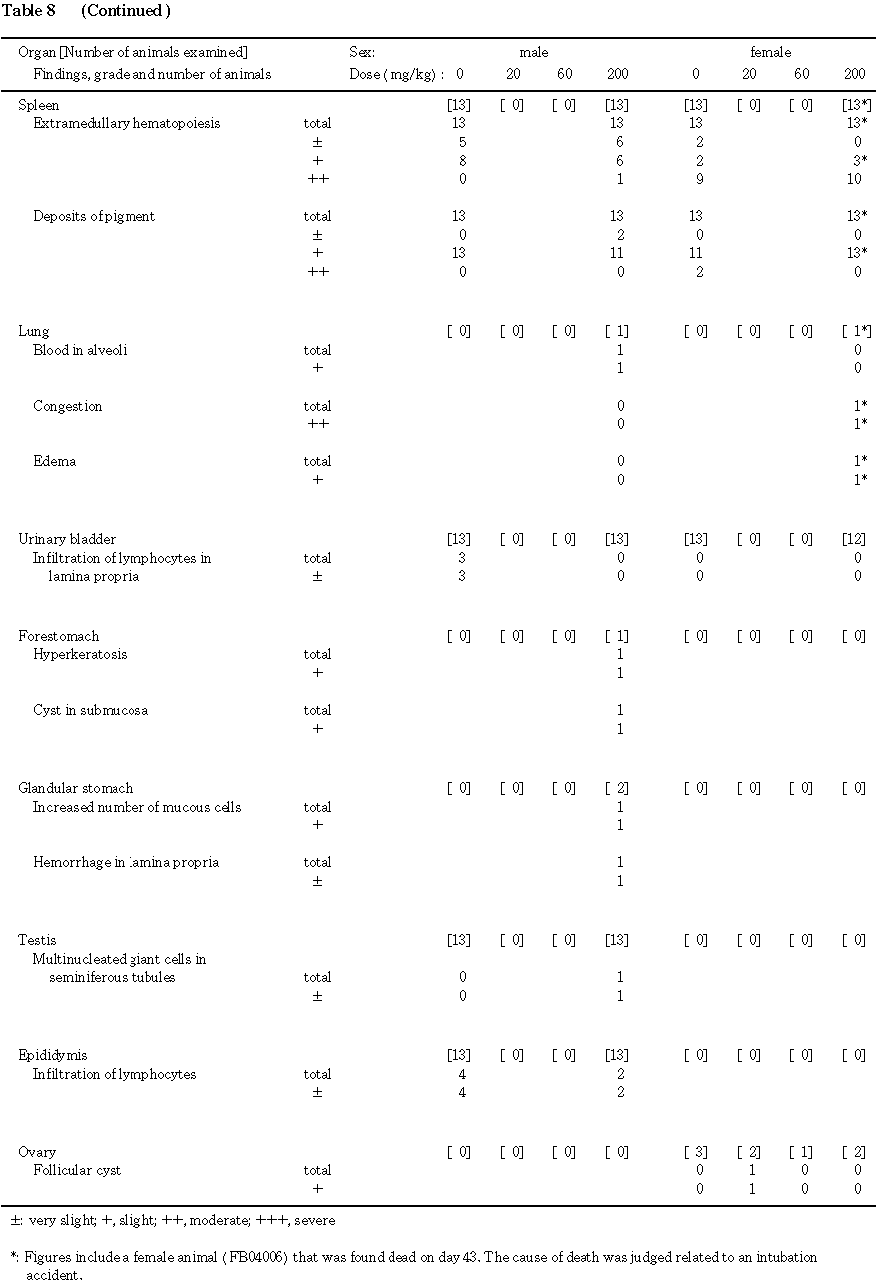
(3) 病理組織所見(Table 8)
各器官における観察所見の概要は以下の通りである.
(胸腺)
対照群の 2匹および死亡発見された200 mg/kg投与群の1匹を含む3匹に軽度から中等度の萎縮が認められたが,毒性学的に意味のあるものではなかった.
(肝臓)
対照群および 200 mg/kg投与群に,小葉周辺性の肝細胞脂肪化,小肉芽腫および髄外造血がみられたが,両群間に頻度および程度の差はみられなかった.
(腎臓)
対照群および 200 mg/kg投与群に萎縮あるいは再生尿細管がみられたが,両群間に頻度および程度の差はなかった.その他,200 mg/kg投与群に髄質尿細管の限局性拡張,腎盂の拡張あるいは尿細管上皮の空胞化が各1例みられたが,毒性的に意味のあるものではなかった.
(副腎)
異常所見は認められなかった.
(脳)
異常所見は認められなかった.
(心臓)
異常所見は認められなかった.
(脾臓)
対照群および 200 mg/kg投与群に髄外造血巣および色素沈着がみられたが,両群間の頻度および程度に差はなかった.
(膀胱)
異常所見は認められなかった.
(卵巣)
不妊あるいは交尾が成立しなかったために組織観察を実施した動物のうち, 20 mg/kg投与群の1匹に卵胞嚢胞がみられた.
(剖検時に異常の認められた器官)
200 mg/kg投与群の死亡発見された1匹の肺に,鬱血および水腫がみられた.
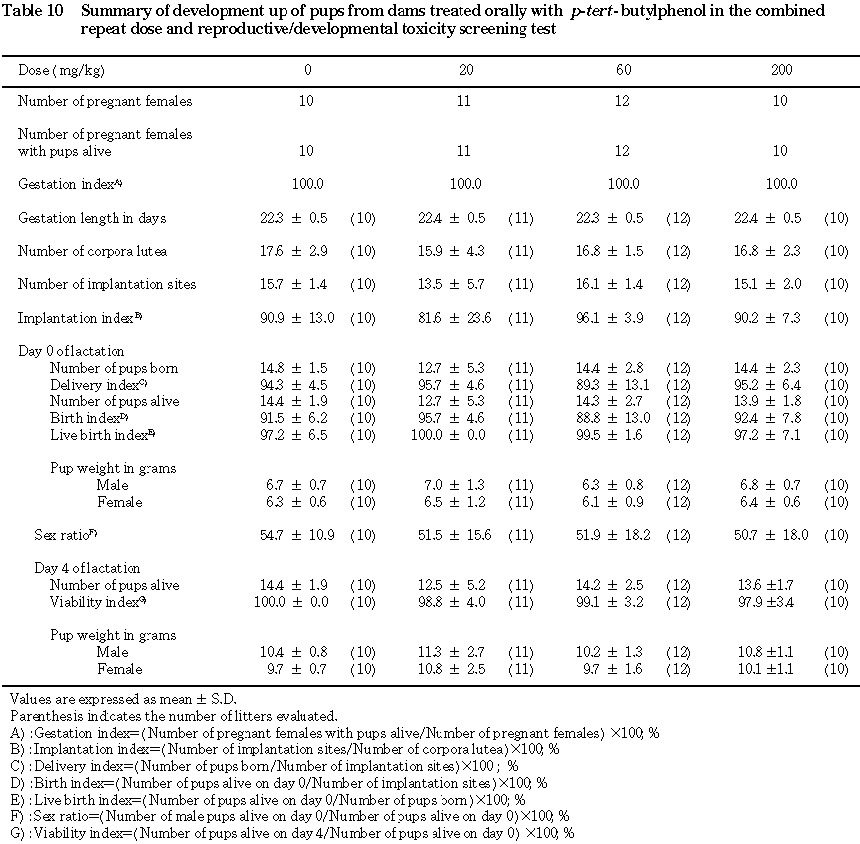
被験物質の投与は,交配成績および妊娠率に影響を及ぼさなかった.
B. 出産率および妊娠期間(Table 10)
出産率および妊娠期間について,被験物質投与の影響は認められなかった.
C. 分娩および哺育状態
200 mg/kg投与群の1匹の母動物が,分娩約1週間前頃より異常呼吸音を発し始め,その後この症状は継続し,分娩翌翌日に死亡発見された.この動物では分娩状態を確認することができなかったが,分娩後の観察でも異常呼吸音以外,分娩状態の異常を示唆する一般状態の変化は認められなかった.しかし,妊娠20日から分娩日までの体重減少率が38.4%と高かった(対照群平均:27.7%).また,営巣行動は認められず,産児の体温は低下しており,哺乳行動も観察されなかった.16匹の産児のうち5匹は分娩日に死亡していた.この母動物で認められた異常と被験物質投与との関係は明確ではなかったが,これ以外には分娩および哺育状態に異常は認められなかった.
D. 黄体数,着床数および着床率(Table 10)
統計的有意差を示す変化は認められなかった.
一方,血漿アルブミンの減少については, 60 mg/kg 投与群における減少は極めて軽微であったことから,毒性学的には意味のないものと考えられるが,200 mg/kg 投与群における減少はp-tert-ブチルフェノール投与による毒性反応と思われる.しかし,その他の血液生化学検査値には,この変化を裏付けるような異常は,血漿蛋白系の変化を除いては認められず,また病理検査においても異常は観察されなかった.
生殖・発生毒性学的には,投与過誤が生じたと判断された 1匹の母動物において新産児死亡がみられたが,これ以外の母動物およびその産児に何らの異常も観察されなかった.
本試験条件下において, p-tert-ブチルフェノールのF0動物に対する反復投与毒性ならびに生殖・発生毒性に関する無影響量は60 mg/kg/dayであり,F1産児に対する無影響量は200 mg/kg/dayであった.
| 1) | E. Salewski, Naunyn-Schmiedebergs Arch. Exp. Pathol. Pharmakol., 247, 367 (1964). |
| 2) | C. W. Dunnett, Biometrics, 20, 482 (1964). |
| 3) | H. Scheff Biometrika, 40, 87 (1953). Biometrika, 40, 87 (1953). |
| 4) | W. H. Kruskal,W. A. Wallis, J. Amer. Statist., 47, 583 (1952). |
| 5) | D. R. Klonne,R. C. Myers,D. J. Nachreiner, Drug and chemical Toxicology, 11, 43 (1988). |
| 6) | J. Pauluhn, W. R殤geler, U. Mohr, Fundam. Appl. Toxicol., 24, 217 (1995). |
| 連絡先 | |||
| 試験責任者: | 藤井孝朗 | ||
| 試験担当者: | 高島宏昌,関 誠,松本亜紀 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257 神奈川県秦野市落合729-5 | |||
| Tel. 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Takaaki Fujii(Study director) Hiromasa Takashima, Makoto Seki, Aki Matsumoto | ||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano, Kanagawa, 257, Japan | |||
| Tel. +81-463-82-4751 | Fax +81-463-82-9627 | ||