 法,ブドウ糖はGlucose dehydrogenase法,総コレステロールはCOD・DAOS法,トリグリセライドはGPO・DAOS法,Caはo-CPC法,無機リンはMolybdenum blue法により,自動分析装置(AU 500,オリンパス光学工業(株))を用いて測定した.
法,ブドウ糖はGlucose dehydrogenase法,総コレステロールはCOD・DAOS法,トリグリセライドはGPO・DAOS法,Caはo-CPC法,無機リンはMolybdenum blue法により,自動分析装置(AU 500,オリンパス光学工業(株))を用いて測定した.
雌においては, 1000 mg/kg群で流涎,自発運動の低下,眼瞼下垂がみられ,1/12例が死亡した.体重および摂餌量は,各投与群とも対照群との間に差はみられなかった.死亡例の剖検では,肺の暗赤色化および空腸・回腸の赤色化がみられた.生存例の剖検では,いずれの群においても異常はみられなかった.器官重量では,各投与群とも対照群との間に差はみられなかった.病理組織学的検査では,1000 mg/kg群で心臓,胸腺,肝臓,脾臓,腎臓,卵巣,副腎および脳に投与に起因すると思われる変化はみられなかった.また,死亡例においても,剖検時に異常が観察された器官・組織に投与に起因すると思われる変化はみられなかった.
総出産児数,分娩率,哺育 0日の新生児数,児の産出率,死産児数,出生率,性比,哺育4日の新生児数,哺育4日の生存率では,各投与群とも対照群との間に差はみられなかった.外表観察では,いずれの群においても異常はみられなかった.体重では,各投与群の雌雄とも哺育0日および哺育4日ともに対照群との間に差はみられなかった.一般状態では,対照群および各投与群とも異常症状はみられなかった.また,剖検では,いずれの群においても異常はみられなかった.
以上のことから,当試験条件下におけるメタクリル酸 (2-ヒドロキシプロピル)エステルの一般毒性学的無影響量は,雌雄とも300 mg/kg/dayと考えられる.また,生殖発生毒性学的な無影響量は,雌雄の生殖および児動物の発生に関していずれも1000 mg/kg/dayと推察される.
被験物質は秤取し,注射用水に溶解して必要濃度の投与検体を調製した.なお, 0.8および20%濃度の調製液は,室温・遮光条件下で7日間保存しても安定性に問題のないことが確認されていたため,2,6および20%濃度の調製液は調製後,室温・遮光条件下で保管し,調製後7日以内に使用した.0.6%濃度の調製液は,定量限界以下の濃度であり,安定性の確認ができなかったため,用時に6%濃度の調製液を注射用水で希釈して調製し,速やかに投与に用いた.また,被験物質は純度換算しないで,投与量は原体重量で表示した.
動物は,室温 20〜24℃,湿度40〜70%,明暗各12 時間(照明:午前6時〜午後6時),換気回数12回/時に設定した飼育室で飼育した.検疫・馴化期間中はステンレス製懸垂式ケージを用いて1ケージあたり5匹までの群飼育とし,群分け後はステンレス製五連ケージを用いて個別飼育した.ただし,交配はステンレス製懸垂式ケージ内で行った.また,母動物は,妊娠18日にオートクレーブ処理した床敷(サンフレーク,日本チャールス・リバー(株))を入れたプラスチック製ケージに個別に移し,自然分娩および哺育をさせた.飼料は固型飼料(CRF-1,オリエンタル酵母工業(株))を,飲料水は水道水をいずれも自由に摂取させた.なお,剖検前日の午後 4 時からは絶食とした.
投与量は,先に実施した雄ラットを用いた 2週間経口投与による予備試験(投与段階:0,30,100,300および 1000 mg/kg,各群5例)の結果により決定した.すなわち,1000 mg/kg群で投与直後に流涎がみられたのみで,各群とも死亡発現はなく,体重推移および剖検でも異常はみられなかった.そこで,当試験の投与量は,1000 mg/kgを最高用量とし,以下公比約3で300,100および 30 mg/kgとした.また,対照として被験物質と同一液量の媒体(注射用水)を投与する群を設けた.
投与期間は,雄では交配前 14日間とその後35日間の合計49日間とし,雌では交配前14日間,交配期間中(最長14日間),妊娠期間および哺育4日の剖検前日までの合計41〜48日間とした.なお,投与開始日を投与1日とした.
(1) 一般状態
一般状態および死亡の有無は,投与前・後の 1日2回観察した.なお,死亡例は,発見後速やかに剖検し,異常の認められた器官・組織を10%中性緩衝ホルマリン液に固定後,H-E染色組織標本を作製し,病理組織学的に検査した.
(2) 体重測定
体重は, 1週間に2回測定した.
(3) 摂餌量測定
摂餌量は,交配開始前 14日間および交配期間終了後から毎週2回測定した.
(4) 血液学検査
投与期間終了の翌日に,ペントバルビタールナトリウムの腹腔内投与による麻酔下で腹大動脈から血液を採取し,以下の検査を実施した.
赤血球数 (RBC),ヘモグロビン量,ヘマトクリット値,血小板数および白血球数(WBC)は,EDTA-2KコーティングしたSysmexサンプルカップに採取した血液について,多項目自動血球計数装置(Sysmex E-2000,東亜医用電子(株))を用いて測定した.さらに,平均赤血球容積(MCV),平均赤血球血色素量(MCH)および平均赤血球血色素濃度(MCHC)を算出した.
網状赤血球数 (RET)は,EDTA-2K処理した血液をBrecher法により超生体染色してスライドグラスに塗抹後,Giemsa染色した標本を作製して顕微鏡下で赤血球1000個中の数を計数した.
白血球百分率は, EDTA-2K処理した血液をスライドグラスに塗抹し,May-Giemsa染色した標本を作製して顕微鏡下で白血球100個を分類計数した.
プロトロンビン時間 (PT),活性化部分トロンボプラスチン時間(APTT)およびフィブリノーゲン濃度は,3.13%クエン酸ナトリウムで処理した血漿について,散乱光検出方式により血液凝固分析装置(コアグマスターⅡ,三共(株))を用いて測定した.
(5) 血液生化学検査
血液学的検査用の血液と同時期に腹大動脈から採取した血液を遠心分離し,得られた血清について,以下の検査を実施した.
GOTおよびGPTはHenry変法,ALPはp-NPP基質法,γ-GTPはγ-G-P-NA基質法,総蛋白はBiuret法,総ビリルビンはAzobilirubin法,尿素窒素(BUN)はUrease・GlDH法,クレアチニンはJaff 法,ブドウ糖はGlucose dehydrogenase法,総コレステロールはCOD・DAOS法,トリグリセライドはGPO・DAOS法,Caはo-CPC法,無機リンはMolybdenum blue法により,自動分析装置(AU 500,オリンパス光学工業(株))を用いて測定した.
法,ブドウ糖はGlucose dehydrogenase法,総コレステロールはCOD・DAOS法,トリグリセライドはGPO・DAOS法,Caはo-CPC法,無機リンはMolybdenum blue法により,自動分析装置(AU 500,オリンパス光学工業(株))を用いて測定した.
NaおよびKはイオン選択電極法により,Clは電量滴定法により,いずれも全自動電解質分析装置(EA04,(株)A & T)を用いて測定した.
蛋白分画は,電気泳動法により自動電気泳動装置 (AES 600,オリンパス光学工業(株))を用いて測定した.
アルブミン量は総蛋白量および蛋白分画値から, A/G比は蛋白分画値から算出した.
(6) 剖検
上記の (4)および(5)の項で採血した動物をさらに放血致死させた後に器官・組織の肉眼的観察を行った.胸腺,肝臓,腎臓,精巣および精巣上体は摘出後に重量を測定し,副腎,脳,心臓および脾臓とともに10%中性緩衝ホルマリン液(ただし,精巣および精巣上体はブアン液)に固定した.
(7) 病理組織学的検査
摘出した器官・組織について常法に従ってパラフィン包埋標本を作製した.対照群および 1000 mg/kg群の心臓,肝臓,脾臓,胸腺,腎臓,精巣,精巣上体,副腎および脳についてH-E染色組織標本を作製し,病理組織学的に検査した.
一般状態および死亡の有無は,投与前・後の 1日2回観察した.なお,死亡例は,発見後速やかに剖検し,異常の認められた器官・組織を10%中性緩衝ホルマリン液に固定後,H-E染色組織標本を作製し,病理組織学的に検査した.
(2) 性周期
性周期は,投与開始日から交尾確認日まで毎日 1回観察した.なお,発情期が連続 2 日間にわたって観察された場合は1回と計数した.
(3) 体重測定
体重は,交配開始前 14日間および交配期間中には毎週2回,妊娠期間中には妊娠0,7,14および21日に,哺育期間には哺育0および4日にそれぞれ測定した.
(4) 摂餌量測定
摂餌量は,交配開始前 14日間までは毎週2回測定した.また,妊娠期間中は妊娠2,9,16および21日に,哺育期間中は哺育4日に測定した.
(5) 交尾不成立雌の剖検
交尾不成立雌は,交配期間終了後にエーテル麻酔下で腹大動脈から放血致死させた後に剖検し,着床の有無により妊娠の有無を確認した.
(6) 分娩状態の観察
交尾雌は自然分娩させ,分娩状態の異常の有無,分娩終了の確認を妊娠 21日から妊娠25日の午前10時まで毎日行った.午前10時に分娩が終了していた場合,その日を哺育0日とした.
(7) 妊娠25日の午前10時までに分娩しなかった動物
妊娠 25日の午前10時までに分娩しなかった雌は,妊娠25日にエーテル麻酔下で腹大動脈から放血致死させた後に剖検し,着床の有無により妊娠の有無を確認した.
(8) 哺育状態の観察および剖検
母動物は,哺育状態を哺育 4日まで毎日観察し,哺育4日にエーテル麻酔下で腹大動脈から放血致死させた後に剖検し,着床痕数および黄体数を数えた.肝臓,腎臓,胸腺および卵巣は摘出後に重量を測定し,副腎,脳,心臓および脾臓とともに10%中性緩衝ホルマリン液に固定した.
(9) 病理組織学的検査
摘出した器官・組織について常法に従ってパラフィン包埋標本を作製した.対照群および 1000 mg/kg群の心臓,肝臓,脾臓,胸腺,腎臓,卵巣,副腎および脳についてH-E染色組織標本を作製し,病理組織学的に検査した.
交尾確認は毎朝ほぼ一定時刻に行い,腟垢内に精子または腟栓を確認した雌を交尾成立動物として,その日を妊娠 0日として起算した.
(1) 出産時の観察
出産時に総出産児数と性,死産児数,新生児数および外表異常の有無を観察した.
(2) 新生児の観察
新生児は,一般状態および死亡の有無を生存期間中毎日 1回観察した.
(3) 体重測定
体重は,哺育 0日(出生日)および4日に測定した.
(4) 剖検
新生児は,哺育 4日の観察終了後にエーテル麻酔下で腹大動脈から放血致死させた後に剖検した.
 法3)を用いて行った.一方,等分散と認められなかった場合は,順位を利用した一元配置法による分析(Kruskal-Wallisの検定4))を行い,有意ならば順位を利用したDunnett法またはScheff
法3)を用いて行った.一方,等分散と認められなかった場合は,順位を利用した一元配置法による分析(Kruskal-Wallisの検定4))を行い,有意ならば順位を利用したDunnett法またはScheff 法を用いて行った.
法を用いて行った.
(1) 一般状態
1000 mg/kg群では,投与11および20日に各1例の合計2例が死亡した.
一般状態観察において,対照群, 30,100および300 mg/kg群では,観察期間を通していずれの動物とも異常はみられなかった.1000 mg/kg群では,流涎が投与 3日から,自発運動の低下が投与11日から,眼瞼下垂が投与16日から投与期間終了日までほぼ継続してみられた.
(2) 体重推移(Fig.1)
各投与群の体重は,対照群とほぼ同様の推移であり,いずれの測定日にも有意差はみられなかった.

(3) 摂餌量
各投与群の摂餌量は,対照群とほぼ同程度であり,いずれの測定日にも有意差はみられなかった.
(4) 血液学検査(Table 1)
300 mg/kg以下の群では,対照群と比べていずれの測定項目にも有意差はみられなかった.1000 mg/kg群では,対照群と比べてヘマトクリット値の有意な低値,赤血球数およびヘモグロビン量の低値傾向がみられた.

(5) 血液生化学検査(Table 2)
各投与群とも,対照群と比べていずれの測定項目にも有意差はみられなかった.

(6) 剖検
生存例の剖検において,対照群および 1000 mg/kg群では,いずれにも異常はみられなかった.30 mg/kg群では片側性腎盂拡張が 1 例と両側性精巣上体の尾部に黄白色結節が1例,100 mg/kg群では片側性精巣上体の尾部に黄白色結節が1例,300 mg/kg群では片側性腎盂拡張と片側性精巣上体の尾部に黄白色結節が1例,両側性精巣・精巣上体の萎縮が 1 例にみられた.
1000 mg/kg群の死亡例の剖検において,肺・肝臓・腎臓の暗赤色化および空腸・回腸の赤色化が 1 例と肺の暗赤色化が1例にみられた.
(7) 器官重量(Table 3)
300 mg/kg以下の群では,対照群と比べていずれの器官重量とも有意差はみられなかった.1000 mg/kg群では,対照群と比べて肝臓の相対重量の有意な高値がみられた.
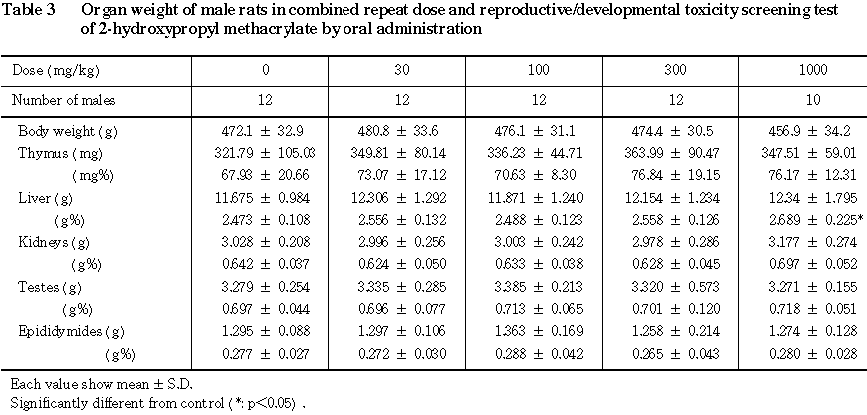
(8) 病理組織学的検査(Table 4)
生存例では,肝臓において門脈周囲の肝細胞の空胞変性が対照群で 7例,1000 mg/kg群で8例にみられた.精巣において,精細管の萎縮が対照群で1例にみられた.精巣上体において,精子肉芽腫が1000 mg/kg群で1例にみられた.その他には,対照群および1000 mg/kg群とも心臓,胸腺,脾臓,腎臓,副腎および脳に異常はみられなかった.
死亡例では, 1000 mg/kg群の1例で肝臓・肺・腎臓のうっ血,肺・腎臓・空腸・回腸の自己融解がみられた.他の1例で肺のうっ血,肺の浮腫,肺の自己融解がみられた.

(1) 一般状態
1000 mg/kg群では,投与15日に1例が死亡した.
一般状態観察において,対照群, 30,100および300 mg/kg群では,観察期間を通していずれの動物とも異常はみられなかった.1000 mg/kg群では,流涎が投与4日から,自発運動の低下が投与11日から,眼瞼下垂が投与11日から投与期間終了日までほぼ継続してみられた.
(2) 体重推移(Fig.2)
交配開始前および交配期間中,妊娠期間中ならびに哺育期間中を通じて,各投与群の体重は対照群とほぼ同様の推移であり,有意差はみられなかった.

(3) 摂餌量
30 および 300 mg/kg群では,対照群と比べていずれの測定日の摂餌量にも有意差はみられなかった.100および1000 mg/kg群では,対照群と比べて投与6および10日に摂餌量の有意な低値がみられたが,妊娠期間および哺育期間には有意差は認められなかった.
(4) 剖検
生存例の剖検において,対照群,各投与群ともいずれにも異常はみられなかった.
1000 mg/kg群の死亡例の剖検において,肺の暗赤色化および空腸・回腸の赤色化が1例にみられた.
(5) 器官重量(Table 5)
各投与群とも,対照群と比べていずれの器官重量にも有意差はみられなかった.

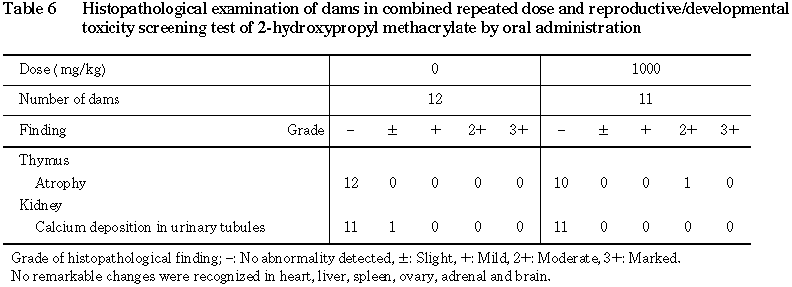
(6) 病理組織学的検査(Table 6)
生存例では,胸腺において萎縮が 1000 mg/kg群で1例にみられた.腎臓において,尿細管内にカルシウム沈着が対照群で1例にみられた.その他には,対照群および1000 mg/kg群とも心臓,肝臓,脾臓,卵巣,副腎および脳に異常はみられなかった.
死亡例では, 1000 mg/kg群の1例で肺の浮腫,空腸・回腸の自己融解がみられた.
(1) 発情回数,交尾率および受胎率(Table 7)
交配前の投与期間 (14日間)の発情回数は,30,300および1000 mg/kg群と対照群とはほぼ同程度であり,有意差はみられなかった.なお,100 mg/kg群で対照群と比べて交配前の投与期間(14日間)の発情回数の有意な高値がみられたが,投与量に依存した変化ではなかった.
100 mg/kg群の3組を除いた全例で交尾が確認された.交尾日数は,各投与群とも対照群との間に有意差はみられなかった.また,交尾率にも,各投与群とも対照群との間に有意差はみられなかった.不受胎雌は,100および300 mg/kg群で各1例みられたが,受胎率には各投与群とも対照群との間に有意差はみられなかった.なお,受胎雌の全例が新生児を分娩した.

(2) 妊娠期間,分娩状態,黄体数,着床率および出産率(Table 8)
各投与群の妊娠期間は,対照群とほぼ同程度であり,有意差はみられなかった.また,いずれの動物とも分娩状態に異常はみられなかった.
30,100および300 mg/kg群で対照群と比べて黄体数の有意な低値および着床率の有意な高値がみられたが,1000 mg/kg群では有意差は認められず,投与量に依存した変化ではなかった.なお,着床痕数は,各投与群とも対照群との間に有意差はみられなかった.
出産率は,対照群,各投与群とも 100 %であった.

(1) 分娩率,出生率および生存率(Table 8)
総出産児数および分娩率は,各投与群とも対照群とほぼ同程度であり,有意差はみられなかった.
哺育 0日の新生児数,死産児数,出生率,児の産出率および性比は,各投与群とも対照群とほぼ同程度であり,有意差はみられなかった.
新生児の一般状態では,いずれの群とも異常症状は観察されなかった.
哺育 4日の新生児数および哺育4日の生存率は,各投与群と対照群と同程度であり,有意差はみられなかった.
新生児の外表異常の観察では,いずれの群とも異常はみられなかった.
(2) 新生児の体重(Table 8)
各投与群の体重は,哺育 0日および4日とも雌雄ともに対照群とほぼ同程度であり,有意差はみられなかった.
(3) 新生児の剖検
対照群,各投与群ともいずれにも異常はみられなかった.
雄動物に対しては, 1000 mg/kg群で2例が死亡した.死亡例の剖検,異常の観察された器官・組織の病理組織学的検査において,消化管の変化あるいは死後変化に基づくと考えられる所見の他には,特筆すべき変化は認められず,死因は明らかにできなかった.一般状態観察において,1000 mg/kg群では投与期間の初期から流涎がみられた.また,投与期間の中期から自発運動の低下,眼瞼下垂がみられた.300 mg/kg以下の群では,死亡発現はなく,一般状態の異常もみられなかった.体重および摂餌量には,1000 mg/kgの投与でも影響はみられなかった.1000 mg/kg群で観察された流涎は,メタクリル酸(2-ヒドロキシプロピル)エステルの刺激性に基づく変化と考えられる.また,自発運動の低下および眼瞼下垂は,メタクリル酸(2-ヒドロキシプロピル)エステルの大量投与による毒性学的変化と考えられるが,体重推移および摂餌量に影響を及ぼすほどのものではなかった.1000 mg/kg群で肝臓の相対重量の有意な高値がみられた.しかし,肝臓の絶対重量には差が認められないこと,血液生化学検査でも関連項目に異常がみられないこと,さらに肝臓の病理組織学的検査でも異常がみられないことから,肝臓の相対重量の変動がメタクリル酸(2-ヒドロキシプロピル)エステルの投与によるものとしても毒性学的に重篤なものではないと考えられる.血液学検査において,1000 mg/kg群でヘマトクリット値の低値,赤血球数およびヘモグロビン量の低値傾向がみられたが,他の項目に異常が認められないことから,メタクリル酸(2-ヒドロキシプロピル)エステルの投与によるものとしても重篤な影響とは考えられない.剖検において,腎盂拡張,精巣上体の尾部に黄白色結節,精巣および精巣上体の萎縮がみられたが,いずれも少数例であり,かつ,最高用量群では認められないことから,メタクリル酸(2-ヒドロキシプロピル)エステルの投与によるものではないと考えられる.病理組織学的検査において,1000 mg/kg群でもメタクリル酸(2-ヒドロキシプロピル)エステルの投与に起因すると思われる変化はみられなかった.
雌動物に対しては, 1000 mg/kg群で1例が死亡した.死亡例の剖検,異常の観察された器官・組織の病理組織学的検査においても,雄と同様に消化管の変化あるいは死後変化に基づくと考えられる所見の他には,特筆すべき変化は認められず,死因は明らかにできなかった.一般状態観察においても,雄の場合と同様に1000 mg/kg群で流涎,自発運動の低下および眼瞼下垂がみられた.摂餌量は,100および1000 mg/kg群で対照群と比べて投与6および10日に有意な低値がみられたが,軽度な差であること,100および1000 mg/kg群の数値はほぼ同じであること,300 mg/kg群では対照群との間に差はみられないことから,メタクリル酸(2-ヒドロキシプロピル)エステルの投与によるものではないと判断した.また,体重,剖検および病理組織学的検査ではメタクリル酸(2-ヒドロキシプロピル)エステルの投与に起因すると思われる変化はみられなかった.
したがって,当試験条件下におけるメタクリル酸 (2-ヒドロキシプロピル)エステルの一般毒性学的無影響量は,雌雄とも300 mg/kg/dayと考えられる.
親動物の生殖発生に対しては,発情回数,交尾率,交尾日数,受胎率および受胎雌数には,各投与群とも影響はみられなかった.また,各投与群とも妊娠期間,分娩状態,黄体数,着床痕数,着床率および出産率にも影響はみられなかった.
新生児に対しては,各投与群で総出産児数,分娩率,死産児数,哺育 0日の新生児数,出生率,児の産出率,性比には影響はみられなかった.外表観察では,いずれの群とも異常はみられなかった.また,一般状態,哺育 4 日の新生児数,生存率,体重,剖検にも影響はみられなかった.
したがって,当試験条件下におけるメタクリル酸 (2-ヒドロキシプロピル)エステルの生殖発生毒性学的な無影響量は,雌雄の生殖および児動物の発生に関していずれも1000 mg/kg/dayと推察される.
| 1) | 佐久間昭,"薬効評価−計画と解析Ⅰ, Ⅱ," 東大出版会,東京,1977,1981. |
| 2) | C. W. Dunnett, Biometrics, 20, 482 (1964). |
| 3) | H. Scheff , Biometrika, 40, 87 (1953). , Biometrika, 40, 87 (1953). |
| 4) | W. H. Kruskal, W. A. Wallis, J. Amer. Statist. Assoc., 47, 583 (1952). |
| 連絡先 | |||
| 試験責任者: | 古橋忠和 | ||
| 試験担当者: | 長瀬孝彦,藤村高志,内藤一嘉,
外山勝己,牧野浩平,木村 均 | ||
| (株)日本バイオリサーチセンター 羽島研究所 | |||
| 〒501-62 岐阜県羽島市福寿町間島6-104 | |||
| Tel 058-392-6222 | Fax 058-392-1284 | ||
| Correspondence | |||
| Authors: | Tadakazu Furuhashi(Study director) Takahiko Nagase, Takashi Fujimura, Kazuyoshi Naitou, Katsumi Toyama, Kohei Makino and Hitoshi Kimura | ||
| Nihon Bioresearch Inc. Hashima Laboratory | |||
| 6-104, Majima, Fukuju-cho, Hashima, Gifu, 501-62, Japan | |||
| Tel +81-58-392-6222 | Fax +81-58-392-1284 | ||