4,4'-ビフェニルジオールは,液晶ポリマーの原料あるいは合成樹脂の改質材として生産されている化学物質である.今回,OECDによる既存化学物質の安全性点検に係わる毒性調査事業の一環として,4,4'-ビフェニルジオールの,0(媒体対照,0.5 %カルボキシメチルセルロースナトリウム水溶液),8,40および200 mg/kgを,Sprague-Dawley系(Crj:CD(SD)IGS)ラットの雌雄(12匹/群)に,雄では42日間,雌では哺育4日(哺育0日=分娩日)まで経口投与し,雌雄動物に対する反復投与の影響,ならびに親動物の生殖・発生および哺育4日までの新生児の発育に及ぼす影響を検討した.また,対照群および200 mg/kg投与群については,雄では交配に供した各5匹を,雌では交配に供した動物とは別にサテライト群を設け,42日間の反復投与終了後,2週間にわたり,回復性ならびに遅発性変化の有無を観察した.結果は,以下のように要約される.
投与期間中および回復期間中のいずれの時期においても,雄ならびにサテライト群を含む雌動物に,死亡および瀕死屠殺はなかった.
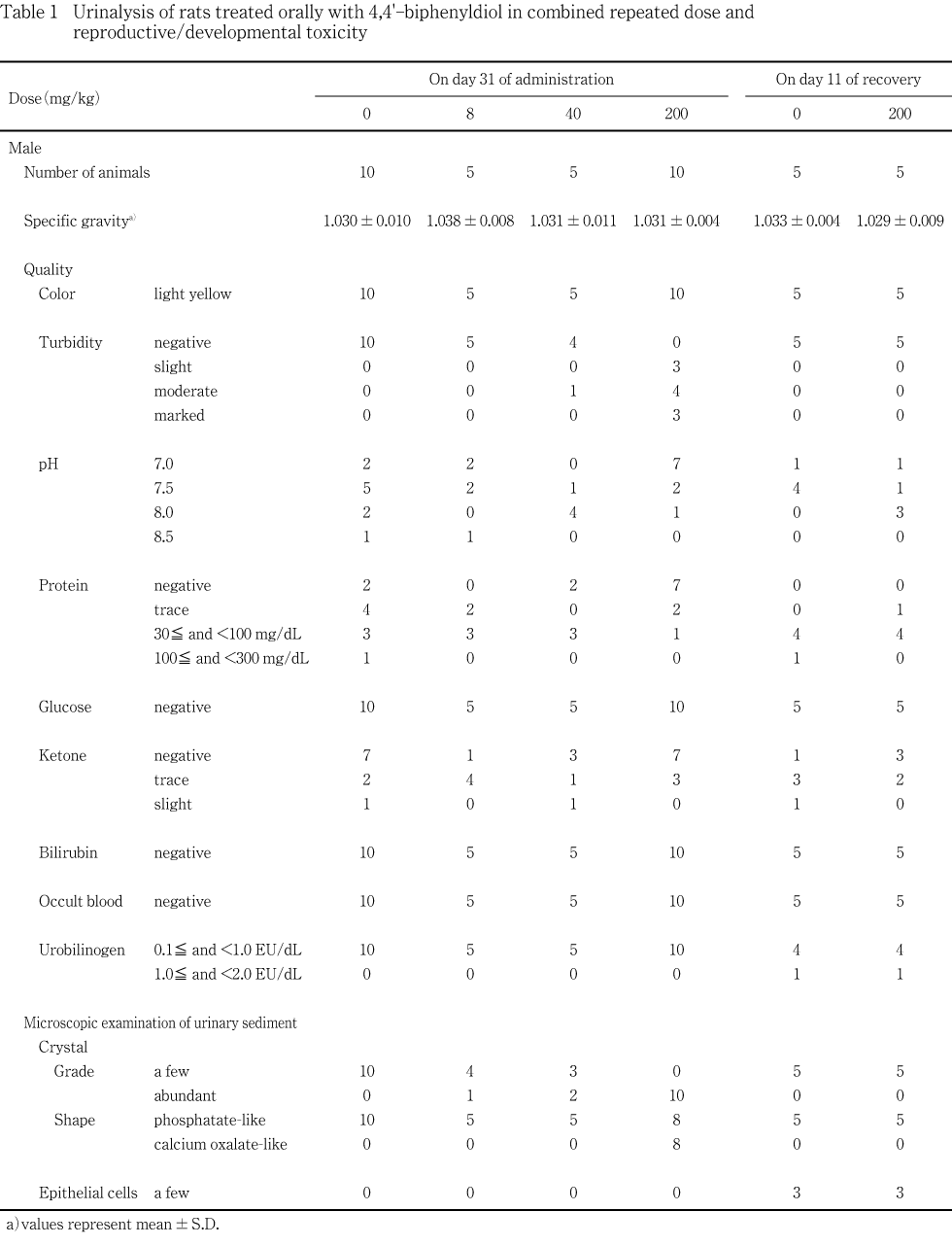
投与期間中は,一般状態の変化として,200 mg/kg投与群の雄ならびにサテライト群を含む200 mg/kg投与群の雌において,排泄された尿が時間経過に従って白濁してくるのが投与15日から認められた.この所見は,床敷の入ったケージに収容されていたために確認できなかった妊娠18日から哺育4日までの雌動物を除き,雌雄において投与終了翌日(剖検日/回復1日)まで観察された.雌雄について,それぞれ投与32日あるいは31日に実施した尿検査では,40 mg/kg以上の投与群において混濁が認められ,シュウ酸カルシウム様の沈渣結晶が,雄では200 mg/kg投与群において,また,雌では40 mg/kg以上の投与群において認められた.さらに,雌ではこれらの投与群において,尿比重の軽度な低下も認められたが,その他の検査項目には雌雄ともに異常は認められなかった.詳細な症状観察で得られたスコアには対照群と被験物質投与群との間で差は認められず,体重増加および摂餌量にも被験物質投与の影響は認められなかった.また,最終投与後に実施した神経学的検査成績にも,雌雄ともに異常を認める例はなかった.
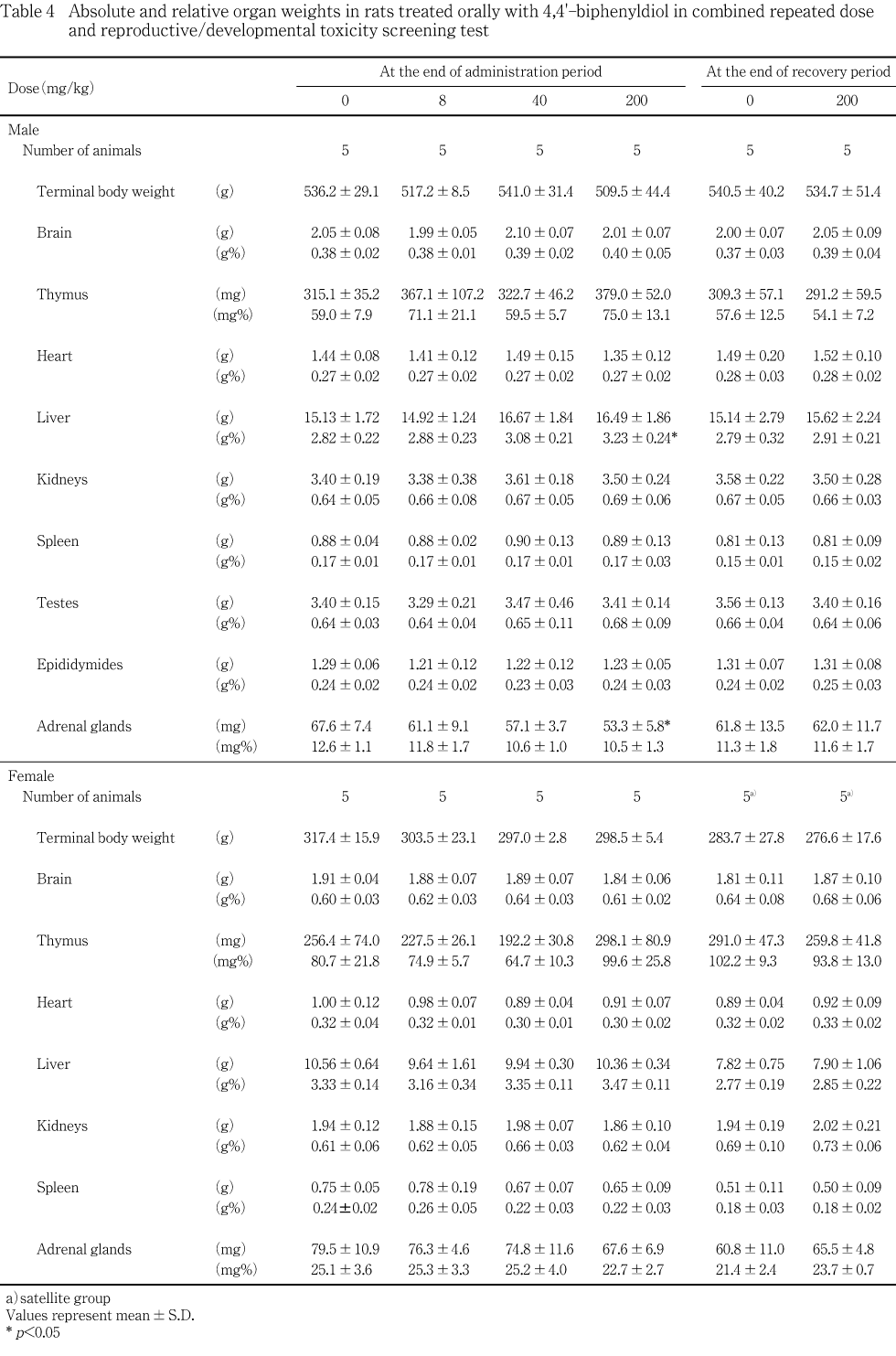
投与期間終了時剖検では,雄では,200 mg/kg投与群の肝臓に腫大あるいは暗色調が認められ,相対重量が対照群と比較して増加し,病理組織学検査において小葉中心性肝細胞肥大を認める例があり,肝臓の門脈周囲における脂肪化の程度が対照群と比較して減弱した.その他の器官/組織については,重量および形態のいずれについても対照群との間に差は認められなかった.雌では,剖検所見,器官重量ならびに病理組織学検査所見のいずれにおいても被験物質投与の影響は認められなかった.血液学検査および血液生化学検査の各成績については,被験物質投与の影響と判断される変化は雌雄ともに認められなかった.
投与中止後の回復期間中は,回復性および遅発性変化の観察に供した被験物質投与群の雌雄いずれにおいても,時間経過に伴う尿の白濁が回復1日まで観察されたものの,その翌日からは一般状態に異常は認められず,回復11日における尿検査においても,混濁やシュウ酸カルシウム様沈渣結晶の認められる例もなく,異常の認められた項目もなかった.詳細な症状観察で得られたスコア,体重増加および摂餌量にも対照群との間で有意差は認められなかった.回復14日に実施した神経学的検査においても異常を認める動物はなかった.
回復期間終了時剖検でも,血液学検査および血液生化学検査のいずれにおいても被験物質投与の影響を示唆する変化は認められず,器官重量についても,雄における肝臓重量および副腎重量を含めて,雌雄ともに対照群との間に有意差の認められる器官はなかった.肝臓の病理組織学検査においても,小葉中心性肝細胞肥大を示す雄は認められず,門脈周囲における脂肪化の程度は対照群と同様であった.また,雌雄ともに,被験物質投与の影響が新たに認められた器官/組織もなかった.
被験物質投与により性周期が変化することはなく,交尾率,受胎率,交尾までの平均発情回帰回数および平均同居日数などの交配成績にも投与の影響は認められなかった.
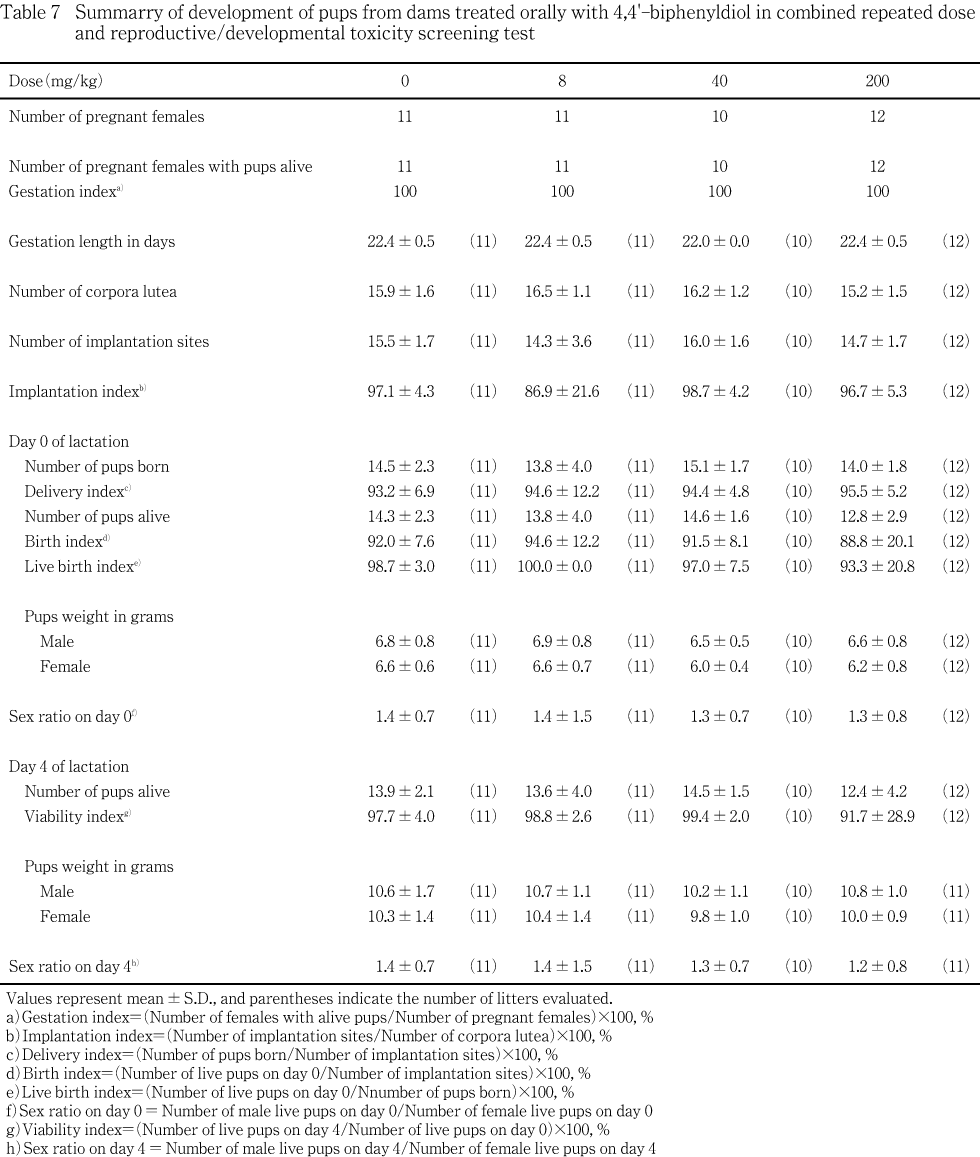
分娩および哺育状態についても,被験物質投与に起因すると判断される異常は認められず,被験物質投与群では対照群と同様の妊娠期間を経て,受胎動物の全例が生児を出産した.黄体数,着床数,着床率,産児数,分娩率,生存児数,生児出産率,出生率,新生児の4日の生存率のいずれについても対照群と被験物質投与群との間で差は認められず,着床前から出生後の哺育4日に到るまでの生存に被験物質投与の影響は認められなかった.哺育0および4日における性比にも被験物質投与の影響は認められなかった.また,出生児の体重には投与の影響は認められず,生死にかかわらず,形態異常はいずれの出生児にも認められなかった.
以上の成績から,本試験条件下では,4,4'-ビフェニルジオールの無作用量は,反復投与毒性に関しては,雌雄ともに8 mg/kg/dayであり,出生児に及ぼす影響を含めて生殖発生毒性に関しては,200 mg/kg/dayであると結論される.また,雌雄動物に認められた4,4'-ビフェニルジオール投与に起因すると考えられる変化は,投与の中止後2週間までに回復し,その間,遅発性の変化は認められないと結論される.
本試験に使用した被験物質の4,4'-ビフェニルジオールは,本州化学工業(和歌山)から提供を受けたもので(ロット番号:020411),純度99.96 wt%の白色結晶である.被験物質は,入手後,使用時まで密閉して遮光下で高温を避けて室温保管した.被験物質の試験期間中における安定性は,残余入手物質を提供元で再分析することにより確認した.
投与検体の調製に際しては,媒体として0.5 %カルボキシメチルセルロースナトリウム水溶液を選択し,濃度毎に秤量した被験物質をこれに懸濁して,いずれの用量においても1回の投与液量が5 mL/kg体重になるように濃度を調整した.媒体は,所定量のカルボキシメチルセルロースナトリウム(カルメロースナトリウム,製造番号2115,丸石製薬)を注射用水(日局注射用水,製造番号A207TT,光製薬)に溶解して調製した.
投与検体の調製頻度および保管方法は,秦野研究所において実施した8日間の安定性試験に基づき設定し,1週間に1回以上の頻度で調製し,冷蔵,遮光保管して調製後7日以内に使用した.各濃度の投与検体に含まれる被験物質の含量も秦野研究所において確認した.
試験には,日本チャールス・リバー厚木飼育センター生産のSprague-Dawley(SD)系(Crj:CD(SD)IGS,SPF)ラットを使用した.雌雄動物はいずれも7週齢で購入し,入荷日を含む8日間,検疫と馴化を兼ねて飼育し,その間毎日一般状態を観察して異常が認められなかった動物を,さらに2週間予備飼育した.予備飼育期間中,雄は一般状態を観察し,雌は一般状態を観察するとともに性周期を観察した.雌雄とも投与開始前日に体重を測定し,体重別層化無作為抽出法により群分けした.雌動物については,群分け日まで4日で発情を回帰している動物を選択して群分けに用いた.
各動物は,許容温湿度各21.0〜25.0℃,および40.0〜75.0 %,換気回数約15回/時間,照明12時間(7時〜19時点灯)に制御された飼育室で,金属製金網床ケージに個別に収容して飼育し,固型飼料(CE-2,日本クレア)および飲料水(水道水,秦野市水道局給水)を自由に摂取させた.妊娠18日(腟栓あるいは精子発見日=妊娠0日)以後の母動物は,哺育4日までラット用プラスチック製繁殖ケージに収容し,紙パルプ製チップ(ペパークリーン,日本エスエルシー)を床敷として供給して飼育した後,再び前述の金属製金網床ケージに収容した.
本試験の投与量は,4,4'-ビフェニルジオールのラットを用いる反復経口投与毒性・生殖発生毒性併合予備試験(以下「4,4'-ビフェニルジオールの予備試験」)を行い,決定した.すなわち,既に報告されている,ラットにおける4,4'-ビフェニルジオールの経口投与による50 %致死量(4920 mg/kg)1),ならびにマウスに対して経口投与により幼若赤血球比率を低下させ,小核出現頻度を増加させる用量(40 mg/kg)2)を参考にして,高用量にはOECD化学物質毒性試験ガイドラインに定められている限度値の1000 mg/kgを設定し,以下公比5で減じて,中用量には200 mg/kgを,低用量には40 mg/kgを設定し,雌雄ラットに18日間反復経口投与した.その間,継続的な観察を含む一般状態の観察を行い,体重および摂餌量を測定した.また,投与7日から,5日間を限度として同群内の雌雄を交配させ,受胎の有無を確認した.雌雄の生存例は,投与18日の翌日に全例について血液検査を行うとともに剖検し,器官重量を測定した.その結果,1000 mg/kgの4,4'-ビフェニルジオールは,反復投与により雌雄動物を死亡させるが,生存例は交尾して妊娠することが確認された.200 mg/kg以下の投与量では18日間反復投与しても死亡は認められなかったが,200 mg/kg投与により,軽度ながら,1000 mg/kg投与群において認められた体重増加抑制,肝臓および腎臓相対重量の増加傾向が認められ,また,尿の白濁も認められたことから,本試験において200 mg/kgをさらに反復投与することにより,親動物に対して明瞭な影響が表れるものと推測された.これらの結果から,本試験における高用量には200 mg/kgを設定し,以下公比5で減じて中用量には40 mg/kgを,低用量には8 mg/kgを設定し,媒体投与群を対照群とした.対照群および200 mg/kg投与群については,被験物質投与による,遅発性変化あるいは回復性の有無を検討するために,雄では,各5例を選定し,また,雌では,各5匹で構成されるサテライト群を別に設定した.
各用量の投与検体は,雄に対しては交配前2週間から最長2週間の交配期間を経て剖検前日に至るまでの連続42日間,また,雌に対しては交配前2週間,交尾までの交配期間,妊娠期間および哺育4日まで,交尾したが分娩しない雌は妊娠25日相当日まで,交尾しなかった雌は剖検前日まで52日間,それぞれ毎日1回,一定時刻の間(9時〜13時)に,ラット用胃管を用いて経口投与した.サテライト群については,42日間,同様に投与した.投与に際しては,投与前に調製検体をマグネチックスターラーで攪拌し,均一であることを目視により確認してから投与を開始し,投与中も調製検体をマグネチックスターラーで攪拌した.また,各動物の投与液量は,雌雄とも最近時の体重をもとに,個体別に算出した.
雌雄とも,全例について,飼育期間中毎日1回以上観察した.投与期間中の動物については,投与前および投与終了後に観察した.観察された症状のうち,速やかな回復が期待されない所見は断続的観察を行わなかった.また,排泄物の時間経過に伴う変化であることが,初回発見時における断続的観察で明らかになった所見についても,その後の断続的観察は行わなかった.
雄は全例について,群分け日,投与7,14,21,28,35および42日の13時〜16時にスコアリング法による詳細な症状観察を行った.回復期間中は,回復7および14日の13時〜16時に,スコアリング法による詳細な症状観察を行った.雌は,全例について,群分け日,投与7,14,21,28,35および42日の13時〜16時にスコアリング法による詳細な症状観察を行った.投与49日までに分娩しない例(未交尾例を含む)は,投与49日にも観察を行った.観察日が分娩中であった例は哺育0日に観察し,その他の分娩例は哺育0日から4日の間に1回観察した.サテライト群は,回復7および14日に観察した.観察では,ケージ越しでの観察を約20秒間行い,ケージから取り出す際に外表を観察し,作業台上での観察を約40秒間行った.次に,作業台上で,姿勢・体位,探索行動,身づくろい,発声,挙尾反応,歩行,常同行動,奇妙な行動,振戦,痙攣,立毛,眼裂および呼吸数を観察した.
神経学的検査として,プライエル反応,瞳孔反射,視覚定位,驚愕反応,痛覚,後肢引込み反射,眼瞼(瞬目)反射,正向反射の有無を観察する機能検査を実施した.これらの検査は,投与終了時の雄は,投与42日の詳細な症状観察に引き続き,各群の動物番号の若い5例および回復観察に供する対照群および高用量群の各5例について実施した.また,回復期間終了時には,回復14日の詳細な症状観察後に,全例について実施した.雌では,投与終了時には,分娩例は,哺育4日に投与期間が近接した各群の動物番号が若い5匹を選び,サテライト群では,投与42日の詳細な症状観察に引き続き,全例について実施した.また,回復期間終了時には,回復14日の詳細な症状観察後にも検査を行った.
雄は生存例の全例について,投与1(投与開始日),7,14,21,28,35,42日,ならびに回復1,7,14日および解剖日(最終投与翌日および回復15日)に測定した.
雌は生存例の全例について,投与1,7,14,21日に測定し,交尾確認後は,妊娠0,7,14,20日に,分娩後は哺育0および4日ならびに解剖日に測定した.分娩の認められなかった例は剖検日に測定した.交尾しなかった雌は,投与21,28,35,42および49日ならびに解剖日に測定した.これらのうち,投与21〜49日の体重,ならびに交尾あるいは分娩しなかった例の剖検時体重は,測定対象が限られていることから評価の対象から除外した.サテライト群の動物は,全例について,投与1,7,14,21,28,35および42日,回復1,7および14日ならびに解剖日(回復15日)に測定した.
雄は生存例の全例について,投与1〜2,7〜8,14〜15,29〜30,35〜36,41〜42日,ならびに回復6〜7,13〜14日に測定した.
雌は全例について,交配前期間は投与1〜2,7〜8および14〜15日に,交尾確認後は妊娠0〜1,7〜8,14〜15および20〜21日に,分娩後は哺育3〜4日に測定した.交尾しなかった雌は投与29〜30,35〜36,41〜42および48〜49日に測定した.サテライト群は,投与1〜2,7〜8,14〜15,29〜30,35〜36および,41〜42日ならびに回復6〜7および13〜14日に測定した.
雄では投与31日および回復11日に各群の動物番号が若い5例および回復観察に供する全例を,交尾した雌は投与32日に各群で妊娠日が近接した7例を,サテライト群では投与32日および回復11日に全例を,代謝ケージに収容し,約4時間蓄尿して採取した尿を検査した.検査では,視診によって色調・混濁度を,また,光学顕微鏡による鏡検によって沈渣を観察した.さらに,クリニテック200+(バイエル・三共)を用いた試験紙法によって,pH・潜血・蛋白・糖・ケトン体・ビリルビン・ウロビリノーゲンを測定し,比重は屈折計(ユリコン・アタゴ社)を用いた屈折法によって測定した.沈渣結晶については,「臨床検査法提要」3),「尿沈渣カラーアトラス」4)および「尿沈渣」5)に掲載の図譜と形状を比較して分類した.
群分け日までは全例について,その後はサテライト群を除く全例について,交尾確認日まで腟スメア標本を作製して観察し,細胞構成から,発情期,発情前期および発情休止期に分類した.これらの分類に基づき,性周期の型を,4日間隔で発情を回帰するものを4日周期,4〜5日間隔で発情を回帰するものを4および5日周期に分類し,投与開始後に性周期の型が変化した動物の頻度を群毎に算出するとともに,投与期間中における平均発情回帰日数(個体毎の発情期から次回発情期までの日数の平均)を群毎に算出した.
交配は,サテライト群を除く雌と雄との間で,2週間投与後(投与15日)の12週齢から,交尾を確認するまで,2週間を限度として同群内の雌雄1:1で連日同居させることによって行った.交尾の確認は,腟スメア中の精子の存在あるいは腟栓を確認することにより行い,いずれかが確認された日を妊娠0日と起算して雄から分離し,個別に飼育した.交配期間終了まで交尾が認められなかった動物も,雌雄を分離し,個別に飼育した.
交配結果から,各群について交尾率((交尾動物数/交配動物数)×100,%)を求め,子宮に着床痕の確認された雌動物を受胎動物として受胎率((受胎動物数/交尾動物数)×100,%)を算出した.また,同居開始日から交尾確認日までの日数およびその間に回帰した発情期の回数も求めた.
各群とも,交尾した雌は,全例を自然分娩させて哺育させた.
分娩の確認は,妊娠21日から分娩が確認されるまで,妊娠25日を限度として毎日行い,11時までに分娩が完了した例についてその日を哺育0日とした.分娩状態を直接観察できた例については,異常の有無を断続的に観察し,直接観察ができなかった例については,分娩前後の一般状態および産児の状態から異常の有無を判断した.
妊娠25日相当日までに分娩が確認されない動物は,翌日剖検し,子宮に着床痕の認められなかった例を不妊と判定した.
分娩を確認した例については,全例の妊娠期間(妊娠0日〜分娩日までの日数)を算定し,出産率((生児出産雌数/受胎動物数)×100,%)を各群について求めた.また,哺育1日から毎日,哺育状態を観察し,哺育5日の剖検において数えられた着床数および妊娠黄体数から着床率((着床数/妊娠黄体数)×100,%)を算出した.
出生児は,哺育0日に,雌雄別に産児数(生存児+死亡児)を調べ,分娩率((産児数/着床痕数)×100,%),生児出産率((出産生児数/着床痕数)×100,%)および出生率((出産生児数/産児数)×100,%)を算出した.生存児については外表奇形の有無を観察した.翌日(哺育1日)から哺育4日までは,毎日一般状態を観察し,生児数と死亡児数を雌雄別に数え,新生児の4日の生存率((哺育4日の生児数/哺育0日の生児数)×100,%)を算出した.生存児については,哺育0および4日に個別の体重を測定し,腹ごとに雌雄別の平均値を算出するとともに,哺育0および4日における性比(哺育0あるいは4日の雄生児数/哺育0あるいは4日の雌生児数)を算出した.
雄は,回復性および遅発性変化の観察に供する対照群および200 mg/kg投与群の各5例を除き,投与42日に絶食を開始し,その18〜24時間後にペントバルビタールナトリウムで麻酔した.これらのうち,各群の5例については腹部後大静脈から採血を行った後に,また,それ以外の動物は麻酔後直ちに放血致死させて剖検し,病理学検査を行った.
雌では,分娩例は哺育4日に,交尾したが分娩しなかった雌は妊娠25日相当日に,また,交尾しなかった雌は投与52日に絶食を開始し,その18〜24時間後にペントバルビタールナトリウムで麻酔した.分娩例については,投与期間が近接した動物の中で,尿検査を実施したものを優先して各群の5例を選んで採血し,その後,放血致死させて剖検し,病理学検査を行った.その他の分娩例,交尾したが分娩しなかった雌,ならびに交尾しなかった雌は,麻酔後に放血致死させた後,剖検し,病理学検査を行った.
採血では,雌雄ともに,まず,クエン酸ナトリウムを抗凝固剤として用い,プロトロンビン時間および活性部分トロンボプラスチン時間測定のための血液を採取した.次いで,EDTA-2 Kを抗凝固剤として用い,その他の血液学検査に供する血液を採取した.さらに,ヘパリンを抗凝固剤として用い,血液生化学検査に供する血液を採取した.
採血の対象とした動物については,脳,心臓,胸腺,肝臓,腎臓,脾臓および副腎の各重量を測定し,雄についてはさらに,精巣および精巣上体の重量も測定した.また,剖検日の体重に対する相対重量を算出した.
分娩例の雌は,全例の子宮について着床痕数を数え,着床痕が認められた例は,実体顕微鏡下で妊娠黄体数を数えた.
回復性および遅発性変化の観察に供した雄,ならびにサテライト群の雌は,回復14日に絶食を開始し,その18〜24時間後にペントバルビタールナトリウムで麻酔して,投与終了時剖検と同様にして全例から血液を採取した.その後,放血致死させて剖検し,病理学検査を行った.また,投与終了時剖検と同様の器官について重量を測定し,相対重量を算出した.
死亡児は発見後速やかに剖検し,0.1Mリン酸緩衝10 %ホルマリン溶液に固定して保存した.生存児は,全例を哺育4日にエーテル吸入により致死させ,剖検した.
プロトロンビン時間および活性部分トロンボプラスチン時間は全自動血液凝固測定装置(CA-1000,東亜医用電子)を用いて光散乱法によって測定した.また,血液自動分析装置(CELL-DYN3500SL,ダイナボット)を用いて,電気抵抗法により赤血球数(RBC),平均赤血球容積(MCV)ならびに血小板数を測定し,血色素量は吸光度法により測定し,白血球数および白血球分類はフローサイトメトリー・レーザー光散乱法あるいは電気抵抗法で測定した.さらに,RBC,MCVあるいは血色素量からヘマトクリット値,平均赤血球血色素濃度(MCHC)あるいは平均赤血球血色素量(MCH)を算出した.
生化学自動分析装置(COBAS MIRA plus,ロッシュ・ダイアグノスティックス)を用い,総蛋白濃度はビウレット法で,アルブミン濃度はBCG法で,尿素窒素濃度(BUN)はウレアーゼ・GlDH法で,クレアチニン濃度はJaff事@で,ブドウ糖濃度はヘキソキナーゼ・G-6-PDH法で,総コレステロール濃度はコレステロールオキシダーゼ・HDAOS法で,トリグリセライド濃度はGPO・HDAOS(グリセリン消去)法で,アルカリフォスファターゼ活性(ALP)はGSCC法で,ALT(GPT),AST(GOT)およびg-GTP活性はIFCC法で,総ビリルビン濃度はアゾビリルビン変法で,無機リン濃度はモリブデン酸直接法で,カルシウム濃度はOCPC法で,それぞれの血漿中濃度を測定し,A/G比は算出した.また,全自動電解質分析装置(EA05,エイアンドティー)を用い,イオン電極法によって,ナトリウム,カリウムおよび塩素の血漿中各濃度を測定した.
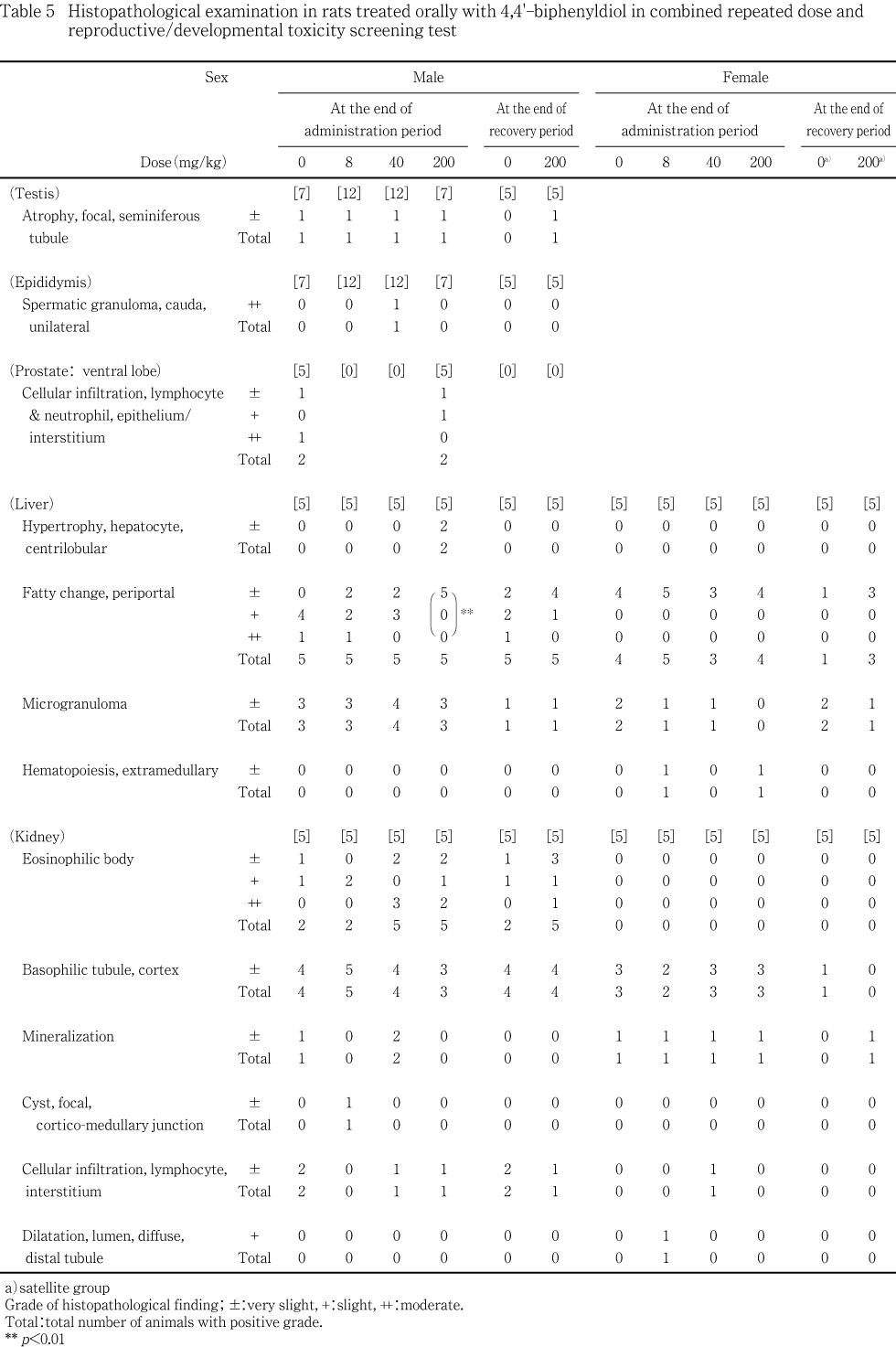
全例について剖検し,器官・組織の肉眼観察を行った.また,雌雄とも全例について,脳,下垂体,脊髄,心臓,気管,肺(気管支を含む),肝臓,腎臓,胸腺,脾臓,副腎,甲状腺および上皮小体,胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,膀胱,下顎リンパ節,腸間膜リンパ節,坐骨神経,大腿骨および骨髄ならびに病変部を採取した.これらに加え,雄では精巣,精巣上体,前立腺腹葉,凝固腺を含む精嚢を採取し,雌では卵巣,子宮,腟を採取した.また,これらの器官・組織の採取において,肺(気管支を含む)は,雌雄ともに,0.1Mリン酸緩衝10 %ホルマリン溶液で注入固定してから採取した.精巣ならびに精巣上体はブアン液(長期保存は0.1Mリン酸緩衝10 %ホルマリン溶液を使用)に固定し,その他は0.1Mリン酸緩衝10 %ホルマリン溶液に固定して保存した.
固定・保存器官のうち,卵巣,精巣および精巣上体は全例について常法に従ってパラフィン切片とし,ヘマトキシリン・エオジン染色を行って病理組織標本を作製し,病理組織学検査を実施した.
その他の器官のうち,肝臓および腎臓は,各群の血液学検査および血液生化学検査を実施した各5例について標本を作製し,検査した.これら以外の組織・器官は,雄の投与終了時剖検および雌の分娩例では,対照群および高用量群において血液学検査および血液生化学検査を実施した各5例について標本を作製し,検査したが,骨髄に付随して採取された大腿骨は検査の対象から除外した.回復期間終了時に剖検した動物については,固定・保存した器官・組織のうち,卵巣あるいは精巣および精巣上体の他に,投与期間終了時剖検において,雄の肝臓重量が被験物質投与群において増加の傾向を示し,副腎重量は低下の傾向を示し,また,腎臓は被験物質投与によって重量が変化する可能性が疑われたので,雌雄の肝臓,腎臓および副腎について標本を作製し,検査した.病変部は投与終了時の剖検で雌雄動物から採取した.これらのうち,40 mg/kg投与群の雄において採取された病変部は,同群のみに認められた孤発例で,被験物質投与との関連性が認められなかったので検査しなかった.その他については,雄では,検査が予定されていた動物の検査予定器官にみられた病変であったこと,雌では200 mg/kg投与群の動物であったことから標本を作製して検査した.
神経学的検査結果,性周期の変化した動物の頻度,交尾率,受胎率ならびに出生児の形態異常の出現頻度についてはFisherの直接確率検定を行った(有意水準:5 %).被験物質投与群の病理組織学検査所見のうち,グレード分けしたデータはMann-WhitneyのU検定(有意水準:5 %)により,陽性グレードの合計値はFisherの直接確率の片側検定(有意水準:5 %)により,対照群との間で有意差検定を行った.その他のデータは,個体ごとに得られた値あるいはlitterごとの平均値を1標本とし,サテライト群内あるいはその他の群内で比較した.その際,解析の対象が2群の場合には,まずF検定を行い,有意差が認められなければStudent's-t検定を行った.F検定において有意差が認められた場合は,Aspin-Welch検定を行った.解析の対象が3群以上の場合は,先ず,Bartlettの方法により各群の分散の一様性について検定(有意水準:5 %)を行った.分散が一様であった場合には,一元配置型の分散分析(有意水準:5 %)を行い,群間に有意性が認められた場合には,Dunnett法により多重比較を行った(有意水準:5 %).一方,いずれかの群で分散が0となる場合および分散が一様でなかった場合には,Kruskal-Wallisの順位検定(有意水準:5 %)を行い,群間に有意性が認められた場合には,Dunnett型の検定法により多重比較を行った(有意水準:5 %).
投与期間中および回復期間中のいずれの時期においても,雄ならびにサテライト群を含む雌動物に,死亡および瀕死屠殺はなかった.
投与期間中における一般状態については,8 mg/kg投与群の雄および40 mg/kg以下の投与群の雌に異常は認められなかった.200 mg/kg投与群の雄ならびにサテライト群を含む200 mg/kg投与群の雌では,排泄された尿が時間経過に従って白濁してくるのが投与15日の投与後約5時間に認められた.その翌日の投与16日に,雄およびサテライト群の雌について投与後から経時的に観察した結果,白濁は排泄後の時間が経過するのに伴って認められることが明らかになったので,その後は,投与前に白濁の有無を観察することとした.その結果,時間経過による白濁は,雄およびサテライト群の雌では,投与終了の翌日(剖検日/回復1日)まで観察された.また,交配に供した雌では,床敷の入ったケージに収容されていたために確認できなかった妊娠18日から哺育4日までの期間を除き,哺育5日の剖検日まで観察された.投与期間中におけるその他の一般状態の変化は,サテライト群を含む雌動物には認められなかった.雄については,被験物質の用量に依存しない偶発的変化として,対照群の1例の左上腕部に,投与15日から痂皮形成が認められた.投与21日に痂皮は認められなくなったが,その部分が投与39日まで脱毛していた.また,40 mg/kg投与群では,1例の右前肢に投与7日から脱毛が認められ,投与23日には左前肢にも認められるようになった.さらに,投与36日には,右胸部および右鼠頚部にも脱毛が認められ,投与終了時の剖検まで回復しなかった.
回復期間中に認められた一般状態の変化としては,回復1日に,前述のように,投与期間中から継続して観察された尿の白濁が200 mg/kg投与群の動物に観察されたが,回復2日には認められなくなった.また,回復期間中に新たな所見を認める動物はなかった.
サテライト群を含めて雌雄ともに,いずれの時期においても対照群と被験物質投与群との間で各観察項目のスコアに有意差は認められなかった.
サテライト群を含めて,雌雄ともに,いずれの投与群においても検査結果に異常は認められなかった.回復14日における検査においても異常は認められなかった.
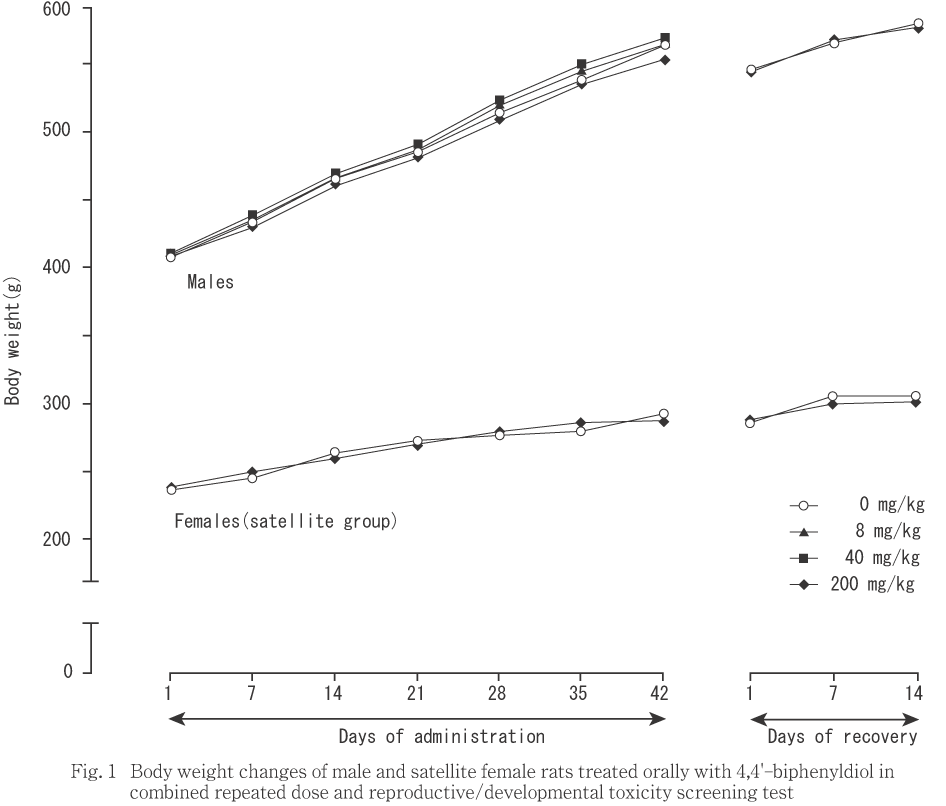
雄では,いずれの時期においても体重(Fig. 1),増加量および累積増加量に対照群と被験物質投与群との間で有意差は認められなかった.
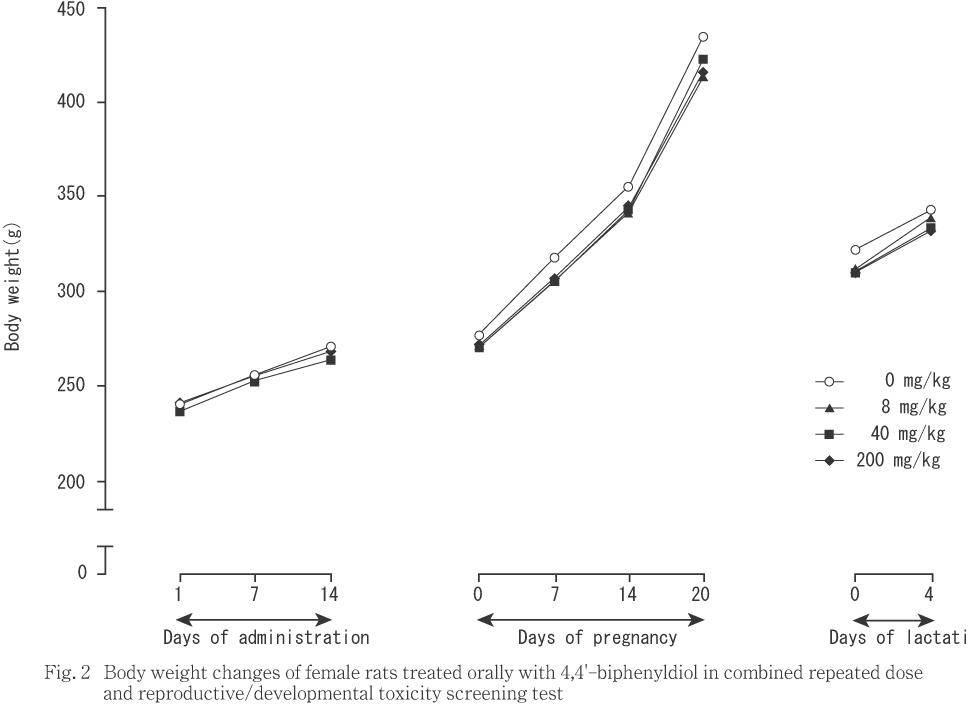
交配に供した雌では,体重(Fig. 2)および累積増加量には,対照群と被験物質各投与群との間で有意差を認めなかった.増加量は,8 mg/kgおよび200 mg/kg投与群において,妊娠0〜7日の値が対照群と比較して有意(p<0.05)な低値を示したが,その他の時期には対照群との間に差は認められなかった.
サテライト群では,200 mg/kg投与群の投与35〜42日および回復1〜7日の増加量が対照群と比較して有意(p<0.05)な低値を示したが,体重(Fig. 1)および累積増加量には対照群との間で有意差を認めなかった.

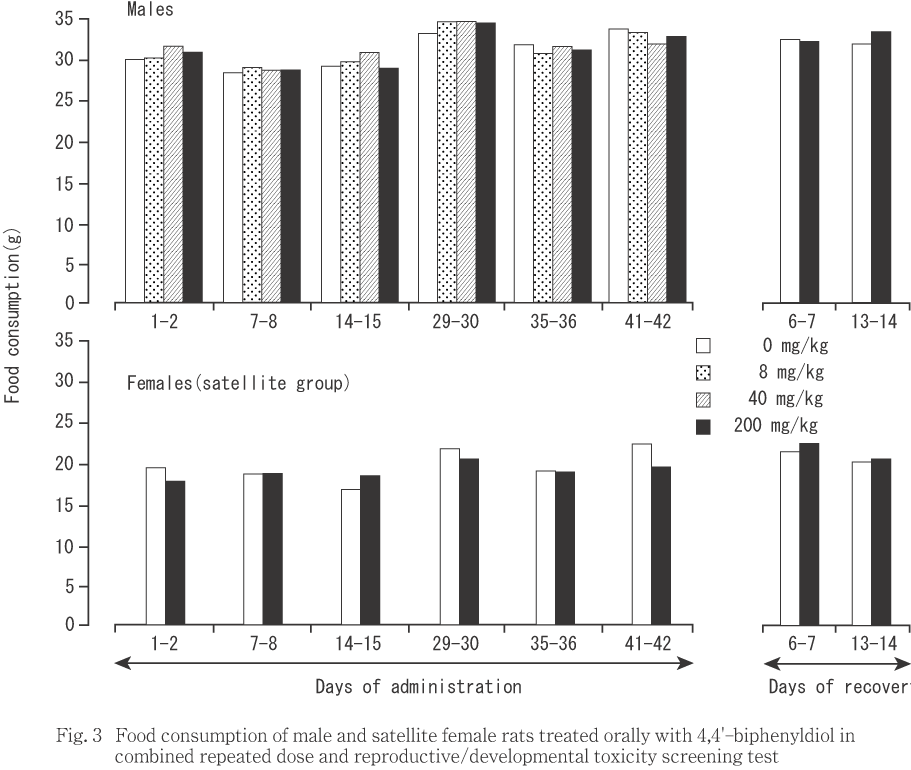
雄では(Fig. 3),いずれの時期も対照群と被験物質投与群との間で有意差は認められなかった.
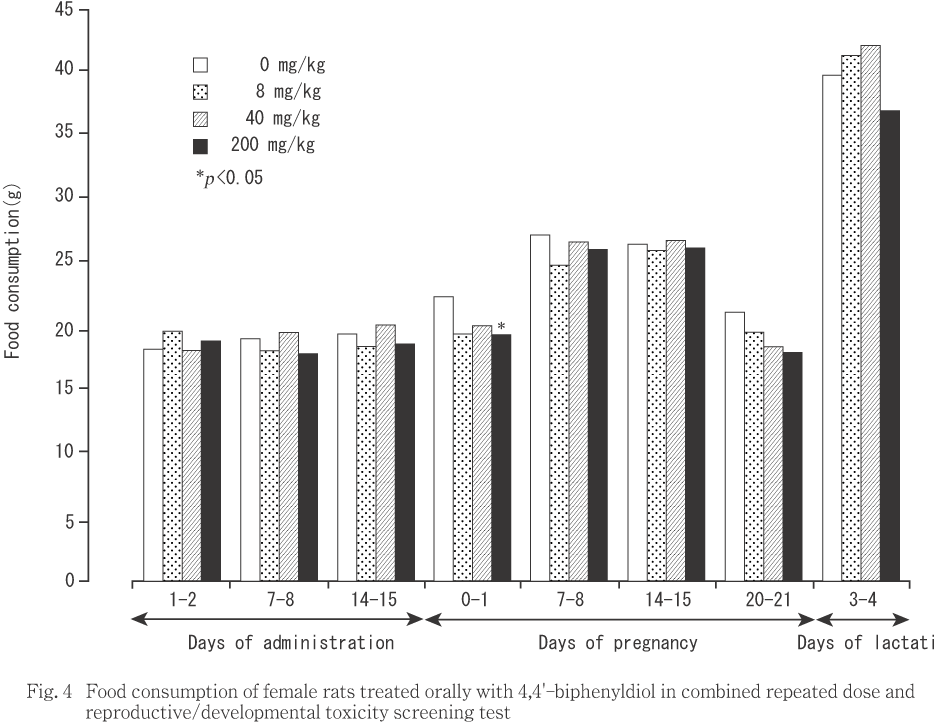
交配に供した雌では(Fig. 4),200 mg/kg投与群の妊娠0〜1日における値が対照群と比較して有意(p<0.05)な低値を示した他に,対照群との間に有意差は認められなかった.サテライト群では(Fig. 3),いずれの時期も対照群との間に有意差を認めなかった.
雄について実施した投与31日における検査では,沈渣結晶が全例に観察されたが,被験物質投与群ではそれが増加しているものが認められ,200 mg/kg投与群では10例全例に増加が認められた.観察された結晶の形状は,リン酸様を呈するものとシュウ酸カルシウム様を呈するものがあったが,リン酸様結晶は,200 mg/kg投与群の2例を除き,全例の動物に観察された.一方,シュウ酸カルシウム様の結晶は,200 mg/kg投与群の8例に観察され,40 mg/kg以下の投与群には認められなかった.また,対照群および8 mg/kg投与群には認められていない尿の混濁が40 mg/kg投与群では,5例中1例に認められ,200 mg/kg投与群では,10例全例に認められ,その程度も被験物質の用量に依存して亢進していた.その他の項目は対照群と同様であった.
交配に供した雌について実施した投与32日における検査では,ほぼ全例に沈渣結晶が観察されたが,被験物質投与群ではそれが増加しているものが認められ,200 mg/kg投与群では7例全例に増加が認められた.観察された結晶の形状は雄と同様であったが,シュウ酸カルシウム様の結晶は,40 mg/kg投与群の7例中1例および200 mg/kg投与群の6例に観察され,8 mg/kg以下の投与群には認められなかった.また,対照群および8 mg/kg投与群には認められていない尿の混濁が,40 mg/kg投与群では7例中2例に,200 mg/kg投与群では7例中6例に認められ,雄と同様に,その程度は被験物質の用量に依存して亢進していた.さらに雌では,40 mg/kg以上の投与群において,比重が対照群と比較して有意(p<0.05,p<0.01)な低値を示した.その他の検査項目は対照群と同様であった.
サテライト群における投与32日の検査でも,200 mg/kg投与群において,尿沈渣結晶の増加が5例中4例に認められ,これらには軽度ないし中程度の混濁も認められた.観察された沈渣結晶は,対照群ではリン酸様の結晶のみであったが,200 mg/kg投与群ではシュウ酸カルシウム様の結晶が混濁の認められた4例に観察された.比重については対照群との間で有意差は認めなかったが,低値の傾向が認められた.その他の検査項目は対照群と同様であった.
回復11日の検査では,雌雄ともに,200 mg/kg投与群の動物の尿に混濁および沈渣結晶の増加は認められず,観察された沈渣結晶はリン酸様の形状を呈するもののみであった.また,その他の検査項目も対照群と同様であった.
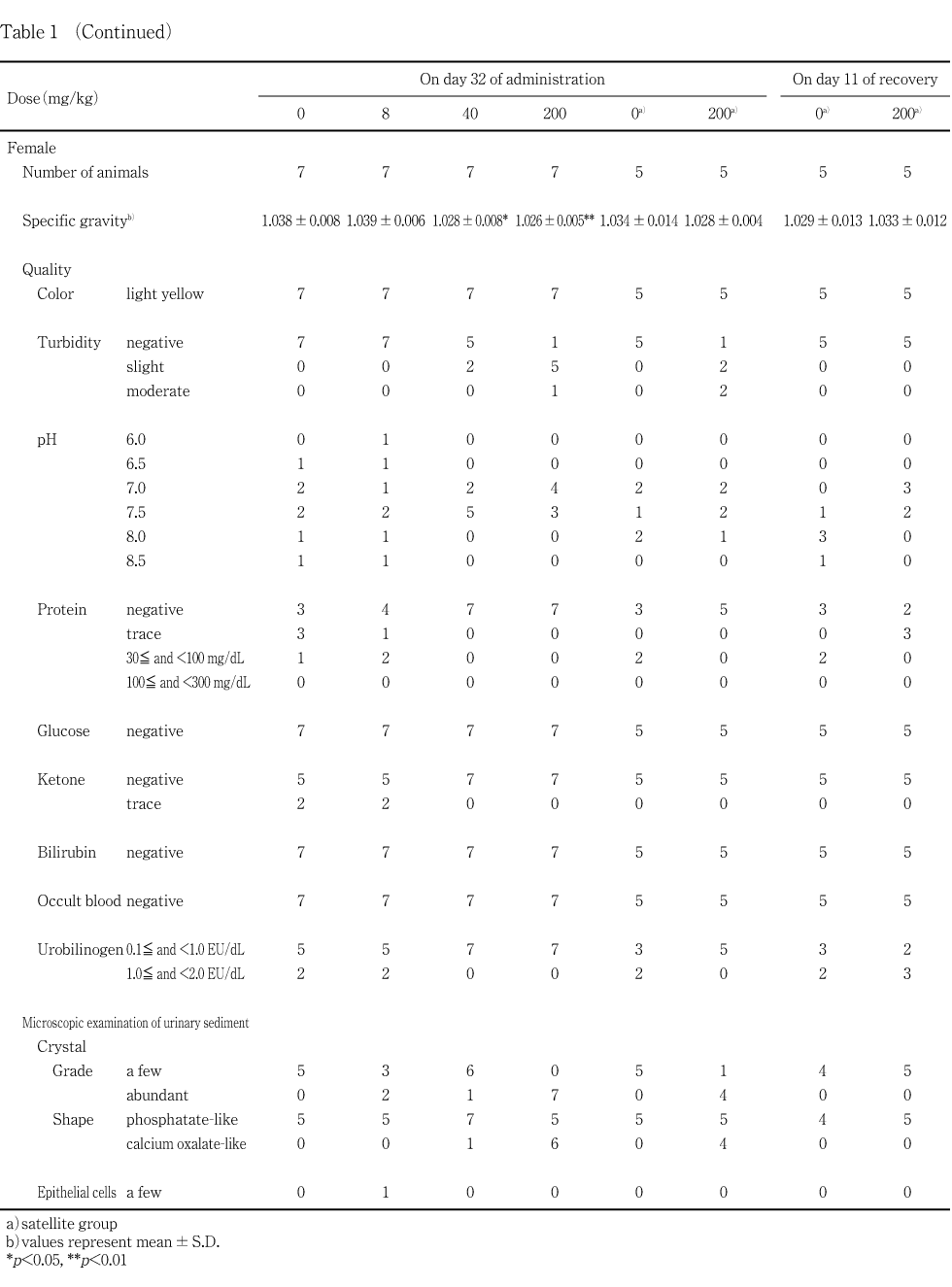
投与43日の雄ならびに哺育5日の雌について実施した投与期間終了時剖検では,8および200 mg/kg投与群の雄には,対照群との間に有意差の認められる検査項目はなかった.40 mg/kg投与群の雄では,平均赤血球容積および平均赤血球血色素量がそれぞれ対照群と比較して有意(p<0.05)に低い値を示した.雌については,対照群と被験物質投与群との間で有意差の認められる項目はなかった.
回復15日に実施した雄およびサテライト群の雌の回復期間終了時剖検では,200 mg/kg投与群の雄における白血球数が有意(p<0.05)に低い値を示した他に,雌雄ともに対照群と200 mg/kg投与群との間で有意差の認められる項目はなかった.
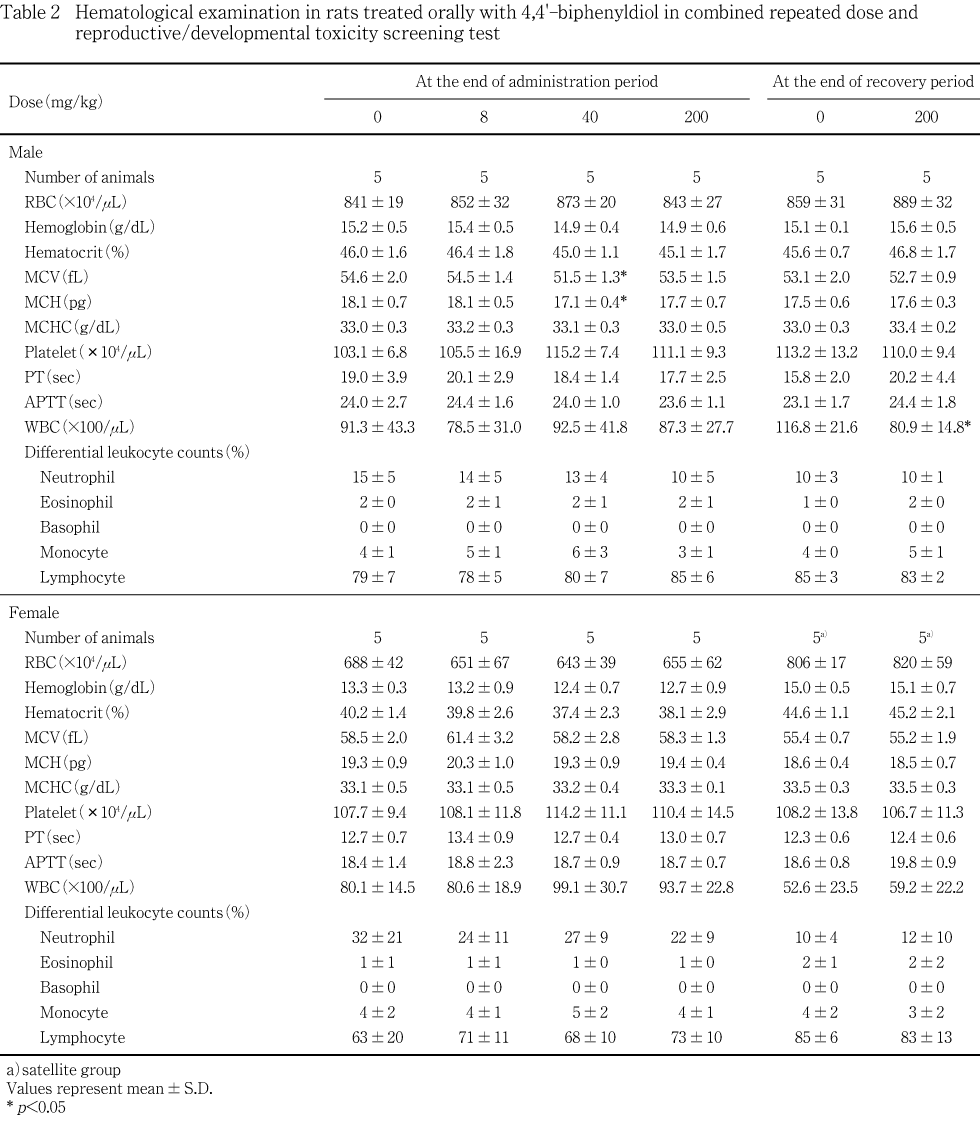
投与期間終了時剖検では,雄では,40 mg/kg以下の投与群に対照群との間に有意差の認められる検査項目はなかった.200 mg/kg投与群では,ナトリウム濃度が有意(p<0.05)な低値を示した他に対照群との間に有意差を認めなかった.雌では,対照群と被験物質投与群との間で有意差の認められる項目はなかった.
回復期間終了時剖検では,雄では,対照群と200 mg/kg投与群との間で有意差の認められる項目はなかった.雌では,AST(GOT)活性が対照群と比較して有意(p<0.05)な低値を示した他に,対照群と200 mg/kg投与群との間で有意差の認められる項目はなかった.
投与期間終了時剖検では,40 mg/kg以下の投与群の雄では,対照群と比較して重量あるいは相対重量に有意差の認められる器官はなかった.200 mg/kg投与群では,対照群と比較して肝臓の相対重量が有意(p<0.05)な高値を示し,副腎重量が有意(p<0.05)な低値を示した.その他の器官については重量および相対重量ともに対照群との間に有意差は認められなかった.雌では,いずれの投与群においても,対照群と比較して重量あるいは相対重量に有意差が認められる器官はなかった.
回復期間終了時剖検では,重量あるいは相対重量に,対照群と200 mg/kg投与群との間で有意差の認められる器官は雌雄ともになかった.
投与終了時剖検では,雄では,対照群および8 mg/kg投与群に異常は認められなかった.40 mg/kg投与群では,1例に局所的な脱毛が観察された.200 mg/kg投与群では,2例に肝臓の暗色調および腫大が認められた.雌では,対照群および40 mg/kg以下の投与群の動物に異常は認められなかった.200 mg/kg投与群では,分娩した1例の両側腎臓に腎盂の拡張が観察された.また,全出生児が死亡した1例には脾臓および胸腺の小型化が観察された.
回復期間終了時剖検では異常を認める例は雌雄ともになかった.
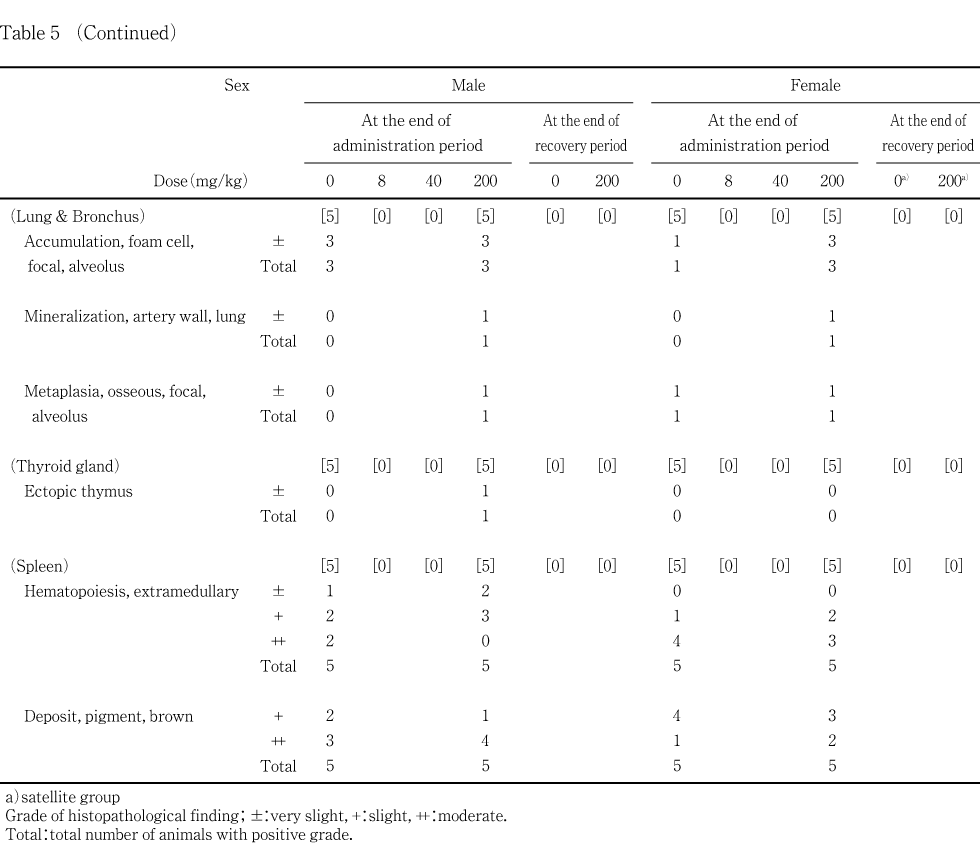
投与終了時剖検において,雄では,精巣,精巣上体,前立腺腹葉,肝臓,腎臓,肺および気管支,甲状腺ならびに脾臓に所見が認められたが,重量変化の認められた副腎に所見は認められなかった.一方,重量変化が認められた肝臓では,200 mg/kg投与群において,小葉中心性肝細胞肥大が2例に認められ,門脈周囲性の脂肪化が対照群と比較して有意(p<0.01)に減弱していた.肝臓にはその他に,小肉芽腫が対照群を含む各群の動物に観察されたが,対照群と被験物質各投与群との間に有意差は認められなかった.その他の器官に認められた所見については,頻度および程度に対照群と被験物質投与群の間で有意差は認められなかった.雌では,肝臓,腎臓,肺および気管支ならび脾臓に所見が認められたが,対照群と被験物質各投与群との間で有意差の認められた所見はなかった.雌の剖検において病変部として採取された器官のうち,両側に腎盂拡張の認められた200 mg/kg投与群の1例の腎臓には,組織標本においても腎盂拡張が認められた.この例の皮質には好塩基性尿細管が認められ,乳頭部には集合管上皮の変性,好中球浸潤および好塩基性尿細管が観察された.また,小型化の認められた200 mg/kg投与群の1例の胸腺には萎縮が認められ,同じ例において小型化の認められた脾臓については,髄外造血および褐色色素の沈着の他に,赤脾髄領域の軽度な縮小が観察された.
回復期間終了時剖検では,雄では,精巣,肝臓および腎臓に所見が認められ,雌では肝臓および腎臓に所見が認められた.しかし,雌雄ともに,対照群と200 mg/kg投与群との間で有意差の認められる所見はなく,雄の肝臓における門脈周囲性の脂肪化の程度も対照群と200 mg/kg投与群との間で差は認められなかった.
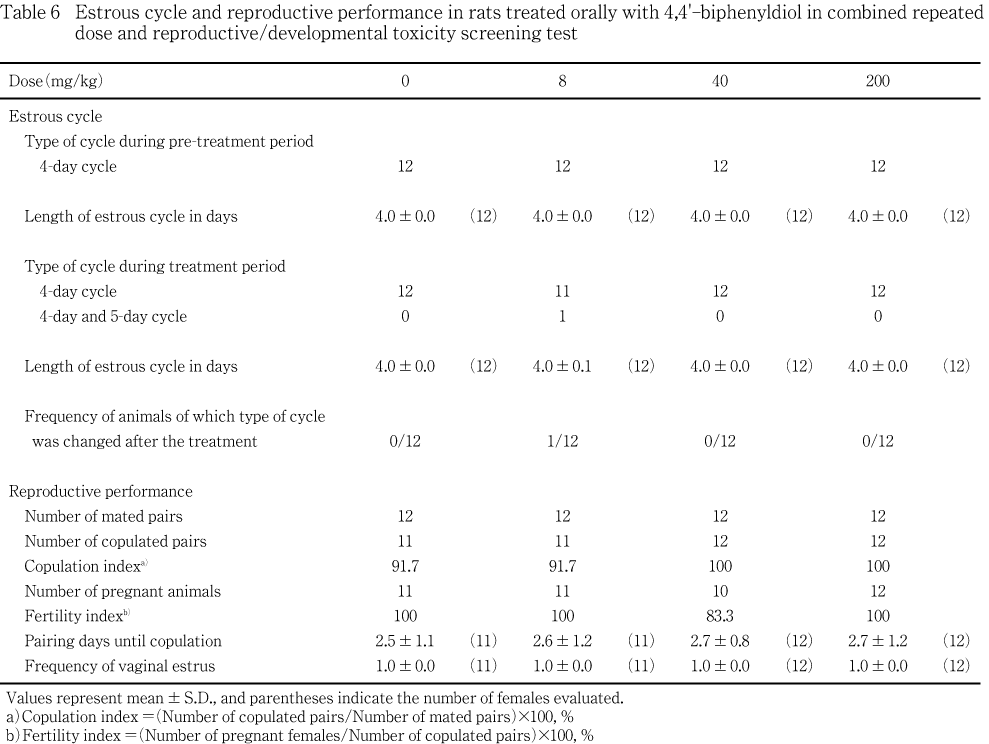
投与開始後に性周期の型が変化した動物は,8 mg/kg投与群に1例認められたのみで,平均発情回帰日数には対照群と被験物質投与群との間で有意差は認められなかった.
対照群および8 mg/kg投与群の各1組が交尾しなかったが,交尾率に対照群と被験物質投与群との間で有意差は認められなかった.また,交配期間中に回帰した発情の回数および交尾までの同居日数にも対照群と被験物質各投与群との間で有意差は認められなかった.
不妊動物は40 mg/kg投与群に2例認められたのみで,その他の投与群では交尾した全例が受胎し,受胎率に対照群と被験物質投与群との間で有意差は認められなかった.
受胎動物の全例が生児を出産した.分娩の直接観察が可能であったのは,対照群の11例中3例,8 mg/kg投与群の11例中2例,40 mg/kg投与群の10例中1例および200 mg/kg投与群の12例中4例であった.これら分娩を直接観察した例には分娩状態の異常は認められなかった.一方,直接観察できなかった例のうち200 mg/kg投与群の1例は,母動物の全身状態に異常は観察されなかったが,5匹の生存児を含む18匹の産児がケージ内に散乱し,分娩状態が不良であったと判断された.本例の出生児は,翌日までに全例が死亡していた.その他の動物に分娩状態の異常は認められず,哺育状態の異常を認める例もなかった.
黄体数は通常の値であるが,着床数が5と少ないために着床率が低くなった動物が8 mg/kg投与群に1例認められたが,その他の例の黄体数,着床数および着床率に異常は認められず,被験物質の用量に依存した変化,あるいは対照群との有意差も認められなかった.
いずれの投与群の動物も行動を含む一般状態に異常は認められなかった(表に示さず).
全出生児が死亡した200 mg/kg投与群の1例以外に,産児の死亡率が高かった例はいずれの投与群にもなく,産児数,分娩率,生存産児数,生児出産率,出生率,新生児の4日の生存率のいずれにも,対照群と被験物質各投与群との間で有意差は認められなかった.また,哺育0および4日における性比にも対照群と被験物質各投与群との間で有意差は認められなかった.
体重については,全出生児が死亡した200 mg/kg投与群の生存産児は,雌雄ともに哺育0日における全例の体重がやや低かった.一方,着床数が少なかった8 mg/kg投与の1例の生存産児は,哺育0日における全例の体重がやや高値を示した.しかし,生存児の体重に被験物質の用量に依存した変化は雌雄ともに認められず,被験物質各投与群と対照群との間で有意差も認められなかった.
雌雄ともに,200 mg/kg までの4,4'-ビフェニルジオールを反復経口投与しても,死亡あるいは瀕死に至ることはなく,詳細な症状観察および神経学的検査において検知されるような神経行動学的異常も示さなかった.また,投与中止後2週間に亘る観察期間中に遅発性の影響を認めることもなかった.一方,200 mg/kg投与により,雌雄動物から排泄された尿が時間の経過に伴って白濁してくるのが認められた.これらの変化は投与を休止すると認められなくなることから,被験物質投与による影響であると考えられる.尿の白濁は排泄後の時間経過に伴い認められたが,後述のように,一般状態の観察では白濁を認めなかった40 mg/kg投与群の雌雄にも,尿検査では混濁が認められたことから,被験物質投与によって尿に排泄された物質が,時間経過により析出して白濁尿として観察されたものと考えられる.排泄された尿の変化の他に,被験物質投与に起因すると考えられる一般状態の変化は認められなかった.
雄では,体重増加および摂餌量に被験物質投与の影響は認められなかった.雌では,交尾した動物の妊娠0〜7日における軽度な体重増加量抑制が,8および200 mg/kg投与群において認められた.200 mg/kg投与群では,妊娠0〜1日における摂餌量も僅かであるが対照群との間で有意差が認められた.また,この時期における8 mg/kg投与群の摂餌量も低値の傾向を示していたことから,両投与群では,摂餌量の軽度な低下を伴う妊娠初期における体重増加抑制があったものと考えられる.しかし,40 mg/kg投与群には摂餌量および体重増加のいずれにも抑制は認められず,体重増加および摂餌量の抑制には明瞭な用量依存の関係も認められなかった.体重増加抑制は,200 mg/kgを投与したサテライト群においても認められたが摂餌量は対照群と同様であった.また,体重増加抑制は,交尾した動物では投与期間の中期に認められたのに対し,サテライト群では投与末期から回復期に認められ,交尾した動物とサテライト群の動物との間で体重増加抑制の時期と投与回数との間に関連性は認められなかった.これらのことから,雌動物に認められた体重増加および摂餌量の抑制は偶発的変化である可能性が高いと判断された.
前述のように,200 mg/kg投与群では,雌雄の尿が排泄後の時間経過に伴って白濁してくるのが認められた.投与31あるいは32日に実施した尿検査では,混濁や沈渣結晶の増加が認められている.観察された沈渣結晶を形状から分類すると,リン酸様結晶が対照群を含む全ての投与群の動物に観察されたのに対し,シュウ酸カルシウム様結晶は40 mg/kg投与群の雌および200 mg/kg投与群の雌雄に観察された.シュウ酸カルシウム結晶は,食餌中に含まれているシュウ酸塩や,生体内におけるグリシンの分解によって生じたシュウ酸など,食餌由来や生理的な過程で生成されたシュウ酸に由来して形成されるが5),エチレングリコールなど外来性化学物質による曝露でもこれが尿沈渣に増加することが知られている6).本試験において,シュウ酸カルシウム様結晶は,特に200 mg/kg投与群の雌雄に高頻度に認められ,同じ動物を対象とした回復11日における検査では認められなかったことから,尿沈渣へのシュウ酸カルシウム様結晶の出現は,被験物質投与による影響であると考えられる.
シュウ酸カルシウム様の沈渣結晶は,40 mg/kg投与群の雄には認められなかった.しかし,40 mg/kg投与群では,200 mg/kg投与群の動物で顕著に認められた尿の混濁が,雄では5例中1例に,また,雌では7例中2例に認められた.40 mg/kg投与群の尿にみられた混濁は,200 mg/kg投与群と比べて軽度ではあったが,8 mg/kg以下の投与群には認められていないこと,回復11日における検査では認められなかったこと,ならびに,40 mg/kg投与群において混濁の認められた雌の2例中1例にはシュウ酸カルシウム様沈渣結晶の増加も認められていることから,被験物質投与による影響であると考えられる.
尿の沈渣結晶として,リン酸様結晶の増加も認められた.リン酸結晶は,ラットの尿沈渣に一般的に観察される結晶で,本試験においても対照群を含むほぼ全例に観察された.対照群では沈渣結晶の増加は雌雄ともに認められなかったが,被験物質各投与群では沈渣結晶の増加する例があり,そのうち,8 mg/kg投与群の雌雄および40 mg/kg投与群の雄の例では,リン酸様結晶だけが観察された.前述のように,被験物質投与によってシュウ酸カルシウム様結晶が出現してくるが,その前段階として,生理的に存在する沈渣結晶が増加してくる可能性も考えられる.しかし,シュウ酸カルシウム様の沈渣結晶が1例に観察された40 mg/kg投与群の雌では,この例以外に沈渣結晶の増加する例は認められなかった.また,尿沈渣にシュウ酸カルシウムを増加させるエチレングリコールを,Fisher 344ラットに2年間混餌投与した試験7)でも,三リン酸塩の増加とエチレングリコールの投与量あるいは投与期間との関連性は認められていない.さらに,本試験と同様の条件下で,同系統のラットを飼育すると,本試験でみられたのと近傍の週齢(18週齢)に沈渣結晶が増加してくるものが認められている8).従って,リン酸様結晶を主体とする沈渣結晶は,自然発生により増加したものと判断された.
雌において,尿比重の有意な低下が40 mg/kg以上の投与群に認められた.サテライト群の雌でも,対照群との間に有意差は認められなかったが,200 mg/kg投与により尿比重が低下する傾向が認められ,被験物質投与による影響であると考えられる.尿比重の低下は,尿量の増加を伴うことが多いが,本試験では,新鮮尿を検査したため,尿量に及ぼす影響は明らかではない.しかし,一般状態の観察で認められるような尿量の増加は認められず,比重の低下も僅かであった.さらに,投与終了時の剖検では,腎臓重量あるいは腎臓の病理組織学所見に被験物質投与の影響は認められず,血液生化学検査成績にも腎機能の異常を示唆する変化は認められなかったことから軽度な影響であると考えられる.雌における尿検査と近接した投与時期に尿検査を実施した雄に尿比重の変化は認められなかった.予備試験では1000 mg/kg投与により雄の腎臓に明瞭な毒性変化が認められたが,本試験では,腎臓重量あるいは腎臓の病理組織所見に被験物質投与の影響は認められなかった.さらに,血液生化学検査の成績にも腎臓機能の変化を示唆する変化は認められず,混濁やシュウ酸カルシウム様沈渣結晶の出現といった尿の性状変化が40 mg/kg 以上の投与群で認められたのみであった.
雄の投与終了時における血液学検査では,40 mg/kg投与群において平均赤血球容積および平均赤血球血色素量がやや低下したが,軽度であり,用量に依存した変化ではなかったことから,これらは偶発的変化であると考えられる.また,同時期に実施した血液生化学検査において,200 mg/kg投与群におけるナトリウム濃度が僅かに低下した.しかし,ナトリウム濃度以外に変化の認められた項目はなく,また,個体毎に比較しても,カリウム濃度を含めて関連して変動した検査項目は認められなかった.さらに,尿比重の低下が認められている雌でも血漿ナトリウム濃度を含めて血液生化学の各検査項目に投与の影響は認められなかったことから,200 mg/kg投与群の雄における血漿ナトリウム濃度の僅かな低下は偶発的変化である可能性が高い.
雌の投与終了時における血液学検査および血液生化学検査では,いずれの項目についても被験物質投与の影響は認められなかった.サテライト群は,回復15日にこれらの検査を行ったが,200 mg/kg投与群において,AST(GOT)活性が対照群と比較して有意な低値を示した.しかし,逸脱酵素の活性が低下したことは,被験物質の影響を示唆するものではなく,むしろ対照群における活性がやや高かったことによるものと考えられる.従って4,4'-ビフェニルジオールは,回復15日における血液生化学検査の成績にも影響は及ぼさないと考えられる.
雌雄ともに,上記以外に,尿検査,血液学検査ならびに血液生化学検査において,被験物質投与との関連性を考慮すべき項目はなかった.
投与終了時に測定した雄の器官重量は,200 mg/kg投与群において肝臓相対重量が増加し,副腎重量が低下した.いずれも軽度な変化であったが,肝臓の剖検所見として,腫大あるいは暗色調の認められる例もあり,さらに病理組織学検査では,対照群の肝臓には認められなかった小葉中心性肝細胞肥大を認める例もあった.回復期間終了時の剖検ではこうした変化が認められなかったことから,4,4'-ビフェニルジオールの反復投与が雄の肝臓に形態学的変化をもたらすことにより,肝臓相対重量を増加させたものと考えられる.雌の肝臓にはこれらの変化は認められていないことから,4,4'-ビフェニルジオールが肝臓に及ぼす影響には性差の存在する可能性が示唆された.これらの他に,200 mg/kg投与群の雄の肝臓には門脈周囲性の脂肪化の程度の減弱も認められた.一方,副腎の病理組織学検査では,異常所見はいずれの動物にも認められず,副腎皮質ホルモンの影響を受けやすい胸腺重量にも,被験物質投与の影響は認められなかった.さらに,1000 mg/kgを反復投与した4,4'-ビフェニルジオールの予備試験では,副腎重量はむしろ増加していたことから,200 mg/kg投与群の雄における副腎重量の低下は偶発的な変化である可能性が高い.
雌の器官重量には被験物質投与の影響は認められなかった.
4,4'-ビフェニルジオールの予備試験において腎臓に変化が認められたことから,本試験では,雌雄ともに全ての投与群において病理組織学検査を行った.しかし,いずれの所見も対照群と被験物質投与群との間で差は認められず,また,用量に依存した変化の認められた所見あるいは,投与終了時と回復15日との間で明瞭な変化の認められた所見もなかった.これらのことから,200 mg/kgまでの4,4'-ビフェニルジオールは腎臓の形態に明瞭な影響は及ぼさないと考えられた.
200 mg/kg投与群において哺育1日までに全出生児が死亡した1例に,脾臓および胸腺の小型化が観察され,病理組織学検査でもこれらの組織に所見が認められたが,投与終了時の剖検例に類似した所見は認められなかった.また,上記の雄における肝臓の所見以外はいずれも対照群と被験物質投与群との間で差は認められず,被験物質投与の影響によるものではないと考えられる.
以上のように,4,4'-ビフェニルジオールの反復投与の結果,40 mg/kg以上の4,4'-ビフェニルジオールは雌雄の尿を混濁させ,雌では40 mg/kg以上の投与量により尿沈渣にシュウ酸カルシウム様結晶を出現させ,尿比重を低下させることが認められた.また,雄では,200 mg/kgにより尿沈渣にシュウ酸カルシウム様結晶を出現させ,これら尿の変化により,一般状態の観察において,200 mg/kg投与により雌雄動物の尿が排泄後の時間経過に伴い白濁するのが認められた.さらに,200 mg/kgの4,4'-ビフェニルジオールは雄に対してのみ組織学的変化を伴う肝臓重量の増加を招来するが,いずれも投与の中止によって回復することが明らかになった.
200 mg/kg投与を受けても性周期の変化した動物はなく,全例が交尾して受胎したことから,200 mg/kgまでの被験物質投与は性周期および交配のいずれにも影響を及ぼさないと考えられる.
妊娠期間はいずれも正常で,被験物質投与は妊娠期間に影響を及ぼさないと考えられるが,200 mg/kg投与群において12例中1例の母動物に全出生児の死亡が認められた.この例では,生死にかかわらず産児はケージ内に散乱し,生存児には腹部にミルクスポットが認められず,また,体重も他の腹の生存児と比べて低かったが,形態異常は観察されなかったことから,分娩における母性行動の欠如があったものと判断された.市販の繁殖用飼料の給与を受けているSD系妊娠ラットに,比較的大量のコーン油を毎日経口投与すると,腎臓の尿細管上皮が障害され,分娩の翌日までに母動物の全身状態が悪化して出生児の生存率が低下することが報告されている9).200 mg/kg の4,4'-ビフェニルジオールは,尿沈渣にシュウ酸カルシウム様結晶を増加させ,尿比重を軽度に低下させる量であることから,腎臓に対する本被験物質の負荷と分娩の異常との関連性が示唆されるが,本例の分娩前後における全身状態に異常は観察されなかった.また,本例以外に,全出生児の死亡を認める例もなく,分娩時における生存率が著しく低下した例もなかったことから,4,4'-ビフェニルジオールの腎臓に対する負荷と全出生児死亡との関連性は乏しいと考えられる.母動物の全身状態の他に,母性行動には,神経内分泌学的な要因も大きく影響する.4,4'-ビフェニルジオールは,エストロゲン受容体と結合親和性を有し10, 11),去勢雌ラットの子宮重量を増加させる活性も有している11).分娩直前のラットでは,後分娩排卵に向けて卵巣にグラーフ卵胞が形成され,エストロゲンが盛んに分泌されているが,本試験において投与した4,4'-ビフェニルジオールが,内因性のエストロゲンを凌駕するだけのエストロゲン活性を有していると仮定すると,4,4'-ビフェニルジオールが母性行動に関わる神経内分泌に影響を及ぼした可能性も考えられる.しかし,エストロゲンは,ラットに対して,直接的にも,また,母性行動を促進するプロラクチンの下垂体前葉からの分泌を亢進させることによって間接的にも,母性行動を促進すると考えられている12).従って,4,4'-ビフェニルジオールが有すると報告されているエストロゲン活性が,分娩時の母性行動に関わる神経内分泌に悪影響を及ぼして,分娩時の母性行動を欠如させた可能性は乏しいと考えられる.本試験では,母性行動の欠如によると考えられる全出生児の死亡が高用量群の1例に観察されたが,本試験と同一の試験ガイドライン下で実施した試験13)の媒体(注射用水)投与群にも母性行動の欠如による全出生児の死亡が1例に認められている.この例も本例と同様に,分娩前後における母動物の全身状態にも,出生児にも異常は認められていないことから,本例における分娩時の母性行動の欠如も被験物質投与とは関連しない変化であると判断された.哺育状態についても,異常の認められた例はなく,また,本例以外に全出生児が死亡した例もなかったことから,200 mg/kgまでの4,4'-ビフェニルジオールは分娩および哺育状態に影響は及ぼさないと考えられる.
黄体数,着床数,着床率,産児数,分娩率,生存児数,生児出産率,出生率,新生児の4日の生存率のいずれについても,対照群と被験物質各投与群との間で差は認められず,着床前から出生後の哺育4日に到るまでの生存に,200 mg/kgまでの4,4'-ビフェニルジオールは影響を及ぼさないと考えられる.また,性比にも影響は認められなかった.
出生児の成長についても,哺育0および4日の体重に,対照群と被験物質各投与群との間に差は認められず,被験物質投与の影響は認められなかった.さらに,生存死亡のいずれにおいても形態異常を示す出生児は認められなかったことから,200 mg/kgまでの4,4'-ビフェニルジオールは出生児の形態に影響を及ぼさないと考えられる.
以上の試験成績から,本試験条件下では,4,4'-ビフェニルジオールの無作用量は,反復投与毒性に関しては,雌雄いずれにおいても40 mg/kg/day以上の投与群で尿の混濁が認められたことから,雌雄ともに8 mg/kg/dayであると結論される.生殖発生毒性に関しては,200 mg/kg/dayを投与しても雌雄ともに影響が認められなかったことから200 mg/kg/dayであると結論される.出生児に関しても投与の影響が認められなかったことから200 mg/kg/dayであると結論される.また,雌雄動物に認められた4,4'-ビフェニルジオール投与に起因すると考えられる変化は,投与の中止後2週間までに回復し,その間,遅発性の変化は認められないと結論される.
| 1) | National Technical Information Service: OTS0534530, Springfield, VA, USA. |
| 2) | Ciranni R, Barale R, Marrazzini A, Loprieno N: Benzene and genotoxicity of its metabolites, 1. Transplacental activity in mouse fetuses and in their dams. Mutation Res, 208:61-67(1988). |
| 3) | 金井泉:「臨床検査法提要(改訂29版)」金井正光(編),金原出版,東京(1983). |
| 4) | 藤森勲,小沢亨史,佐藤和文,小林寛,神谷一成,片瀬史朗:「尿沈渣カラーアトラス」岡本一也(監),近代出版,東京(1992). |
| 5) | 長浜大輔:「尿沈渣第4版」文光堂,東京(1993). |
| 6) | Bruckner J, Warren DA: Toxic effects of solvents and vapors. In メCasarett and Doull's Toxicologyモ, 6th ed., Klaassen CD(ed.), McGraw-Hill, New York(2001)pp.869-916. |
| 7) | DePass LR, Garman RH, Woodside MD, Giddens WE, Maronpot RR, Weil CS:Chronic toxicity and oncogenicity studies of ethylene glycol in rats and mice. Fund Appl Toxicol, 7:547-565(1986). |
| 8) | Tanaka A, Azegami Z, Kojima K, Imai K: Response to commercial low protein diet. in メBiological Reference Data on Crj:CD(SD)IGS Rats -1998モ, Matsuzawa T, Inoue H(eds.), CD(SD)IGS Study Group, Yokohama(1998)pp.19-30. |
| 9) | Sato M, Wada K, Marumo H, Nagao T, Imai K, Ono H: Influence of corn oil and diet on reproduction and the kidney in female Sprague-Dawley rats. Toxicol Sci, 56:156-164(2000). |
| 10) | Paris F, Balaguer P, Terouanne B, Servant N, Lacoste C, Cravedi JP, Nicolas JC, Sultan C: Phenylphenols, biphenols, bisphenol-A and 4-tert-octylphenol exhibit alpha and beta estrogen activities and antiandrogen activity in reporter cell line. Mol Cell Endocrinol, 193:43-49(2002). |
| 11) | Yamasaki K, Imatanaka N, Yakabe Y: Comparative study of the uterotrophic potency of 14 chemicals in a uterotrophic assay and their receptor-binding affinity. Toxicol Lett, 146:111-120(2004). |
| 12) | Numan M:Maternal behavior, in メPhysiology of Reproductionモ, 2nd ed., vol. 1, Knobil E, Neil JD(eds.), Raven Press, New York(1994)pp.221-302. |
| 13) | 代田眞理子ら:臭化リチウムのラットを用いる反復経口投与毒性・生殖発生毒性併合試験.化学物質毒性試験報告, 10:329-346(2003). |
| 連絡先 | |||
| 試験責任者: | 代田眞理子 | ||
| 試験担当者: | 田子和美 | ||
| 7食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Mariko Shirota(Study director) Kazumi Tago | ||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano-shi, Kanagawa 257-8523, Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||