1,2,4-ベンゼントリカルボン酸トリオクチルのラットを用いる
反復経口投与毒性・生殖発生毒性併合試験
Combined Repeat Dose and Reproductive/Developmental Toxicity Screening Test
of Trioctyl benzene-1,2,4-tricarboxylate by Oral Administration in Rats
要約
1,2,4-ベンゼントリカルボン酸トリオクチルについては,毒性に関する報告がほとんどない.そこで,今回,既存化学物質の安全点検に係わる毒性調査の一環として,ラットを用いる反復投与毒性・生殖発生毒性併合試験を実施した.1,2,4-ベンゼントリカルボン酸トリオクチルの0,30,125および500 mg/kgをSprague-Dawley 系雌雄ラットに交配前2週間から交配を経て,雄については連続42日間,雌については妊娠期間を通して哺育4日まで反復経口投与し,雌雄動物に対する反復投与毒性ならびに生殖発生毒性について検討した.
その結果,500 mg/kg投与群の雌1例が妊娠23日に死亡した以外に,死亡例は認められなかった.一般状態の変化として,投与直後の流涎が500 mg/kg投与群の雌雄に観察された.500 mg/kg投与群の雌では,妊娠7〜14日の体重増加量が低値を示したが,雄の体重推移および雌雄の摂餌量には被験物質の影響は認められなかった.雌では赤血球数の減少および肝臓重量の増加が125 mg/kg以上の投与群で,血中蛋白濃度の減少,ブドウ糖濃度の増加が500 mg/kg投与群で認められた.雄では血中蛋白濃度の減少,アルカリフォスファターゼ活性の上昇が500 mg/kg投与群で認められた.病理組織学検査では,小葉中心性の肝細胞肥大が雄の500 mg/kg投与群で観察されたが,生殖器系には被験物質の投与に起因したと考えられる異常は認められなかった.
生殖毒性に関しては,雌の性周期,雌雄の交尾率,受胎率,さらには母動物の分娩および哺育状態に被験物質の影響を示唆する変化は認められなかった.また,出産率,妊娠期間,妊娠黄体数,着床数および着床率にも被験物質の影響は認められなかった.さらに,出生児の生存性,性比,体重および形態に関しても被験物質に起因する変化は認められなかった.
以上の試験結果から,本試験条件下における1,2,4-ベンゼントリカルボン酸トリオクチルの反復投与毒性に関する無作用量は,雄では 125 mg/kg/day,雌では30 mg/kg/day,生殖発生毒性に関する無作用量は,親動物および出生児ともに500 mg/kg/day と判断された.
方法
1. 被験物質
試験には,大日本インキ化学工業(株)(千葉)より提供された純度99 %以上の1,2,4-ベンゼントリカルボン酸トリオクチル(ロット番号:C-120,不純物:主に異性体)を用いた.被験物質は,使用時まで,容器を密栓し,室温で保管した.使用した被験物質は,提供元において,再度,品質試験を実施し,試験期間中の安定性を確認した.
媒体は,被験物質が水に溶けにくいため,コーン油を選択した.投与検体は,被験物質を各濃度ごとに秤量し,所定の濃度となるようにコーン油(製造番号:V9F1299,ナカライテスク(株))に溶解して調製した.1および25 w/v%の調製検体については,冷蔵,遮光条件下で8日間の安定性が確認されていることから,調製した検体は,冷蔵,遮光下で気密容器に入れて保管し,調製後8日以内に投与した.各濃度の投与検体については,秦野研究所において被験物質の含量を測定し,平均含量が所定濃度の97.6〜102 %にあることを確認した.なお,投与検体は溶液であることから,均一性試験は実施しなかった.
2. 使用動物および飼育方法
試験には,7週齢のSprague-Dawley系(Crj:CD(SD)IGS,SPF)雌雄ラットを日本チャールス・リバー(株)厚木飼育センターから購入して使用した.購入した動物は,入荷後6日間,検疫と馴化を兼ねて飼育した.検疫終了後は,群分け日までの14日間,性周期を観察した.群分けは,群分け日(投与開始前日)の体重に基づく体重別層化無作為抽出法により行い,各群とも雌雄各13匹を配した.なお,性周期が規則的に回帰しなかった雌は,群分けの対象から除外した.投与開始時の週齢は,雌雄ともに10週齢であった.
動物は,基準温度22〜25 ℃,基準湿度50〜65 %,換気回数約15回/時間,照明12時間(7時〜19時点灯)に制御された飼育室で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2,日本クレア(株))および水道水(秦野市水道局給水)を自由に摂取させて飼育した.雌については,妊娠18日(交尾確認日=妊娠0日)以降,ラット用プラスチック製繁殖ケージに収容し,床敷として紙パルプ製チップ(ALPHA-dri 加商(株))を供給した.
3. 投与量の設定および投与方法
投与量は,予備試験の結果に基づいて決定した.すなわち,被験物質の500および1000 mg/kgを各群5匹の雌雄ラットに14日間反復経口投与した結果,1000 mg/kg投与群において体重の増加抑制が認められ,同群の雌においては投与後に一過性の流涎が観察された.また,雄では500 mg/kg以上の投与群において肝臓重量の増加が認められ,1000 mg/kg投与群の肝臓には淡色領域が観察された.雌の500 mg/kg以上および雄の1000 mg/kg投与群では前胃粘膜の浮腫が認められた.以上の結果と本試験での投与期間を考慮し,死亡を発現せず,明らかな毒性徴候を示すと判断された500 mg/kgを高用量とし,以下公比約4で減じて125 および30 mg/kgを中および低用量に設定した.なお,対照群にはコーン油を被験物質投与群と同一条件で投与した.
投与期間は,雄に対しては交配前2週間から交配を経て,剖検日前日までの連続42日間,雌に対しては交配前2週間から交配および妊娠期間を通して哺育4日(分娩日=哺育0日)まで,分娩しなかった雌は妊娠25日相当日まで,毎日1回,ラット用胃管を用いて強制経口投与した.なお,毎日の投与は9時〜12時の間に行い,各動物に投与する液量(体重1 kg当たり2 mL)は,最近時の体重を基に算出した.
4. 観察および検査
1) 親動物
A. 一般状態
全例について,毎日1回以上,投与期間中は投与前後の毎日2回以上観察した.
B. 体重測定
雄は投与1(投与開始日),7,14,21,28,35,42日および解剖日に,雌は投与1,7,14日および妊娠0,7,14,20日に,分娩例は哺育0,4日および解剖日に体重を測定した.なお,未分娩例は妊娠26日相当日に,また死亡例は発見時に体重を測定した.
C. 摂餌量測定
雄は投与1〜2,7〜8,14〜15,29〜30,35〜36および41〜42日に,雌は投与1〜2,7〜8,14〜15日および妊娠0〜1,7〜8,14〜15,20〜21日に,分娩例は哺育3〜4日にそれぞれ給餌量および残餌量を測定し,その差から摂餌量を算出した.
D. 性周期
群分け日までの性周期観察に引き続き,腟スメアを毎日採取し,同居後,交尾が確認されるまで性周期を観察した.性周期は4日周期(4日間隔で発情を回帰)および不正周期(4または5日以外の間隔で発情を回帰)に分類し,投与開始後に性周期が変化した動物の頻度および平均発情回帰日数(発情期から次回発情期までの平均日数)を群ごとに算出した.
E. 交配
交配は投与15日(雌雄とも12週齢)の夕方から,同群内の雌雄を1対1で連日同居させて行った.交尾の確認は,腟スメア中の精子および腟栓の確認により行い,交尾が確認された雌については,その日を妊娠0日として起算し,雄から分離して個別に飼育した.交配結果および妊娠の成否により,各投与群における交尾率〔(交尾動物数/同居動物数)× 100〕,受胎率〔(妊娠動物数/交尾動物数)× 100〕,同居開始から交尾日までの日数およびその間に回帰した発情期の回数を求めた.
F. 分娩および哺育状態の観察
交尾した雌は,全て自然分娩させた.分娩の確認は妊娠21日から毎日行い,午前11時までに分娩が終了した例については,その日を分娩日と規定し,妊娠0日から分娩日までの日数(妊娠期間)を算出した.なお,午前11時を過ぎて分娩を終了した動物については,翌日を分娩日とした.分娩状態が直接観察できた動物についてはその状態を断続的に観察し,直接観察できなかった動物についても,分娩前後の一般状態および産児の状態から分娩困難や遅延などの分娩障害の有無を判断して記録した.哺育例については,哺育1〜4日の哺育状態を毎日観察した.
G. 尿検査
投与5週に,各群とも動物番号の若い順から雌雄各5例を選び,代謝ケージに4時間収容し,尿を採取してpH,潜血,蛋白,糖,ケトン体,ウロビリノーゲン,ビリルビンを試験紙法(クリニテック200+,バイエル・三共(株)),色調ならびに混濁度を視診によりそれぞれ検査した.
H. 血液学検査
雄は投与42日の翌日に,分娩した雌は哺育4日の翌日に,交尾をしたが分娩しなかった雌は妊娠26日相当日に,それぞれ前日より18〜24時間絶食させた後,ペントバルビタールナトリウム麻酔下で,腹部後大静脈より採血した.抗凝固剤としてクエン酸ナトリウムを用いた血液からは,全自動血液凝固測定装置(CA-1000,東亜医用電子(株))によりプロトロンビン時間および活性部分トロンボプラスチン時間(光散乱検出法)を測定した.また,抗凝固剤としてEDTA-3Kを用いた血液からは,血液自動分析装置(CELL-DYN3500SL,ダイナボット(株))により,赤血球数,平均赤血球容積および血小板数(電気抵抗法),白血球数および白血球分類(フローサイトメトリー・レーザ光散乱法),血色素量(吸光度法)を測定し,これらを基にヘマトクリット値,平均赤血球血色素量および平均赤血球血色素濃度を算出した.なお,血液の一部は塗抹標本とし,網状赤血球比率(Brecher 法)を求めた.
I. 血液生化学検査
血液学検査用の採血に引き続き,抗凝固剤としてヘパリンを用いて採取した血液は,血漿を分離して,遠心方式生化学自動分析装置(COBAS-FARA,ロシュ・ダイアグノスティックス(株))により,総蛋白濃度(ビウレット法),アルブミン濃度(BCG 法),総コレステロール濃度(COD・DAOS法),ブドウ糖濃度(グルコキナーゼ・G6PDH法),尿素窒素濃度(ウレアーゼ・G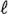 .DH法),クレアチニン濃度(Jaffe'法),アルカリフォスファターゼ活性(GSCC法),GOT(AST)活性およびGPT(ALT)活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),無機リン濃度(モリブデン酸直接法),総ビリルビン濃度(Jendrassik/Grof法),カルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム,カリウムおよび塩素濃度(イオン電極法)を測定した.
.DH法),クレアチニン濃度(Jaffe'法),アルカリフォスファターゼ活性(GSCC法),GOT(AST)活性およびGPT(ALT)活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),無機リン濃度(モリブデン酸直接法),総ビリルビン濃度(Jendrassik/Grof法),カルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム,カリウムおよび塩素濃度(イオン電極法)を測定した.
J. 病理学検査
生存例は採血後に,死亡例は発見後に,すみやかに剖検し,器官および組織の肉眼的観察を行った.その際,生存例については脳,心臓,胸腺,肝臓,腎臓,脾臓,副腎,精巣および精巣上体の重量を測定し,併せて比体重値(相対重量)を算出した.雌では卵巣および子宮を摘出し,卵巣は実体顕微鏡下で妊娠黄体数を,子宮は着床数をそれぞれ数え,着床率[(着床数/妊娠黄体数)× 100]を算出し,子宮に着床痕が確認されなかった動物は不妊例とした.全例の脳,下垂体,脊髄,甲状腺,心臓,気管,気管支,肺,肝臓,腎臓,胸腺,脾臓,副腎,胃,十二指腸,空腸,回腸,盲腸,結腸,直腸,膀胱,下顎リンパ節,腸間膜リンパ節,坐骨神経,大腿骨骨髄,雄の前立腺腹葉ならびに精嚢(凝固腺を含む),雌の卵巣,子宮ならびに腟,および病変部は,0.1 Mリン酸緩衝10 vol%ホルマリン液に固定して保存した.その際,肺は注入固定を行った.雄の精巣および精巣上体はブアン液に固定後,長期保存のために0.1 Mリン酸緩衝10 vol%ホルマリン液に置換した.
卵巣,精巣および精巣上体は全例について標本を作製し,病理組織検査を実施した.肝臓については,雄は全例,雌は対照群および500 mg/kg投与群の全例,胃については,雌は全例,雄は対照群および500 mg/kg投与群の全例について病理組織検査を実施した.その他の保存器官については,対照群および500 mg/kg投与群の動物番号の若い順から,雄は各5例について,雌は不妊例を除く各6例について病理組織検査を実施した.なお,剖検時に異常が認められた125 mg/kg投与群の雌1例については,脾臓,肝臓,腸間膜リンパ節および大腿骨骨髄の病理組織検査を追加して実施した.
2) 出生児
A. 産児数および死亡児
哺育0日に産児の性別および外表奇形の有無を観察した後,生存児数および死亡児数を雌雄別に数え,分娩率 [(産児数/着床痕数)× 100],生児出産率 [(出産生児数/着床痕数)× 100],出生率 [(出産生児数/産児数)× 100] および性比 [(雄生児数/雌生児数)× 100] および出産率〔(生児出産雌数/妊娠動物数)× 100〕を求めた.
哺育1〜4日に生児数と死亡児数を雌雄別に毎日調べ,哺育4日の新生児生存率 [(哺育4日の生児数/哺育0日の生児数)× 100] および性比 [(雄生児数/雌生児数)× 100] 求めた.死亡児は,発見後速やかに剖検し,0.1 Mリン酸緩衝10 vol%ホルマリン液に固定して保存した.
B. 体重測定
哺育0日および4日に個別に体重を測定し,各腹ごとに雌雄別の平均値を算出した.
C. 剖検
哺育4日に全例をエーテル吸入により致死させ剖検した.
5. 統計解析
性周期の変化した動物の頻度,交尾率ならびに受胎率についてはFisherの直接確率検定を行った.病理組織学検査所見のうち,グレード分けしたデータはMann-WhitneyのU検定により,陽性グレードの合計値はFisherの直接確率の片側検定により対照群との間で有意差検定を行った.その他のデータは,個体ごとに得られた値あるいはlitterごとの平均値を1標本として,先ずBartlettの方法により各群の分散の一様性について検定を行い,分散が一様である場合には,一元配置型の分散分析を実施し,群間に有意性が認められた場合は,Dunnett法により多重比較を行った.一方,いずれかの群で分散が0となる場合および分散が一様でない場合には,Kruskal-Wallisの順位検定を行い,群間に有意性が認められる場合には,Dunnett型の検定法により多重比較を行った.有意水準はいずれも5 %とした.
結果
1. 反復投与毒性
1) 一般状態
500 mg/kg投与群の雌1例は,投与42日(妊娠23日)の投与後に死亡した.死亡した動物は,投与直後の流涎が投与14日から断続的にみられた他,死亡日の投与前には紅涙および眼周囲褐色汚染が観察された.生存例では,投与直後の流涎が500 mg/kg投与群の雄11例および雌4例に観察された.流涎は,最も早い動物で投与9日から断続的みられ,いずれも投与の2〜3時間後には消失する一過性の変化であった.その他,脱毛が各投与群の雌雄合わせて2〜5例に,削痩,軟便および外陰部周囲汚染が対照群の雌1例に観察された.
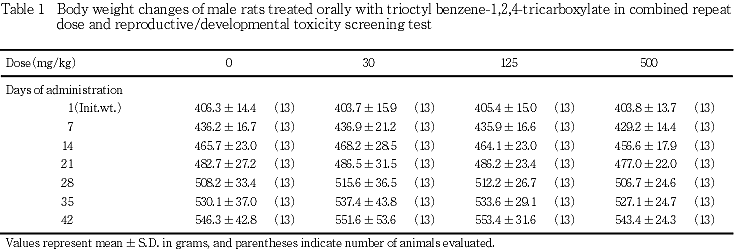
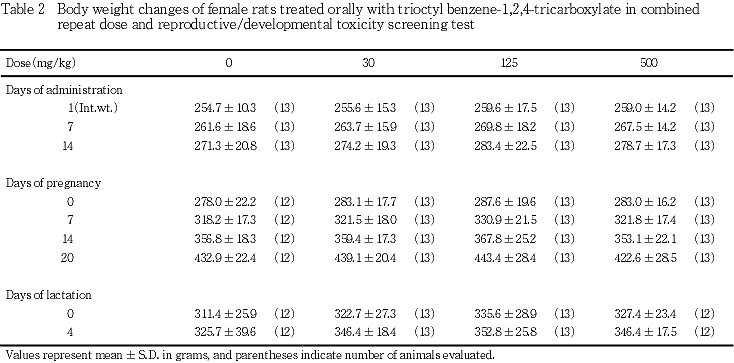
2) 体重(Tables 1, 2)
雄では,体重の実測値および増加量について,対照群と被験物質投与群との間に有意差は認められなかった.雌では,体重の実測値に有意差は認められなかったが,500 mg/kg投与群における妊娠7〜14日の増加量が,対照群と比較して有意な低値を示した(Tableには示していない).
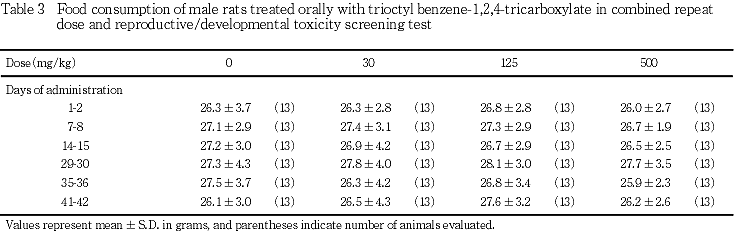
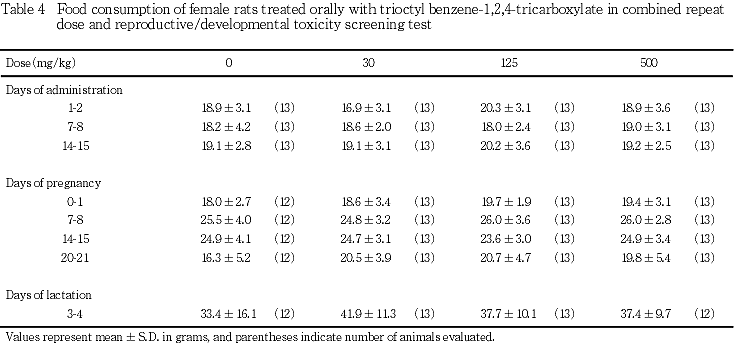
3) 摂餌量(Tables 3, 4)
摂餌量は,雌雄,いずれの時期においても,対照群と被験物質投与群との間に有意差は認められなかった.
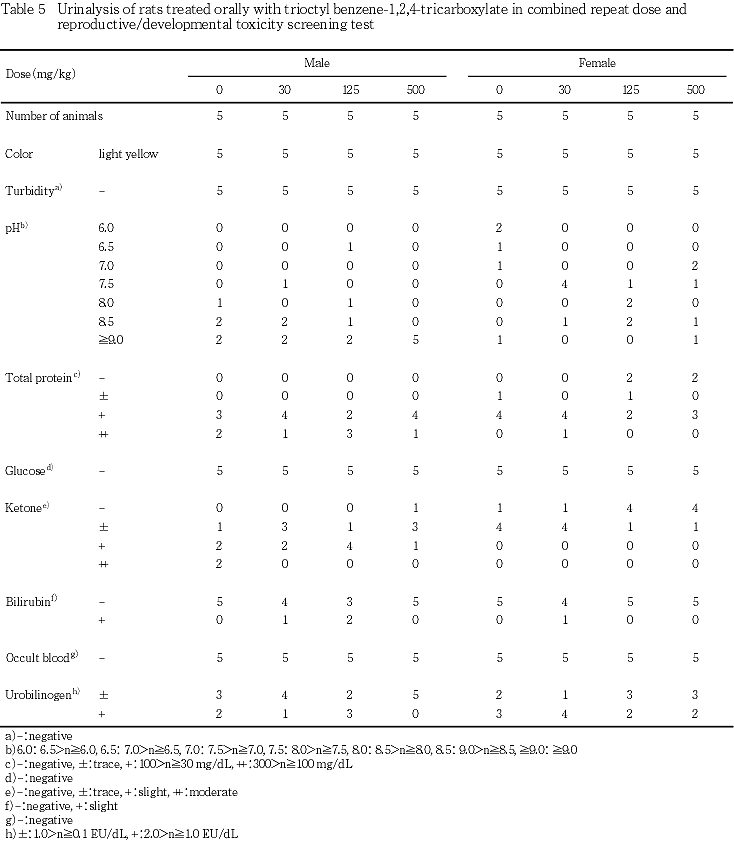
4) 尿検査(Table 5)
尿のpHが高値であった動物が,500 mg/kg投与群の雄で多くみられたが,その他の検査項目については,被験物質の影響を示唆する変化は認められなかった.
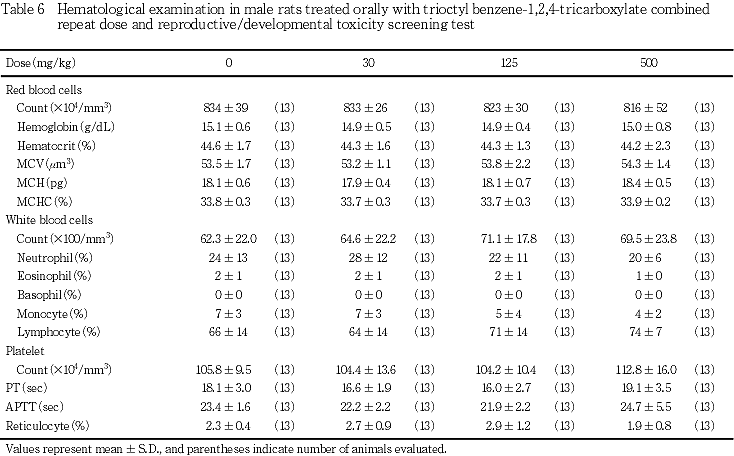
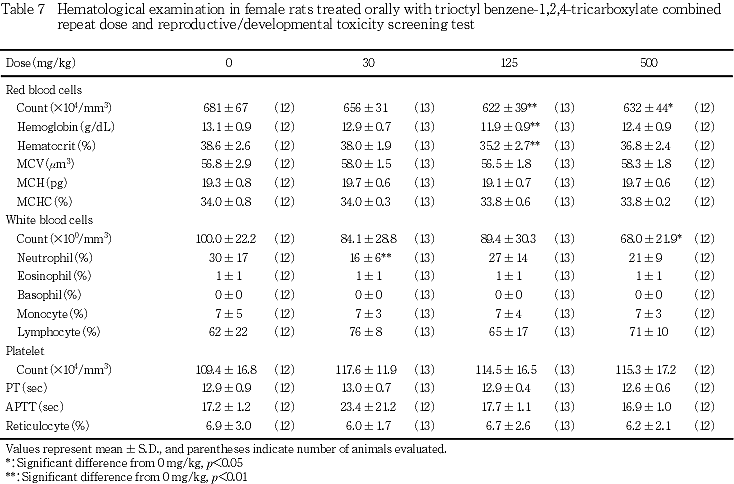
5) 血液学検査所見(Tables 6, 7)
雄では,いずれの検査項目についても,対照群と被験物質投与群との間に有意差は認められなかった.雌では,赤血球数の有意な減少が125 mg/kg以上の投与群で,また,白血球数の有意な減少が500 mg/kg投与群で認められた.その他,血色素量およびヘマトクリット値の有意な減少が125 mg/kg投与群において,白血球分類における好中球の有意な減少が30 mg/kg投与群でみられたが,被験物質の用量に依存した変化ではなかった.
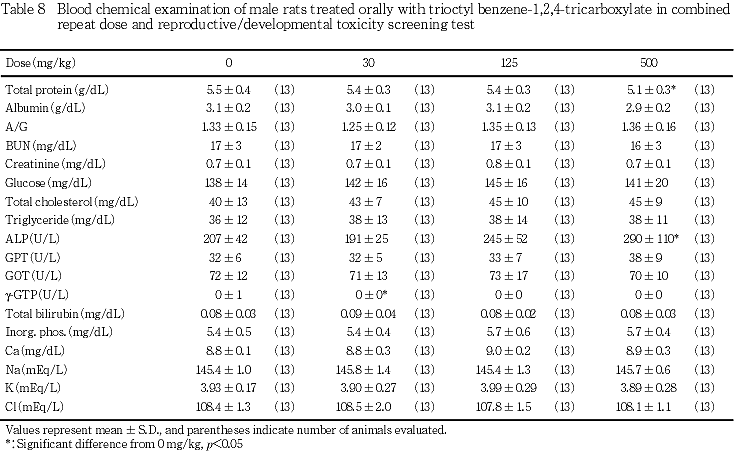
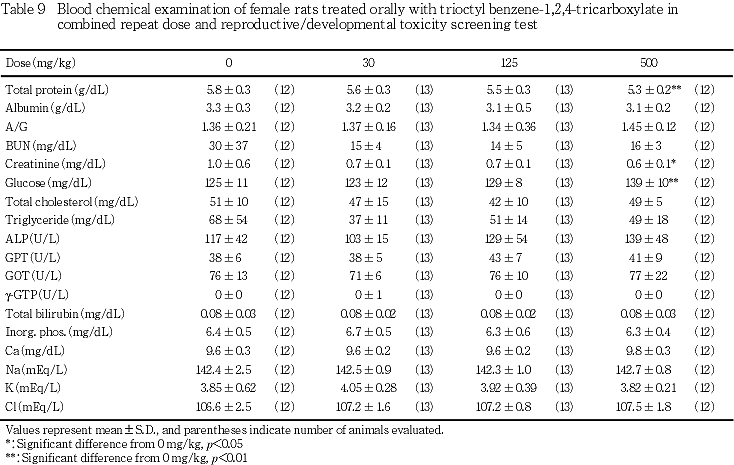
6) 血液生化学検査所見(Tables 8, 9)
総蛋白濃度の有意な減少が500 mg/kg投与群の雌雄で認められ,さらに同群の雄では,アルカリフォスファ
ターゼ活性の有意な上昇,雌ではクレアチニン濃度の有意な減少,さらにブドウ糖濃度の有意な増加が認められた.その他,γ-GTP活性の有意な低下が30 mg/kg投与群の雄にみられたが,用量に依存した変化ではなかった.
7) 剖検所見
雄では,生殖器の異常として,精巣の小型化および水腫が125 mg/kg投与群の1例に,精巣上体の結節が500 mg/kg投与群の1例に,いずれも片側性に観察された.生殖器以外の異常としては,脾臓の腫大,あるいは前胃粘膜の肥厚および白濁が500 mg/kg投与群の各1例に,回腸に憩室が対照群の1例に観察されたが,被験物質の影響を示唆する変化は認められなかった.
雌では,妊娠23日に死亡した500 mg/kg投与群の1例に,腎臓の暗色化,脾臓の淡色化を伴う小型化,肝臓の淡色化を伴う腫大,胸腺の小型化,副腎の腫大がみられた他,前胃および腺胃粘膜の黄色化,被毛の汚れが観察された.
雌の生存例では,腺胃粘膜の黒色あるいは暗赤色点が,30 mg/kg投与群の1例および500 mg/kg投与群の2例に観察された.また,125 mg/kg投与群の1例では,腫大した脾臓に黄白色域がみられ,腎臓,卵巣,胃および脂肪組織と癒着していたほか,肝臓,腸間膜リンパ節の腫大および骨髄の淡色化が観察された.その他,胸腺の小型化が対照群の2例および125 mg/kg投与群の1例に観察され,このうち対照群の2例には,脾臓の小型化,腎臓の淡色化,肝臓の淡色化などが観察された.
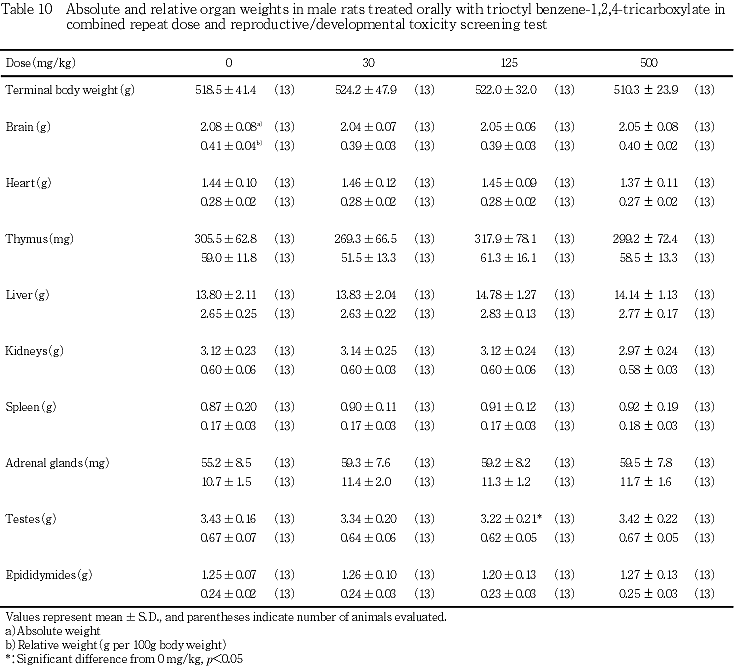
8) 器官重量(Tables 10, 11)
雄では,精巣重量の有意な低下が125 mg/kg投与群に認められたが,用量に依存した変化ではなく,その他の器官についても,対照群と被験物質投与群との間に有意差は認められなかった.
雌では,肝臓重量の有意な増加が125 mg/kg以上の投与群で認められ,500 mg/kg投与群では,肝臓の相対重量も有意に増加した.その他,被験物質投与群で心臓の相対重量が対照群より有意に低下したが,絶対重量には有意な変化は認められなかった.

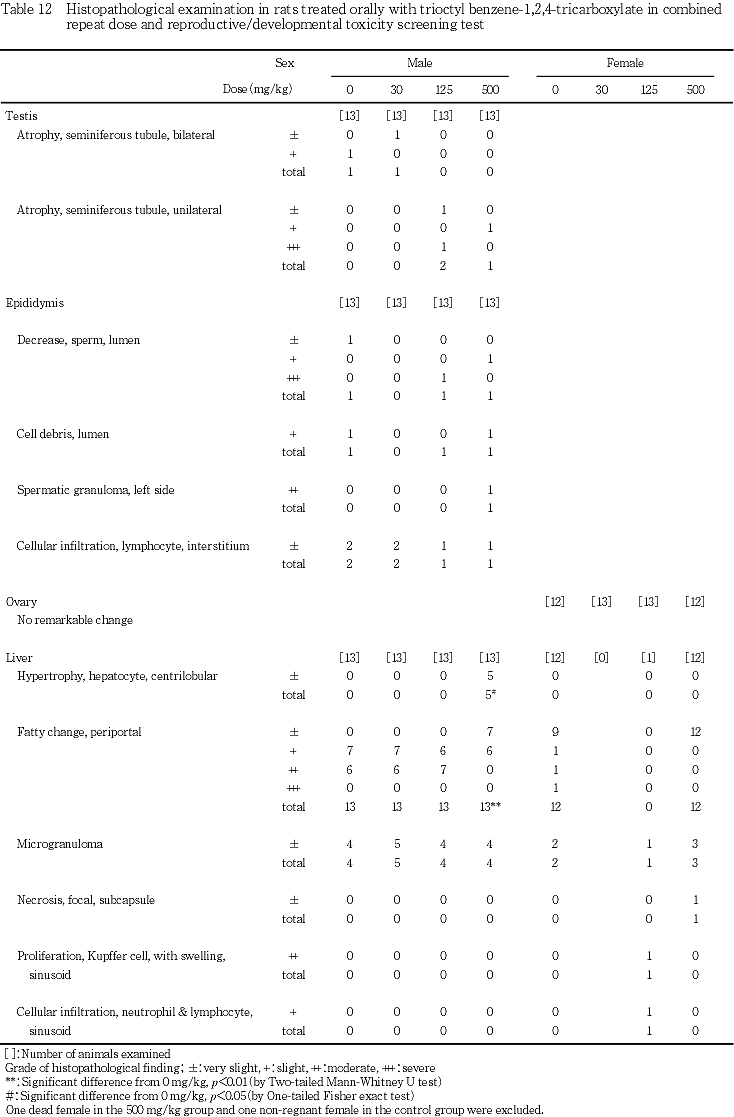
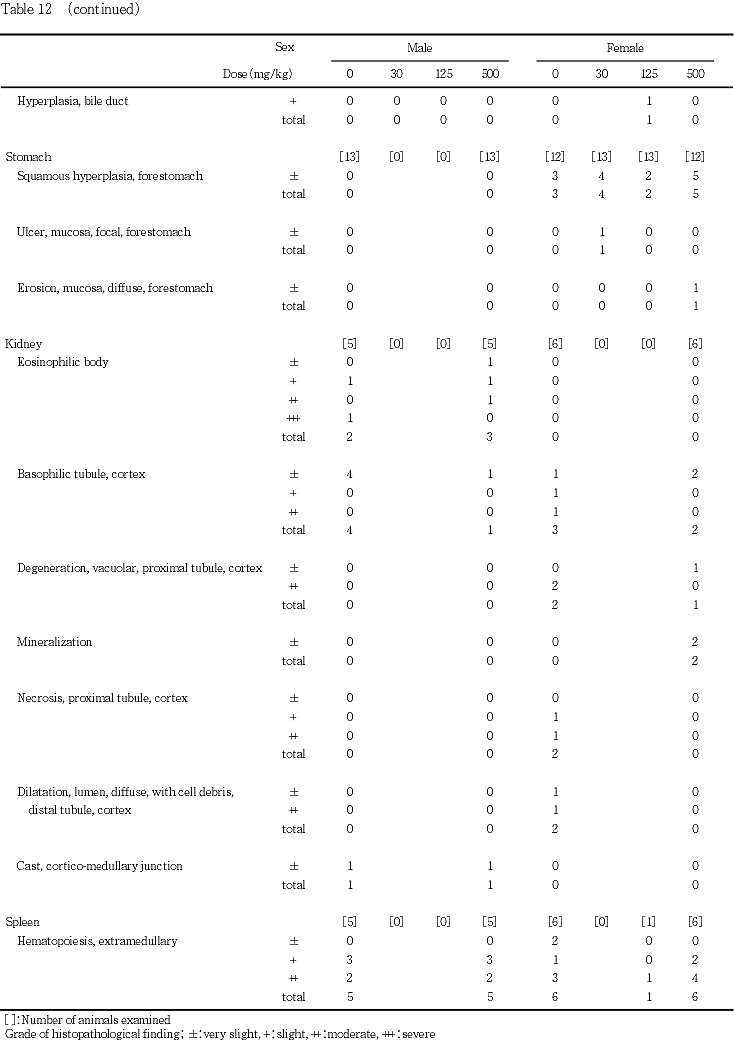
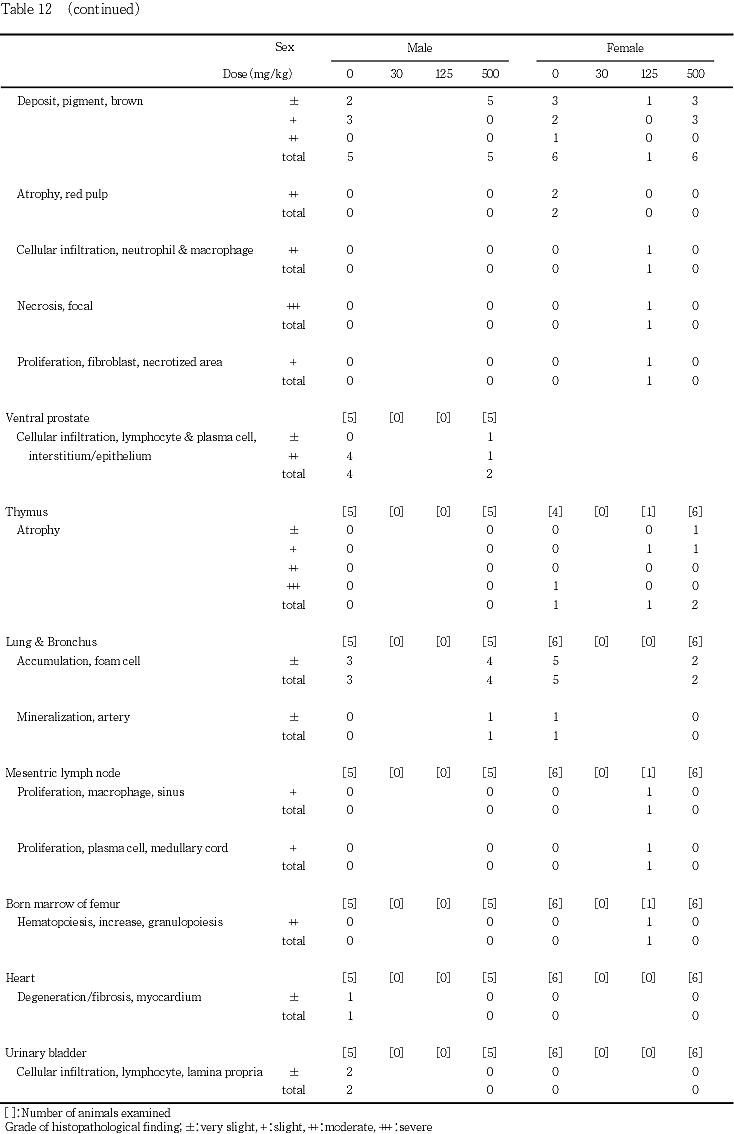
9) 病理組織学検査(Table 12)
雌の死亡例(Tableには示していない)には,腎臓の皮質に近位尿細管の壊死および空胞変性,遠位尿細管に細胞残屑を伴った管腔の拡張が認められたほか,近位尿細管に好酸性色素の沈着,皮質および髄質に好酸性の円柱が多数観察された.なお,好酸性の色素および円柱は,benzidine reactionに陽性で,PAS染色に陰性であったことから,ヘモグロビンであると判断した.同例の脾臓には,髄外造血および褐色色素の沈着がみられたが,白脾髄および赤脾髄は萎縮していた.その他,胸腺の萎縮,前胃粘膜のびらん,副腎の束状帯における脂肪滴の増加,肝臓に門脈周囲性の脂肪化が観察された.
精巣には,両側性の精細管萎縮が対照群および30 mg/kg投与群の各1例に,片側性の精細管萎縮が125 mg/kg投与群の2例および500 mg/kg投与群の1例に観察された.精巣上体には,精細管萎縮の程度が強かった例に精巣上体管内の精子減少や細胞残屑が観察され,さらに精子肉芽腫が500 mg/kg投与群の1例に,間質へのリンパ球浸潤が各投与群の1〜2例に認められたが,その他の動物に異常は認められず,用量に依存した変化はなかった.
卵巣には,異常は観察されなかった.
肝臓には,小葉中心性の肝細胞肥大が500 mg/kg投与群の雄5例に認められたが,いずれも軽度な変化であった.また,門脈周囲性の脂肪化が観察した全ての動物でみられたが,雄の500 mg/kg投与群における脂肪化の程度は,対照群に比較して有意に軽減した.その他,ごく軽度の小肉芽腫が各群で散見され,ごく軽度な限局性壊死が500 mg/kg投与群の雌1例にみられた.
胃には,雌において前胃の扁平上皮細胞の過形成が,対照群の3例,30 mg/kg投与群の4例,125 mg/kg投与群の2例および500 mg/kg投与群の5例に観察されたが,いずれの例も程度はごく軽度であった.その他,前胃粘膜の潰瘍が30 mg/kg投与群に,びらんが500 mg/kg投与群に各1例みられたが,雄においては,胃の異常は観察されなかった.
腎臓には,好酸性小体が組織検査を実施した対照群および500 mg/kg投与群の雄で,皮質の好塩基性尿細管が,組織検査を実施した対照群および500 mg/kg投与群の雌雄で観察されたが,両群間に程度および頻度の差はなかった.500 mg/kg投与群の雌では,さらに,近位尿細管の空胞変性が1例に,鉱質沈着が2例に観察されたが,いずれもごく軽度な変化であった.その他,近位尿細管の壊死および空胞変性,遠位尿細管の拡張が対照群の雌2例に,皮髄境界部に円柱が対照群の雄1例で観察された.
脾臓には,剖検時に脾臓の腫大が観察された125 mg/kg投与群の雌の1例に,髄外造血および褐色色素の沈着に加え,好中球およびマクロファージの浸潤と線維芽細胞の増殖を伴う限局性の壊死巣が多数認められた.また,同例の肝臓には,類洞に腫大したクッパー細胞の増殖,好中球およびリンパ球の浸潤,胆管の増生,小肉芽腫が認められた他,腸間膜リンパ節には類洞のマクロファージと髄索の形質細胞の増生が,大腿骨の骨髄には顆粒球系細胞の造血亢進が観察された.髄外造血および褐色色素の沈着は,雌雄とも,対照群および500 mg/kg投与群の全例に観察されたが,両群間に程度の差はなかった.
前立腺には,間質あるいは上皮にリンパ球および形質細胞の浸潤が,対照群および500 mg/kg投与群で観察されたが,両群間に程度および頻度の差はなかった.
胸腺には,萎縮が対照群の雌1例および500 mg/kg投与群の雌2例に認められた他,剖検時に胸腺の小型化が観察された125 mg/kg投与群の雌1例でも萎縮が確認された.
肺には,泡沫細胞の集簇が,対照群および500 mg/kg投与群の雌雄に観察されたが,両群間に程度および頻度の差は認められなかった.その他,動脈に鉱質沈着が500 mg/kg投与群の雄1例,対照群の雌1例で観察された.
上記以外の器官では,心筋の変性および線維化が対照群の雄1例に,膀胱の粘膜固有層にリンパ球浸潤が対照群の雄2例に観察された.なお,対照群の不妊例には,肝臓に門脈周囲性の脂肪化および小肉芽腫がごく軽度にみられたが,その他の器官に異常はなかった.
2. 生殖発生毒性
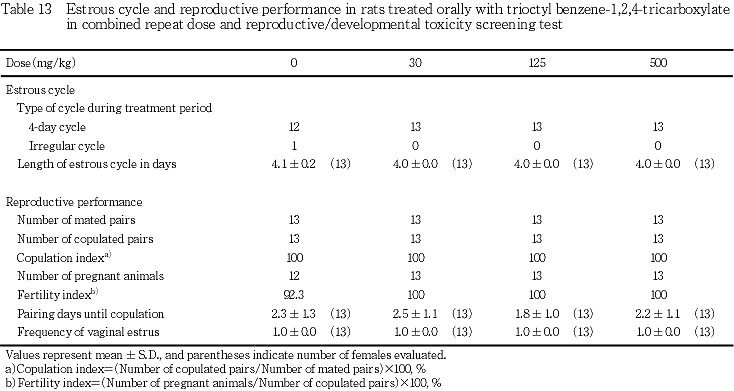
1) 性周期および交配成績(Table 13)
発情回帰の型および平均発情回帰日数に,被験物質の影響は認められなかった.また,交配の結果,全例で交尾が確認され,受胎率,同居開始日から交尾までの日数,およびその間に回帰した発情期の回数にも,対照群と被験物質投与群との間に有意差は認められなかった.
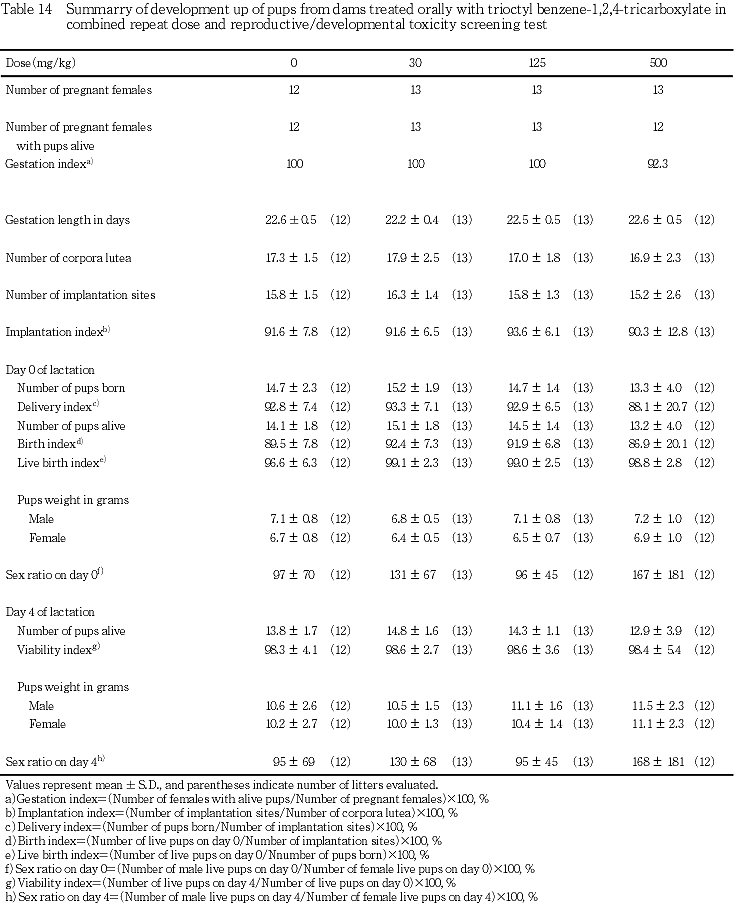
2) 出産率および妊娠期間(Table 14)
500 mg/kg投与群の1例が妊娠中に死亡したため,同群の出産率は92.3 %であったが,その他の群では出産率は100 %であった.妊娠期間については,対照群と被験物質投与群との間に有意差は認められなかった.
3) 黄体数,着床数および着床率(Table 14)
妊娠黄体数,着床数および着床率には,対照群と被験物質投与群との間に有意差は認められなかった.
4) 分娩および哺育状態
妊娠23日に死亡した500 mg/kg投与群の1例以外には,分娩状態の異常は観察されなかった.哺育状態については,哺育3〜4日に哺育児の削痩が対照群の2例で観察されたが,その他の動物には,哺育状態の異常は観察されなかった.
5) 出生児の生存性,体重および形態(Table 14)
産児数,分娩率,生児出産率,出生率,哺育4日の生児数および新生児生存率のほか,哺育0および4日の性比には,対照群と被験物質投与群との間に有意差は認められなかった.
哺育0および4日における雌雄別の哺育児体重には,対照群と被験物質投与群との間に有意差は認められなかった.
哺育0日における生存児の外表観察,哺育4日までに死亡した児の剖検,さらには哺育4日における生存児の剖検では,異常は認められなかった.
考察
500 mg/kg投与群の雌1例が妊娠23日に死亡した.同例の病理組織学検査では,腎臓の近位尿細管の壊死および空胞変性,遠位尿細管の拡張が観察されたが,壊死の程度は軽度であり,腎病変が死因につながる可能性は低いと考えられる.また,同群ではその他の動物に同様の組織所見および分娩状態の異常は観察されず,対照群においても2例に近位尿細管の壊死および空胞変性,さらには遠位尿細管の拡張が観察されていることなどから,500 mg/kg投与群の死亡例は被験物質の毒性を強く示唆するものではないと考えられる.
生存例においては,500 mg/kg投与群の雌雄で投与後の一過性の流涎が観察され,同群の雌では妊娠期間中に体重の増加抑制がみられた.また,125 mg/kg以上の投与群の雌で肝臓重量の増加が認められた.本試験に先立ち実施した予備試験においても,同様の変化がみられていることから,一過性の流涎,体重増加抑制および肝臓重量の増加は,被験物質の投与に起因した変化と考えられる.
血液学検査においては,赤血球数の減少が125 mg/kg以上の投与群の雌で認められたが,網状赤血球比率,脾臓および骨髄の組織学検査で造血機能低下あるいは血球破壊進を示唆する変化は観察されなかったことから,本試験でみられた変化は軽度の貧血と考えられる.なお,500 mg/kg投与群の死亡例においては,組織学検査でヘモグロビン尿が観察されていることから溶血に起因した変化が疑われるが,血液学検査でみられた赤血球数の減少との関係は明らかではなかった.その他,白血球数の減少が500 mg/kg投与群の雌でみられたが,白血球百分比および骨髄の組織学検査では異常は認められず,軽微な変化であった.
尿検査では,500 mg/kg投与群の雄でpHが高値を示した例が多くみられたが,同群の雌には同様の傾向は認められず,泌尿器系の病理組織学検査にも異常は観察されなかった.
病理組織学検査の結果,500 mg/kg投与群の雄で小葉中心性の肝細胞肥大が観察され,同群では門脈周囲性の脂肪化が軽減したが,肝細胞の障害を示唆する重度な変化ではなかった.肝臓重量の増加が認められた雌では同様の所見は認められていないが,血液生化学検査においても,500 mg/kg投与群の雌雄で総蛋白濃度の減少,雄でアルカリフォスファターゼ活性の上昇,雌でブドウ糖濃度の増加が認められ,被験物質の肝臓に対する影響が示唆された.なお,500 mg/kg投与群の雌でみられたクレアチニン濃度の変化は,増加ではないことから毒性学的意義のない変化と判断した.
生殖発生毒性に関しては,雌の性周期,雌雄の交尾率,受胎率に被験物質の影響は認められず,母動物の出産率,妊娠期間,分娩状態,哺育状態,妊娠黄体数,着床数および着床率にも被験物質の投与に起因したと考えられる変化は観察されなかった.また,生殖器系の病理組織学検査においても,被験物質の影響を示唆する異常は観察されなかった.出生児についても,生存性,性比,体重および形態に被験物質投与の影響は認められなかった.
以上の結果から,本試験では反復投与毒性として,125 mg/kg以上の投与群の雌で肝臓重量の増加および軽度の貧血が認められ,500 mg/kg投与群では雌雄で一過性の流涎,雌で体重増加抑制,雄で小葉中心性の肝細胞肥大が認められた.生殖発生毒性としては親動物および出生児に被験物質の影響と考えられる変化は認められなかった.したがって,本試験条件下における反復投与毒性に関する無作用量は雄が125 mg/kg/day,雌が30 mg/kg/day,生殖発生毒性に関する無作用量は親動物および出生児ともに500 mg/kg/dayと考えられた.
| 連絡先 |
| 試験責任者: | 太田 亮 |
| 試験担当者: | 桑形麻樹子,野口早苗,加藤博康,関 剛幸,古谷真美,丸茂秀樹,堀内伸二,稲田浩子,三枝克彦,安生孝子 |
| (財)食品薬品安全センター秦野研究所 |
| 〒257-8523 神奈川県秦野市落合729-5 |
| Tel 0463-82-4751 | Fax 0463-82-4751 | |
| Correspondence |
| Authors: | Ryo Ohta(Study director)
Makiko Kuwagata, Sanae Noguchi, Hiroyasu Kato, Takayuki Seki, Mami Furuya, Hideki Marumo, Shinji Horiuchi, Hiroko Inada, Katsuhiko Saegusa, Takako Anjo |
| Hatano Research Institute, Food and Drug Safety Center |
| 729-5 Ochiai, Hadano-shi, Kanagawa 257-8523, Japan |
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |
 .DH法),クレアチニン濃度(Jaffe'法),アルカリフォスファターゼ活性(GSCC法),GOT(AST)活性およびGPT(ALT)活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),無機リン濃度(モリブデン酸直接法),総ビリルビン濃度(Jendrassik/Grof法),カルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム,カリウムおよび塩素濃度(イオン電極法)を測定した.
.DH法),クレアチニン濃度(Jaffe'法),アルカリフォスファターゼ活性(GSCC法),GOT(AST)活性およびGPT(ALT)活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),無機リン濃度(モリブデン酸直接法),総ビリルビン濃度(Jendrassik/Grof法),カルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム,カリウムおよび塩素濃度(イオン電極法)を測定した.















