ジフェニルジスルフィドはスルフェニル化試薬として,またシクロヘキサン類の脱水素芳香族化試薬として用いられている1).毒性情報としては,OECD TG423で実施した経口投与による急性毒性試験ではCategory 4(>300-2000)に分類された2).しかし,反復投与および生殖発生毒性についての知見はない.ジフェニルジスルフィドを1,6および30 mg/kg/dayの用量でSD系ラット(1群雌雄各12匹,雌はサテライト動物として対照群および30 mg/kg群に各5匹を追加)に交配前14日から交配を経て雄は42日間,雌は妊娠,分娩を経て哺育4日,雌サテライト動物は雄と同様に42日間までそれぞれ経口投与し,反復投与毒性および生殖発生毒性について検討した.
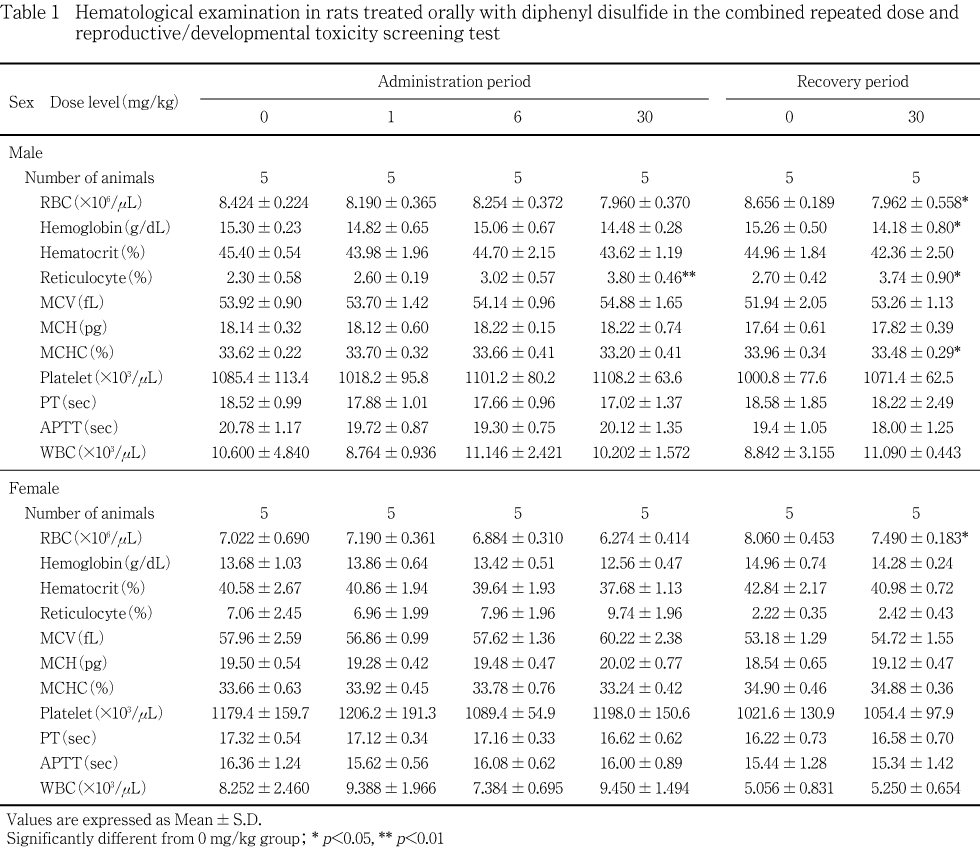
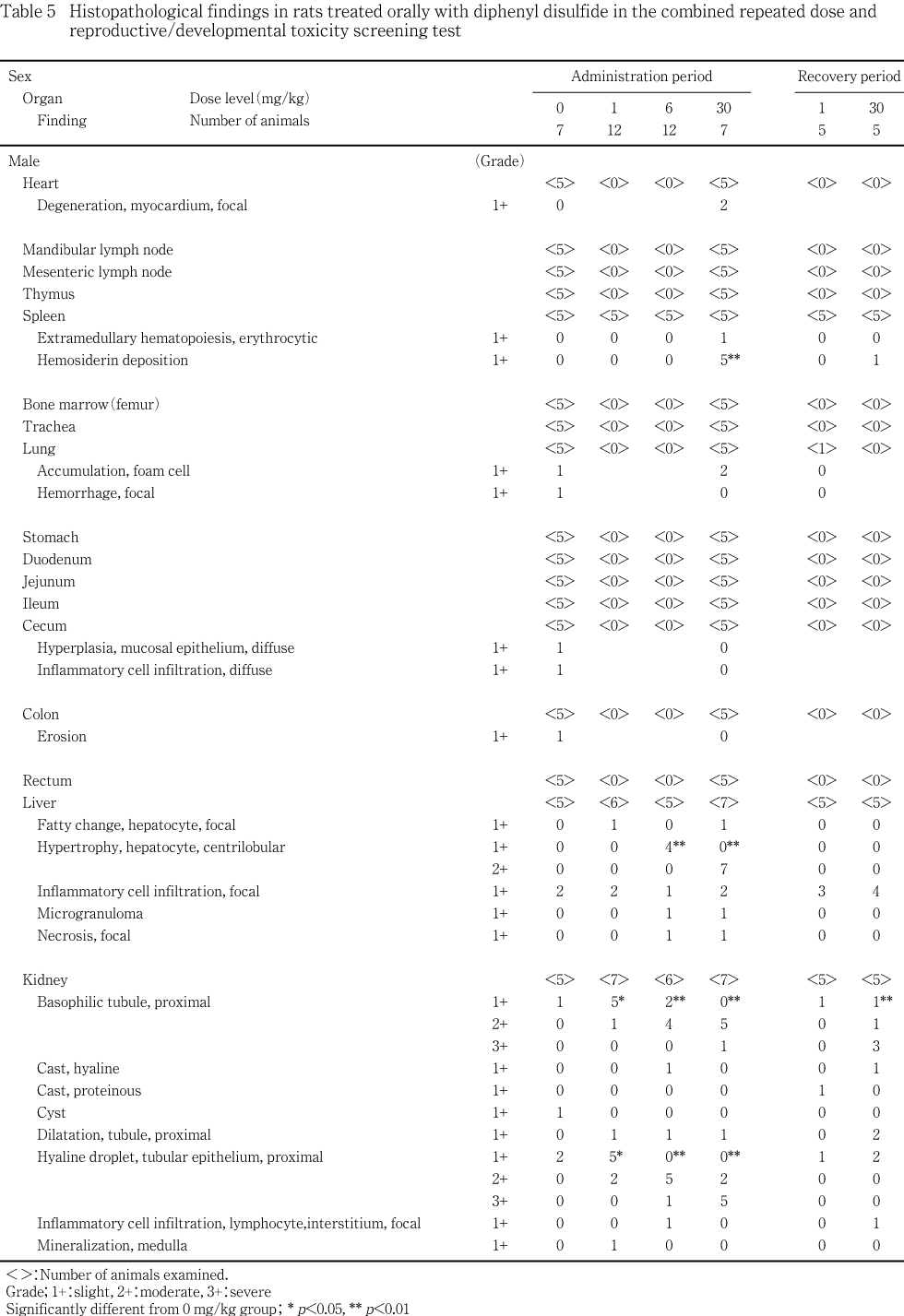
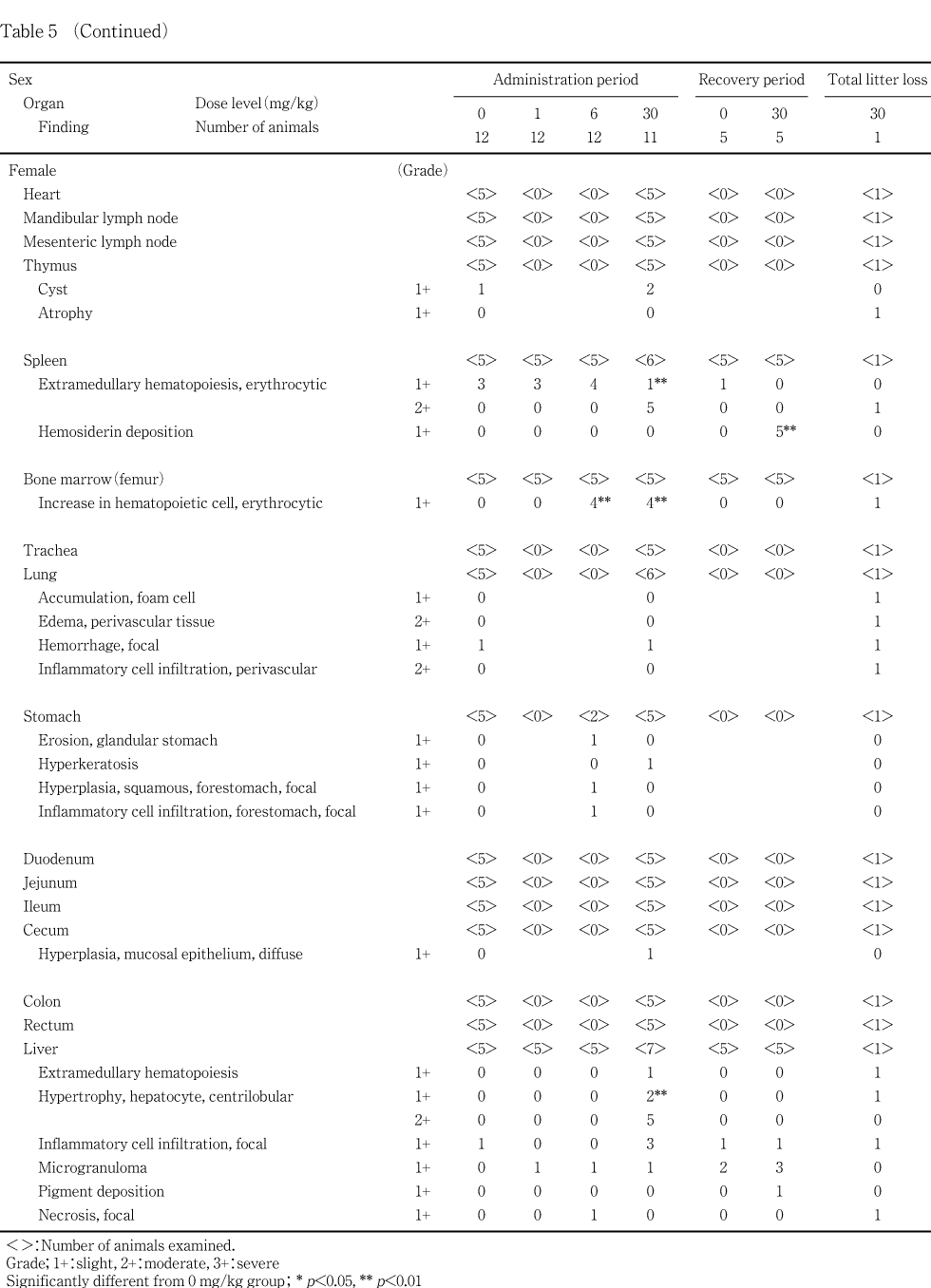
脾臓および大腿骨骨髄に対する影響として,30 mg/kg群で脾臓重量の増加が雌雄,脾臓の腫大と暗赤色化が雌,病理組織検査では脾臓のヘモジデリン沈着および赤血球系髄外造血の増強が雌雄でみられ,大腿骨骨髄の赤血球系造血細胞の増加が6 mg/kg以上の群の雌で認められた.造血系に関連すると考えられる血液学変化として,30 mg/kg群の雌雄で赤血球数の低値,雄でヘモグロビン濃度の低値,網赤血球数の高値など貧血を示唆する変化が認められた.
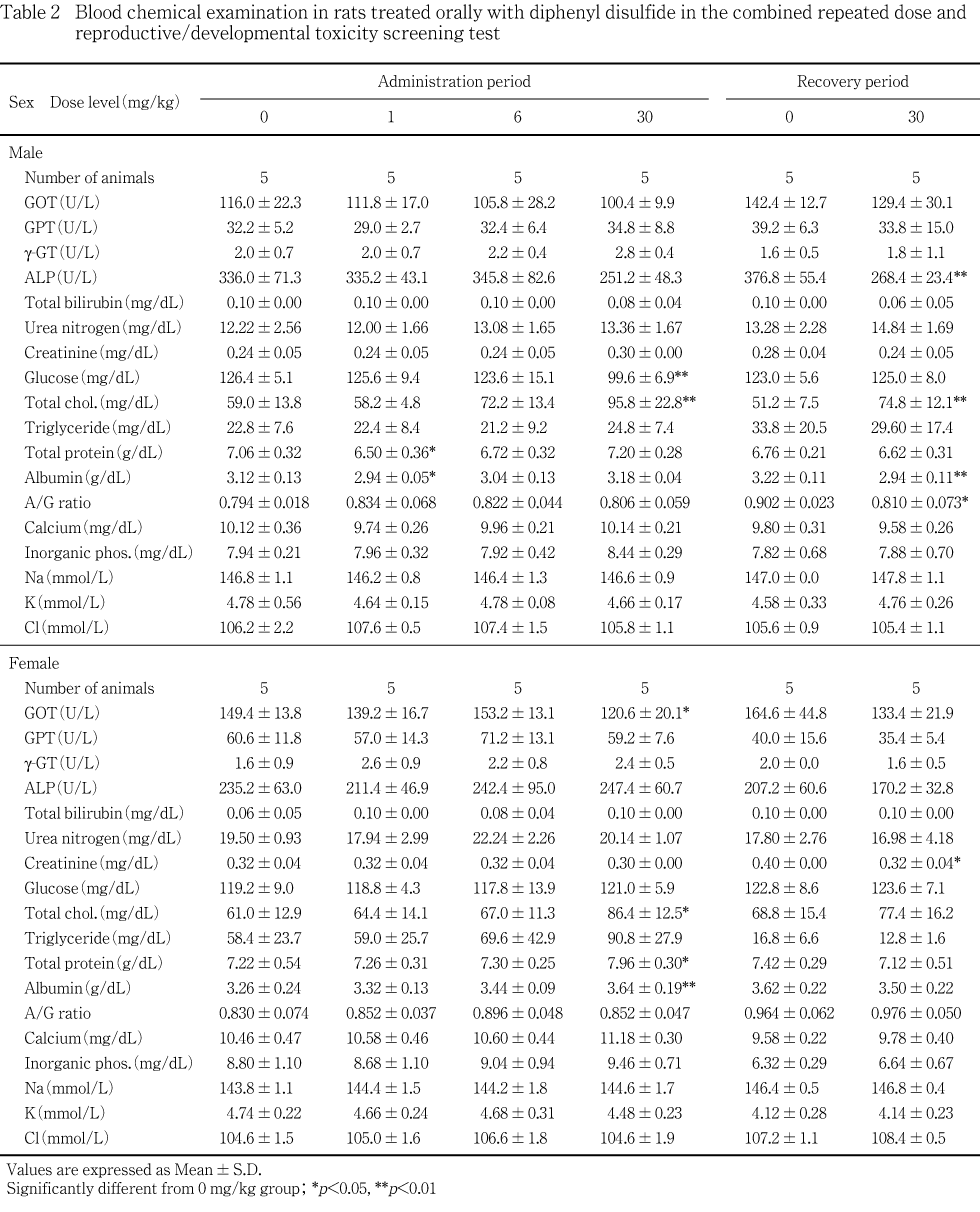
肝臓に対する影響として,30 mg/kg群の雌雄で重量の増加,腫大および小葉中心性肝細胞肥大がみられ,組織変化は6 mg/kg群の雄でも認められた.血液生化学変化として,30 mg/kg群の雄で総コレステロールの高値,グルコースの低値,雌で総コレステロール,総蛋白およびアルブミンの高値が認められた.
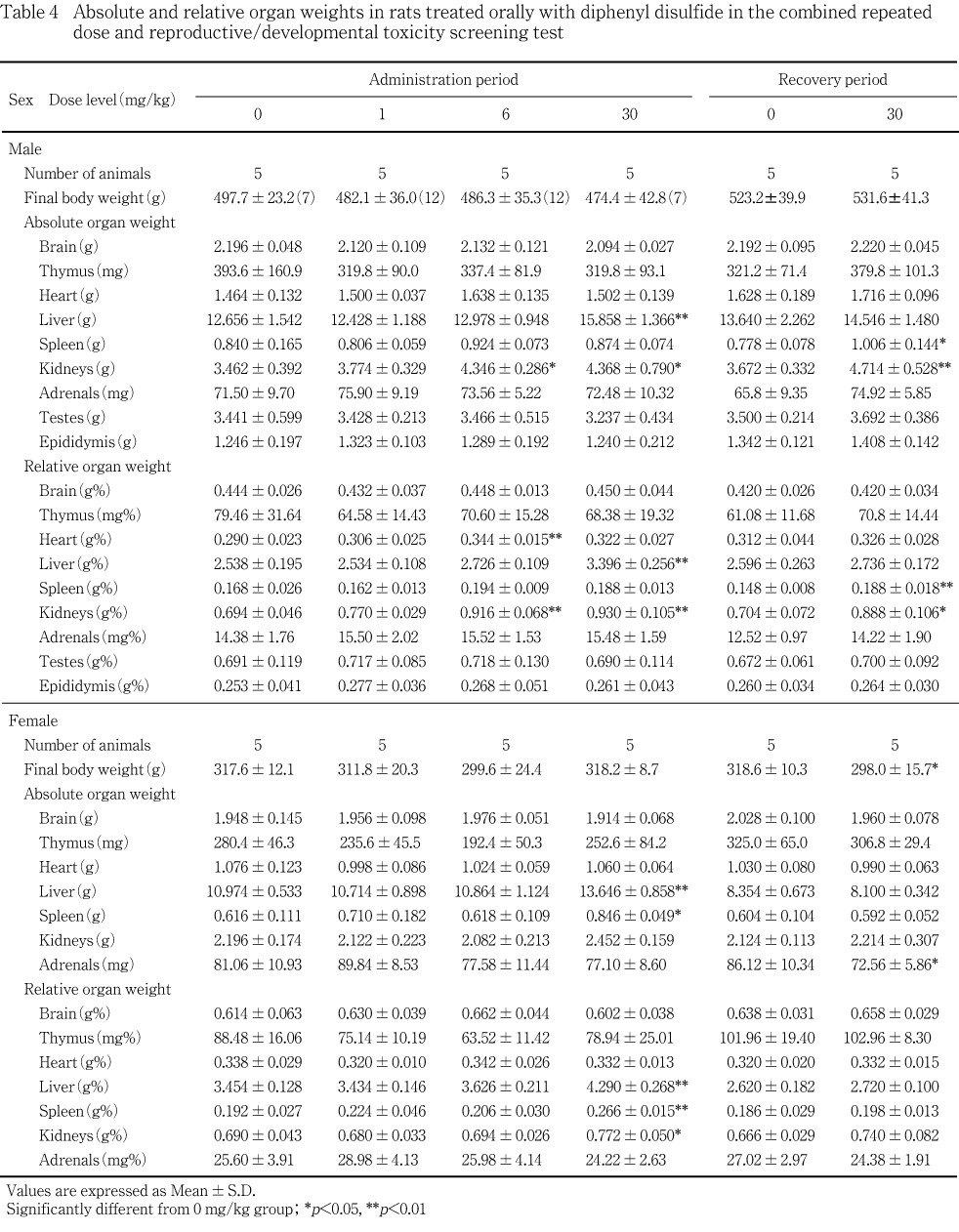
腎臓に対する影響として,腎臓重量の増加が6 および30 mg/kg群の雄,30 mg/kg群の雌で,腎臓の腫大が1 mg/kg以上の群の雄で認められ,組織学的には雄で近位尿細管上皮における硝子滴の発現,好塩基性近位尿細管の発現,雌で尿細管上皮のリポフスチン沈着が認められた.
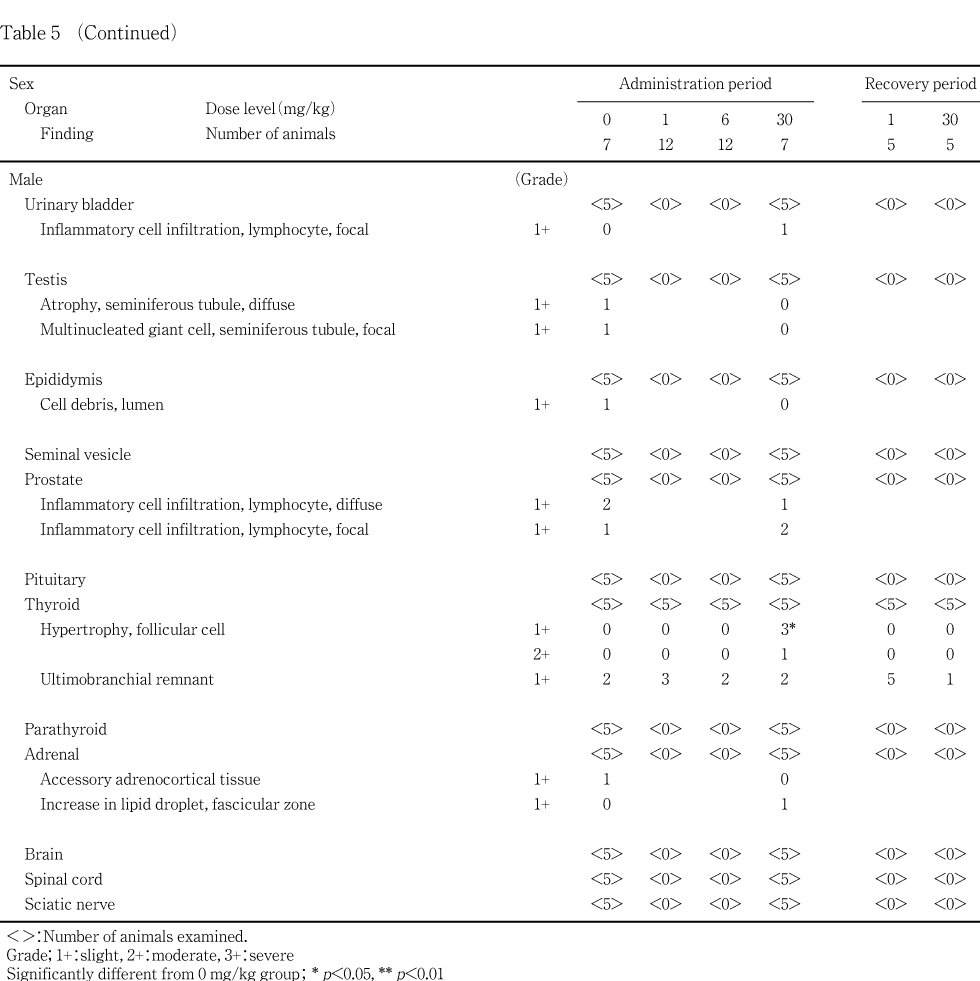
甲状腺に対する影響として,濾胞上皮の肥大が30 mg/kg群の雄に認められた.
投与終了後検査で認められたこれらの病理組織学変化は,2週間の回復期間により消失するか,変化がみられても発現頻度および病変程度が明らかに軽減していることから,回復傾向を示しているものと判断された.
親動物の生殖機能検査において性周期,交尾率,受胎率,分娩率,妊娠期間,黄体数,着床数,着床率,出産率,分娩および哺育行動のいずれにも被験物質に起因する変化は認められなかった.新生児の検査において出産児数,出産生児数,性比,出生率,新生児の4日生存率,外表,一般状態,体重および剖検のいずれにも被験物質に起因する変化は認められなかった.
以上の結果から,ジフェニルジスルフィドの本試験条件下における反復投与毒性に関する無影響量は雄で1 mg/kg/day未満,雌で1 mg/kg/day,生殖発生毒性に関する無影響量は雌雄の親動物ならびに児動物のいずれも30 mg/kg/dayと考えられる.
ジフェニルジスルフィド(Aldrich Chemical(米国),ロット番号15322AB,純度99.8 %)は,キシレンに3 %の溶解性を有する白色の粉末である.被験物質は冷蔵,暗所,気密容器にて保存し,試験期間中安定であることを確認した.投与液の調製には,被験物質を各用量ごとに秤量し,媒体(0.5 %トラガントゴム水溶液,和光純薬工業)に懸濁した.投与液中の被験物質の安定性を投与開始前に調製後8日間安定であることを確認した.投与液は投与に供するまで冷蔵・遮光下で保存し,調製後7日以内に使用した.また,初回および最終調製時に投与液中の被験物質濃度が設定濃度±10 %以内にあることを確認した.
日本チャールス・リバー(厚木生産所)から入手した雌雄のSD系ラット(Crj:CD(SD)IGS,SPF)を5日間検疫・馴化した.その後も馴化を継続し雌雄の一般状態,さらに雌は性周期を7日間観察し,異常のない動物を試験に供した.投与開始前日に体重層別化無作為抽出法により,1群あたり雌雄各12匹に振り分けた.さらに,雌サテライト動物(回復動物)として対照群および30 mg/kg群に各5匹の雌を追加した.投与開始時の週齢は雌雄とも9週齢,体重範囲は雄327〜385 g,雌が208〜258 gであった.検疫・馴化期間を含む全飼育期間を通じて,温度22±2℃,相対湿度55±15 %,換気約12回/時,照明12時間/日(7:00-19:00)に自動調節した飼育室を使用した.動物飼育には,妊娠・哺育期間を除く期間はステンレス製つり下げ式金網製ケージを,妊娠・哺育期間は実験動物用床敷(ベータチップ,日本チャールス・リバー)を敷いたポリカーボネート製ケージを使用した.交配期間は雌雄各1匹,哺育期間は1腹,検疫・馴化期間を含むその他の期間は1匹ずつ収容した.動物には,オートクレーブ滅菌した実験動物用固型飼料(CRF-1,オリエンタル酵母工業)と,孔径5 μmのフィルター濾過後,紫外線照射した水道水を自由に摂取させた.
投与用量は用量設定試験の結果を参考に決定した.すなわち被験物質を0,30,100,300および1000 mg/kgの用量で,1群雌雄各3匹のSD系ラットに14日間反復経口投与した結果,300 mg/kg以上の群で死亡あるいは瀕死が雌雄全例に認められた.100 mg/kg群では一般状態,体重,摂餌量,血液学検査,血液生化学検査,器官重量,剖検の検査項目のすべてに被験物質に起因する変化が認められた.30 mg/kg群でも血液学検査,血液生化学検査に変化がみられ,器官重量では肝臓,脾臓および腎臓重量の高値,剖検では脾臓の暗赤色化および腫大,前胃の壁の肥厚が認められた.これらの結果および本試験の投与期間を考慮し,本試験の高用量は明らかな毒性発現が予想される30 mg/kgとし,以下公比約5で中用量は6 mg/kg,低用量は1 mg/kgの3用量を設定した.また,媒体(0.5 %トラガントゴム水溶液)のみを投与する対照群を設けた.
投与経路は経口とした.投与期間は,雄は交配前14日間および交配期間を経て剖検前日までの計42日間,雌は交配前14日間,交配期間,妊娠期間および分娩を経て哺育4日までとした.交尾しなかった雌および分娩しなかった雌は剖検前日までとした.なお,雌サテライト動物は交配は行わず雄と同様42日間投与した.また,対照群と30 mg/kg群の雄各5匹および同群の雌サテライト動物各5匹については,投与期間終了後14日間の回復期間を設けた.
投与の際はテフロン製胃ゾンデを用いて1日1回,午前中に強制経口投与した.投与液量は5 mL/kgとし,至近日に測定した体重に基づいて算出した.
全例について,生死,外観,行動等を投与前および投与後に毎日観察した.回復動物は1日1回午前中に観察した.
雌雄全例について,詳細な症状観察(ホームケージ内,ハンドリング時,オープンフィールドでの観察)を,投与開始前日に1回,投与期間中は1回/週,いずれも午後に行った.雌雄とも各群5匹を選抜し,機能検査(刺激に対する反応性,握力)および自発運動の測定を,第6週の午後に1回行った.握力はデジタルフォースゲージ(DPS-5),自発運動量にはSUPERMEX(室町機械)を用いて測定した.投与期間中の検査で被験物質の影響が疑われる変化が認められなかったため,回復期間の検査は行わなかった.
雄では第1,4,8,15,22,29,36,42および43日,さらに雄回復動物では第50および56日に測定した.雌サテライト動物は雄と同様の頻度で測定した.雌では第1,4,8および15日,交尾した雌は妊娠0,7,14および20日,分娩した雌は哺育0および4日に測定した.摂餌量は,交配期間を除き体重測定日に測定し,各測定日間の1匹あたりの1日平均摂餌量を算出した.
雄では第42日,雄回復動物および雌サテライト動物では第56日,雌では哺育4日に,全生存動物を午後4時頃より絶食させた.測定対象動物(採血動物)は雄は5例,雄回復動物および雌サテライト動物は全例,雌は分娩日が早く動物番号の小さい順に5例とした.これらの動物は,チオペンタールナトリウムの腹腔内投与による麻酔下で,後大静脈より採血した.採取した血液を用いて以下に示す項目を測定した.
EDTA-2 Kにより抗凝固処理し,赤血球数(球状化処理二次元レーザーFCM法),ヘモグロビン濃度(シアンメトヘモグロビン法),ヘマトクリット値(球状化処理二次元レーザーFCM法),網赤血球数(RNA染色によるレーザーFCM法),血小板数(球状化処理二次元レーザーFCM法),白血球数(酸性界面活性剤によるレーザーFCM法)を多項目自動血球分析装置(ADVIA120,バイエルメディカル),白血球百分率(Wright染色塗抹標本)を血液細胞自動分析装置(MICROX HEG-50,HEG- 50VFオムロン)を用いて測定した.また,検査結果から平均赤血球容積(MCV),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC)を算出した.血液の一部を3.2 w/v%クエン酸三ナトリウム水溶液で抗凝固処理し,遠心分離して得られた血漿を用いてプロトロンビン時間(PT)および活性化部分トロンボプラスチン時間(APTT)(光散乱検出方式)を血液凝固自動分析装置(CA- 510,シスメックス)を用いて測定した.
計画解剖日に採取した血液の一部を室温で約30分間静置後遠心分離し,得られた血清を用いて以下の項目を測定した.
GOTおよびGPT(UV-rate法(JSCC改良法)),g-GT (g-グルタミン-p-ニトロアニリド基質法(SSCC改良法)),ALP(p-ニトロフェニルリン酸基質法(JSCC改良法)),総ビリルビン(酵素法(BOD法)),尿素窒素(酵素- UV法(Urease-LEDH法)),クレアチニン(酵素法(Creatininase-POD法)),グルコース(酵素-UV法(HK- G6PDH法)),総コレステロール(酵素法(CO-HDAOS法)),トリグリセライド(酵素法(GPO-HDAOS法,グリセリン消去法)),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(OCPC法),無機リン(酵素法(PNP-XOD- POD法)),ナトリウム,カリウムおよびクロール(イオン選択電極法)を自動分析装置(TBA-200FR,東芝)を用いて測定した.
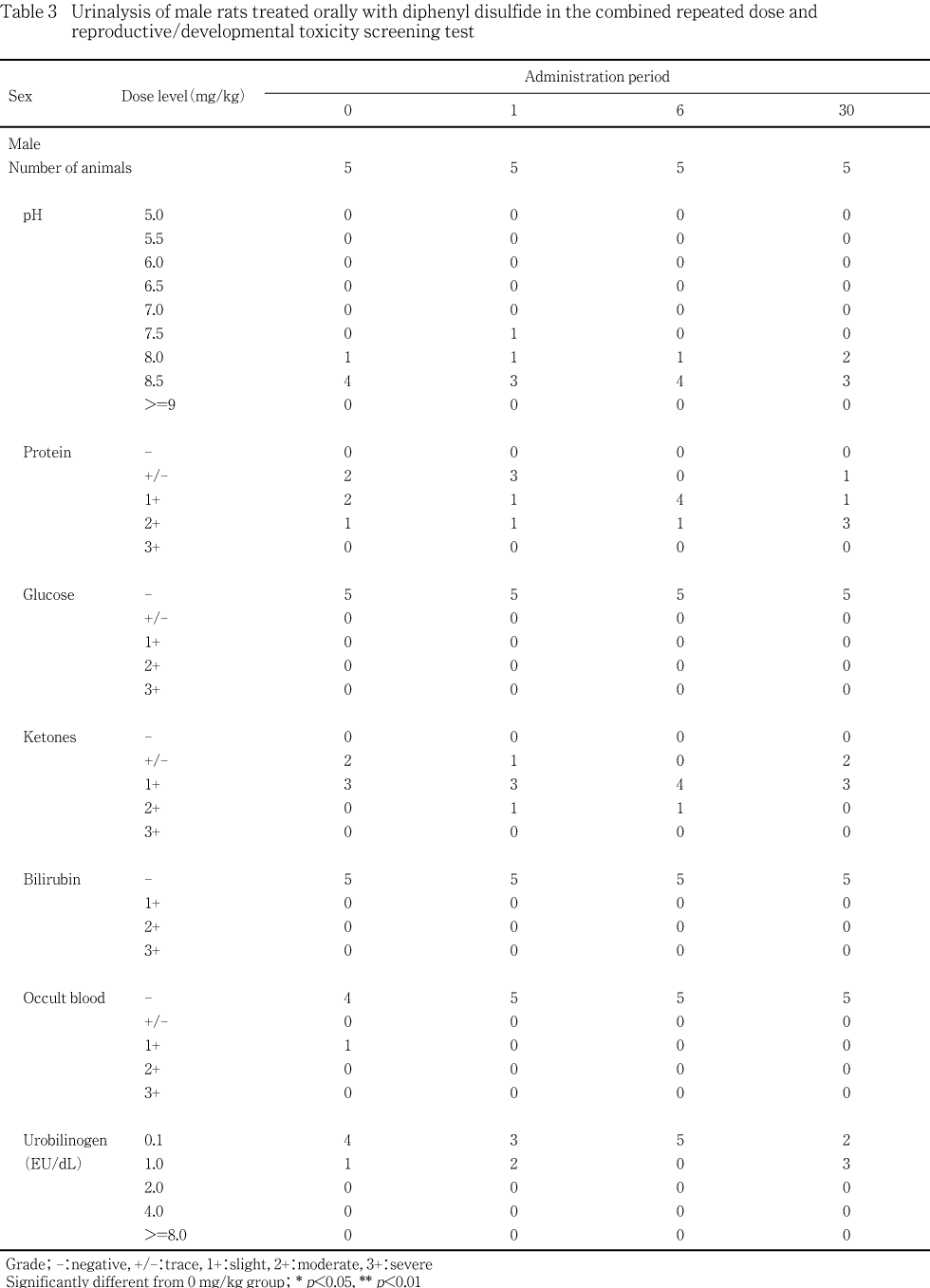
雄について,第38日の投与前に各用量群5匹の新鮮尿を採取し,pH,蛋白,グルコース,ケトン体,ビリルビン,潜血およびウロビリノーゲン(試験紙法,マルティスティックス:バイエルメディカル)を自動尿分析器(クリニテック100,バイエルメディカル)により測定した.被験物質の影響が疑われる変化が認められなかったため,尿沈渣,蓄積尿を用いた検査,回復動物の尿検査は行わなかった.
雌雄全例について,解剖日にチオペンタールナトリウムの腹腔内投与による麻酔下で,腹大動脈の切断・放血により安楽死させて解剖した.計画解剖動物のうち,血液学検査の対象動物と同じ雌雄各5匹(回復動物は全例)の脳,心臓,肝臓,腎臓,副腎,胸腺,脾臓,精巣および精巣上体の重量を測定した.ただし,精巣および精巣上体は雄全例について測定した.また,解剖日の体重を基に相対重量(対体重比)を算出した.さらに,雌雄全例については上記の器官に加えて,下垂体,リンパ節(下顎・腸間膜),気管,肺,胃,腸管(十二指腸,空腸,回腸,盲腸,結腸,直腸),甲状腺・上皮小体,膀胱,精のう,前立腺腹葉,卵巣,子宮,膣,骨髄(大腿骨),坐骨神経,脊髄および肉眼的異常部位を採取し,10 %中性リン酸緩衝ホルマリン液で固定して保存した.ただし,精巣および精巣上体はブアン液で固定後,保存した.病理組織学検査は,対照群と30 mg/kg群の投与後解剖動物のうち,雌雄各5例(血液学検査および器官重量測定対象動物と同様)の上記器官,瀕死期解剖動物の上記器官ならびに乳腺,対照群を含む全動物の肉眼的異常部位および非妊娠雌1例の卵巣について,常法に従ってヘマトキシリン・エオジン染色標本を作製し,鏡検した.この結果,被験物質に起因すると思われる変化が雌雄の肝臓,脾臓,腎臓および雄の甲状腺と雌の大腿骨骨髄に認められた.このため, 1および6 mg/kg群の投与後解剖動物の各5例と回復後解剖動物の雌雄全例の当該器官・組織(甲状腺は雄のみ,大腿骨骨髄は雌のみ)についても検査を行った.さらに,雌の腎臓にみられた黄褐色色素の性質を確認し,その程度を比較するためにヘマトキシリン・エオジン染色を行った雌全例の腎臓についてシュモール反応を,雄の脾臓にみられた黄褐色色素の性質を確認するために,対照群の雄2例,30 mg/kg群の雄5例の脾臓についてベルリンブルー染色を実施した.
投与開始日から交配開始日まで雌の膣垢を毎日午前中に採取,性周期を検査し,平均性周期日数および異常性周期動物の発現率を算出した.交配前の投与期間終了後,各群内で雄1雌1の交配対を設けて最長14日間昼夜同居させた.交尾確認は毎日午前中に行い,膣栓形成あるいは膣垢標本中に精子が認められた場合を交尾成立とし,その日を妊娠0日とした.交配した対は雌雄を分離し,以後の検査に供した.これらの結果から,交尾所要日数(交配開始後,交尾成立までに要した日数),交尾成立までに逸した発情期の回数,交尾率 [(交尾動物数/同居動物数)×100],受胎率[(受胎動物数/交尾動物数)×100]を算出した.
交尾が確認された雌は全例を自然分娩させ,分娩状態を観察した.午前9時の時点で分娩が完了している動物を当該日分娩とし,その日を哺育0日とした.交尾確認後25日を経ても分娩しない場合は,非分娩雌とした.分娩した動物は新生児を生後4日(哺育4日)まで哺育させ,授乳,営巣,食殺の有無等の哺育状態を毎日観察した.母動物は剖検時に卵巣および子宮を摘出し,黄体数および着床数を検査した.これらの結果から,妊娠期間(妊娠0日から分娩完了日までの期間),出産率[(生児出産雌数/受胎雌数)×100],着床率[(着床数/黄体数)×100],分娩率[(総出産児数/着床数)×100]を算出した.
哺育0日に出産児数(出産生児数,死産児数),性別および外表異常の有無を検査した.その後は,一般状態,死亡の有無を哺育4日まで毎日観察した.哺育0および4日の生存児数から出生率[(出産生児数/総出産児数) ×100],新生児の4日の生存率[(哺育4日生児数/出産生児数)×100]を算出した.
生後0および4日に全生存児を個体ごとに測定した.
生後4日に全生存児の口腔を含む外表を検査した後,親動物と同様に安楽死させ,剖検した.死亡動物については10 %中性リン酸緩衝ホルマリン液に浸漬,固定した後,実体顕微鏡下で剖検した.
計量データについては,パラメトリックデータはBartlett法による等分散性の検定を行い,分散が等しい場合は一元配置分散分析を行った.分散が等しくない場合およびノンパラメトリックデータはKruskal-Wallisの検定を行った.群間に有意差が認められた場合はDunnett法またはDunnett型の多重比較を行った.計数データのうち尿検査および病理組織所見はa×bのx^2検定を行い,有意差が認められた場合はArmitageのx^2検定により対照群と各被験物質投与群間の比較を行った.その他の計数データはFisherの直接確率法により検定した.各検定の有意水準は5 %とした.新生児に関するデータは各母動物ごとに算出した平均値を標本単位とした.
死亡例は雌雄ともいずれの投与群においても認められなかった.
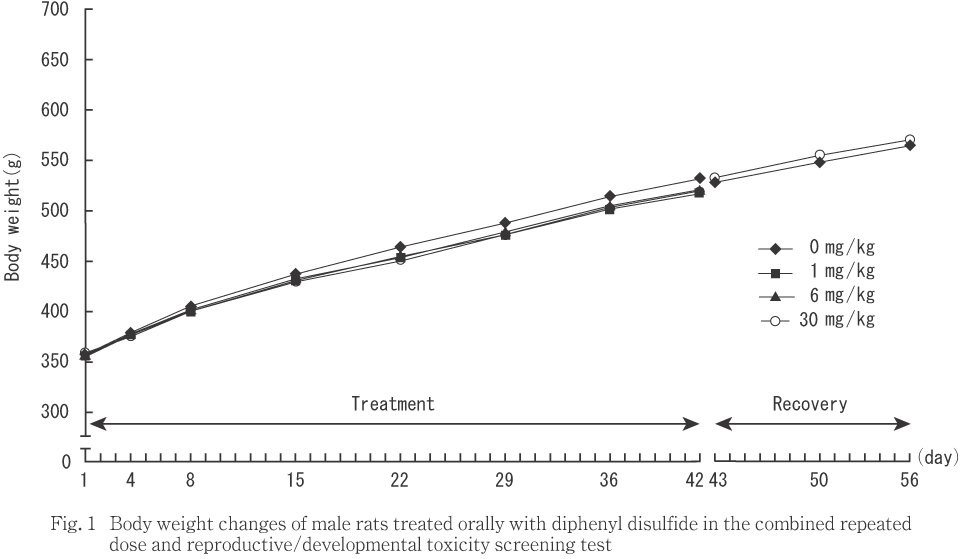
投与期間および回復期間の雌雄とも被験物質の影響と考えられる変化は認められなかった.
なお,30 mg/kg群の1例は分娩開始から完了まで約1.5日を要し,哺育0日(分娩完了日)には耳介,眼球等が蒼白化を示し貧血様の症状を呈し,翌日には全出生児が死亡したため瀕死期解剖とした.本動物は分娩困難な状態が継続した影響で貧血様を示し,その延長で正常な哺育行動を示すことができず,全出生児が死亡したものと考えられる.
詳細な症状観察,機能検査および自発運動量測定のいずれも被験物質の影響と考えられる変化は認められなかった.
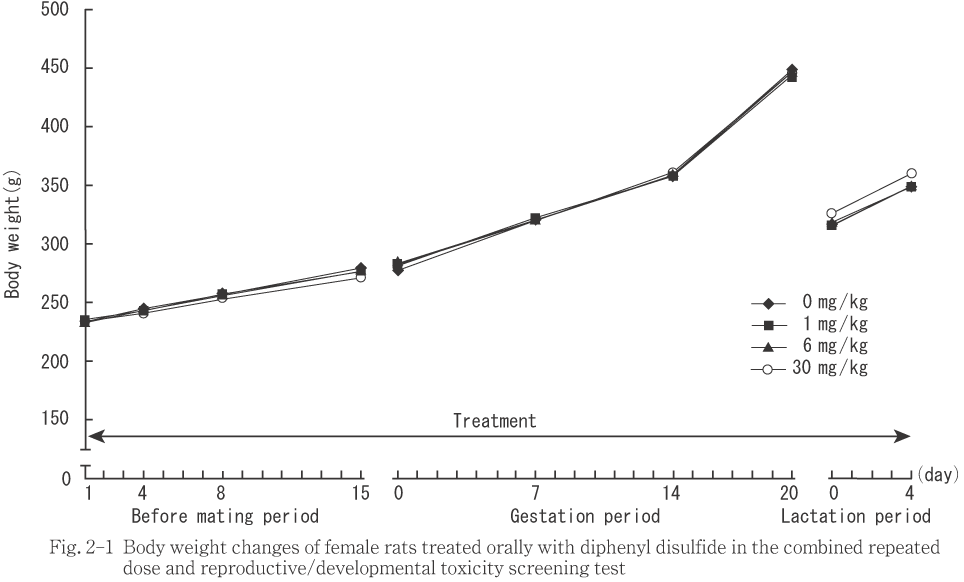
30 mg/kg群の雌で体重増加量が第4および15日に有意に低下した.雌サテライト動物では同群の体重は第22,29,36および56日,体重増加量では第29および36日に対照群と比べ有意に低下した.なお,母動物では妊娠および哺育期間とも対照群と被験物質投与群との間に有意な差は認められなかった.
対照群では第1日(投与開始前)より体重の重い動物が雌サテライト動物に偏った.また,雌サテライト動物の各測定日間の体重増加量をみると,30 mg/kg群の第4日に有意な低値,第50日に有意な高値を示したが,投与期間および回復期間を通して対照群と同程度の体重増加が認められた.これらのことから,30 mg/kg群で体重増加抑制を疑う変化がみられたが,投与開始前の体重の偏りによる差に起因するものと考えられ,被験物質の影響を示すものではないと判断した.

被験物質の影響と考えられる変化は雌雄とも認められなかった.
30 mg/kg群の雄で第29日の摂餌量が有意に増加したが,一過性の変化でわずかな増加であることから毒性学的に意義のない変化と考えられる.回復期間では変化は認められなかった.雌では,投与,妊娠および哺育期間ならびに回復期間のいずれにも変化は認められず,対照群と同様に推移した.
被験物質の影響と考えられる変化が,30 mg/kg群の雄では投与および回復終了後検査で,赤血球数およびヘモグロビン濃度の低値あるいは低値傾向,網赤血球数の高値が認められた.30 mg/kg群の雌では投与および回復終了後検査で,赤血球数の低値あるいは低値傾向,投与終了後検査で網赤血球数の高値傾向が認められた.なお,30 mg/kg群の雄では,回復終了後検査で平均赤血球血色素濃度の低値がみられたが,投与終了後検査では変化はなかった.
1および6 mg/kg群の雌雄とも対照群との間に有意な差は認められなかった.
被験物質の影響と考えられる変化が,30 mg/kg群の雄では投与終了後検査で総コレステロールの高値,グルコースの低値,さらに,回復終了後検査でも総コレステロールの高値が認められた.30 mg/kg群の雌では投与終了後検査で総コレステロール,総蛋白およびアルブミンの高値が認められた.
また,30 mg/kg群の雄の回復終了後検査でALPの低値,同群の雌の投与終了後検査でGOTの低値が認められたが,これらの変化は減少方向であることから,毒性学的意義に乏しい変化と考えられる.その他,1 mg/kg群の雄の投与終了後検査で総蛋白およびアルブミンの低値,30 mg/kg群の雄の回復終了後検査でアルブミンおよびA/G比の低値,同群の雌の回復終了後検査でクレアチニンの低値が認められた.これらは用量に関連のないことや,投与終了後検査ではみられていないことから,被験物質とは関連のない偶発的な変化と判断した.
6 mg/kg群の雄,1および6 mg/kg群の雌では対照群との間に有意な差は認められなかった.
各被験物質投与群とも,被験物質の影響と考えられる変化は認められなかった.
被験物質の影響と考えられる変化が肝臓,腎臓および脾臓で認められた.
雄の投与終了後検査では,30 mg/kg群の肝臓と腎臓,ならびに6 mg/kg群の腎臓に絶対および相対重量の高値が認められた.回復終了後検査では,30 mg/kg群の脾臓と腎臓に絶対および相対重量の高値が認められた.雌の投与終了後検査では,30 mg/kg群の肝臓と脾臓に絶対および相対重量,腎臓に相対重量の高値が認められた.回復終了後検査では変化は認められなかった.
その他,投与終了後の検査では6 mg/kg群の雄で心臓の相対重量の高値,回復終了後の検査では30 mg/kg群の雌で副腎の絶対重量の低値がみられた.しかし,雄の心臓は30 mg/kg群で変化がないこと,雌の副腎は投与終了後検査では変化がないことから被験物質と関連のないものと考えられる.
被験物質の影響と考えられる変化が雌雄の肝臓,雄の腎臓および雌の脾臓に認められた.
肝臓の腫大が投与後解剖動物の30 mg/kg群の雄2例,雌3例に認められた.回復後解剖動物では,この変化は認められなかった.腎臓の腫大が投与後解剖動物の1 mg/kg群の雄1例,6 mg/kg群の雄2例,30 mg/kg群の雄4例に認められた.回復後解剖動物でもこの変化は30 mg/kg群の雄2例に認められた.脾臓の腫大と暗赤色化が投与後解剖動物の30 mg/kg群の雌1例に認められた.回復後解剖動物ではこの変化は認められなかった.
瀕死期解剖動物では,肺の全葉にわたる直径1.0〜3.0 mmの褐色斑の散発,肝臓の白色斑(内側左葉に2つ),脾臓の腫大が認められた.
被験物質の影響と考えられる変化が雌雄の肝臓,脾臓,腎臓および雄の甲状腺,雌の大腿骨骨髄に認められた.
肝臓:小葉中心性肝細胞肥大が,投与後解剖動物の6 mg/kg群の雄4例,30 mg/kg群の雌雄全例に認められた.このうち,30 mg/kg群の雄全例,雌5例では中等度の変化を示した.この変化は回復後解剖動物では認められなかった.
脾臓(雄):ヘモジデリン沈着が,投与後解剖動物の30 mg/kg群全例で認められた.この変化は回復後解剖動物では30 mg/kg群1例のみに認められた.なお,ヘモジデリンは,ベルリンブルー染色で青染することによって確認した.この他,赤血球系髄外造血が投与後解剖動物の30 mg/kg群の1例で認められた.
脾臓(雌):中等度の赤血球系髄外造血が,投与後解剖動物の30 mg/kg群の5例で認められた.赤血球系髄外造血は,対照群および1 mg/kg群の各3例,6 mg/kg群の4例にも軽度に認められたが,30 mg/kg群の5例では程度が強かった.回復後解剖動物ではこの変化は認められなかったが,30 mg/kg群全例でヘモジデリン沈着が認められた.
大腿骨骨髄(雌):赤血球系造血細胞の増加が,投与後解剖動物の6 および30 mg/kg群の雌各4例に認められた.この変化は,回復後解剖動物では認められなかった.
腎臓(雄):近位尿細管上皮における硝子滴の軽度の発現が,投与後解剖動物の対照群の2例および1 mg/kg群の5例,中等度の発現が1 mg/kg群の2例,6 mg/kg群の5例および30 mg/kg群の2例,重度の発現が6 mg/kg群の1例および30 mg/kg群の5例に認められ,投与群では対照群に比べて発現程度が増強していた.回復後解剖動物では,この変化は対照群の1例および30 mg/kg群の2例に軽度に認められたのみで,発現程度の増強は認められなかった.また,好塩基性近位尿細管の軽度の発現が,投与後解剖動物の対照群の1例,1 mg/kg群の5例および6 mg/kg群の2例,中等度の発現が1 mg/kg群の1例,6 mg/kg群の4例および30 mg/kg群の5例,重度の発現が30 mg/kg群の1例に認められ,投与群では対照群に比べて発現程度が増強していた.回復後解剖動物においても,この変化は対照群で軽度の発現が1例だけに認められたのに対し,30 mg/kg群では軽度の発現が1例,中等度の発現が1例,重度の発現が3例に認められ,発現程度の増強が認められた.
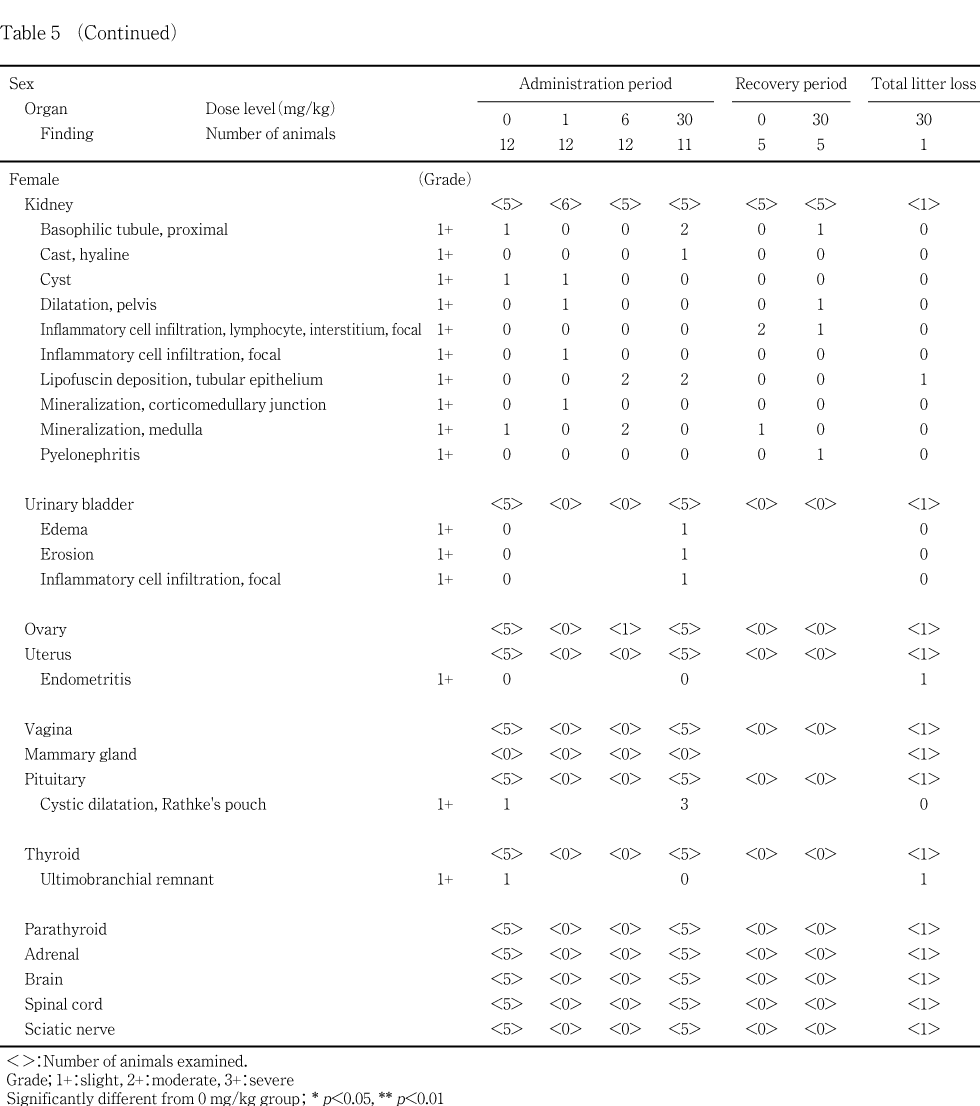
腎臓(雌):尿細管上皮のリポフスチン沈着が,投与後解剖動物の6および30 mg/kg群の各2例で認められた.この変化は回復後解剖動物では認められなかった.なお,リポフスチンはシュモール反応で青染することによって確認した.
甲状腺:濾胞上皮の肥大が,投与後解剖動物の30 mg/kg群の雄4例で認められ,うち1例では中等度の変化であった.この変化は回復後解剖動物では認められなかった.
瀕死期解剖(全出生児死亡)を行った30 mg/kg群の雌1例では,衰弱原因と考えられる変化として,子宮内膜炎,肺の血管周囲性の浮腫および出血を伴う炎症細胞浸潤,肝臓の炎症性細胞浸潤を伴う限局性肝細胞壊死が認められた.被験物質起因と判断したものと同質の変化として,脾臓の赤血球系髄外造血,大腿骨骨髄の赤血球系造血細胞の増加,肝臓の小葉中心性肝細胞肥大,腎臓のリポフスチン沈着が認められた.また,衰弱に関連する非特異的変化として,胸腺の萎縮が認められた.この他にもいくつかの変化が認められたが,ラットでは非特異的に発現する変化であることから偶発的変化と判断した.
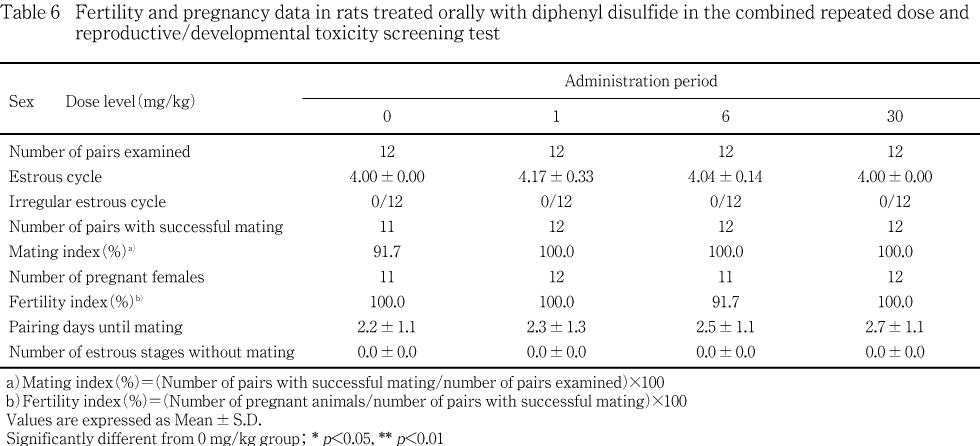
性周期検査では,4日周期を示した動物が対照群,1,6および30 mg/kg群でそれぞれ各群12例中,12,10,11および12例にみられ,被験物質投与による性周期の延長あるいは短縮は認められなかった.さらに,連続発情あるいは発情休止期の継続などの異常性周期を示す動物も認められなかった.
交尾は対照群の1対を除き各群の全例で成立し,交尾率,交尾所要日数,交尾成立までに逸した発情期の回数ともに被験物質投与群と対照群との間に有意差は認められなかった.非妊娠の動物は6 mg/kg群の1例にみられただけで,受胎率にも被験物質投与群と対照群との間に有意差は認められなかった.
交尾しなかった雌雄,非妊娠雌ならびに相手雄のいずれにも生殖機能に影響を及ぼすと考えられる生殖器の異常は認められなかった.
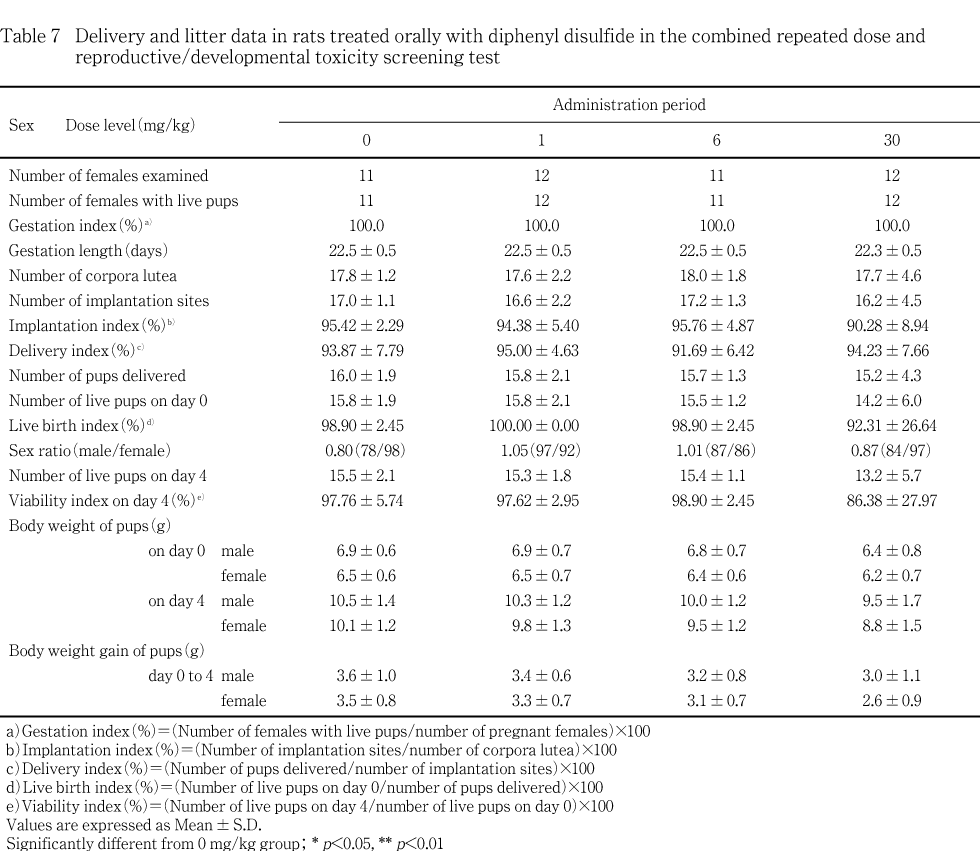
妊娠期間,黄体数,着床数,着床率,出生率および分娩率のいずれにも被験物質投与群と対照群との間に有意な差は認められなかった.
分娩開始から完了まで1.5日を要した動物が,30 mg/kg群の1例で認められた.哺育0日(分娩完了日)には娩出した児(雄2,雌10)のうち生存児は雄1例だけで,その後母動物は哺育行動を示さず,翌日には全出生児が死亡した.他の母動物に分娩および哺育行動の異常は認められなかった.
出産児数,出産生児数,性比,出生率および新生児の4日生存率ともに被験物質投与群と対照群との間に有意な差は認められなかった.一般状態の観察では,被験物質に起因する異常は認められなかった.また,対照群を含む各群で出産児の外表に異常は認められなかった.
雌雄の体重および体重増加量とも被験物質投与群に変化は認められなかった.
哺育4日の生存児の剖検および死亡児の剖検では,被験物質に起因する異常所見は認められなかった.
脾臓および大腿骨骨髄に対する影響として,脾臓重量の増加,脾臓の腫大と暗赤色化,病理組織検査では脾臓のヘモジデリン沈着および赤血球系髄外造血の増強が30 mg/kg群の雄あるいは雌でみられ,大腿骨骨髄の赤血球系造血細胞の増加が6 mg/kg以上の群の雌で認められた.骨髄における赤血球系造血細胞の増加は,出血,溶血性貧血,赤血球の酸素運搬能の低下あるいは赤血球寿命の短縮などで引き起こされる3).このような場合には,骨髄に加え脾臓においても髄外造血の発現がみられることが多い3).投与後解剖動物の雌の対照群,1および6 mg/kg群に認められた軽度の髄外造血は,妊娠・出産による髄外造血の亢進と考えられるが4),30 mg/kg群でみられた中等度の髄外造血は被験物質の影響によって増強した結果と考えられる.髄外造血は原因が除去されれば速やかに回復するとされている5)が,回復後解剖動物はいずれも非妊娠動物であるため,回復性は明らかではなかった.また,脾臓のヘモジデリン沈着は,溶血性貧血の際にしばしば認められる6)変化であり,被験物質により溶血性貧血を起こしている可能性が示唆された.造血系に関連すると考えられる血液学変化として,30 mg/kg群の雌雄で赤血球数の低値,雄でヘモグロビン濃度の低値,網赤血球数の高値など貧血を示唆する変化が認められた.被験物質が属する有機硫黄化合物のうち類似化合物であるジメチルジスルフィドをウサギの皮膚に投与した結果,上述の血液学変化と造血の亢進が認められている7).回復終了後の検査では,雌雄とも脾臓のヘモジデリン沈着が消失することはなかった.
肝臓に対する影響として,肝臓重量の増加,腫大および小葉中心性肝細胞肥大が30 mg/kg群の雌雄でみられ,組織変化は6 mg/kg群の雄でも認められた.肝臓の小葉中心性肝細胞肥大は種々の化学物質の投与によってしばしば発現する変化で,一般に薬物代謝酵素誘導による生体の適応性変化と考えられている8, 9).この変化は,投薬を中止することで軽減するとされており9),本試験でも,回復後解剖動物では認められなかった.血液生化学変化として,総コレステロールの高値およびグルコースの低値が30 mg/kg群の雄,総コレステロール,総蛋白およびアルブミンの高値が30 mg/kg群の雌で認められた.
腎臓に対する影響として,腎臓重量の増加が6 および30 mg/kg群の雄,30 mg/kg群の雌,腎臓の腫大が1 mg/kg以上の群の雄で認められた.組織学的には雄で近位尿細管上皮における硝子滴の発現,好塩基性近位尿細管の発現,雌で尿細管上皮のリポフスチン沈着が認められた.腎臓の尿細管上皮へのリポフスチン沈着は,種々の薬物投与によって発現する変化であり,シュモール反応で陽性を示す10, 11).腎臓の近位尿細管における硝子滴は蛋白物質が尿細管上皮に再吸収されることで発現し,特に雄ラットではa2 μグロブリンを含む硝子滴の発現が種々の化学物質によって増強することが知られている12).回復後解剖動物における硝子滴の発現状況は,対照群と被験物質投与群で差はみられず,速やかな回復が認められた.また,硝子滴の増強に伴い,尿細管上皮の細胞死や再生,修復が起こることが知られており12),本試験でも好塩基性尿細管の発現増強がみられた.特に,回復後解剖動物において病変の程度が増強していたが,硝子滴発現による尿細管上皮の傷害に対する再生像であり,回復に向かっていることを示す像であると考えられる.
甲状腺に対する影響として,濾胞上皮の肥大が30 mg/kg群の雄で認められた.甲状腺の濾胞上皮の肥大は,肝臓における酵素誘導に関連することが示唆されている13).本試験では肝臓の小葉中心性肝細胞肥大を伴って,その二次的影響により濾胞上皮の肥大がみられたものと考えられる.
被験物質に起因するこれらの病理組織変化は,いずれも2週間の回復期間により消失するか,変化がみられても発現頻度および病変程度が明らかに軽減していることから,2週間で回復もしくはその傾向を示しているものと判断された.
親動物の生殖機能への影響を示唆する変化は認められなかった.
全出生児死亡が認められた30 mg/kg群の母動物1例は,分娩困難な状況が続きその延長で正常な哺育行動を示すことができなかったものと考えられる.また,分娩困難に伴うと考えられる衰弱性の病理組織変化が認められた.妊娠動物では同じような状況の動物が稀にみられ,当研究所の過去10年間の背景データ(1994-2004)では全出生児死亡が3腹,分娩困難による母動物の死亡が1腹に認められている.また,本試験では他の母動物でも各検査において被験物質の影響がみられているが,本動物以外に分娩および哺育異常を示す母動物がいないことから,被験物質による異常とは考え難く,偶発的な変化の可能性が強いと考えられる.
この他,性周期,交尾率,受胎率,分娩率,妊娠期間,黄体数,着床数,着床率および出産率には被験物質に起因する変化は認められなかった.親雄動物には被験物質に起因する生殖機能への影響は認められなかった.
新生児の検査において出産児数,出産生児数,性比,出生率,新生児の4日生存率,外表,一般状態,体重および剖検のいずれにも被験物質に起因する変化は認められなかった.したがって,次世代の発育への影響はないと考えられる.
被験物質が属する有機硫黄化合物のうち類似化合物のジメチルジスルフィドをラットに吸入させ生殖発生毒性試験を行った結果,50 ppmで母体毒性が起こり,胎児の体重低下や骨化遅延が報告されている7).吸入試験による50 ppmが経口投与でどの程度の用量となるか不明であるが,本試験条件下では次世代への影響は認められなかった.
以上のように,ジフェニルジスルフィドを反復経口投与した結果,一般毒性学的な主な変化として30 mg/kg群の雌雄で貧血性の変化,それに対する生体の反応として脾臓および大腿骨骨髄の造血亢進が認められた.さらに肝臓および腎臓でも変化がみられ,特に腎臓では1 mg/kg群の雄で近位尿細管上皮における硝子滴発現の増強が認められた.これら投与期間で認められた変化は2週間の回復期間により消失するか,変化がみられても発現頻度および病変程度が明らかに軽減し,回復傾向を示しているものと判断された.生殖発生毒性に及ぼす影響は親動物ならびに新生児とも被験物質に起因する変化は認められなかった.したがって,本試験条件下における反復投与毒性に関する無影響量は雄で1 mg/kg/day未満,雌で1 mg/kg/day,生殖発生毒性に関する無影響量は雌雄の親動物ならびに児動物のいずれも30 mg/kg/dayと考えられる.
| 1) | 有機合成化学協会(編):「有機化合物辞典」講談社,東京(1985)p.428. |
| 2) | 平塚秀明ら:ジフェニルジスルフィドのラットを用いた経口投与による急性毒性試験.化学物質毒性試験報告,12:405-407(2005). |
| 3) | William F. Mackenzie,. Bone marrow. In メPathology of the Fischer ratモ, Gary A. Boorman, Scot L. Eustis, Michael R, Elwell, Charles A. Montgomery, Jr., William F. Mackenzie editors. San Diego, Academic Press(1990)pp.395-403. |
| 4) | Piersma AH, Verhoef A, Biesebeek J, Pieters MN, Slob W:Developmental toxicity of butyl benzyl phthalate in the rat using a multiple dose study design. Reproductive Toxicology, 14:417-425 (2000). |
| 5) | Greaves P. Haemopoietic and Lymphatic Systems. Spleen:Extramedullary haemopoiesis, In メHistopathology of preclinical toxicity studies, editor. 2nd. ed.モ Greaves P, Amsterdam, Elsevier (2000)pp.114-115. |
| 6) | 大滝サチ:造血器,非腫瘍性病変,造血臓器の色素沈着.In:「毒性病理組織学」前川昭彦(責任編集),日本毒性病理学会,名古屋(2000)pp.394-395 |
| 7) | Farr CH, Kirwin CJ.Jr. 加茂谷裕子(訳):有機硫黄化合物,メルカプタン.In:「化学物質毒性ハンドブックⅥ」内藤裕史,横手規子(監修),丸善,東京(2000)pp.3-18. |
| 8) | Gopinath C, Prentice DE, Lewis DJ, The liver: Morphological lesions in the liver. Hypertrophy. In: メAtlas of experimental toxicological pathologyモ, Gopinath C, Prentice DE, Lewis DJ, editors, Lancaster, MTP Press(1987)p.53. |
| 9) | Greaves P. Digestive system 2. Liver: Hepatocellular hypertrophy and hyperplasia. In: メHistopathology of preclinical toxicity studies, 2nd. ed.モ Greaves P, editor, Amsterdam:Elsevier (2000)pp.445-452. |
| 10) | 渡辺満利,西川秋佳:腎臓,非腫瘍性病変,色素沈着.In:「毒性病理組織学」前川昭彦(責任編集),日本毒性病理学会,名古屋(2000)p.252 |
| 11) | Greaves P. Urinary system. Kidney, Pigment droplets, In: メHistopathology of preclinical toxicity studies. 2nd. ed.モ Greaves P, editor, Amsterdam, Elsevier (2000)pp.579-580. |
| 12) | Greaves P. Urinary system. Kidney, Hyaline droplets, In: メHistopathology of preclinical toxicity studies. 2nd. ed.モ Greaves P, editor, Amsterdam, Elsevier (2000)pp.575-579. |
| 13) | Gopinath C, Prentice DE, Lewis DJ. The endocrine glands, Thyroid, In: メAtlas of experimental toxicological pathologyモ, Gopinath C, Prentice DE, Lewis DJ, editors, Lancaster, MTP Press(1987)pp.112- 113. |
| 連絡先 | |||
| 試験責任者: | 星野信人 | ||
| 試験担当者: | 佐藤ゆかり,藤代真弓,小山 隆 爰島洋子,豊田直人 | ||
| ㈱三菱化学安全科学研究所鹿島研究所 | |||
| 〒314-0255 茨城県鹿島郡波崎町砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | |||
| Authors: | Nobuhito Hoshino(Study director) Yukari Sato, Mayumi Fujishiro, Takashi Koyama, Hiroko Kokoshima, Naoto Toyota | ||
| Kashima Laboratory, Mitsubishi Chemical Safety Institute Ltd. | |||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-0255, Japan | |||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | ||