ジフェニルジスルフィドをOECD Test Guideline 423; Acute oral toxicity testに従って8〜8.5週齢のCrj: CD(SD)IGS系雌ラットに強制経口投与し,その急性毒性を検討した.投与用量は第一回投与用量を300 mg/kgとし,第二回,第三回および第四回投与用量はそれぞれ300,2000および2000 mg/kgとした.ジフェニルジスルフィドは0.5 w/v%トラガントゴム水溶液に懸濁調製し,投与前日の夕方から絶食したラットに10 mL/kgの投与容量で投与した.
300 mg/kg群では,死亡・瀕死期解剖動物は認められず,一般状態,体重および剖検で異常は認められなかった.
2000 mg/kg群では,第4日以降に削痩,横臥位,円背位,自発運動の低下,緩徐呼吸あるいは体温低下が認められた.また,第1日から第8日に体重減少が認められた.その結果,第8日から第 10日にかけて同群の1例が死亡し,2例を瀕死期解剖した.死亡・瀕死期解剖動物の剖検では,腺胃の出血,前胃の隆起巣と壁の肥厚,胸腺の小型化,脾臓の小型化と暗赤色化,結腸の膨満,副腎の腫大,空腸の異常内容物および膀胱の着色尿(黄色)貯留が認められた.第15日まで生存した動物では,異常症状は第14日までに消失し,体重は第8日以降増加した.また,生存動物の剖検では,前胃の隆起巣および胸腺の小型化が認められた.
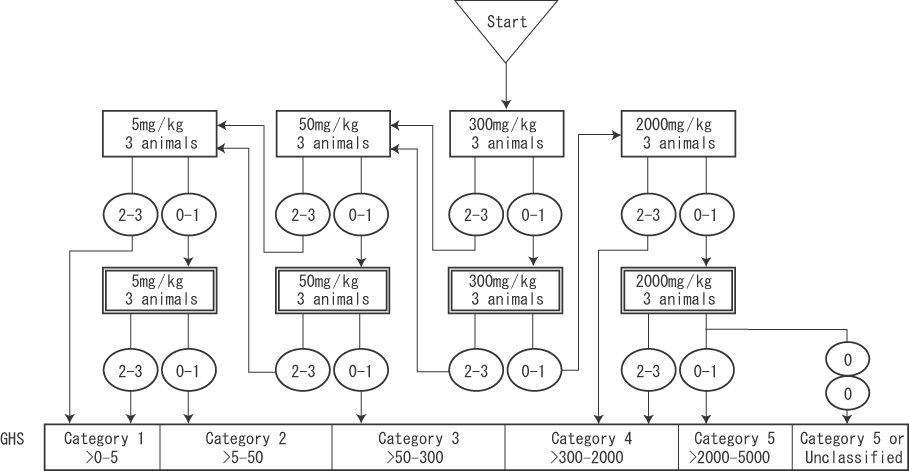
以上,ジフェニルジスルフィドを雌ラットに単回経口投与した結果,2000 mg/kg群で1/6例が死亡し,2/6例を瀕死期解剖した.従って,本試験条件下におけるジフェニルジスルフィドはGHS(Globally Harmonized Classification System)の基準でCategory 4(>300-2000 mg/kg)と分類された.
Aldrich Chemical(USA)から提供されたジフェニルジスルフィド(純度:99.8 %,ロット番号: 15322AB)を冷蔵,暗所,気密条件下で保存し,使用した.
被験物質を0.5 w/v%トラガントゴム水溶液(トラガントゴム;和光純薬工業)に懸濁して投与液を用時調製した.
日本チャールス・リバーからCrj:CD(SD)IGSラット(SPF)を入手後,5日間検疫・馴化し,その後投与日まで馴化した.各投与につき,動物数は雌3匹とし,投与前日に無作為に抽出・選抜した.投与日の週齢は8〜8.5週齢,体重範囲は186〜210 gであった.
検疫・馴化期間を含む全飼育期間を通じて,温度19.0〜25.0℃(許容範囲),相対湿度35.0〜75.0 %(許容範囲),換気6〜20回/時(オールフレッシュエアー供給),照明12時間/日(7:00-19:00)に自動調節した飼育室を使用した.
動物は,実験動物用床敷(ベータチップ,日本チャールス・リバー)を敷いたポリカーボネート製ケージに,動物選抜前は1ケージあたり4匹以下,動物選抜後は1ケージあたり3匹収容し,飼育した.
動物には,実験動物用固型飼料(MF,オリエンタル酵母工業)と,5 μmのフィルター濾過後,紫外線照射した水道水をそれぞれ自由に摂取させた.
被験物質製造者(Aldrich Chemical,USA)のMSDS (Material Safety Data Sheet)にマウスのLD50(腹腔内投与)が100 mg/kgとのデータがある.よって,本試験の第一回投与用量は300 mg/kgとし,下図のフローチャートに従って試験を開始した.
投与前日の夕方から約18時間絶食させたラットに胃ゾンデを装着したディスポーザブルシリンジを用いて投与した.投与終了後約3時間は飼料を与えなかった.投与液量は10 mL/kgとし,投与直前に測定した体重に基づいて算出した.
第一回投与用量である300 mg/kgの投与の結果,死亡は認められなかった.そのため,第二回投与用量を300 mg/kgとした.第二回投与の結果,死亡は認められなかった.そのため,第三回投与用量は2000 mg/kgとした.第三回投与の第3日まで(第4日までの死亡・瀕死期解剖動物の有無で第四回投与の投与量を判断した),死亡・瀕死期解剖動物が認められなかったため,第四回投与用量は2000 mg/kgとした.なお,第三回投与の結果,第8日に1例を瀕死期解剖,第9日に1例が死亡した.以下に実際の流れを示した.
生死および一般状態を投与日には投与後10分,30分,1,3および6時間の5回,その後は1日1回,14日間観察した.体重は,全生存動物について投与直前,第4,8および15日に測定した.また,各測定日間の増加量を算出した.死亡動物は発見時に剖検した.瀕死期解剖例および生存動物は,それぞれ瀕死期解剖決定時および観察終了時(第15日)にチオペンタールナトリウム麻酔下で放血し,安楽死させた後剖検した.

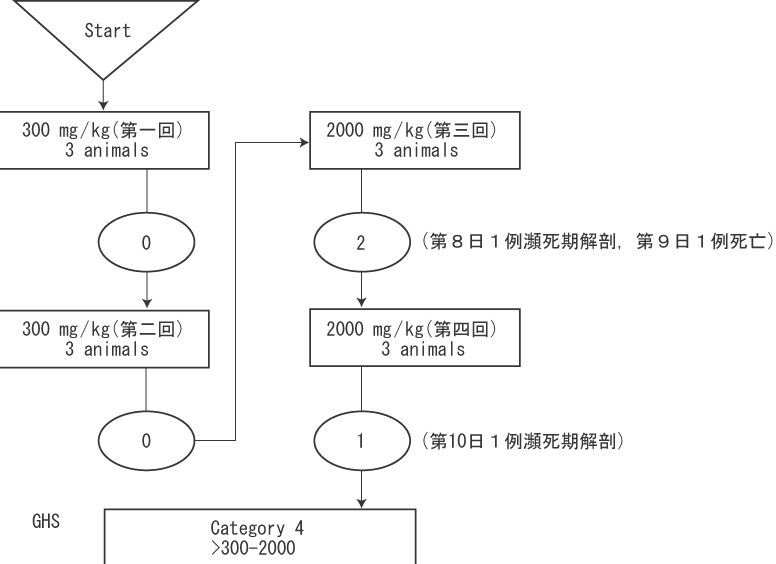
300 mg/kg群では死亡は認められなかった.2000 mg/kg群では,第三回投与の第8日に1例を瀕死期解剖,第9日に1例が死亡し,第四回投与の第10日に1例を瀕死期解剖した.
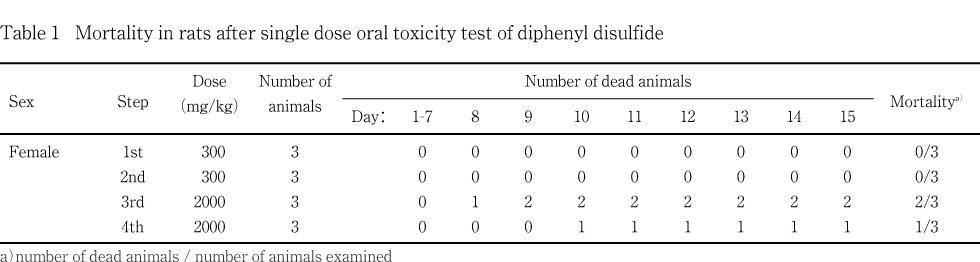
2000 mg/kg群では,削痩,横臥位,円背位,自発運動の低下(第三および第四回投与で共通),緩徐呼吸(第三回投与)および体温低下(第四回投与)が認められた.これらの症状は第4日以降に発現した.これらの症状が発現した後,上記の通り同群の1例が第9日(第三回投与)に死亡し,2例(第三回および第四回投与の各1例)を第8および10日に瀕死期解剖した.第15日まで生存した3例(第三回投与1例,第四回投与2例)の症状は,第14日までに消失した.
300 mg/kg群では,被験物質に起因した異常は認められなかった.
2000 mg/kg群の体重および体重増加量は,第1〜4日および第4〜8日に体重減少または増加抑制を示した.第15日まで生存した動物は,第8日まで体重減少を示したが,第8日以降体重は増加し,第8〜15日の体重増加量は300 mg/kg群よりも高値を示した.
300 mg/kg群の体重は順調に増加した.
死亡・瀕死期解剖例(死亡1例,瀕死期解剖2例)では,胸腺および脾臓の小型化が全例,脾臓の暗赤色化が1例,腺胃の限局性出血が全例,前胃の隆起巣が2例,前胃の壁の肥厚,結腸の膨満,空腸の異常内容物(タール様),膀胱の着色尿(黄色)貯留がそれぞれ1例,副腎の腫大(両側)が2例に認められた.
2000 mg/kg群の生存例(3例)では,胸腺の小型化が1例,前胃の隆起巣が全例に認められた.
300 mg/kg群では,異常は認められなかった.
ジフェニルジスルフィドを300または2000 mg/kgの用量で雌ラットに単回経口投与した.
その結果,2000 mg/kg群で第4日以降に削痩,横臥位等の諸症状が発現し,体重が減少した.第8日から第10日にかけて同群の1例が死亡し,2例を瀕死期解剖した.死亡・瀕死期解剖動物の剖検では,全例で腺胃の出血,前胃の隆起巣あるいは肥厚が認められ,被験物質の胃粘膜への刺激性が示唆された.これらの胃の傷害性変化が,死亡あるいは衰弱の原因と考えられた.死亡・瀕死期解剖動物では,胃の変化の他に衰弱あるいはストレスに起因すると考えられる胸腺および脾臓の小型化あるいは副腎の肥大等の変化が認められた.第15日まで生存した動物では,上記の症状の発現および体重減少が認められたが,症状は第14日までに消失し,第8日以降体重は増加した.生存動物の剖検では,前胃の隆起巣および胸腺の小型化が認められた.
以上,ジフェニルジスルフィドを雌ラットに単回経口投与した結果,2000 mg/kg群で1/6例が死亡し,2/6例を瀕死期解剖した.従って,本試験条件下におけるジフェニルジスルフィドはGHSの基準でCategory 4(>300-2000 mg/kg)と分類された.
| 連絡先 | |||
| 試験責任者: | 平塚秀明 | ||
| 試験担当者: | 大塚直美,松本和代 | ||
| ㈱三菱化学安全科学研究所鹿島研究所 | |||
| 〒314-0255 茨城県鹿島郡波崎町砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | |||
| Authors: | Hideaki Hiratsuka(Study director) Naomi Outsuka, Kazuyo Matsumoto | ||
| Kashima Laboratory, Mitsubishi Chemical Safety Institute Ltd. | |||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-0255, Japan | |||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | ||