2-エチル酪酸について,マウスを用いる小核試験を実施した.
用量設定試験結果をもとに,BDF1系雄マウスに500, 1000および2000 mg/kgの3用量を1日1回2日間連続して強制経口投与し,最終投与後24時間に骨髄塗抹標本を作製し,検鏡することにより小核誘発性を検討した.
2-エチル酪酸投与による小核を有する多染性赤血球の誘発傾向は認められなかった.全赤血球中の多染性赤血球の割合については,陰性対照と比較し減少傾向が認められ,骨髄が被験物質により暴露されたものと推察された.
以上の結果より,本試験条件下では2-エチル酪酸は,小核を誘起しない(陰性)と結論した.
試験には,日本エスエルシーから購入した8週齢のBDF1系マウス(C57BL/6×DBA/2,SPF)を,7日間検疫と馴化を兼ねて飼育した後,9週齢で試験に供した.
温度24.5±2.5℃,湿度55±20 %,換気回数1時間あたり18回,照明12時間(午前7時点灯,午後7時消灯)に設定した飼育室で動物を飼育した.床敷きとして,アルファドライ(Shepherd Specialty Papers)を入れたZyfone製飼育ケージに,検疫期間中は2匹,群分け後は3匹ずつ収容し,固型飼料(MF:オリエンタル酵母工業)と水道水(福田町上水道給水)を自由に摂取させた.
被験物質の2-エチル酪酸(ロット番号:01-20704)は純度99.9 %の無色透明の液体である.本剤は水に0.22 %可溶,アルコール,エーテルに可溶である.チッソ(東京)から提供された被験物質を使用した.被験物質は,使用時まで冷蔵,遮光で保管した.試験終了後,被験物質提供元において残余被験物質を分析した結果,安定性に問題はなかった.
1回目の投与直前に,被験物質をトウモロコシ油(ナカライテスク)を用いて溶解し,調製原液とした.調製原液を使用媒体を用いて順次所定濃度に希釈し,投与初日用ならびに投与2日目用に小分けした.投与初日用は調製後速やかに投与し,投与2日目用の調製液は冷蔵(4℃)にて保存し,翌日の投与に用いた.
1024〜2000 mg/kgの4用量(公比1.25)を用い,雄雌両性のマウスを用いて用量設定試験を実施した.その結果,雄雌とも2000 mg/kg群で明確な体重の減少が観察されたが,すべての用量で雄雌とも死亡例は認められなかった.
以上の結果から,本試験では2000 mg/kgを最高用量とし,以下1000および500 mg/kg(公比2)の3用量および陰性対照群を設定した.また,雄雌の毒性発現に顕著な差が認められなかったため小核試験は雄のみで実施することとした.
なお,陽性対照として,マイトマイシンC(MMC:協和醗酵工業)を2 mg/kgの用量で試験した.
いずれの試験群とも6匹に投与し,そのうちの5匹を評価に使用した.
被験物質の投与経路は経口とし,ディスポーザブルシリンジとテフロン製ゾンデを用いて1日1回,24時間間隔で2日間連続強制投与した.陽性対照物質の場合は腹腔内投与とし,マイクロシリンジと25G注射針を用いて1回投与した.
投与容量は体重10 g当たり0.1 mLとし,群分け時の体重から投与液量(mL)を求めた.
用量設定試験では,動物搬入時,検疫期間終了時(群分け時)および最終投与後24時間に電子天秤(PG802-S:Mettler Toledo AG)を用いて体重を測定した.初回投与後0.5,2,4および24時間ならびに最終投与後0.5,2,4および24時間に動物の一般状態を観察した後,各用量の最終投与後24時間での生存率を求めた.
小核試験では,動物搬入時,検疫期間終了時(群分け時)および標本作製直前に電子天秤PG802-SあるいはPG2002(Mettler Toledo AG)を用いて体重を測定した.標本作製直前に,動物の一般状態を観察した.なお,陰性対照および被験物質投与群については,初回投与後1,21,24時間,最終投与後2,19時間ならびに標本作製時に,陽性対照群については,投与後2,19時間ならびに標本作製時に一般状態の観察を実施した.
Schmidの方法1,2)に従い,骨髄塗抹標本を作製した.最終投与後24時間(陽性対照群は投与後24時間)に動物を炭酸ガス吸入法で安楽死させた.大腿骨を摘出し少量の非働化(56℃,30分)済みウシ胎児血清(Invitrogen)を用いて骨髄細胞を洗い出し,遠心分離法(トミー精工LC-122:190×g,5分間)により余剰血清を除いた後,各動物につき2枚の塗抹標本を作製した.十分に乾燥させた塗抹標本を99.8 %メタノールで固定した後,3 %ギムザ液(Merck KGaA)で30分間染色した.1/100 mol/L ナトリウム・リン酸緩衝液(Merck KGaA:pH 6.8)および精製水で洗浄し,乾燥させた.さらに0.001 %クエン酸水溶液および精製水で洗浄した後,再び乾燥させた.
全ての標本をコード化した後,小核を観察した.
動物1匹当たり2000個の多染性赤血球(Polychromatic erythrocyte:PCE)を顕微鏡下(×1000程度)で観察した.小核を有する多染性赤血球(Micronucleated polychromatic erythrocyte:MNPCE)数を計測するとともに,骨髄に対する影響を調べるため全赤血球500個中の多染性赤血球数についても計測した.
小核の出現頻度は,小核を有する多染性赤血球数を観察した多染性赤血球数で割ることにより算出した.全赤血球に対する多染性赤血球の割合は,多染性赤血球数を観察した赤血球数で割ることにより算出した.
各試験群の小核を有する多染性赤血球の出現頻度は条件付き二項検定(Kastenbaum and Bowmanの推計学的方法:有意水準0.05)を用い,また,観察赤血球中の多染性赤血球の割合についてはDunnettのt-検定法を用いて有意差(有意水準0.05)を判定した.
陰性対照群と比較し,被験物質処理群あるいは陽性対照群において統計学的な有意差が認められた場合,陽性と判定した.
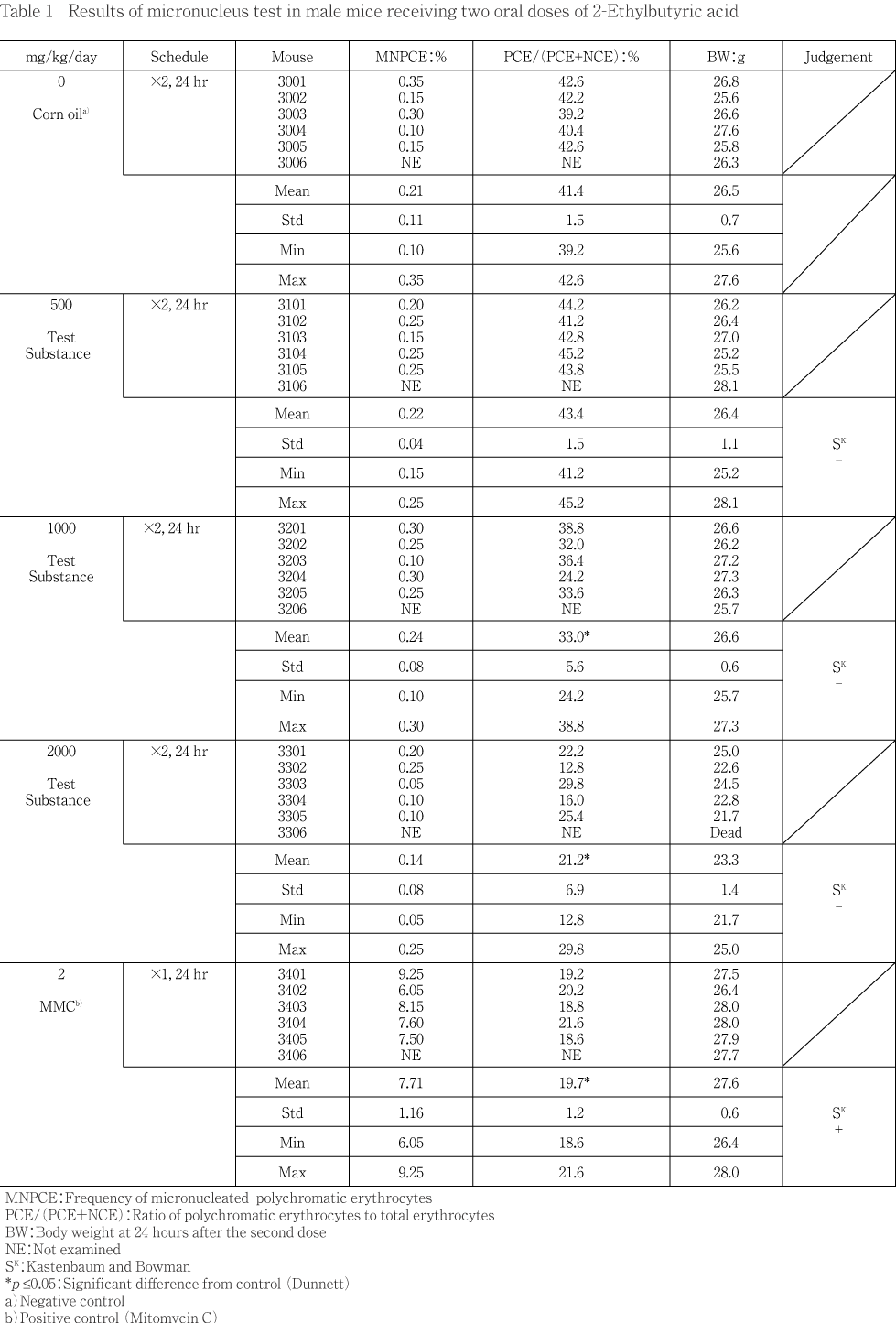
小核試験の結果をTable 1に示した.2-エチル酪酸処理群の場合,2000 mg/kg群で明確な体重減少傾向が観察された.また,最終投与後19時間に1例の死亡が確認されたほか,自発運動減少が3例に,立毛が2例に認められた.個体別に多染性赤血球2000個を観察した結果,陰性対照群での小核(MNPCE)の出現頻度は0.21 %であった.また,全赤血球中における多染性赤血球の割合(PCE比)は41.4 %であった.2-エチル酪酸投与によるMNPCEの出現頻度は,500 mg/kg群で0.22 %,1000 mg/kg群で0.24 %および2000 mg/kg群で0.14 %であり,陰性対照群と比較して統計学的に有意な増加は認められなかった.また,被験物質の骨髄細胞に対する影響の指標であるPCE比は,500,1000および2000 mg/kg群でそれぞれ43.4,33.0(p<0.05)および21.2 %(p<0.05)であり,陰性対照群と比較して統計学的に有意な減少傾向が認められ,骨髄が被験物質に暴露されたものと推察された.
一方,MMCを投与した陽性対照群ではMNPCEの出現頻度は7.71 %と明確に増加し,陰性対照群に比べ統計学的に有意(p<0.05)な増加を示した.さらに,PCE比は19.7 %(p<0.05)に減少しており,骨髄細胞の分裂抑制作用が確認された.
以上の試験結果から,本試験条件下において2-エチル酪酸のマウスに対する小核の誘発性は陰性と判定された.このことより,本物質の染色体異常ないし紡錘体形成阻害誘発性はないものと推定された.
なお,本被験物質(2-エチル酪酸)について,細菌を用いる復帰突然変異試験で陰性3),CHL細胞を用いた染色体異常試験で陽性3)との報告があったが,発がん性に関する報告はなかった.
類縁体である酢酸ブチル(N-butyl acetate),酪酸(butyric acid),イソ吉草酸エチル(ethyl isovaletate)およびギ酸イソアミル(isoamyl formate)は細菌を用いる復帰突然変異試験で陰性4),また,氷酢酸(glacial acetic acid),酪酸および乳酸(lactic acid)はCHL細胞を用いた染色体異常試験の連続処理法で陰性5)との報告があった.
| 1) | Schmid W:The micronucleus test. Mutation Res, 31:9-15(1975). |
| 2) | Schmid W:The micronucleus test for cytogenetic analysis. In メChemical Mutagensモ, Vol. 4, Hollaender A(ed.), Plenum press, New York(1976) pp. 31-53. |
| 3) | 榎本佳明ら:2-エチル酪酸の細菌を用いる復帰変異試験.化学物質毒性試験報告,9:90-97 (2002). |
| 4) | 石館基(監修):「微生物を用いる変異原性試験データ集」,エル・アイ・シー,東京(1991)pp.70-71, pp.84-85, pp.234-235, pp.324-325. |
| 5) | 祖父尼俊雄(監修):「染色体異常試験データ集〈改訂1998年版〉」,エル・アイ・シー,東京(1999) pp.28-29, p.99, p.300. |
| 連絡先 | |||
| 試験責任者: | 中嶋 圓 | ||
| 試験担当者: | 古屋有佳子,春田由美江, 柴本美恵子,鈴木ゆみ子, 赤星まゆみ,仲村渠奈美子, 鈴木雅也 | ||
| 7食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田郡福田町塩新田582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | |||
| Authors: | Madoka Nakajima(Study director) Yukako Furuya, Yumie Haruta, Emiko Shibamoto, Yumiko Suzuki, Mayumi Akahoshi, Namiko Nakandakari, Masaya Suzuki |
||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-pyo Center) |
|||
| 582-2 Shioshinden, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan |
|||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | ||
