��2,6-������륢�˥��������ˤĤ��Ƥϡ���åȤ�ޥ����ˤ�����и�LD50�ͤ�705-840 mg/kg1)�ǡ���åȤˤ�����ȿ����Ϳ������Ǵ�¡����¡�����¤���Ϥ��Ф���ƶ��������������ɡ�о�������𤪤���������ͭ�դ����ä�ǧ���줿�Ȥ������2)�Ϥ��뤬��ɬ�פ��Ľ�ʬ�ʾ����������ޤ�������ȯ�������ˤĤ��Ƥ����Ϥߤ��ʤ�����ʪ���ΰ����ΤǤ���2,3-3)��2,4-(̤ȯɽ)�����3,4-4)�ˤĤ��Ƥϡ���åȤˤ�����ȿ����Ϳ�����˴ؤ���ܺ٤���𤬤ߤ�졤�Ϸ����Ϸ줪���¤�����ȿ����Ѳ�����¡����ӿ�¡���Ф���ƶ��ʤɤ�ȯ�����Ƥ��롥
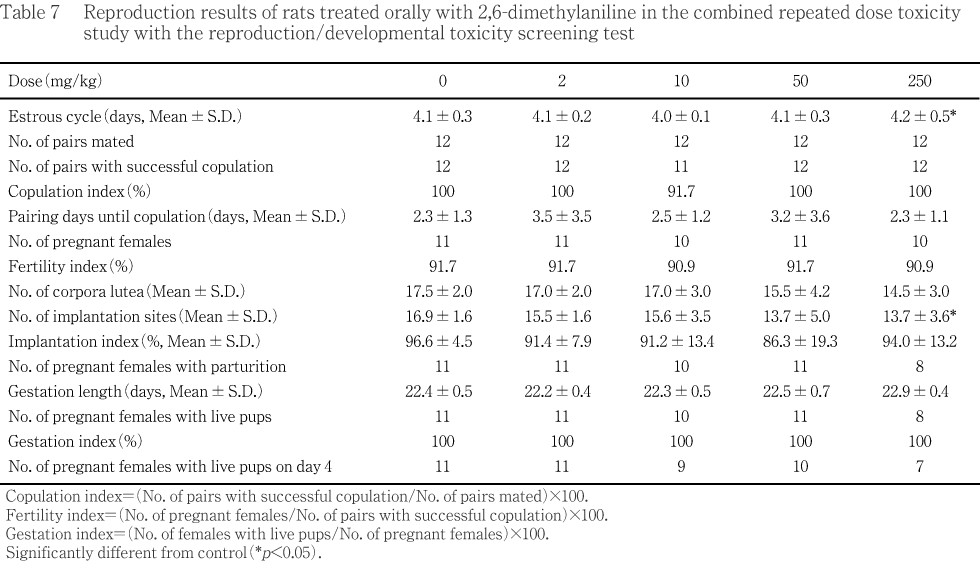
������2,6-������륢�˥��ˤĤ��ơ�SD��[Crj: CD(SD)IGS]��åȤ��Ѥ���0(����)��2, 10, 50�����250 mg/kg���̤ǡ����۳���14�������顤ͺ��42���֡����ʬ�ڸ�Ӯ��4���ޤǷи���Ϳ������ưʪ���ϡ�1����ͺ��12ɤ����Ϳ���ֽ�λ���˻���5���Ȥ���������ˡ�ͺ�ˤĤ��Ƥϡ�12ɤ����5ɤ�����̤����оȤ����250 mg/kg���̤β������Ȥ�����ˤĤ��Ƥ�1����ͺ��5ɤ���оȤ����250 mg/kg���̤α��������ߤ��ơ�14���ֲ����������ꤷ����
��250 mg/kg���ˤ����ơ���ͺ����Ϳľ��ΰ������ή����ȯ��ư�㲼�����۲��⡤���Ϥ���Ӽ�ȯ��ư�̤������¤Ӥ��ν�����������ǧ���줿�����3ɤ�ϡ���˰��̾��֤����������λ���֤Ȥʤä����������˻�������ͺ��Ǣ�����Ǥϡ�Ǣ�̤����ä���Ӥ���ˤ��Ǣ��š��ʥȥꥦ�ࡤ���ꥦ�ࡤ����ѥ�����ӥ��ȥ���ǻ�٤������¤Ӥ�pH���㲼��ǧ���줿����ճظ����Ǥϡ���ͺ�˥�ȥإ⥰���ӥ�ǻ�٤����á�ͺ���ַ�������ӷ쿧��ǻ�٤θ����¤Ӥ��־��ַ��������ä�ǧ���졤ͺ��ʿ���ַ�����ѤϹ��͡�ʿ���ַ��쿧��ǻ�٤����ͤ�������������ظ����Ǥϡ�ͺ��̵���������á����GOT�����ӥ��ӥ�������쥹�ƥ���������ä�ǧ���줿���ﴱ���̤Ǥϡ���ͺ�˿�¡��ͺ�˴�¡����˹þ����Τ���������н��̤������¤Ӥ�ͺ���¡�����Ф�������н��̤����ä�ǧ���줿�������ȿ��ظ����Ǥϡ���¡�δκ�˦���礬��ͺ�ˡ���¡�ι�������Ǣ�ٴɤ����÷����������Ƭ���ब��ͺ�ˡ����Ǣ�ٴɾ���ξ˻�ũ���ä����������줬ͺ�ˡ�Ǣ�ٴɤΤӤޤ�����ĥ����ˡ��¡�Υإ⥸�ǥ���������ä���ͺ�ˡ���¤������÷�����ͺ��ǧ���줿��50 mg/kg���Ǥϡ���ͺ����Ϳ����μ�ȯ��ư�㲼����Ӵ�¡�δκ�˦�����㤬������˻�ˤ������쥹�ƥ���������ä�ǧ���줿���������ˤ����Ƥϡ��︳ʪ������Ϳ�ˤ���Ѳ��ϲ������뤤�ϲ������������ĵ�Ū�Ǥ��뤳�Ȥ���ǧ���줿��
���ʾ�η�̤��顤2,6-������륢�˥��Υ�åȤؤ�ȿ���и���Ϳ�ˤ�ꡤ��˷�ա���¡����¡������¡�ʤɤ��Ф��������ƶ���ǧ���줿��̵�ƶ���(NOEL)�ϡ���ͺ�Ȥ�10 mg/kg/day �ȷ������줿��
��ͺ��ưʪ������ǽ���Ф��������ƶ���ǧ����ʤ��ä������ưʪ�ˤĤ��Ƥϡ�250 mg/kg���Dz��ο������ͷ�����ǧ���졤 �徲����ͭ�դ����ͤ�������ưʪ��ȯ�����Ф���ƶ��ˤĤ��Ƥϡ�250 mg/kg�������л����������ͷ����ˤ��ꡤ��������ͭ�դ����ͤ�����
���������äơ�ͺ��ưʪ������ǽ���Ф���̵�ƶ��̤�250 mg/kg/day�����ưʪ������ǽ����ӻ�ưʪ��ȯ�����Ф���̵�ƶ��̤ϡ��������50 mg/kg/day�ȷ������줿��
��ưʪ�ϡ�SD�ϡ�Crj:CD(SD)IGS����åȤ����ܥ��㡼�륹����С�(������)�������������ͺ�Ȥ�13���ָ��֤��ͤƻ�Ķ����벽���������δ֤˻�ˤĤ��Ƥ�紹������ˤ���������γ�ǧ��Ԥ���10����ǻ�˶�������1����ưʪ���ϻ�ͺ��12ɤ�Ȥ�����Ϳ���ֽ�λ���˻���5���Τۤ����оȷ�����Ӻǹ����̷��ˤĤ��Ƥϡ�ͺ��12ɤ����5ɤ�����̤����оȤ����250mg/kg���̤β������Ȥ������1����ͺ��5ɤ���оȤ����250mg/kg���̤α��������ߤ��Ʋ������Ȥ���14���֤β������֤��ߤ������ʤ�����β������ˤĤ��Ƥϸ��ۤ�Ԥ�ʤ��ä�����ʬ���ϡ���Ϳ�����������νŤ˴�Ť��ز�̵������ˡ�ˤ��Ԥʤä�����Ϳ���ϻ����νŤ�ͺ��326��416g�����200��249g�Ǥ��ä�����åȤϡ�����21.2��25.4��,����47��63%�����椷�����鼼�ǡ����֥������˸����̤˼��Ƥ����Ƿ�����[���MR���ȥå���������������]����ӿ��ͳ���ݼ褵���ƻ��餷������������������ǧ��λ�ϡ��������[�ۥ磻�ȥե졼�������ܥ��㡼�륹����С�]�����줿�ݥꥫ���ܥ͡������������˼��Ƥ�����
����Ϳ���֤���Ӥ����³��14���֤β������֤��̤��ơ� ưʪ������, ����, ��ư�ʤɤ������ѻ�������
����Ϳ������������Ӥ��θ�Ͻ�1��ưʪ�ݥ�������Ф�������ӥ��������Υ�����������ץ�ե������(370 W��560 D��40 Hmm)�ǡ�����������νФ��פ�������������Ф����ΰ����פ����ζ���ĥ(�дˡ���ľ)������(��)�����¤ߡ�Ω�ӡ���ʬ��ʪ�������ĺ����֡�����ͽС�ή�ޡ���ɡʬ��ʪ(����)��ή����ʢ�����Ӥ�Ǣ�ˤ����졤������Ϥ��ؤˤ����졤ȯ�����Ƶۡ���������ڻ�����õ����ư(������)���ٲ�������ȯ��ư(��ư��)�����(����)���۾��ư(���������������Ԥʤ�)����Ʊ(���٤���������ȿ������ư�ʤ�)���ռ�����(���¡�������ץ���������)���ͻ�ڶ�ĥ�١���Ǣ�������ʵ��29���ܤˤĤ��ƴѻ�������
��ͺ�Ϻǽ���Ϳ�������Ӯ��������1�ޤ��������λ�ͺ�Ϻǽ���Ϳ������Ӳ������ֽ�λ���ˡ�İ��ȿ�������ȿ��������ȿ��������ȿ�͡��˳�ȿ����Ʒ��ȿ�͡�Ʊ¦����ȿ�͡�����ȿ�ͤ��������ȿ�ͤ�Ĵ�٤���
��ͺ����Ϳ41�������Ӯ��������1�ޤ��������λ�ͺ�Ϻǽ���Ϳ������Ӳ���13���ˡ����ϳ�����(����Ϥ��ɤꡤ30 cm�ι⤵������Ȥ��������פ�����¬��)�����褪��Ӹ��ΰ���(��åȡ��ޥ����Ѱ���¬�����֡�MK-380R/FR����Į����)�¤Ӥ�ͺ��30ʬ�֤����60ʬ�֡����30ʬ�֤μ�ȯ��ư��(��ȯ��ư��¬�����֡�SUPERMEX����Į������¬��������ζ��֤�60ʬ�֤ˤ������ư�����¬��)��¬�ꤷ�����������λ�μ�ȯ��ư�̤ϡ�60ʬ�֤�¬�ꤷ����
���νŤϡ���1����˻�����¬�ꤷ�����ݱ��̤�, �轵1��1��(24����)�λ��������̤�¬�ꤷ����
����ˤĤ��ơ��벽�����ִ��֤˰���³������������ǧ�����ޤǡ�Giemsa�����ˤ��紹�����ɸ�ܤ�������������ˤ���������ʳ���Ƚ���Ԥä���ʿ���������ϡ��Ѳ���˦�Τߤ����ߤޤ��Ͻ������ˤߤ���ȯ������������������ʿ���ͤȤ�����
����Ϳ15���θ��ˡ�ͺ�Υ�������Ʊ�췲��λ������(1��1)����������ǧ�����ޤ�14���֤���٤Ȥ���Ϣ³Ʊ�蘆�����������γ�ǧ����ī�������˹Ԥ������������뤤��紹�������Ҥ���ǧ���줿����ǥ��0���Ȥ�����ʬ�ھ��֤δѻ���Ʊ������˹Ԥ���1ʢ���Ȥ�ʬ�ڤν�λ����ǧ���줿����Ӯ��0���Ȥ��������ۤ����ʬ�ڤδѻ���̤��顤�Ʒ��ˤĤ��Ƹ���Ψ(%)[(����ưʪ��/Ʊ��ưʪ��)��100]������Ψ(%)[(���ۻ��/������Ω���)��100]����ӽл�Ψ(%)[(�����л����/ǥ�����)��100]�¤Ӥ�ʬ�ڤ���ǧ���줿��ˤĤ���ǥ������(ǥ��0������ʬ�ڤ���ǧ���줿���ޤǤ�����)���ꤷ������α������ϡ����ۤ�Ԥ�ʤ��ä���
��ͺ�ˤĤ��ơ���Ϳ40������Ӳ������ˤĤ��Ƥϲ���8���ˡ�ưʪ����3������ե������˼��Ƥ�������줿Ǣ���Ѥ��ơ����Ѥδѻ������ˡ[�ޥ�ƥ����ƥ��å������Х����롦����]�ˤ��pH�����졤����ѥ�����, ���ȥ��Ρ��ӥ��ӥ�ӥ����ӥ�Ρ����������Ū�����¤Ӥ����֤θ���(URI-CELL�ա�����֥�å����ߥ���ץ������ȼҡ����������ƶ���)��Ԥä�������ˡ�18���ּ��Ƥ�������줿Ǣ�ˤĤ��ơ�Ǣ�̡����[���ס��������]�¤Ӥ˥ʥȥꥦ�प��ӥ��ꥦ��[�Ų����ưʬ�����֡�NAKL-132���찡���ȹ���]��¬�ꤷ����
���η�ϡ���Ϳ���֤���Ӳ������ֽ�λ�����˥����ƥ���첼�dz�ʢ����ʢ��ư̮���Ԥä���ưʪ�Ϻη������θ��5��������¤�����Τߤ��Ϳ�������μ褷����դ�3ʬ�䤷�����ΰ����ϡ�EDTA-2K�ǶŸ��ɻ߽�������¿���ܼ�ư��������[E-4000���찡�����Ż�]�ˤ�ꡤ�ַ���(�ŵ���������)���쿧����(�饦���β���ʥȥꥦ��-�إ⥰���ӥ�ˡ)���إޥȥ���å���(�ѥ륹��������)��ʿ���ַ������(MCV)��ʿ���ַ��쿧����(MCH)��ʿ���ַ��쿧��ǻ��(MCHC���ʾ����)�����������ӷ쾮�Ŀ�(�ʾ塤�ŵ���������)�ޤ�����ɸ�ܤ���������־��ַ���(Brilliant cresyl blue���������ƶ���)���������ɴʬΨ(May-Giemsa���������ƶ���)��¬�ꤷ�����ޤ������ϡ�3.8 %��������ʥȥꥦ��դǶŸ��˻߽������Ʒ�����ʬΥ������նŸǼ�ư¬������[KC-10A��������]�ˤ�ꡤ�ץ��ȥ���ӥ����(PT��Quick����ˡ)����ӳ�������ʬ�ȥ���ܥץ饹�������(APTT�����饸���������ˡ)��¬�ꤷ����
���μ褷����դΰ������������ʬΥ���������ؼ�ưʬ������[JCA-BM8�������Ż�]�ˤ�ꡤ������ѥ�(Biuretˡ)������֥ߥ�(BCGˡ)��A/G��(����)�����륳�������ȥꥰ�ꥻ�饤�ɡ������쥹�ƥ�����(�ʾ塤����ˡ)�����ӥ��ӥ�(������ˡ)��Ǣ������(Urease-UVˡ)�����쥢���˥�(Jaff��@)��GOT��GPT��g-GTP��ALP(�ʾ塤JSCCˡ)��LDH(SFBCˡ)��������ƥ顼��(BTC-DTNBˡ)�����륷����(OCPCˡ)�����̵�����(����ˡ)�ޤ��Ų����ưʬ������[NAKL-132���찡���ȹ���]�ˤ�ꡤ�ʥȥꥦ�ࡤ���ꥦ�प��ӱ���(�ʾ塤�������Ŷ�ˡ)��¬�ꤷ����
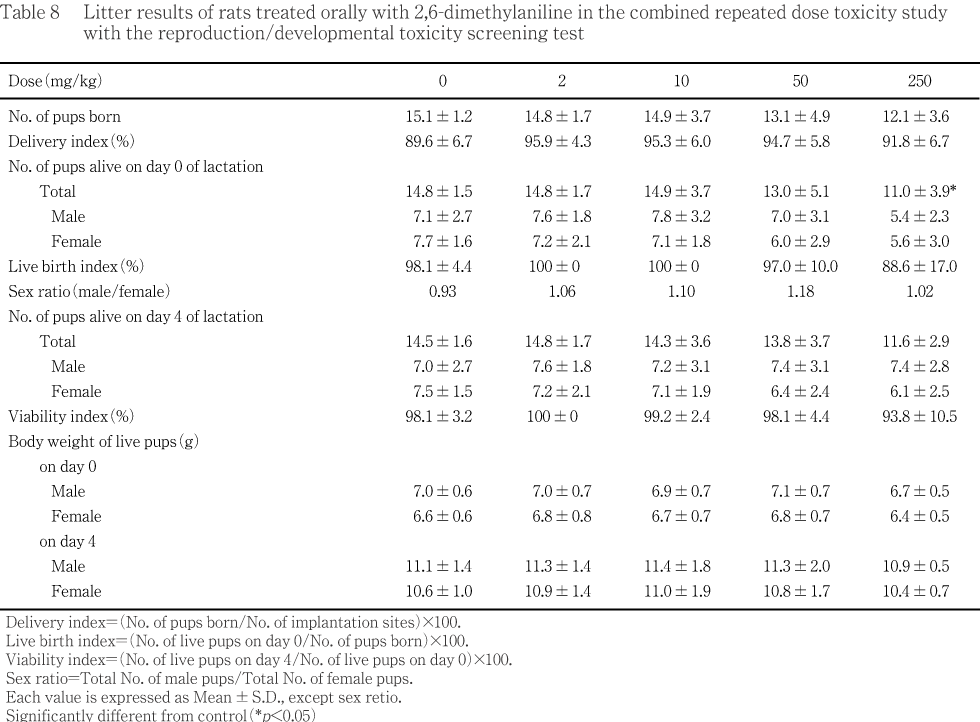
��ͺ�ηײ��˻�ưʪ����Ϳ42������������Ǥ�ʬ�ڤ�Ӯ����Ĵ�Ǥ��ä����Ӯ��5������������Ω���ʤ��ä���ϸ��۴��ֽ�λ��24��(��Ϳ52��������)����������Ω������ʬ��ͽ���4����ޤ�ʬ�ڤ�ǧ����ʤ��ä���Ϥ����������ޤ����������ˤĤ��Ƥϲ���14���������ˡ����줾�쥨�ݥƥ���첼�������˻�������ɽ��������Ǵ�줪����������ﴱ������Ū�˴ѻ��������ޤ����Ʒ���ͺ��5ɤ�δ�¡����¡�����ա��������¡��Ǿ����¡�������Ρ��þ����������ǹ�¤Ӥ����Ƥ�ͺ�����㤪���������Τ�����(���н���)�����˻������νŤ˴�Ť������ν���(���н���)�Ф�������ˤĤ��Ƥϡ�����β��ο�����ӻҵܤ��徲����Ĵ�١��徲Ψ(%) [(�徲��/���ο�)��100]�Ф�����
������ˤĤ���Ǿ�������Ρ��þ��������������ɡ���(����դ������忻��)���ߡ�IJ����¡����¡���¡����¡�����ա���������㡤������Ρ���Ω������ǹ�����㡤�ҵܡ��Կ�(����������������)�����������С�����(���ܹ�)��������(���������ᡤIJ���������)������������¾����Ū�۾����̤�μ褷��10 %���������˾ץۥ�ޥ���(���㡤������Τϥ֥���դ�������)�Ǹ��ꤷ����¸�����������ȿ��ظ����ϡ������˴���¤Ӥ��оȷ������250 mg/kg���λ�ͺ��5ɤ�Τ������¸�ﴱ�ˤĤ��Ƽ»ܤ���������ˤĤ��Ƥϡ����ҷ����������븡��(���ơ����������������������=)��Ԥä�����������ޤऽ��¾�η��ˤĤ��Ƥϡ�250 mg/kg�����︳ʪ������Ϳ�ˤ��ƶ����ͤ���줿��ͺ�δ�¡������¡�¤Ӥ�ͺ�ο�¡��������㡤�������ˤĤ��ƤϤ���˴ﴱ���̤��Ѳ���ǧ���줿��ο�¡�ˤĤ��Ƥ⸡���������Ʒ�������Ū�۾����̤ˤĤ��Ƥ�����ˤĤ��Ƹ����������ޤ�����������Ω�λ�ͺ����Ӹ�������Ω������ʬ��ͽ���4����ޤ�ʬ�ڤ�ǧ����ʤ��ä���ˤĤ��Ƥϡ�ͺ�Ǥ����㡤������Ρ���Ω���������ǹ��Ǥ����㡤�ҵܤ���Ӳ����Τ������������ϡ���ˡ�˽��äƥѥ�ե������Ҥ��������H-E������ܤ��ƶ����������ޤ�������ʪ��Ʊ�ꤹ�뤿�ᡤ�¡������ˤĤ���Ŵ(�٥���֥롼)�������оȷ������250 mg/kg����ͺ�γ�2ɤ�ο�¡��PAS������Ԥä���
��ʬ�ڴ�λ�γ�ǧ�塤��ʢ�λ�����(�������Ȼ�˴���ι��)��Ĵ�١�ʬ��Ψ��(���л�����/�徲��)��100�ͤޤ�������������͵���Ĺû�ˤ�����̤�Ƚ�ꤷ�������Ȥ�����Ф������������ˤĤ��Ƥϡ��������ޤɽ�ΰ۾��ѻ�������
���������̾��֤����������ǧ��������Ψ��(�л���ǧ��������/���л�����)��100�ͤ���ӿ�������¸ΨΨ��Ӯ��4��������/�л���ǧ��������)��100�ͤ����
���������ˤĤ���Ӯ��0�������4���˻�ͺ�̤˳�ʢ���Ȥ����νŤ�¬�ꤷ��1ɤ�������ʿ���νŤФ���.
����˴��Ϥ������١���¸���Ӯ��4���˥����ƥ���첼������व������ʢ���ˤ�������״ﴱ������Ū�˴ѻ�������
������줿ʿ���ͤ��뤤�����٤ˤĤ��ơ��оȷ��Ȥ�ͭ�պ�(����Ψ5 %�ʲ�)������Ū�ǡ�������ӥѥ��ȥ�å��ǡ����ˤĤ��ơ������3���ʾ�ξ�硤Bartlett��ʬ�������Ԥ���ʬ�������ͤʾ��ϰ층���֤�ʬ��ʬ�Ϥ�Ԥä���ʬ�������ͤǤʤ���礪��ӥΥ�ѥ��ȥ�å��ǡ����ϡ�Kruskal-Wallis�ν�̸����Ԥä��������η��ͭ�պ���ǧ���硤Dunnett�ʤ���Dunnett���θ���ˡ�ˤ��¿����Ӥ�Ԥä��������2���֤ξ��ϡ��ѥ��ȥ�å��ǡ����ˤĤ���F�����Ԥ������η��ʬ�������ͤʾ��� Student��t�����ʬ�������ͤǤʤ�����Aspin-Welch��t�����Ԥä����ޤ����Υ�ѥ��ȥ�å��ǡ����ϡ�Mann-Whitney��U�����Ԥä������ƥ��ꥫ��ǡ����ˤĤ��Ƥϡ�Fisher��ľ�ܳ�Ψˡ���Ѥ��Ƹ��ꤷ�����ʤ����л����˴ؤ���ǡ����ϡ�1ʢ��1ɸ�ܤȤ�����
��50 mg/kg����ͺ��2ɤ����ӻ��3ɤ����Ϳ1����250 mg/kg���λ�ͺ�������Ϳ1��6���δ֤ˡ����٤ʼ�ȯ��ư�㲼����Ϳ�峵��10ʬ����3��6���֤ˤ�����ǧ���졤¿���ϴ��۲����ȼ�äƤ������ޤ���Ϳ15���ʹߤˡ�250 mg/kg����ͺ��3ɤ����ӻ��5ɤ�ǡ���Ϳ�Τ������������뤤����Ϳľ���ȯ����1���ְ���˾ü�����ή��ǧ���줿��250 mg/kg���λ�ͺ�μ�ȯ��ư�㲼����Ӵ��۲����¤Ӥ˻��ή��ȯ��Ψ�ˤ�ͭ�պ���ǧ���줿����Ϳ����μ�ȯ��ư�㲼����Ӵ��۲����¤Ӥ���Ϳľ���ή�ϡ�250 mg/kg���λ�α������ˤ����Ƥ�ǧ���줿��
���ʤ���250 mg/kg���λ�ǡ�1ɤ����Ϳ22��24���ˤ����ơ��̤�2ɤ����Ϳ40���ˡ��ޤ˰��̾��֤���������3ɤ�Ȥ⼫ȯ��ư�㲼�����٤Ȥʤä�ʢ��̤��褷�����β����Ƶ����塤�����Ρ��������ޡ���ʢ���α��졤���뤤�Ϻ��餬ǧ���졤��������λ���֤Ȥʤä����������˻��������λ���˺μ褷����դθ����Ǥϡ�3ɤ�˶��̤��ơ���ȥإ⥰���ӥ�Ǣ�����ǡ����ӥ��ӥ��쥢���˥������쥹�ƥ����뤪��ӥȥꥰ�ꥻ�饤�ɡ�����2ɤ�ǤϤ����LDH��GOT��GPT��g-GTP�ʤɤΤ��������ͤ�ǧ���줿��
���������֤ˤ����Ƥϡ����̾��֤��Ѳ�����ӻ�˴��ǧ����ʤ��ä���
����Ϳ������Ϳ�����椪��Ӳ���������δѻ��ˤ����ơ��ƴѻ����ܤ�ͭ�դ��Ѳ���ǧ����ʤ��ä���
����Ϳ6������Ӳ���2���θ����ˤ����ơ��Ƹ������ܤ�ͭ�դ��Ѳ���ǧ����ʤ��ä���
��250 mg/kg���ǡ���Ϳ���ֽ�λ����¬��ǻ�ͺ�Ȥ�����谮���¤Ӥ˼�ȯ��ư�̤����ͷ�����ǧ���졤��α�ư�̤ˤ�ͭ�պ���ǧ���줿���ޤ����������Τ����ưʪ����Ϳ������θ����ˤ����Ƥ�Ʊ�ͤη�����ǧ���졤�������谮�Ϥ���ӻ�ͺ�μ�ȯ��ư�̤�ͭ�պ���ǧ���줿��
�������������¬��Ǥϡ���ͺ�Ȥ�ͭ�դ��Ѳ���ǧ����ʤ��ä���
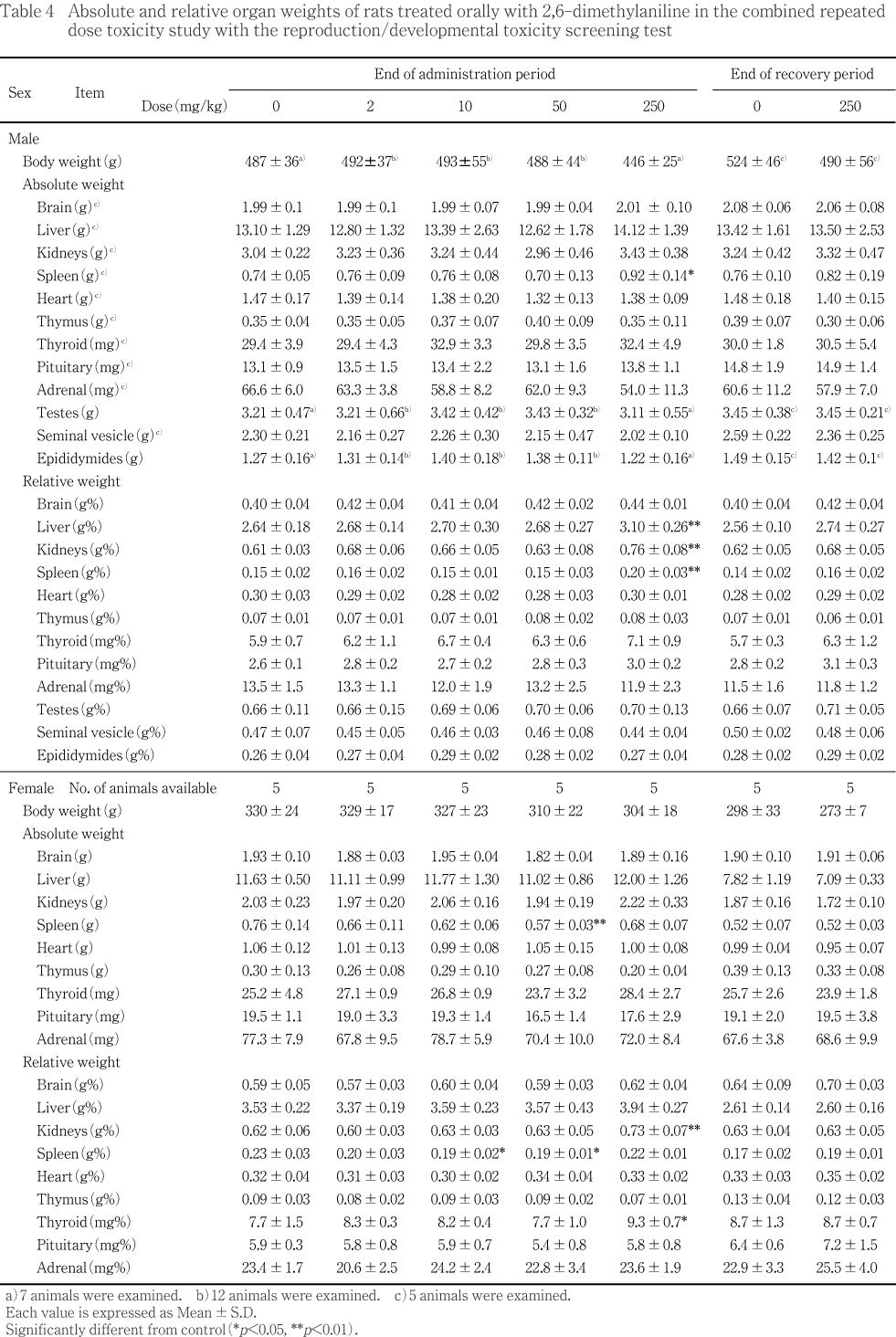
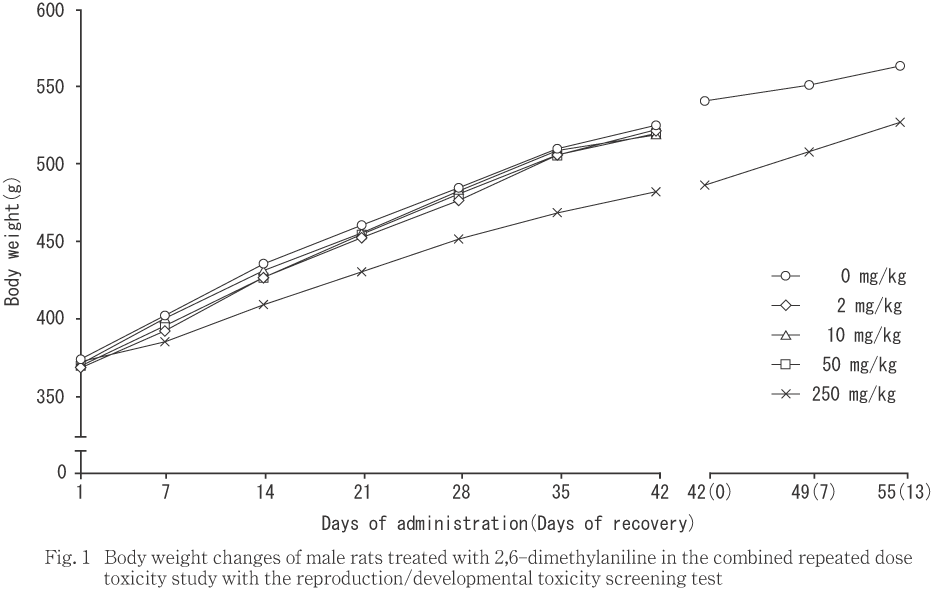
��ͺ��250 mg/kg���ϡ���¬��������νŤ�ͭ�պ���ǧ����ʤ��ä���Τ��оȷ���äƿ�ܤ�����Ϳ��������ν������̤�ͭ�դ����ͤ�������ˤ����Ƥ�ͺ���������������ǧ���졤������14���֤��ν������̤�ͭ�դ����ͤ�����ǥ�������椪���ʬ�ڸ�Ӯ��4���ޤǤδ֤��νŤ�����ν������̤ˤ�ͭ�դ��Ѳ���ǧ����ʤ��ä����ޤ���250 mg/kg���λ�α��������νŤ��оȷ���äƿ�ܤ�����Ϳ35���������Ϳ14���ʹߤ��νŤ�ͭ�պ���ǧ���졤��Ϳ��������ν������̤�ͭ�պ���ǧ����ʤ��ä���Τ����ͷ����ˤ��ä���
���������֤ˤ����Ƥϡ�ͺ�ǡ�250 mg/kg�����ν������̤��оȷ���ͭ�դ˾��ꡤ����������ǧ���줿����α������⡤�νŤ�ͭ�պ���ǧ����ʤ��ʤꡤ����������ǧ���줿��

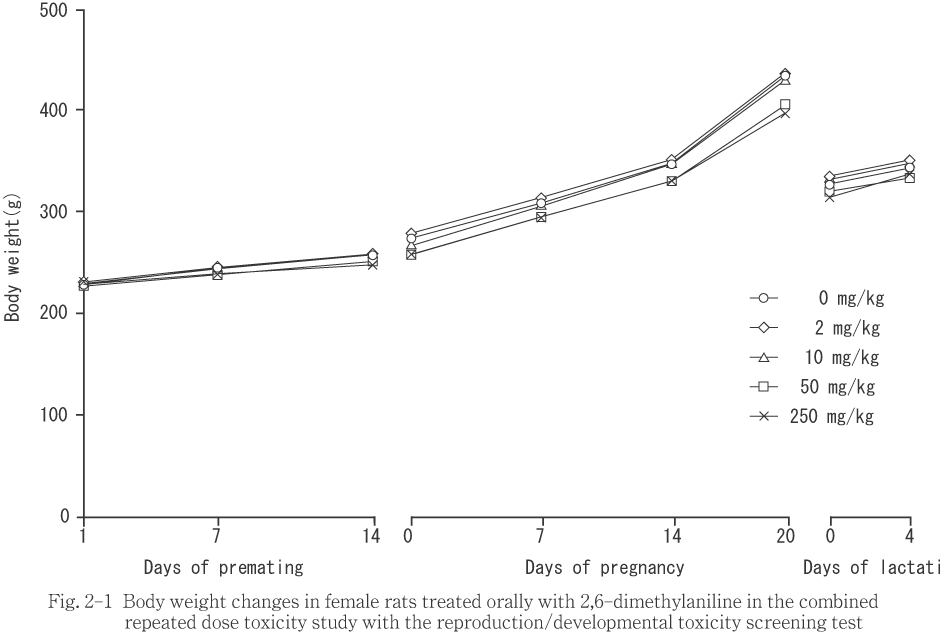
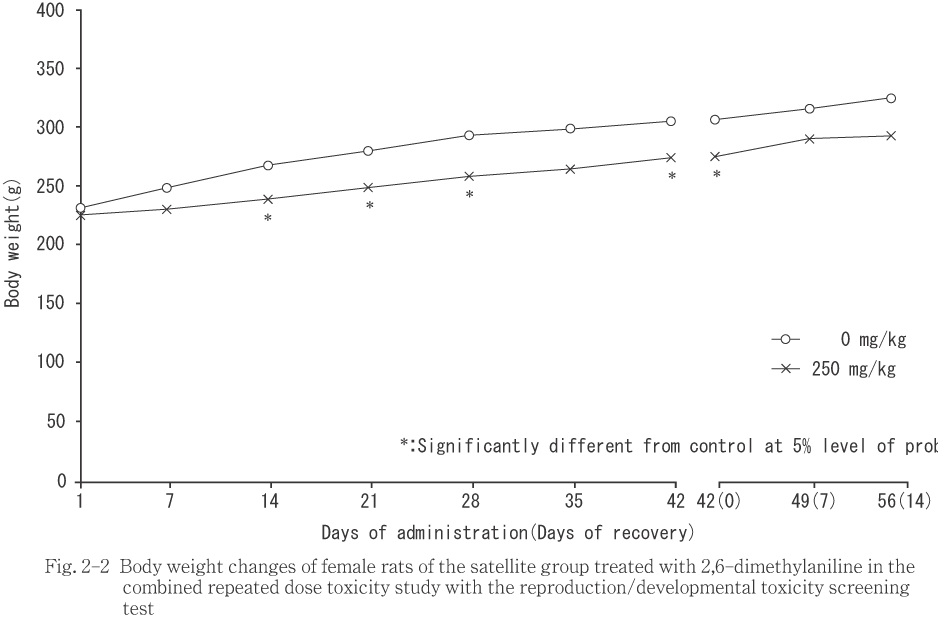
��250mg/kg���ǡ�ͺ����Ϳ1�����ݱ��̤�ͭ�դ����ͤ�����Ʊ���λ�Ǥ�ͭ�դ��Ѳ���ǧ����ʤ��ä�������α������Ǥϡ���Ϳ1�����ݱ��̤����ͷ����ˤ��ä���
���������֤ˤ����Ƥϡ�ͺ�ϲ���7�����ݱ��̤�ͭ�դʹ��ͤ�������α������Ǥ�ͭ�դ��Ѳ���ǧ����ʤ��ä���
����Ϳ������θ����ˤ����ơ�250 mg/kg���ǡ�Ǣ�̤�ͭ�դ����ä�ǧ���졤Ǣ����¤Ӥ˥��ꥦ�प��ӥ���ѥ���ǻ�٤�ͭ�դ����ͤ����ʥȥꥦ��ǻ�٤����ͷ����ˤ��ä����������ʤ��顤���ꥦ�प��ӥʥȥꥦ���18���֤ˤ������������̤ˤ�ͭ�դ��Ѳ���ǧ����ʤ��ä�������ѥ��ˤĤ��Ƥ�50 mg/kg���Ǥ�ͭ�դ����ͤ�ǧ���줿�����طʥǡ����ˤ����������ϰϤϡȡޡ�++�ɤǡ�����62 %�ϡ�+�ɤ��������ϰϤΤ�ΤǤ��ä���
������������θ����Ǥϡ���Ϳ������θ�����ǧ���줿�Ѳ���ǧ���줺�����ȥ���ǻ�٤�ͭ�դ����ͤΤߤ�ǧ���줿��
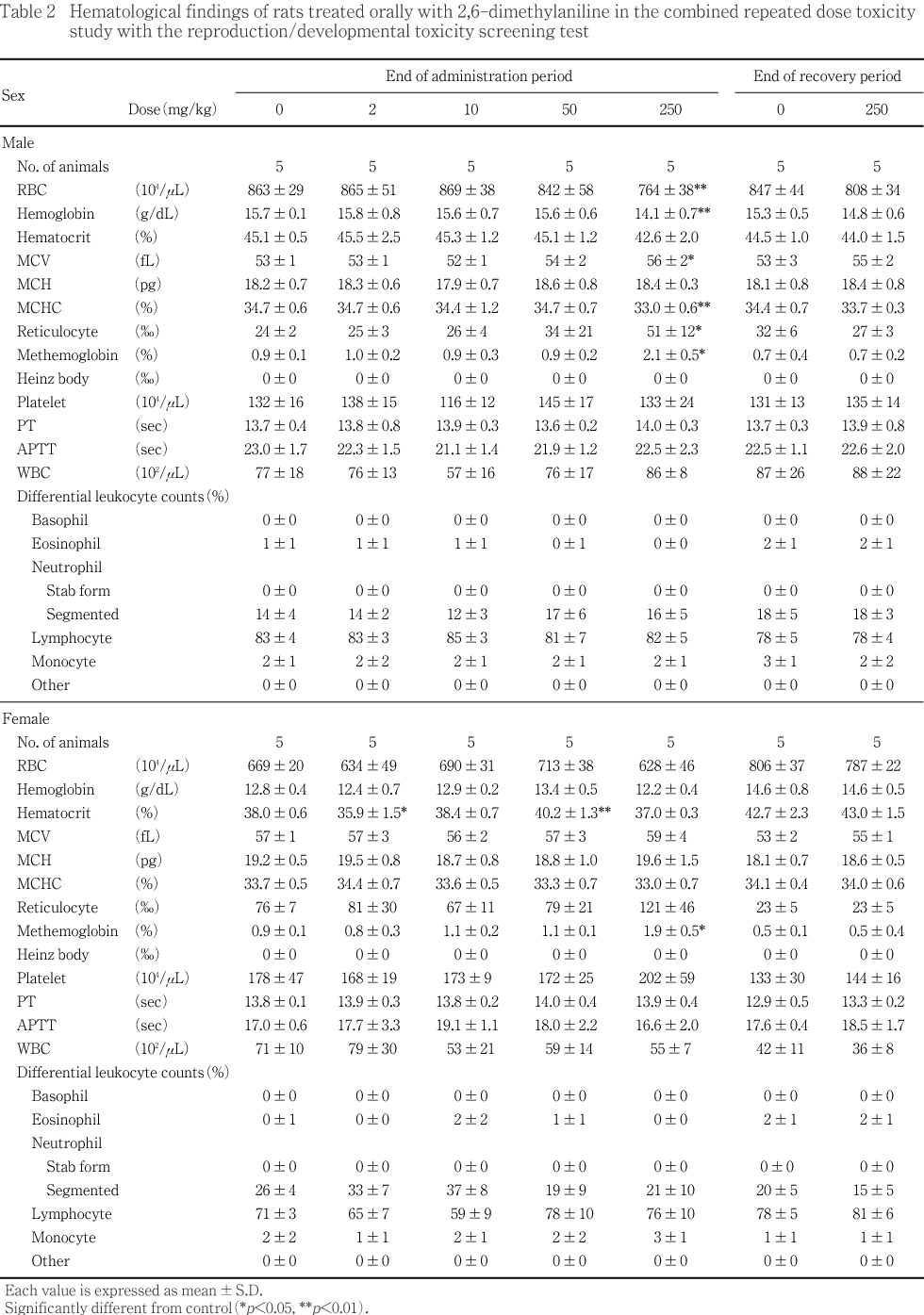
��250 mg/kg����ͺ���ַ�������ӷ쿧��ǻ�٤�ͭ�դʸ������إޥȥ���å��ͤθ��������¤Ӥ��־��ַ�������ӥ�ȥإ⥰���ӥ�ǻ�٤�ͭ�դ����ä�ǧ���졤 ʿ���ַ�����Ѥ�ͭ�դʹ��͡�ʿ���ַ��쿧��ǻ�٤�ͭ�դ����ͤ������ޤ���Ʊ���λ�ˤ����Ƥ⡤��ȥإ⥰���ӥ�ǻ�٤�ͭ�դ����ä�����־��ַ��������÷�����ǧ���줿���ʤ�����Υإޥȥ���å��ͤˤ����ơ�2 mg/kg����ͭ�դ����͡�50 mg/kg����ͭ�դʹ��ͤ�ǧ���줿�����Ѳ��������������ǧ���줺����������طʥǡ����ˤ����������ϰϤ��ͤǤ��ꡤ�︳ʪ������Ϳ�Ȥ�̵�ط��ʶ�ȯŪ�긫��Ƚ�Ǥ��줿��
���������Ǥϡ��Ƹ������ܤ�ͭ�դ��Ѳ���ǧ����ʤ��ä���
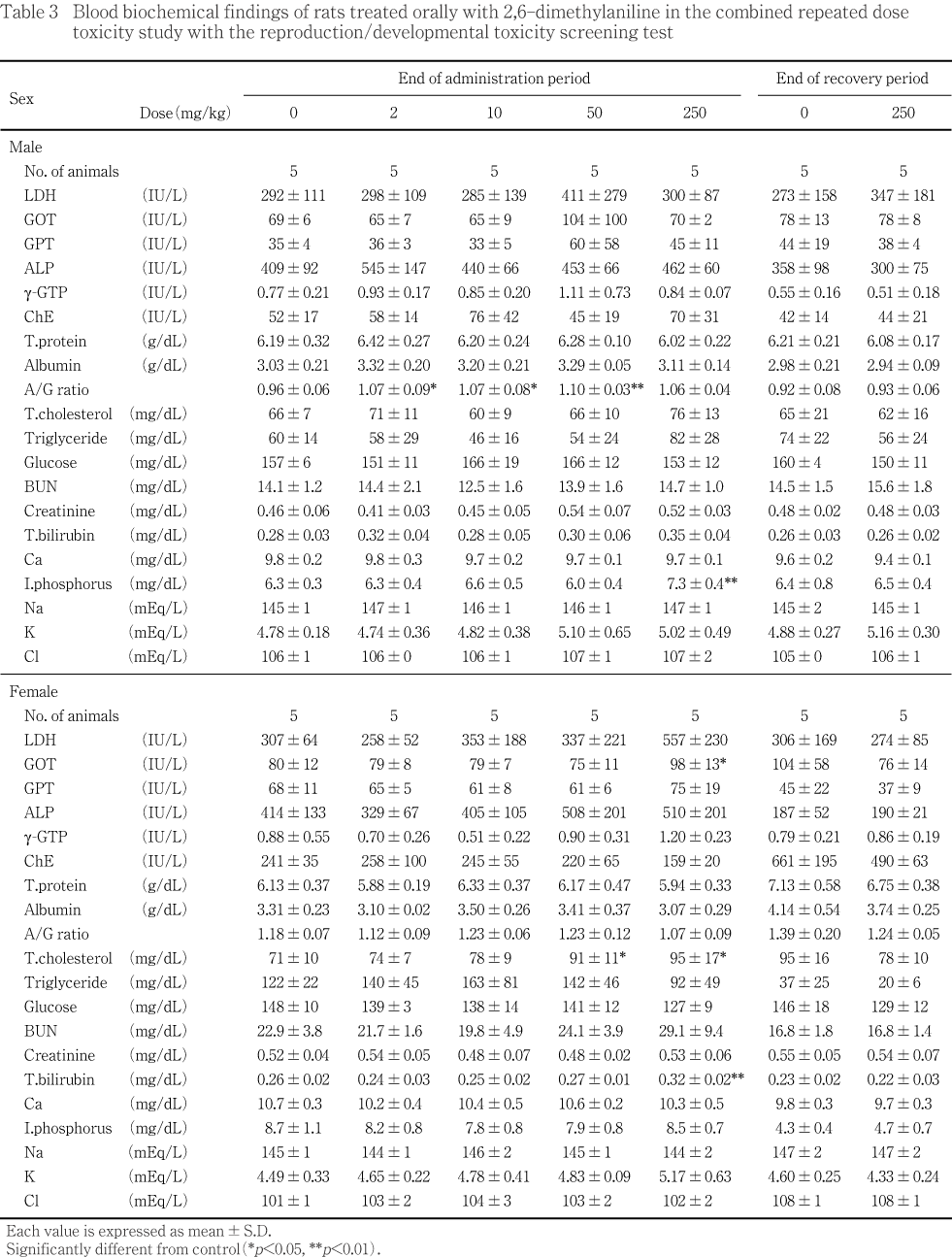
��50 mg/kg ���ǻ�ˡ������쥹�ƥ������ͭ�դ����ä�ǧ���줿��250 mg/kg���Ǥϡ���������쥹�ƥ����롤GOT��������ӥ��ӥ��ͭ�դ����á�ͺ��̵������ͭ�դ����ä�ǧ���줿���ʤ����︳ʪ����Ϳ�Ʒ���ͺ��A/G����оȷ�����٤�����Ū�˹��ͷ����ˤ��ꡤ2��10�����50 mg/kg����ͭ�պ���ǧ���줿�����Ѳ��������������ǧ���줺����������طʥǡ����ˤ����������ϰϤ��ͤǤ��ꡤ�︳ʪ������Ϳ�Ȥ�̵�ط��ʶ�ȯŪ�긫��Ƚ�Ǥ��줿��
���������Ǥϡ��Ƹ������ܤ�ͭ�դ��Ѳ���ǧ����ʤ��ä���
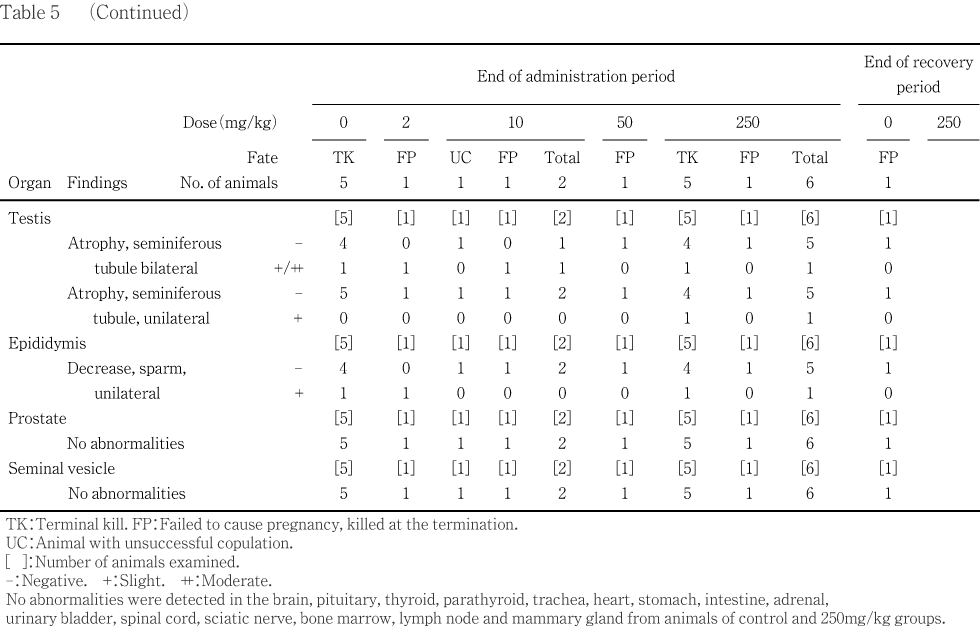
��ǥ������Ω������ͺ�ˤ����ơ�250 mg/kg����6ɤ���¡���緿����2ɤ���������ֿ��褬1ɤ��ǧ���줿���ޤ�������ξ�����(��¦��)���оȷ���7ɤ��1ɤ�����250 mg/kg����1ɤ��ǧ���줿�����ۡ�ʬ�ڤ���Ӯ��ޤǽ�Ĵ�Ǥ��ä���ˤ����ơ��Ѳ���ǧ����ʤ��ä���������10 mg/kg����ǧ���줿��������Ω��1�ФǤϡ���ͺ�Ȥ��Ѳ���ǧ����ʤ��ä�����������Ω���������ۤ��ʤ��ä��оȷ���1�Ф����10 mg/kg����1�ФǤϡ���������λҵܤ������ϰϤ�ۤ��������٤λҵܹп�𤬡��ޤ�2 mg/kg����1�ФǤ�ͺ������ξ�����(ξ¦��)��ǧ���졤50 mg/kg����1�Ф����250 mg/kg����1�ФǤϻ�ͺ�Ȥ��Ѳ���ǧ����ʤ��ä���2��10�����250 mg/kg���dz�1ɤ��ǧ���줿ʬ�ڸ�������˴�λ�ˤ��Ѳ���ǧ����ʤ��ä���
����Ϳ��������λ���֤Ȥʤä����������˻�����250 mg/kg����3ɤ�Ǥϡ��¡����Ӷ����ξ�������������դ��緿�������̤���ǧ���졤����˿�¡���緿����2ɤ����Ӵ�¡���緿����1ɤ��ǧ���줿��
���������ˤ����Ƥϡ��оȷ���1�Фθ�������Ω��ͺ��ޤ�ơ�������λ�ͺ�ˤ��Ѳ���ǧ����ʤ��ä���
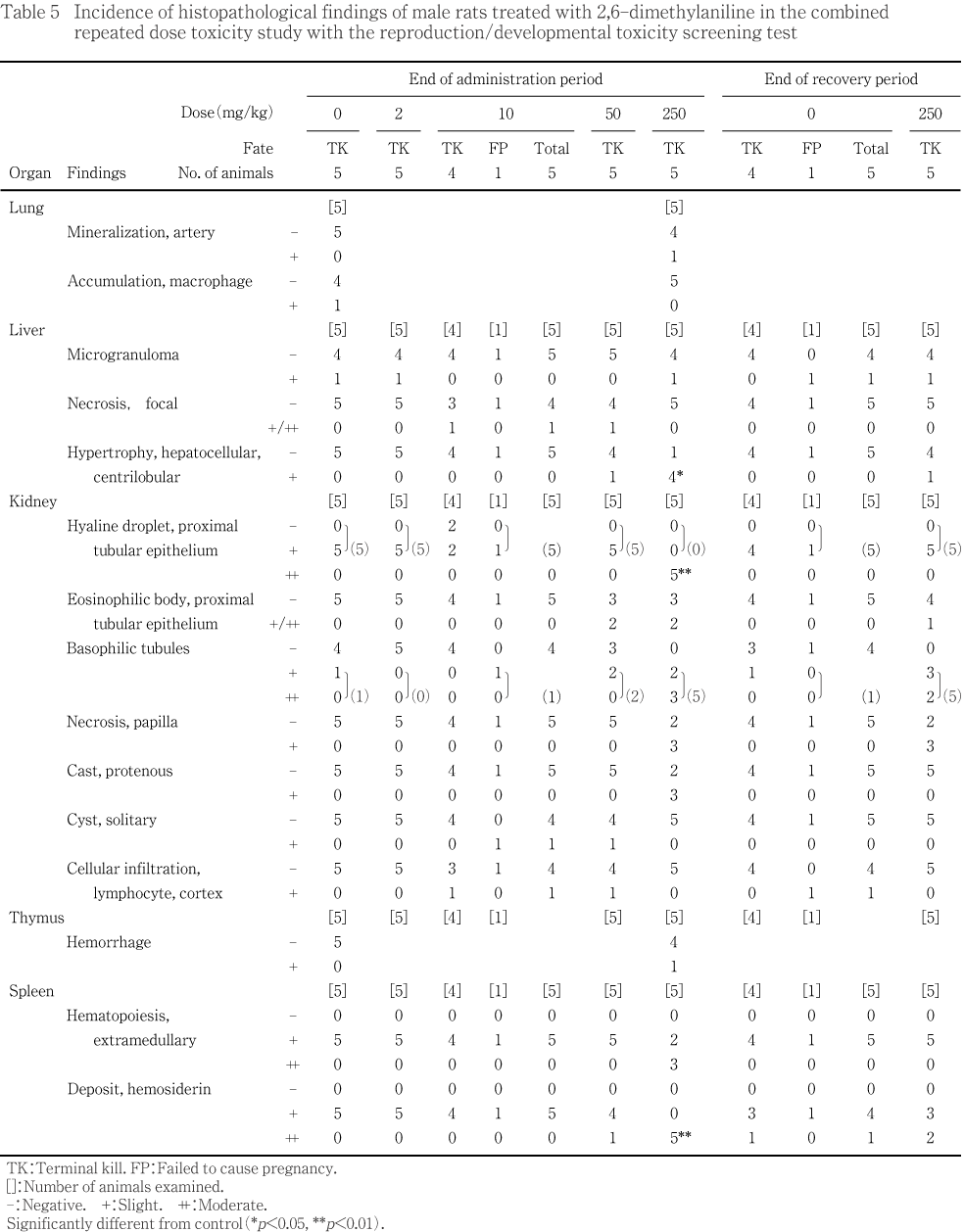
��250 mg/kg���ǡ���ͺ�˿�¡��ͺ�˴�¡����˹þ��������н����¤Ӥ�ͺ���¡�����Ф�������н��̤Τ������ͭ�դ����ä�ǧ���줿��
���ʤ�������¡��10 mg/kg�������н��̡�50 mg/kg �������Ф�������н��̤�ͭ�դ����ͤ�ǧ���줿����250 mg/kg���Ǥ��Ѳ���ǧ���줺���������Ū�ʽ긫�ǤϤʤ��ä���
���������Ǥϡ��ƴﴱ�ν��̤��Ѳ���ǧ����ʤ��ä���
A.��������ϰʳ��δﴱ
���︳ʪ������Ϳ�˵��������Ѳ�������¡����¡������¡��ǧ���줿��
a.����¡
���κ�˦���礬50mg/kg����ͺ1ɤ����1ɤ�ˡ�250mg/kg���Ǥ�ͺ4ɤ����ӻ�3ɤ��ǧ���졤250mg/kg����ͺ��ȯ��Ψ�ˤ�ͭ�պ���ǧ���줿�����礷���κ�˦�Ͼ����濴�Ӥ˸¶ɤ�����٤��Ѳ��Ǥ��ä����������Ǥ�ͺ��1ɤ�˴κ�˦���礬��¸���Ƥ�������¾��ưʪ�ˤ�ǧ���줺�����餫�ʲ��������������κ�˦����ʳ��ˡ���������𤪤��������ब��ȯŪ��ȯ�����������︳ʪ������Ϳ�Ȥδ�Ϣ����ǧ����ʤ��ä���
b.����¡
����������Ǣ�ٴɤ�ͺ�Ǥ��оȷ��η�����1ɤ���Ф���250 mg/kg���ǤϷ��٤��뤤���������㤬5ɤ����ˤ����Ƥ�250 mg/kg���ˤΤ߷����㤬3ɤǧ���졤��ͺ�Ȥ������Ǣ�ٴɤ�ȯ��Ψ�����÷�����ǧ���줿���ޤ���Ʊ������Ƭ���बͺ��3ɤ����ӻ��4ɤ��ǧ���졤���1ɤ�ǤϹۼ������ȼ�äƤ���������ˡ��оȷ���ͺ�ζ��Ǣ�ٴɾ���ˤϾ˻�ũ�����٤�ǧ���줿����250 mg/kg���ǤϾ˻�ũ�����ä���5ɤ���㤬�����٤��Ѳ��������ޤ���250 mg/kg���Ǽ��������ˤ�����������줬ͺ��3ɤ��Ǣ�ٴɤΤӤޤ�����ĥ�����2ɤ��ǧ���줿���������Ѳ��Τ�����ͺ�ι�������Ǣ�ٴɤ���������پ˻�ũ�¤Ӥ˻����Ƭ�����ȯ��Ψ�ˤ�ͭ�պ���ǧ���줿���������Ǥϡ���ͺ�Ȥ������Ǣ�ٴɤ������Ƭ����ϻ�¸���Ƥ�������ȯ��Ψ���뤤���Ѳ������٤�������������Ǥ�졤�ޤ�����¾���Ѳ���ǧ���줺���������Ƥ�����
���ʾ���Ѳ��˲ä��ơ���Ω��ǹ˦����ͺ�ˡ�������ѵ忻�ͺ�ˡ�������ۼ����夬���ǧ���줿�����︳ʪ������Ϳ�Ȥδ�Ϣ����ǧ����ʤ��ä����ޤ���ͺ�Ƕ��Ǣ�ٴɾ���ι��������Τ�50�����250 mg/kg���ˡ���ǤϾ˻ұ��줬250 mg/kg����ǧ���줿�����������1��2ɤ��ȯ���ǡ���åȤ˼���ȯ��Ū��ǧ�����긫�Ǥ��뤳�Ȥ��顤�︳ʪ������Ϳ�Ȥ�̵�ط����Ѳ���Ƚ�Ǥ��줿��
c.���¡
���¡����磿�ˤ�����إ⥸�ǥ������ϡ��оȷ��Ǥϻ�ͺ���㤬���٤Ǥ��ä�����50 mg/kg����ͺ��1ɤ�¤Ӥ�250 mg/kg����ͺ��5ɤ����ӻ��4ɤ�ˤ������٤����夬ǧ���졤250 mg/kg���λ�ͺ�������������ȯ��Ψ�ˤ�ͭ�պ���ǧ���줿���ޤ���ͺ�ǡ���磿�ο�¤����оȷ���ޤ� 50 mg/kg�ʲ��η��Ǥ����㤬���٤Ǥ��ä�����250 mg/kg���Ǥ�3ɤ�������٤ǡ���¤���ж�ʷ�����ǧ���줿���������Ǥϡ���ͺ�Υإ⥸�ǥ�����太���ͺ�ο�¤��ж�ʤȤ����������ǧ���줿��
d.������¾�δﴱ
���оȷ������250 mg/kg���λ�ͺ���뤤�Ϥ��Τ����줫�ˡ��٤�ư̮�ɹۼ����太���ˢ����˦���뤤�ϥޥ����ե������ν����¤Ӥ˶����νз줬ǧ���줿�������١����ġ���ȯŪ���Ѳ��ǡ��︳ʪ������Ϳ�Ȥδ�Ϣ����ǧ����ʤ��ä����ޤ�����ιþ��������н������ä�ǧ���줿���������ȿ���Ū�ˤ��Ѳ���ǧ����ʤ��ä���
B.��������ϴﴱ
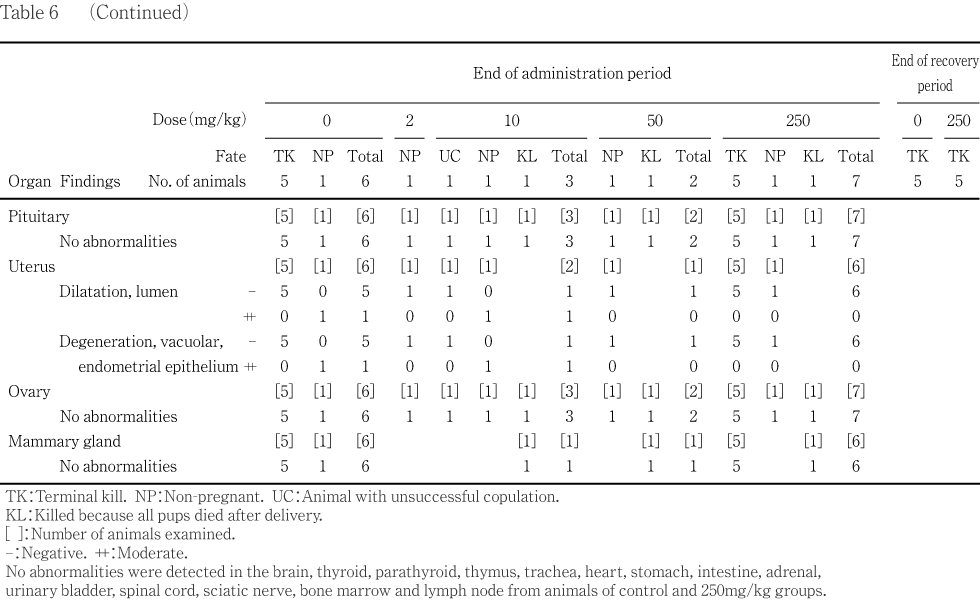
���︳ʪ������Ϳ�˵��������Ѳ��ϡ�ǧ����ʤ��ä���ǥ������Ω������ͺ�ˤ����ơ�250 mg/kg������������ٴɰ�̤�2ɤ(ξ¦��1ɤ����¦��1ɤ)��ǧ���줿���оȷ��ˤ�1ɤ(ξ¦��)��ǧ���졤���ҷ����������븡���Ǥ�ͭ�դ��Ѳ���ǧ����ʤ��ä����ޤ�����Ω���������ǹ���Ѳ���ǧ����ʤ��ä����ʤ����оȷ����������ٴɰ����Ǥ�������Τ�������δ������Ҥθ�����ȼ�äƤ�����ǥ����ʬ�ڤ���Ӯ��ޤǽ�Ĵ���ä���Ǥϡ����㤪��ӻҵܤ��Ѳ���ǧ����ʤ��ä���
���������оȷ������10mg/kg����ǧ���줿��������Ω������ǥ�����ʤ��ä����줾��1�ФǤϡ���������ǻҵܤ���������ȼ���Ѳ���ۤ����ҵܹг�ĥ������������ζ�˦������ǧ���졤�����10mg/kg�������ͺ�ˤ���������ٴɰ�̤�ǧ���줿��2mg/kg����ǧ���줿��ǥ��1�Фˤ����Ƥ⡤ͺ����������ٴɰ�̤����������Τ�������δ������Ҹ�����ǧ���줿��10mg/kg����ǧ���줿��������Ω��1���¤Ӥ�50�����250mg/kg����ǧ���줿��ǥ�γ�1�ФǤϻ�ͺ��������ϴﴱ����ӻ�β����Τ��Ѳ���ǧ���줺��10��50�����250mg/kg���dz�1ɤ��ǧ���줿ʬ�ڸ�������˴�λ�ˤ����Ƥ⡤���㡤��������Ӳ����Τ��Ѳ���ǧ����ʤ��ä���
����Ϳ������������˻�����250 mg/kg���λ��3ɤ�Ǥϡ���¡�ξ����濴���κ�˦���礬2ɤ����¡�ΤӤޤ���Ǣ�ٴɳ�ĥ��3ɤ����Ƭ���ब1ɤ���¡�����Ū���٤ʥإ⥸�ǥ�����夬3ɤ��ǧ���줿�ۤ��������������̡��¡����ӥ�����Υ��ѷϺ�˦������¤Ӥ����դ������˦���礬3ɤ�˶��̤���ǧ���줿��
����ʬ������������������ޤǤˤ����ơ��оȷ���1ɤ����������㤬3.7��5.5����ȯ�������оȷ���ޤ����Ϳ����ʿ����������4.0��4.2���Ǥ��ꡤͭ�դ��Ѳ���ǧ����ʤ��ä���
���ʤ������Ҥ��оȷ���1ɤ�ϡ���ʬ�����ޤǤ��������Ͻ�Ĵ�Ǥ��ä����������������饹�ᥢ����ȯ��ٻߴ��Ȥʤꡤ13���ܰʹߤ�������������������
�������ϡ�10 mg/kg����1�Ф�������������Ω����������Ω�ޤǤ��פ������������Ψ�ˤ�ͭ�դ��Ѳ���ǧ����ʤ��ä���10 mg/kg���θ�������Ω�λ�ϡ��������ޤǤ��������Ͻ�Ĵ�Ǥ��ꡤ���۳�����(0��)��ȯ��������(��)�����������������紹������ˤ����Ƹ��۳��ϸ�2������ȯ��ٻߴ�����³�������۳��ϸ�14��(���۽�λ��)��ȯ���������ǧ���줿��ǥ������Ω�ϡ��оȷ���ޤ����Ϳ���Ǥ��줾��1�Ф���ǧ���줿���������Фϡ�������ǧ���줿���Υ��ᥢ����ȯ������(��)���魶(��)������������(�оȷ�1ɤ��10 mg/kg��1ɤ)��ȯ��ٻߴ�(��)�������(250 mg/kg��1ɤ)�����ȯ������(��)�������(2 mg/kg����50 mg/kg����1ɤ)�ǡ����Τʤ���50 mg/kg���λ�ϡ����۳��ϸ�2�����ȯ��ٻߴ�����³����ȯ������(��)����ǧ�᤺�����۽�λ���˸�������ǧ���줿��
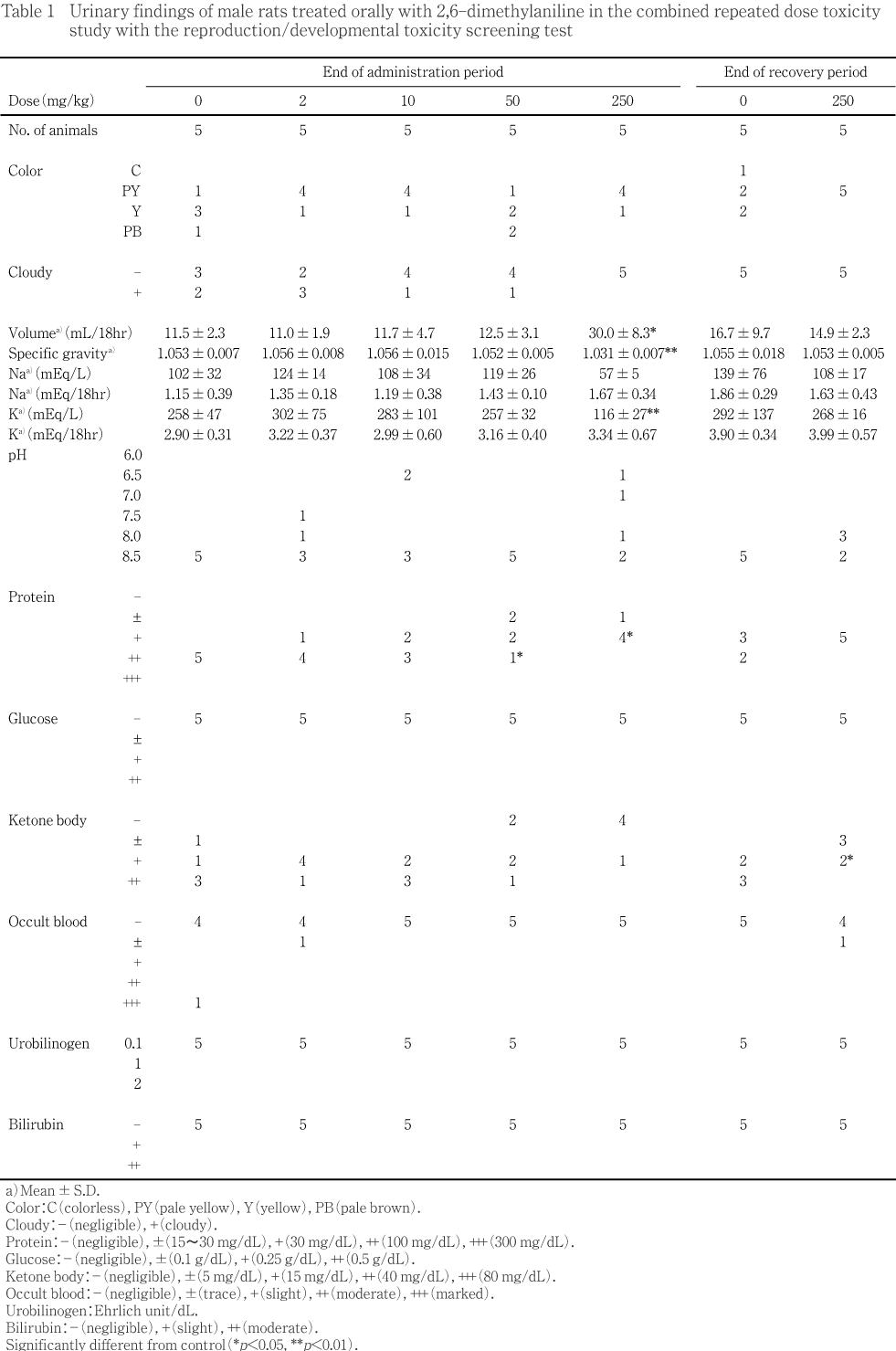
��250 mg/kg���ǡ����ο������ͷ�����ǧ���졤�徲����ͭ�դ����ͤ��������徲Ψ�ˤ��Ѳ���ǧ����ʤ��ä���
���оȷ���ޤ�50mg/kg�ʲ��η��Ǥϡ����ۤ���ưʪ������˽л���ǧ���줿��250mg/kg���ˤ����Ƥ���ۤ���10ɤ��2ɤ��ʬ�������λ���֤Τ��������˻�������250mg/kg������¸����8ɤ����˽л���ǧ���졤���Ƥη��ǽл�Ψ��100%�Ǥ��ä����ޤ���ǥ�����֤ˤ��Ѳ���ǧ����ʤ��ä���
��ʬ�ھ��֤ΰ۾��ǧ����ʤ��ä���Ӯ����֤ˤĤ��Ƥϡ�10 mg/kg����1ɤ��50 mg/kg��1ɤ�����250 mg/kg����1ɤ�Ǥ������������Ӯ��1���ޤǤ˻�˴���������������Ū���Ѳ��ǤϤʤ��ä�����������ưʪ�ϡ��������ʬ�ڸ�Ӯ���ư��Ȥ�ʤ��ä���
��250 mg/kg���νл����������ͷ����ˤ��ꡤӮ��0������������ͭ�դ����ͤ�����Ʊ���ν���Ψ�������ͷ����ˤ��ä�����ͭ�պ���ǧ����ʤ��ä�������ˤ��Ѳ���ǧ����ʤ��ä���
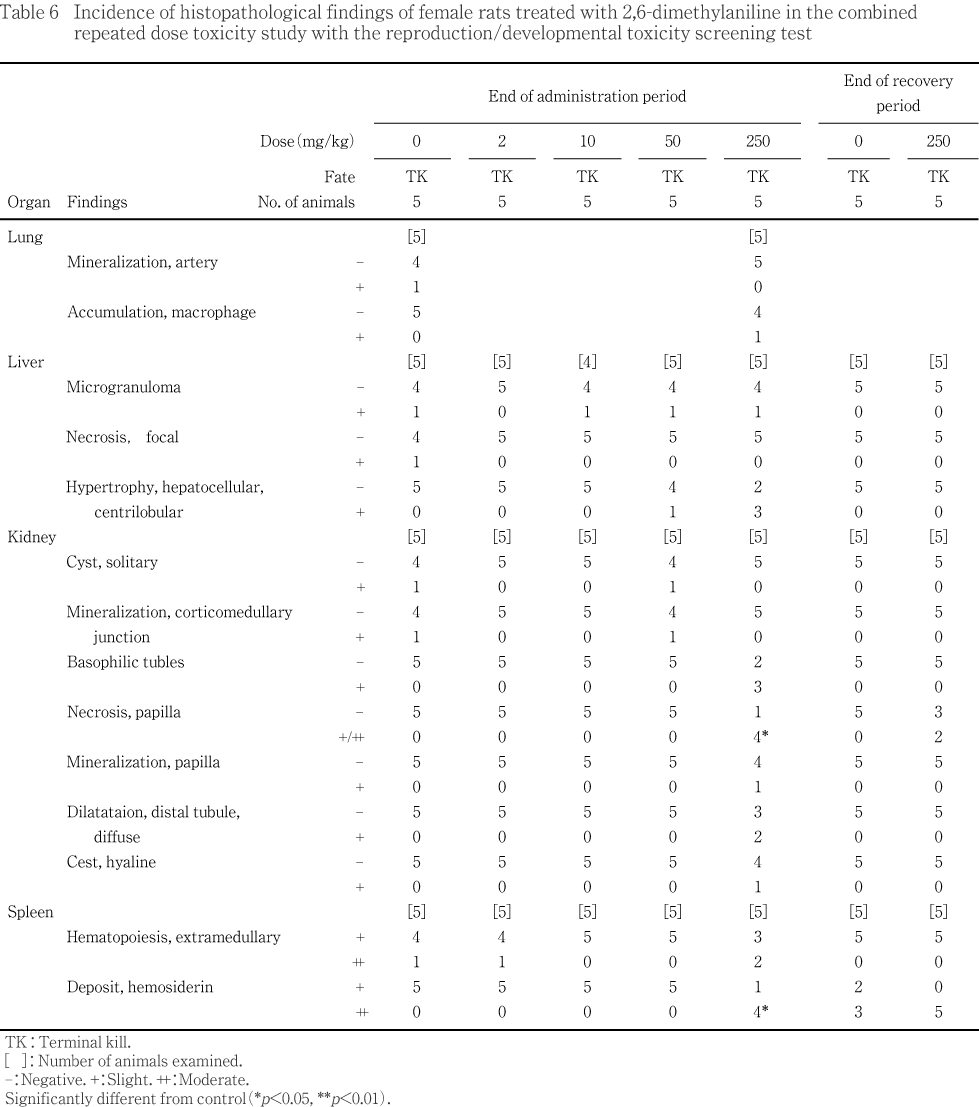
���侮����10 mg/kg��1ɤ(ȯ��Ψ0.7 %)�����50 mg/kg����1ɤ(0.6 %)ǧ���줿¾�ϡ�������η��ˤ����Ƥ⳰ɽ�������¡�۾��ͭ�����ưʪ��ǧ����ʤ��ä�����¡�ѰۤˤĤ��Ƥϡ�������������α���оȷ���ޤ�Ʒ�(1.3��4.2 %)�ˡ�����ư̮��Ĥ�2 mg/kg��(0.6 %)�����10 mg/kg��(0.7 %)�ˡ��ع�Ǣ�ɤ��оȷ���ޤ�Ʒ�(1.0��2.1 %)�ˡ��ޤ���Ǣ�ɳ�ĥ��2 mg/kg��(0.6 %)�ǤΤ�ǧ���졤��������¡�Ѱۤ�ͭ�����ưʪ�ϡ��оȷ���9ɤ(5.5 %)��2 mg/kg����7ɤ(4.4 %)��10 mg/kg����6ɤ(4.2 %)��50 mg/kg����5ɤ(3.0 %)�����250 mg/kg����3ɤ(2.7 %)�Ǥ��ä�����������¡�Ѱۤ�ȯ��Ψ�ˤ��оȷ����︳ʪ����Ϳ���Ȥδ֤�ͭ�պ��Ϥʤ����ޤ������̤���ؤ������÷�����ǧ����ʤ��ä���
��������륢�˥��������ˤĤ��ơ�2,6-������륢�˥��ΰ����ΤǤ���2,3-��3)��2,4-��(̤ȯɽ)�����3,4-��4)�Υ�åȤǤ�ȿ����Ϳ�����ˤĤ��Ƥ��Τ��Ƥ��ꡤ�����˶��̤��ƥ�ȥإ⥰���ӥ��ɤ�ȼ���Ϸ����Ϸ�긫������Ϸ����Ϸ�ȴ�Ϣ����¤�����ȿ���������Ū�Ѳ��¤Ӥ˾����濴���κ�˦�������ħ�Ȥ����¡���Ф���ƶ���ǧ����Ƥ��롥�ޤ�����¡�ˤ����Ƥϡ�2,3-�Τ���Ƭ���प���Ǣ�ٴɳ�ĥ�ʤɤ��Ѳ���2,4-�Τ����3,4-�Τ�ͺ�ζ��Ǣ�ٴɾ���ξ˻�ũ���ä�ǧ����Ƥ��롥����»ܤ���2,6-������륢�˥��Υ�åȤ��Ѥ���28���֤�ȿ���и���Ϳ������ˤ����Ƥ⡤��ա���¡���¡����¡�ʤɤ��Ф��������ƶ���ǧ���줿��
����դ��Ф���ƶ��ˤĤ��ơ�250mg/kg���ǻ�ͺ�˥�ȥإ⥰���ӥ�ǻ�٤����ä�ǧ���졤�����ͺ�Ǥ��ַ������쿧��ǻ�٤���ӥإޥȥ���å��ͤθ��������¤Ӥ�ʿ���ַ�����Ѥι��ͤ����ʿ���ַ��쿧��ǻ�٤����ͤ�ǧ���줿�������Υ�ȥإ⥰���ӥ��ɤ�����Ϸ�긫�ȴ�Ϣ���ơ��¡���ַ����˲�ж�ʤ�����إ⥸�ǥ����������ä���ͺ��ǧ���줿����������ظ�����250mg/kg���λ��ǧ���줿���ӥ��ӥ�����ä⡤��Ҥδ�¡���Ф���ƶ��˲ä��ơ��ַ����˲�ж�ʤȴ�Ϣ�����Ѳ��Ǥ����ǽ�����ͤ����롥����ˡ�Ʊ�����־��ַ������÷�������ͺ�ˡ��¡�ο�¤��������÷�����ͺ��ǧ���줿�����������Ϸ���Ф����������¤��ж�ʤ�����긫�ȹͤ����롥�ޤ���250mg/kg���λ�ͺ��ǧ���줿�¡���̤����äϡ������������ȿ���Ū�Ѳ��ˤ���ΤȻפ��롥
��˧��²���ߥ�ʪ�ϥ�ȥإ⥰���ӥ��ɤ�ȼ���Ϸ����Ϸ��浯��5)�����Ҥΰ����Τˤ����Ƥ��Ϸ����Ϸ��ȯ������ǧ����Ƥ��뤬��2,6-������륢�˥��ˤ����Ƥ��դ��Ф���Ʊ�ͤαƶ���ͭ�����Τȹͤ����롥
���ʤ���50mg/kg�����¡�Υإ⥸�ǥ�����夬�оȷ���ǧ���줿��������٤����ͺ��1ɤ��ǧ�����������η�ճظ����긫�������ϰϤΤ�Τǡ��������ˤ����Ƥ�Ʊ���٤Υإ⥸�ǥ�����夬�оȷ���1ɤ�ˤ�ǧ����Ƥ��뤳�Ȥ��顤�︳ʪ������Ϳ�ˤ���դ��Ф���ƶ��������ΤǤϤʤ���Ƚ�Ǥ��줿��
����¡���Ф���ƶ��ˤĤ��ơ�250mg/kg����ͺ�˴�¡���н��̤����ä�ǧ���졤�����ȿ��ظ����Ǥϴ�¡�˾����濴���κ�˦���礬50mg/kg����ͺ1ɤ����1ɤ�ˡ�250mg/kg���Ǥ�ͺ4ɤ����ӻ�3ɤ��ǧ���줿����������ظ�����50mg/kg�ʾ�η��ǻ��ǧ���줿�����쥹�ƥ��ݥ�����ä����250mg/kg���ǻ��ǧ���줿GOT��������ӥ��ӥ�����ä⡤��¡���Ф���ƶ��ȴ�Ϣ�����Ѳ��ȹͤ����롥
����¡���Ф���ƶ��ˤĤ��ơ������ȿ��ظ�����250mg/kg���λ�ͺ����Ƭ���प��Ӿ㳲���줿Ǣ�ٴɤκ������ȹͤ����빥������Ǣ�ٴɤ����ä�ǧ���졤�����ͺ�Ǥ϶��Ǣ�ٴɾ���ξ˻�ũ�����ä����������졤��Ǥ�Ǣ�ٴɤΤӤޤ�����ĥ��ǧ���졤��ͺ�Ȥ��¡���н��̤Ϲ��ͤ�����ͺ��Ǣ������Ʊ����ǧ���줿Ǣ�̤����ä��������ظ�����ͺ��ǧ���줿̵���������ä⡤��¡���Ф���ƶ��ȴ�Ϣ�����Ѳ��ȹͤ����롥
���ʤ���Ǣ������¤Ӥ˥ʥȥꥦ�ࡤ���ꥦ�ࡤ����ѥ�����ӥ��ȥ���ǻ�٤����ͷ�����Ǣ�̤����ä�ȼ����Τǡ��ʥȥꥦ�ࡤ���ꥦ���18�����������̤ˤ��Ѳ���ǧ����ʤ��ä���
��������륢�˥��ο�¡���Ф���ƶ��Ȥ��ơ����Ҥ����褦��2,3-�Τ���Ƭ���प���Ǣ�ٴɳ�ĥ�ʤɤ��Ѳ���2,4-�Τ����3,4-�Τ�ͺ�ζ��Ǣ�ٴɾ���ξ˻�ũ���ä�ǧ����Ƥ��뤬��2,6-�ΤǤϤ����2,3-�Τ�2,4-�Τ����3,4-�Τ�ǧ������Ѳ��Τ�����⤬ǧ���줿��
���ʾ���Ѳ��˲ä��ơ�250mg/kg���ǻ�ͺ����Ϳ���Ͻ���η��٤ʼ�ȯ��ư�㲼����۲��⡤���Ϥ���Ӽ�ȯ��ư�̤����ͤ�����ν����ä�������ǧ���줿�ۤ������3ɤ�ϵ�ʰ��̾��֤��Ѳ���ȼ�ä��λ���֤Ȥʤä����������˻�������������ưʪ�ˤ���¸ưʪ��ǧ���줿�Ѳ��ȼ�Ū�����������¡����¡������¡�ˤ�����������Ū�Ѳ�����ȥإ⥰���ӥ����¤Ӥ����ӥ��ӥ������쥹�ƥ����롤�ȥꥰ�ꥻ�饤�ɡ�LDH��GOT��GPT�����g-GTP�ι��ͤʤɤδε�ǽ�ΰ۾������긫��Ǣ�����Ǥ���ӥ��쥢���˥�ι��ͤʤɤοյ�ǽ�ΰ۾������긫��ǧ���줿���ޤ������դ������˦���硤�������������¤Ӥ��¡����ӥ�����Υ��ѷϺ�˦�������ǧ���줿�����������Ѳ�����¸ưʪ�Ǥ�ǧ����Ƥ��ʤ����Ȥ��顤�︳ʪ�������������٤�ȯ���������Ȥˤ�륹�ȥ쥹�����ð�Ū�ƶ�6)�ˤ���Τȿ仡����롥
���ʤ�����˹þ��������н������ä�ǧ���줿�������ȿ���Ū�ˤ��Ѳ���ǧ���줺�������ƶ�������긫�ǤϤʤ���Ƚ�Ǥ��줿������ˡ���ͺ��ή��ǧ���줿����Ϳľ����Ѳ��Ǥ��ꡤ�ܺ٤����ѻ��Ǽ�Ω���зϤ��Ф���ƶ��������Ѳ���ǧ����Ƥ��ʤ����Ȥ��顤�︳ʪ���������ƶ��ˤ���ΤǤϤʤ�����Ϳ�դ��Ф������ȿ���Ȳ��롥
��50mg/kg���ˤ����Ƥϡ���ͺ�˼�ȯ��ư�㲼����Ӵ�¡�δκ�˦�����㡤����˻�ˤ������쥹�ƥ���������ä�ǧ���졤�︳ʪ������Ϳ�ˤ�������ƶ������٤�ȯ�����Ƥ����Τ�Ƚ�Ǥ��줿��
���ʤ���ͺ��Ǣ�����ǥ���ѥ�ǻ�٤����ͤ�ǧ���줿�������ϰϤ��Ѳ��ǡ��оȷ��������ͷ����ˤ��ä����Ȥˤ��Ȼפ�졤¾�˴�Ϣ����긫��ǧ����ʤ��ä����Ȥ��顤������Ū�յ��Ϥʤ���Τ�Ƚ�Ǥ��줿���ޤ����������ˤ�����,Ǣ�楱�ȥ���ǻ�٤����ä�ǧ���줿������Ϳ������θ����Ǥ�ǧ����ʤ��ä��Ѳ��Ǥ��ꡤ��ȯŪ�긫�ȹͤ����롥
����ưʪ���Ф��ơ�250mg/kg���Dz��ο������ͷ���������徲����ͭ�դ����ͤ�ǧ���졤Ʊ���λ�ưʪ�ˤ����Ƥϡ����л����������ͷ����������������ͭ�դ����ͤ�ǧ���줿�������η�̤ϡ�����ˤ�������ҷ������뤤��������Ф��벿�餫�αƶ������Ƥ����Τȹͤ����뤬�����㤪��Ӳ����Τ�ޤ������Ϥ������ʬ��ϴﴱ�������ȿ���Ū�Ѳ���ǧ���줺��ȯ�����������餫�ˤ��뤳�ȤϽ���ʤ��ä���
���ʤ��������������ǧ����ʤ���������Ω�㡤ǥ������Ω�㤪���������˴����ưʪ������Ϳ���˻�ȯŪ��ǧ���줿��
��10mg/kg����1�Ф�ǧ���줿��������Ω�ϡ���ͺ�Ȥ��������Ū�۾��ǧ���줺����������������η�̤��顤���ᥢ�μ�ʤɤγ�Ū�ɷ�ˤ�äƵ�ǥ��������Τ�Ƚ�Ǥ��졤���줬��������Ω�θ����ˤʤä���Τȹͤ����롥�ޤ����оȷ��λ�ˤ����ơ���������ȯ��ٻߴ�����12���ֻ�³����1ɤ�ˤĤ��Ƥǥ����������Τ�Ƚ�Ǥ��줿��
��ǥ������Ω���оȷ���ޤ����Ϳ���Ǥ��줾��1�Ф���ǧ���줿������ͺ�Ȥ��������Ū�۾��ǧ����ʤ��ä���ʬ�ڸ�Ӯ���ư��Ȥ餺��ʬ�ڤ������ޤǤ���������˴������ưʪ��10��50�����250mg/kg����1ɤ���Ĥߤ�줿�����������̾��֤���Ӳ����Τ�ޤ������ϴﴱ�˰۾��ǧ����ʤ��ä����Ȥ��顤��Ϳ�Ȥ�̵�ط��ʶ�ȯŪ�긫��Ƚ�Ǥ��줿��
����ưʪ�ˤ����Ƥϡ��︳ʪ����Ϳ���Ǿ�����γ�ɽ�۾郎���ޤ����оȷ���ޤ����Ϳ������¡�Ѱۤ��ߤ�줿����������⼫��ȯ��Ū��ǧ������Τǡ�ȯ��Ψ��ͭ�պ�����������������ǧ����ʤ����Ȥ��顤�Ŵ�����������Ѳ��ǤϤʤ���Ƚ�Ǥ��줿��
���ʾ�η�̤��顤2,6-������륢�˥��Υ�åȤؤ�ȿ���и���Ϳ�ˤ�������ƶ�������˷�ա���¡����¡������¡�ʤɤ�ǧ���졤��ưʪ�ؤ�ȿ����Ϳ�ˤ��̵�ƶ���(NOEL)�ϻ�ͺ�Ȥ��10mg/kg/day�ȷ������줿���ޤ���ͺ��ưʪ������ǽ���Ф���̵�ƶ��̤�250mg/kg/day�����ưʪ������ǽ����ӻ�ưʪ��ȯ���ˤĤ��Ƥϡ��徲�������ͤ���������������ͤ�ǧ���졤̵�ƶ��̤Ϥ������50mg/kg/day�ȷ������줿��
| 1) | Richardson ML and Gangolli S:In "The Dictionary of Substances and their Effects", Volume 3, The royal society of chemistry, England(1993) pp.592-594 |
| 2) | IUCLID(International Uniform Chemical Information Data Base)Data Set, EU(2000)�� |
| 3) | ���������:2,3-������륢�˥��Υ�åȤ��Ѥ���28����ȿ���и���Ϳ�����������ʪ����������5:133-146(1997) |
| 4) | �����Ƿ��:3,4-������륢�˥��Υ�åȤ��Ѥ���28����ȿ���и���Ϳ�����������ʪ����������3:143-156(1996) |
| 5) | ë�ܵ�ʸ:����ճ�-�ҥȤ�ưʪ������-����������(1982)p.708. |
| 6) | �������������ز��ԡ������������ȿ��؎������ڥå������(2000)pp.383-433�� |
| Ϣ���� | |||
| ���Ǥ�ԡ� | ���������� | ||
| �ô���ԡ� | ���ġ��ơ���ƣ���顤���ڡ�� ����������ƣ�Ȼ��ݡ����������� ��ƣ��ɧ | ||
| 7�ܻ���ʪ�ʳذ�������� | |||
| ��229-1132����������ϸ��Զ�����3-7-11 | |||
| Tel 042-762-2775 | Fax 042-762-7979 | ||
| E-mail anzen@abox5.so-net.ne.jp | |||
| Correspondence | |||
| Authors: | Makiko Yamaguchi(Study director) Atsushi Noda, Masaya Ito, Hiroshi Akagi, Tadami Sugimoto Shiho Fujinami, Naomi Kon, Yoshihiko Ito | ||
| Research Institute for Animal Science in Biochemistry and Toxicology | |||
| 3-7-11 Hashimotodai, Sagamihara-shi, Kanagawa, 229-1132, Japan | |||
| Tel +81-42-762-2775 | Fax +81-42-762-7979 | ||
| E-mail anzen@abox5.so-net.ne.jp | |||