 ),アルカリフォスファターゼ活性(P-ニトロフェニルリン酸基質法),GOT 活性(SSCC法),GPT活性(SSCC法), 総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-p-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(電量滴定法),A/G比(計算)について分析した.
),アルカリフォスファターゼ活性(P-ニトロフェニルリン酸基質法),GOT 活性(SSCC法),GPT活性(SSCC法), 総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-p-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(電量滴定法),A/G比(計算)について分析した.
その結果,雄では,200 mg/kg以上の投与群において,脾臓が暗色を呈する例が増加し,肝臓の比体重値ならびに脾臓の重量および比体重値が有意な高値を示した.200 mg/kg以上の投与群の脾臓において,色素沈着,髄外造血およびうっ血が対照群と比較して有意に増強し,また,赤血球数,血色素量,ヘマトクリット値および平均赤血球血色素濃度の減少ならびに網状赤血球比率の増加が認められた.これらは,いずれも用量に伴って変化し ており,200 mg/kg以上の投与量は,軽度な溶血性貧血を惹起するものと考えられる.
すべての 1-アミノアントラキノン投与群において腎臓の近位尿細管上皮細胞の細胞質内に好酸性滴状物の形成,およびeosinophilic bodyの形成が増強した.血漿無機質についても,200 mg/kg以上の投与群において,塩素濃度が,また,1000 mg/kg投与群では,カリウム濃度も有意に減少したことから,40 mg/kg以上の投与量は,腎臓に器質的変化を生じさせ,さらに,200 mg/kg以上の投与量は軽度な機能的変化を生じさせる量であると考えられる.
雌動物では,1-アミノアントラキノン各投与群において,哺育開始後,全身状態の悪化を示し,哺育行動が廃絶するものが増加した.これらのうち,一部は,全出生児が死亡した後に回復したが,200 mg/kg以上の投与群では,瀕死状態になるものが認められ,1000 mg/kg投与群では2例が死亡した.
剖検では,肝臓および脾臓の暗色調変化が1-アミノアントラキノン各投与群でみられ,出生児生存例では,1000 mg/kg投与群において脾臓重量比体重値が有意に増加した.これらの動物の血液学的検査では,いずれの動物も分娩により貧血傾向を示していた.病理組織学的検査において,200 mg/kg以上の投与群の脾臓に色素沈着およびうっ血が対照群と比較して有意に増強し,肝臓では,少なくとも1000 mg/kg投与群においてクッパー細胞の色素沈着が有意に増強した.これらのことから,雌においても200 mg/kg以上の投与量により,軽度な溶血性貧血が惹起されるものと考えられた.
一方,哺育開始後,全身状態が不良となり,死亡,瀕死あるいは出生児が死亡した動物の腎臓の病理組織学的検査では,尿細管上皮細胞に壊死および再生,空胞変性ならびに脂肪滴がみられ,とくに,瀕死屠殺および死亡動物ではその程度が著しかった.これらのことから,1-アミノアントラキノンの40 mg/kg以上の投与量は,腎臓の尿細管上皮に壊死および再生を惹起し,さらに200 mg/kg以上の投与量は瀕死あるいは死亡に至らせる毒性発現量であると考えられる.
一方,生殖発生毒性に関しては,交尾率および同居開始から交尾成立までに要した日数に対照群と 1-アミノアントラキノン各投与群との間で有意差は認められなかった.また,着床および受胎率にも対照群と1-アミノアントラキノン各投与群との間で有意差は認められず,妊娠雌の黄体数,着床数および着床率にも対照群と1-アミノアントラキノン各投与群との間で有意差は認められなかったことから,1000 mg/kgまでの1-アミノアントラキノンに雌雄の交尾および受胎能力ならびに胚の着床に対する影響はみられなかった.また,分娩状態,出産率および妊娠期間に影響は認められなかった.しかし,分娩後,1-アミノアントラキノン各投与群で哺育行動の廃絶が認められ,1-アミノアントラキノンの40 mg/kg以上の投与量は哺育状態に悪影響を及ぼすものと考えられた.
分娩率,新生児の出生率には,1-アミノアントラキノンの影響は認められなかった.
新生児生存率は,低値の傾向を示した.しかし,児の体重には影響は認められず,また,1000 mg/kgまでの投与量には催奇形作用はないものと考えられた.
これらのことから本試験条件下では,1-アミノアントラキノンの反復投与毒性に関する無影響量は,雌雄ともに40 mg/kg/dayを下回る量と推定される.また,生殖発生毒性に関する無影響量は,雄では,1000 mg/kg/day,雌では,40 mg/kg/dayを下回る量と推定される.
投与液は,室温,遮光条件下で保管し,調製後8日以内に投与した.投与液中の被験物質は,室温,遮光条件下で少なくとも8日間安定であり,また,使用した投与液にはほぼ所定量の1-アミノアントラキノンが均一に含有されていたことを確認した.
各動物は,温度24±1℃,相対湿度55±5%,換気回数約15回/時間,照明12時間(午前7時〜午後7時)に条件設定されたバリアーシステムの飼育室で,金属製金網床ケージ(日本ケージ)に個別に収容して飼育し,固型飼料(CA-1,日本クレア)および水道水を自由に摂取させた.妊娠18日以後の母動物には,飼育ケージの床に金属製床板を敷き,床敷として木製チッ プ(ホワイトフレーク(R) ,日本チャールス・リバー)を適宜供給した.供給した飼料,水および床敷には試験に支障を来す可能性の考えられる混入物はなかった.
その結果,200 mg/kg以上の1-アミノアントラキノンは,14日間の反復経口投与によって雌雄ラットに軽度な正常血球性,正常色素性の貧血を惹起し,また,雄ラットの肝臓に色調変化をもたらした.さらに,1000 mg/kg投与は,雌の肝臓,および雌雄の脾臓にも色調変化をもたらし,雌雄の肝臓重量および雄の精巣重量を増加させ,血液生化学検査において尿素窒素濃度の上昇とアルカリフォスファターゼ活性の低下が認められ,雄の腎機能ならびに雌の肝臓機能にも軽度な影響を及ぼすことから,これらの投与量は,雌雄動物に対する影響量であることが示唆された.このことから,併合試験では,予備試験と同様に,最高用量には,1000 mg/kg/dayを選び,以下を公比5で除して中間用量を200 mg/kg/day,最低用量を40 mg/kg/dayに設定した.
雌雄とも,全例について試験期間中毎日観察した.
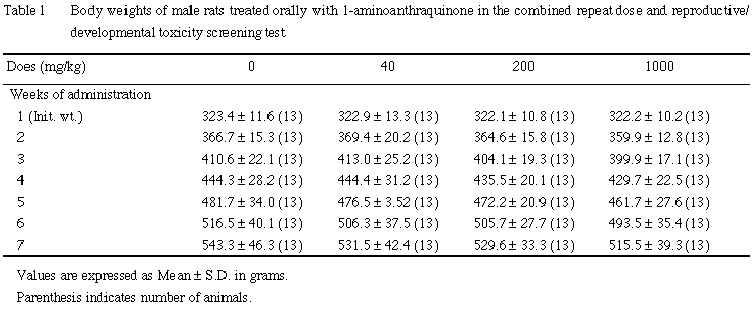
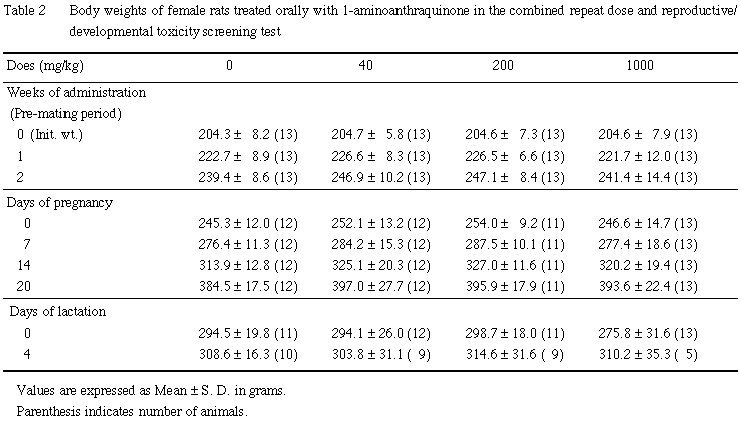
B. 体重
雌雄とも,全例について体重を試験期間中週1回〔雄:投与1,8,15,22,29,36,42日,雌:投与1,8,15日〕および解剖日に測定した.投与22日までに交尾が成立しなかった雌は,投与22日にも体重を測定した.また,交尾成立雌では,妊娠0,7,14,20日,分娩した雌では,分娩後1および3日(哺育0および4日)の体重を測定した.
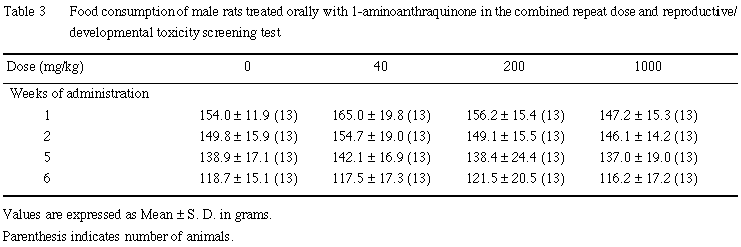
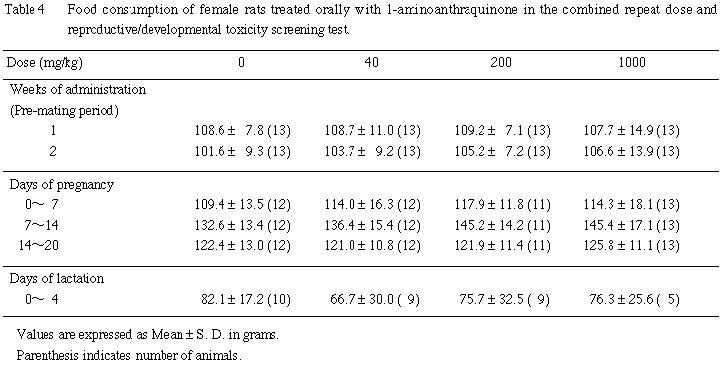
C. 摂餌量
雌雄とも,全例について体重測定日と同日に餌重量を測定し,測定日から次の測定日までの間の摂餌量を算定した.2週間の交配期間中の摂餌量は測定しなかった.交尾成立雌では,妊娠 0〜7, 7〜14, 14〜20日の,さらに,分娩した雌では,哺育0〜4日の摂餌量を測定した.
D. 交配
交配は,投与15日(投与開始日=投与1日)の夕方から最長2週間,同一群内の雌雄を1対1で同居させて行った.交尾成立の確認は,毎朝,腟栓および腟垢中の精子の存在を調べることにより行い,交尾が確認された雌は,その日を妊娠0日と起算して雄から分離し,個別に飼育した.交配結果から,各群について交尾率[(交尾動物数/同居動物数)×100],受胎率[(妊娠動物数/交尾動物数)×100],同居開始日から交尾確認日までの日数およびその間に回帰した発情数を求めた.
E. 分娩状態
各群とも交尾成立雌は,全例を自然分娩させた.分娩状態の直接観察は,可能なものについて行った.
F. 分娩日の算定
分娩の確認は,午前9時〜11時に限定し,この時間帯に分娩が完了していることを確認した動物について,その日を哺育0日,その前日を分娩日と規定した.午前11時を過ぎて分娩した動物については,翌日を哺育0日とした.分娩を確認した全例について妊娠期間(妊娠0日〜分娩日の日数)を算定し,出産率[(生児出産雌数/妊娠雌数)× 100]を各群について求めた.
G. 病理学的検査
a) 雄動物
イ. 剖検,器官重量および病理組織学的検査
最終投与日の投与終了後から絶食を開始し,翌日〔投与43日相当日〕にペントバルビタール深麻酔下で放血・致死させて剖検した.その際,全例について肝臓,腎臓,胸腺,脾臓,精巣および精巣上体の重量を測定した.また,これらの器官のうち,精巣および精巣上体はブアン液に固定して保存し,その他の器官および脳,心臓,骨髄,副腎,膀胱ならびに剖検において異常を認めた器官は,10%ホルマリンに固定して保存した.これらの器官のうち,腎臓および脾臓は各群の全例について,その他の器官は,対照群および1000 mg/kg投与群の全例について組織切片を作製し,ヘマトキシリン−エオジン染色を行って病理組織学的検査を行った.対照群の1例,40 mg/kg投与群の2例,200 mg/kg投与群の2例および1000 mg/kg投与群の1例の腎臓の組織切片については,PAS染色も施して観察した.なお,脾臓重量の測定および骨髄の病理組織学的検査は,予備試験において軽度な貧血が認められたため追加した.
ロ. 血液学的検査
全例について,剖検に先立ち,ペントバルビタール麻酔下で腹部後大静脈よりEDTAを抗凝固剤として採血し,赤血球数(RBC),白血球数(WBC) ,血色素量(Hb) ,平均赤血球容積(MCV),ヘマトクリット値(Ht) ,平均赤血球血色素量(MCH) ,平均赤血球血色素濃度(MCHC) ,血小板数を多項目血液自動測定機(Coulter Counter Model S-PLUS IV)により測定し,白血球百分比はWright-Giemsa染色を行い,また,網状赤血球比率はBrecher法を用い,光学顕微鏡下で観察して算出した.網状赤血球比率の測定は,予備試験において軽度な貧血が認められたため追加した.
ハ. 血液生化学的検査
全例について,血液学的検査のための採血に引き続き,ヘパリンを抗凝固剤として採血し,それぞれ血漿を分離して遠心方式生化学自動分析装置(COBAS- FARA)およびNa-K-ClアナライザーIT-3型を用い,総蛋白濃度(ビウレット法),アルブミン濃度(BCG法),総コレステロール濃度(COD・DAOS法) ,ブドウ糖濃度(グルコキナーゼ・G6PDH法), 尿素窒素濃度(ウレアーゼ・Gl.DH法),クレアチニン濃度(Jaff ),アルカリフォスファターゼ活性(P-ニトロフェニルリン酸基質法),GOT 活性(SSCC法),GPT活性(SSCC法), 総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-p-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(電量滴定法),A/G比(計算)について分析した.
),アルカリフォスファターゼ活性(P-ニトロフェニルリン酸基質法),GOT 活性(SSCC法),GPT活性(SSCC法), 総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-p-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(電量滴定法),A/G比(計算)について分析した.
b)雌動物
イ. 剖検,器官重量および病理組織学的検査
交尾不成立雌は交配期間終了日に,交尾したが分娩しない雌は妊娠25日相当日に,それぞれエーテル深麻酔下で放血・致死させ,剖検した.分娩した雌は哺育4日に,また,瀕死状態と判断された動物および死亡動物は,その都度剖検した.妊・不妊のいずれの例においても卵巣および子宮を摘出し,子宮についてはSalewski法9)を応用して着床痕を染色して着床数を確認した.卵巣はブアン液に固定して保存し,実体顕微鏡下で黄体数を 数えた.不妊例および交尾不成立例の卵巣については,病理組織学的検査を行った.また,肝臓,腎臓,脾臓および胸腺の重量を,死亡例を除く全例について測定した.これらの器官および脳,心臓,骨髄,副腎,子宮,膀胱および剖検において異常を認めた器官は10 %ホルマリンに固定して保存した.これらの器官のうち,腎臓および脾臓は各群の全例について,その他の器官は,1000 mg/kg 投与群および対照群の全例について組織切片を作製し,ヘマトキシリン−エオジン染色を施して病理組織学的検査を行った.対照群の1例および1000 mg/kg投与群の2例の腎臓の組織切片については,PAS染色も施した.なお,脾臓重量の測定および骨髄の病理組織学的検査は,予備試験において軽度な貧血が認められたため追加した.
ロ. 血液学的検査
後述のように,分娩終了後に貧血様の症状を示し,また,分娩後の時間が経過しているにもかかわらず,腟から血様分泌物を排出する動物も認められ,全身状態の悪化した動物が多発したため,貧血の有無と血液凝固不全の有無とを確認するため,哺育4日の剖検あるいは瀕死屠殺に先立ち,全例について以下の項目について検査した.血液は,ペントバルビタール麻酔下で腹部後大静脈より,まず,クエン酸ナトリウムを抗凝固剤として血液凝固時間自動測定装置(クロテック)によるプロトロンビン時間(PT)および活性部分トロンボプラスチン時間(APTT)の測定用に採取し,次に,EDTAを抗凝固剤として雄と同様の血液学的検査のために血液を採取した.
哺育0日に産児数(生存児+死亡児)を調べ,児の分娩率[(産児数/着床痕数)×100]および出生率[(出産生児数/着床痕数)× 100]を求めた.また,産児の外表異常の有無および性別を調べた.
B. 死亡児数の算定
死亡児数を毎日調べ,哺育0日の生存率[(生児数/産児数)× 100]および哺育4日の生存率[(哺育4日の生児数/哺育0日の生児数)× 100]を求めた.死亡児は剖検し,胸腔および腹腔内の器官を除去した後,エタノールに固定して保存した.
C. 体重測定
哺育0日および4日に一腹単位で雌雄別に体重(litter 重量) を測定し,[litter 重量/測定児数]を各腹について求めた.
D. 剖検
哺育4日に全例をエーテル吸入により致死させ,剖検した.胸腔および腹腔内の器官は,一括して摘出し,一腹ごとに10%ホルマリンに固定して保存した.カーカスは,一腹ごとにエタノールに固定して保存した.
 法13) により対照群と各被験物質投与群との間で平均値の差の検定を行った.分散が一様でなかった場合,および分散が0となる群が存在するときは,Kruskal-Wallis順位検定14) を行い,群間に有意性が認められた場合に,対照群と1-アミノアントラキノン各投与群との差についてDunnett型12)あるいはScheff
法13) により対照群と各被験物質投与群との間で平均値の差の検定を行った.分散が一様でなかった場合,および分散が0となる群が存在するときは,Kruskal-Wallis順位検定14) を行い,群間に有意性が認められた場合に,対照群と1-アミノアントラキノン各投与群との差についてDunnett型12)あるいはScheff 型13) の検定を行った.有意水準は,5%および1%とした.病理組織学的検査結果については,Mann-WhitneyのU検定15) を用いて検定した.
型13) の検定を行った.有意水準は,5%および1%とした.病理組織学的検査結果については,Mann-WhitneyのU検定15) を用いて検定した.
雌では,妊娠末期までいずれの投与群にも死亡動物は認められなかった.しかし,対照群の1例が,妊娠22日に死亡した.また,1000 mg/kg投与群の2例は,分娩終了確認時までは,尿および糞便の色調変化などは同群の他の動物と同様な変化のみを示していたが,哺育行動の廃絶,腟口周囲の血様汚染などが認められ,それぞれ哺育4日および3日に死亡した.また,雌では,200 mg/kg投与群の1例および1000 mg/kg投与群の2例が,哺育開始後,被毛汚染,削痩,蒼白,自発運動の減少,閉眼など全身状態が悪化したため,屠殺して剖検した.
生存例の一般状態については,対照群を含むすべての投与群に軟便および投与後一過性の流涎が観察された.軟便は,投与期間の初期に雌雄動物の全例に認められた.流涎は,雄では,対照群の約半数およびすべての投与群のほぼ全例に,また,雌では,対照群を含むすべての投与群の約半数に認められた.流涎の認められた期間は,全投与期間にわたったが,いずれの投与群も雄は雌と比較して高頻度で観察された.
1-アミノアントラキノン投与群のみに観察された変化としては,オレンジ色の尿の排泄が40 mg/kg以上の投与群の雌雄動物の全例に,また,オレンジ色の便の排泄が200 mg/kg以上の投与群の雌雄動物の全例に観察された.これらの変化は,雌雄ともに投与開始後から認められ,剖検日まで継続して観察された.
その他の変化としては,貧毛あるいは脱毛および脱毛部の痂皮形成が,対照群を含む各群に1〜2例ずつ観察された.
雌では,いずれの時期も,1-アミノアントラキノン投与の影響は認められなかった.また,摂餌量には,雌雄とも有意性のある変化は認められなかった.
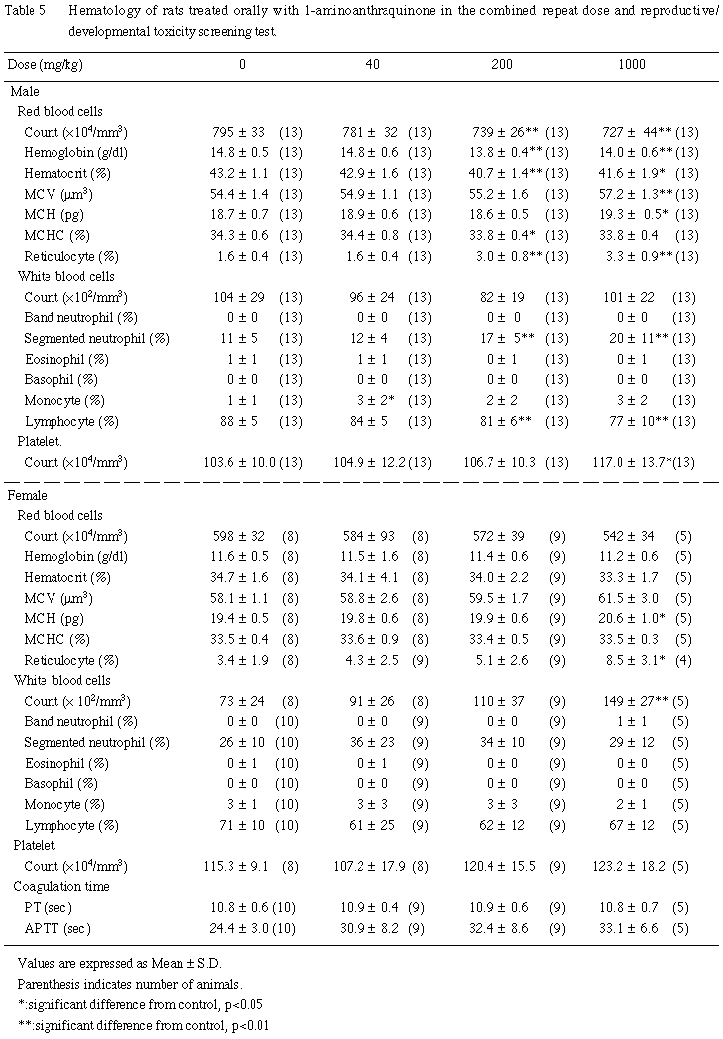
(1)血液学的検査所見 (Table 5)
200 mg/kg以上の投与群において,軽度ではあるが,有意な赤血球数の減少ならびに網状赤血球比率の増加が認められ,さらに,1000 mg/kg投与群では,平均赤血球容積および平均赤血球血色素量の有意な増加がみられた.血色素量,ヘマトクリット値および平均赤血球血色素濃度については,200 mg/kg以上の投与群間ではほぼ同程度であったが,対照群と比較すると,血色素量およびヘマトクリット値は,両投与群において有意な減少が,また,平均赤血球血色素濃度については,200 mg/kg投与群において有意な減少が認められた.
血小板数については,1000 mg/kg投与群において有意な増加がみられた.
白血球数については,いずれの 1-アミノアントラキノン投与群においても有意性のある変化は認められなかったが,200 mg/kg以上の投与群において,有意な分葉核好中球比率の増加およびリンパ球比率の低下が認められた.
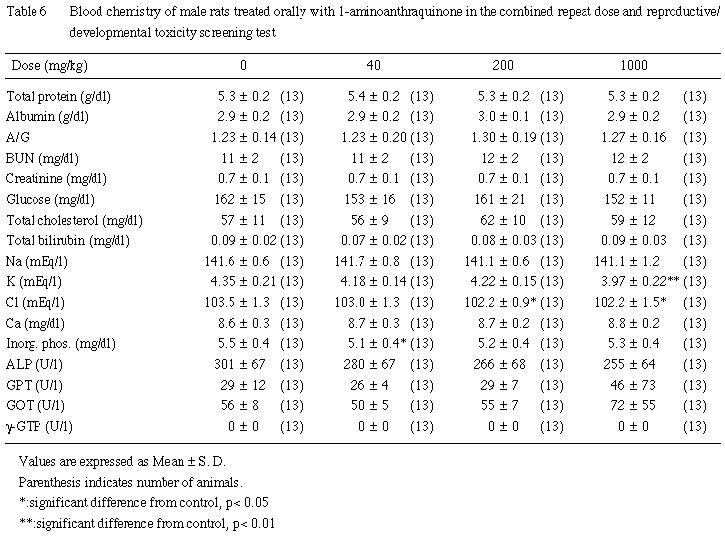
(2) 血液生化学的検査所見 (Table 6)
総蛋白濃度,アルブミン濃度,総コレステロール濃度,ブドウ糖濃度,尿素窒素濃度,クレアチニン濃度,総ビリルビン濃度およびA/G比については,いずれの1-アミノアントラキノン投与群においても有意性のある変化は認められなかった.
血漿無機質については,塩素濃度が200 mg/kg以上の投与群において,また,カリウム濃度が1000 mg/kg投与群において有意に減少した.アルカリフォスファターゼ活性が用量に依存して低下する傾向が認められたが,対照群との間に有意差は認められなかった.GPTおよびGOT活性については,1000 mg/kg投与群の1例が異常な高値を示したほかには,異常値を示すものはなく,対照群と1- アミノアントラキノン各投与群との間に有意差は認められなかった.
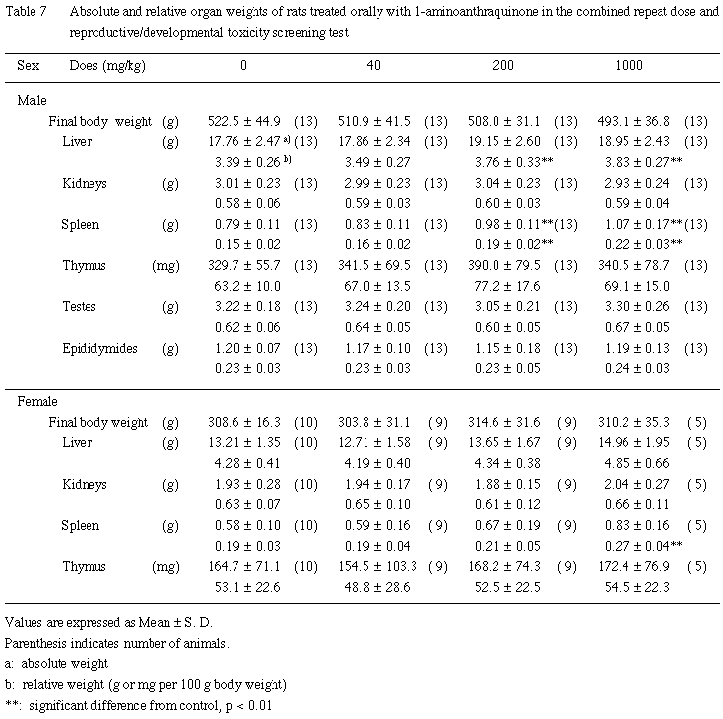
(3) 器官重量 (Table 7)
200 mg/kg以上の投与群において肝臓の比体重値ならびに脾臓の重量および比体重値が有意な高値を示した.このほかにはいずれの1-アミノアントラキノン投与群においても有意差のある器官重量の変化は認められなかった.
(4) 剖検所見
200 mg/kg以上の投与群では,脾臓が暗色を呈する例が多く,1000 mg/kg投与群では脾臓の腫大する例があった.40 mg/kg投与群の脾臓に変化はなく,その他の器官に毒性変化とみなされる所見はなかった.
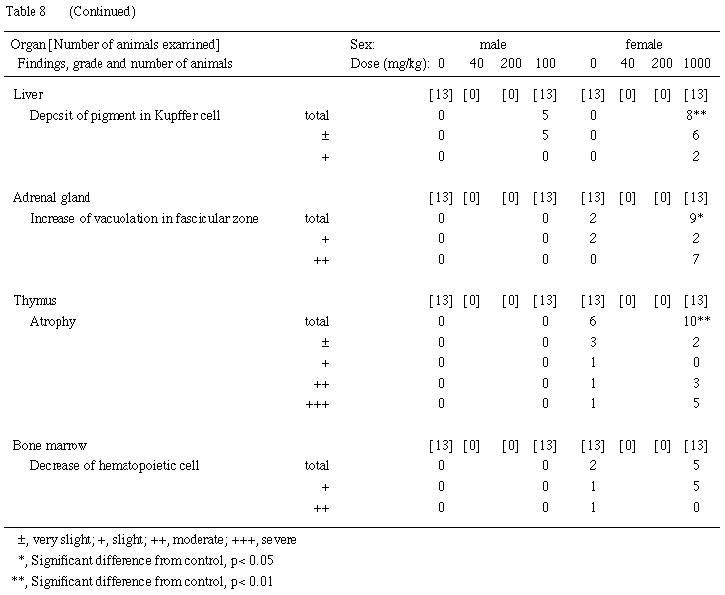
(5) 病理組織学的検査所見 (Table 8)
各器官における観察所見を以下に示す.
(腎臓)
40 mg/kg投与群の11例,200および1000 mg/kg投与群の13例全例の近位尿細管上皮細胞の細胞質内に,好酸性の滴状物がみられた.この滴状物は,eosinophilic bodyに類似するが,形態はやや異なり,周囲にhaloは認められず,細胞質内に数個が含まれ,より好酸性が強く,ほぼ円形を呈しており,PAS染色陰性であった.同様の滴状物は対照群にも認められたが,1例のみでごく少数であり,対照群と比較すると,1-アミノアントラキノン各投与群では有意に増強していた.さらに,対照群を含む各群で,近位尿細管上皮細胞にeosinophilic bodyの形成が認められたが,その頻度は上記の滴状物と同様に1-アミノアントラキノン各投与群では有意に増強した.
(脾臓)
200 および1000 mg/kg投与群では,色素沈着,髄外造血およびうっ血が対照群に比較して有意に増強した.
(肝臓)
1000 mg/kg投与群の5例のクッパー細胞に,ごく軽度な色素沈着が認められた.その他,小葉周辺部の肝細胞の脂肪滴形成,髄外造血および小肉芽腫がみられたが,対照群および1000 mg/kg投与群の間に頻度および程度の差はなかった.
(心臓)
対照群および1000 mg/kg投与群に心筋の壊死巣がみられたが,両群間に頻度および程度の明らかな差はなかった.
(膀胱)
照群および1000 mg/kg投与群の各2例の粘膜固有層に,ごく軽度なリンパ球浸潤がみられたほかに変化はなかった.
(精巣)
対照群および1000 mg/kg投与群の各2例に,ごく少数の萎縮精細管がみられたほかに,変化はなかった.
その他,対照群および1000 mg/kg投与群の副腎,脳,胸腺,骨髄および精巣上体に変化はみられなかった.
B. 雌〔解剖日:哺育4日(出生児生存),哺育4日(全出生児死亡),瀕死屠殺日〕
(1)血液学的検査所見
a)哺育4日解剖例(Table 5)
1000 mg/kg投与群では,赤血球数およびヘマトクリット値がやや低値を示し,平均赤血球容積,平均赤血球血色素量および網状赤血球数がやや高値を示し,平均赤血球血色素量および網状赤血球比率に有意差が認められた.
血液凝固に関連した検査項目では,用量に依存した活性部分トロンボプラスチン時間の延長傾向が認められたが,いずれも対照群との間に有意差は認められなかった.プロトロンビン時間については,いずれの1-アミノアントラキノン投与群においても有意性のある変化は認められなかった.
白血球数は,用量に依存して増加し,1000 mg/kg投与群では有意差が認められた.
b)全出生児死亡例
いずれの動物の測定値も,同群の出生児生存例の結果と同程度であった.
c)瀕死屠殺例
哺育2日に瀕死屠殺を行った,200 mg/kg投与群の1例は,赤血球数,血色素量,ヘマトクリット値および血小板数の増加傾向が認められ,血液凝固時間の延長傾向が認められた.また,哺育3日に瀕死屠殺を行った,1000 mg/kg投与群の2例は,赤血球数,血色素量およびヘマトクリット値が哺育4日剖検例と同程度の値であったが,網状赤血球が観察されなかった.また,血液凝固時間の延長,とくに活性部分トロンボプラスチン時間の著しい延長が認められた.
(2) 剖検所見
1-アミノアントラキノン各投与群では,胸腺の萎縮,脾臓の萎縮および暗色化,副腎の腫大,腎臓の淡色化あるいは暗色化,肝臓の暗色化などがみられた.また,1000 mg/kg 投与群では,眼および口周囲の被毛汚染,ならびに腟内に暗色調粘液の貯留およびそれによると考えられる下腹部の被毛汚染がみられた.これらの所見のうち,肝臓および脾臓の暗色化は,動物の経過にかかわらずみられたが,その他の所見は,出生児の多くが死亡した例に多く観察された.また,脱水が 1000 mg/kg 投与群の全出生児死亡例に観察された.
(3) 器官重量(Table 7)
| a) | 哺育4日出生児生存例では,1-アミノアントラキノンの用量に依存した脾臓重量の増加が認められ,1000 mg/kg 投与群の比体重値には有意差が認められた.その他の器官の重量については,いずれの投与群も対照群との間に有意差は認められなかった. |
| b) | 全出生児死亡例では,1000 mg/kg 投与群に肝臓比体重値が高値であるものが,散見された.また,対照群を含む各群に腎臓比体重値が高値を示すもの,また,胸腺比体重値が低値を示すものが散見された.このほか,脾臓比体重値が著しく低値であったものが,対照群と 40 mg/kg 投与群に1例ずつ認められた.
瀕死屠殺例3例は,いずれも脾臓重量が著しい低値を示し,1000 mg/kg 投与群は2例ともに腎臓比体重値が高値を示した. |
(4) 病理組織学的所見(Table 8)
各器官における観察所見を以下に示す.
(腎臓)
対照群の1例,40 mg/kg投与群の4例,200 mg/kg投与群の2例および1000 mg/kg投与群の8例では皮質に多数の再生した尿細管上皮がみられ,しばしば,それらの腔内には壊死した尿細管上皮細胞の崩壊物を含んでいた.また,200および1000 mg/kg投与群では,崩壊物を含む尿細管腔内に石灰が沈着していた.再生した尿細管は,40および1000 mg/kg投与群の髄質にもみられた.さらに,1-アミノアントラキノン投与群では,皮質において空胞変性に陥った近位尿細管上皮細胞の散在する例が認められた.なお,対照群と比較すると,1000 mg/kg投与群で皮質および髄質の再生尿細管上皮,尿細管上皮細胞の壊死,皮質尿細管上皮細胞の空胞変性の変化の頻度および程度がいずれも有意に増強していた.近位尿細管上皮細胞における脂肪滴が,対照群を含む各群にみられたが,対照群と比較すると,1000 mg/kg投与群では頻度および程度が有意に増強した.尿細管の壊死および再生像が明らかな例は,いずれも瀕死時屠殺例や死亡例,あるいは哺育期間中に全児または半数以上の出生児が死亡した例であった.
(脾臓)
対照群の1例,40および200 mg/kg投与群の2例,1000 mg/kg投与群の4例では,濾胞の萎縮がみられ,いずれも腎臓に尿細管の壊死および再生の認められる例であった.対照群を含む各群の全例に色素沈着がみられたが,200および1000 mg/kg投与群においてその程度が有意に増強した.また,対照群を含む各群にうっ血がみられたが,200および1000 mg/kg投与群では,対照群より頻度が有意に増加した.
(膀胱)
1-アミノアントラキノン投与群に変化はなかった.
(肝臓)
1000 mg/kg投与群では,クッパー細胞の色素沈着が有意に増強した.死亡した2例の小葉中心部に肝細胞の壊死がみられ,このうち1例には巣状の壊死がみられた.
(副腎)
1000 mg/kg投与群では,束状帯細胞の空胞が有意に増加した.
(胸腺)
対照群でも萎縮する例がみられ,死亡した1例には,著しく多数のリンパ球が壊死していたが,1000 mg/kg投与群では,より多くの例の胸腺が萎縮していた.
(骨髄)
造血細胞の全体的な減少が,対照群の2例および1000 mg/kg投与群の5例にみられた.
(脳)
変化はみられなかった.
(心臓)
変化はみられなかった.
(卵巣)
不妊であったために標本を作製した例のうち,40および200 mg/kg投与群の各1例に黄体嚢胞がみられた.

交尾率,交尾成立までの日数および受胎率に対照群と 1-アミノアントラキノン各投与群との間で有意差は認められなかった.
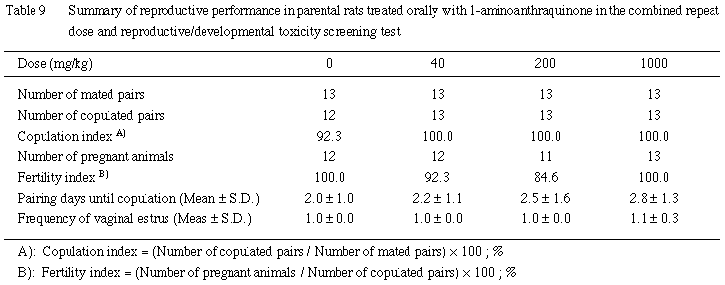
2) 分娩および哺育状態
対照群の妊娠動物12例中1例が,分娩中に死亡したほかには,いずれの投与群においても分娩状態に異常は認められなかった.
哺育状態については,対照群を含む各投与群で,哺育0日から,児集めを行わない動物が認められ,その数は1- アミノアントラキノンの用量に依存して増加した.分娩状態の観察が可能であった動物では,いずれも分娩終了後の哺育行動に異常は観察されなかった.
また,哺育行動の廃絶により全出生児が死亡した例あるいは半数以上の出生児が死亡した例が,対照群では11例中1例であったのに対し,40 mg/kg投与群では12例中4例,200 mg/kg投与群では11例中3例,1000 mg/kg投与群では13例中8例に達し,1000 mg/kg投与群では対照群との間に有意差が認められた.
3) 黄体数,着床数および着床率 (Table 10)
妊娠動物の黄体数,着床数および着床率に対照群と1-アミノアントラキノン各投与群との間で有意差は認められなかった.
4) 出産率および妊娠期間 (Table 10)
出産率および妊娠期間に対照群と1-アミノアントラキノン各投与群との間で有意差は認められなかった.
哺育0日の生存性については,1000 mg/kg投与群では,一腹平均の産児数が対照群と比較して有意に増加したが,分娩率,生児出産率および出生率には対照群との間で有意差は認められなかった.
哺育開始後,対照群を含む各群の出生児に,腹部に乳汁の貯留が認められず,体温の低下しているものがみられた.対照群では,哺育3日に1腹全例が死亡した.40 mg/kg投与群では,2腹の出生児が哺育2日に全例死亡した.200 mg/kg投与群でも2腹の出生児が哺育2日に全例死亡した.
さらに,1000 mg/kg投与群では,6腹の出生児がいずれも死亡した.このため,200 mg/kg以上の投与群の哺育4日の生存率は対照群との間に有意差は認められなかったが低値を示した.性比については対照群と1-アミノアントラキノン各投与群との間で有意差は認められなかった.
2) 体重(Table 10)
体重については対照群と1-アミノアントラキノン各投与群との間で有意差は認められなかった.
3) 形態
哺育0日の外表観察および死亡児の剖検では,被験物質の投与に起因した異常は観察されなかった.
哺育4日における全出生児の剖検において,1000 mg/kg投与群の1腹の全例に,胃内に貯留しているミルクが淡赤色調を呈しているのが観察されたほかには,いずれの投与群の新生児にも異常は認められなかった.
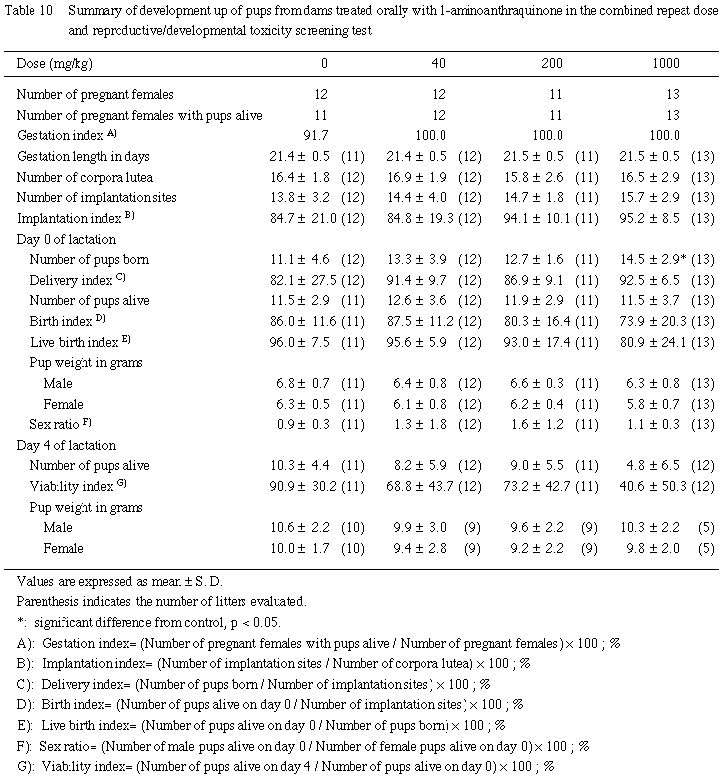
雌動物は,分娩終了までは,いずれの投与群の動物も雄と類似した変化が認められた.
また,分娩にも異常は認められなかったが,哺育開始後,急速に全身衰弱を示す動物が増加し,200 mg/kg以上の投与群では,その一部は瀕死状態に至り,1000 mg/kg投与群では,死亡も認められた.また,哺育行動が廃絶したため,これらの動物の出生児は死亡したが,瀕死状態に至らなかった母動物の全身状態は,出生児の死亡を境に改善され,哺育開始と毒性発現との間に強い因果関係があるものと考えられる.
各種検査成績を哺育状態の経過とあわせて評価すると,母動物に対する1-アミノアントラキノンの影響を二つに大別できると考えられる.すなわち,哺育状態に異常の認められなかった動物では,200 mg/kg以上の投与群において脾臓のうっ血および色素沈着の増強がみられ,さらに,1000 mg/kg投与群において網状赤血球比率の増加,脾臓重量の増加および肝臓の色素沈着の増強など,雄と同様に溶血性貧血を示唆する変化とそれに伴う 造血の亢進が認められた.一方,全出生児死亡例では,肝臓および脾臓の色素沈着の増強は,哺育状態が正常であった動物と同様に認められたが,腎皮質尿細管の上皮細胞に壊死および再生が認められ,瀕死剖検例および死亡例ではその程度が著しかった.また,脾臓は萎縮し,骨髄の造血細胞の減少も認められた.しかし,これらの動物では末梢血中の血球数は赤血球数および白血球数ともに,哺育状態正常例と同程度かあるいは高値の傾向を示した.また,哺育4日まで出生児の一部は生存していたが,全身状態の不良が認められた動物では,多血の傾向が認められた.泌乳ラットは,乳汁として体液を大量に体外へ排出している.そのため,分娩後の動物の循環血量は増加し17) ,恒常性を維持している.
今回,尿細管上皮細胞に壊死性の変化が認められた動物では,水分および電解質の再吸収が体液の喪失を補充するのに充分ではなかったものと推測され,その結果,一部の動物の解剖時にみられたように,脱水に陥ったものと考えられる.このうち,尿細管上皮の障害の程度が著しいものは瀕死状態に至り,障害が比較的軽度なものは,泌乳量の低下および哺育行動の廃絶により,出生児が死亡して泌乳による体液の損失が軽減されると回復に向かったものと考えられる.一方,出生児の一部が生存し,泌乳がわずかでも継続していた動物は軽度な脱水状態が持続していたものと考えられる.一般状態の悪化から瀕死状態に至るまでの経過が急激であったので,死因の一部として尿毒症が関与している可能性もあるが,本試験結果から腎障害による尿毒症発症の有無については明らかにはできなかった.
造血細胞の減少については,1-アミノアントラキノンの位置異性体である 2-アミノアントラキノンの毒性変化としても認められている7) が,今回は,対照群の全出生児死亡動物にも観察されていることから,1-アミノアントラキノンの直接作用である可能性は乏しい.
一方,腎障害において腎臓のエリスロポイエチン産生細胞が障害されると,エリスロポイエチン分泌が減少するために貧血が起きることが知られている.エリスロポイエチンは,出生後は主に,腎臓の間質細胞で産生されているといわれているが18) ,今回の病理組織学的検査では間質細胞に病変は観察されなかった.しかし,腎病変が重篤であったものに造血の低下が観察されていることから,造血の低下は,腎障害に伴う二次的変化であると推測される.
全出生児死亡動物では,脾臓における濾胞の減少および胸腺の萎縮が観察された.これらの動物では,副腎が腫大し,糖質コルチコイド産生の場である副腎皮質束状帯の空胞形成増加が認められた.同様の変化は,対照群の死亡例および全児死亡例にも観察されていることから,全身状態の不良などのストレスにより,糖質コルチコイド分泌が亢進したことによる,二次的な変化であると考えられる.
今回,脾臓の病理組織学的検査から,雌においても200 mg/kg以上の投与量により,溶血性貧血が惹起されるものと考えられた.しかし,その他の変化は,いずれも皮質尿細管上皮細胞の壊死および再生に付随した変化であると考えられる.皮質尿細管上皮細胞の壊死および再生は,対照群にも1例観察されているが,すべての1-アミノアントラキノン投与群において腎病変の発生頻度が増加する傾向が認められた.このことから,1-アミノアントラキノンは,40 mg/kg以上の投与量により尿細管上皮細胞に壊死および再生を惹起するものと考えられる.2-アミノアントラキノンにも雌に対する腎臓毒性が認められているが,その病変は,尿細管腔内に形成された結晶の栓塞を主体とするもので7),今回認められた変化とは病理発生が異なるものと考えられる.皮質尿細管上皮細胞の壊死および再生は非妊娠動物では稀な変化であるが,2-アミノアントラキノンとの病変の差がアミノ基の付加位置による構造活性に起因した相違なのか,使用したラットの系統差によるものか,あるいは非妊娠動物と泌乳動物との生理状態の違いによるものかは,さらに検討が必要であると考えられる.血液凝固時間は,1-アミノアントラキノン 投与群で延長の傾向が認められたが,有意差はなかった.一方,哺育状態が不良であった動物の多くに,分娩後の時間が経過しているにもかかわらず,腟からの血様分泌物が認められていること,瀕死屠殺した動物では血液凝固時間に異常な延長が認められていることから,哺育不良と血液凝固遅延は何らかの関係があるものと考えられるが,全身状態の悪化による栄養不良や,脱水による血液性状の変化などの二次的変化である可能性も考えられる.
哺育以外の生殖発生毒性については,1000 mg/kgまでの1-アミノアントラキノンは,雌雄動物の交尾および受胎能力,着床,ならびに分娩に対する影響は認められなかった.
次世代の生後発育については,出生児の死亡が1-アミノアントラキノン各投与群で増加した.これは,前述のように母動物の全身状態の悪化に起因するものと考えられるが,1000 mg/kg投与群において,胃内の乳汁が被験物質と同様な色調を呈する児が認められたことから,乳汁移行の可能性があるものと考えられる.アントラキノン系の下剤を泌乳中の婦人に投与すると,乳汁を介して児へ移行するとの報告19) もあることから,出生児に対する影響は養子実験などを通して確認する必要があるものと考えられる.しかし,催奇形作用は,1000 mg/kgまでの 1- アミノアントラキノンにはないものと推察される.
これらのことから本試験条件下では,1-アミノアントラキノンの雄に対する無毒性量は,反復投与毒性に関しては40 mg/kg/dayを下回り,生殖発生毒性に関しては1000 mg/kg/dayであると推察される.また,雌に対する無毒性量は,反復投与毒性および生殖・発生毒性ともに 40 mg/kg/dayを下回る量であると推察される.
| 1) | The Merck Index, S. Budavari, M.J. O'Neil, A. Smith, P.E. Heckelman, eds., Eleventh edn., Merck & CO., Inc., Rahway, N.J., U.S.A., 1989. |
| 2) | V. A. Volodchenko, Gigiena Truda i Professional'nye Zabolevaniia, 21, 27-30 (1977). |
| 3) | J.V. Marhold "Institut Pro Vychovu Vedoucicn Pracovniku Chemickeho Prumyclu Praha," Czechoslovakia, 1972, p. 121. |
| 4) | S. Lahman, H.C. Grice, J.W. Sinclair, Toxicol. Appl. Pharmacol., 8, 1966, p. 346. |
| 5) | C.F. Cesarone, C. Bolognesi, L. Santi, Toxicol. Suppl. 5, 355-359 (1982). |
| 6) | D.P. Griswold, Jr., A.E. Casey, J.H. Weisburger, Cancer Res., 28, 924-933 (1968). |
| 7) | J.R. Baker, E.R. Smith, Y.H. Yoon, G.G. Wade, H. Rosenkrantz, B. Schmall, J. Toxicol. Envirn. Health., 1, 1-11 (1975). |
| 8) | A.S.K. Murthy, A.B. Russfield, M. Hagopian, R. Monson, J. Snell, E.K. Weisburger, Toxicol. Let. , 4, 71-78 (1979). |
| 9) | E. Salewski, Pharmacology, 247, 367 (1964) |
| 10) | 西村秀雄, "胎児科学," 雄鶏社, 東京 (1976), pp. 115〜177. |
| 11) | 佐久間昭, "薬効評価−計画と解析," 東大出版会, 東京 (1977). |
| 12) | C.W. Dunnett, Biometrics, 20, 482-491 (1964). |
| 13) | H. Scheff Biometrika, 40, 87-104 (1953). Biometrika, 40, 87-104 (1953). |
| 14) | W.H. Kruskal, W.A. Wallis, J. Amer. Statist. Assoc., 47, 583-621 (1952). |
| 15) | 丹後俊郎, "医学への統計学(古川俊之 監修)," 朝倉書店, 東京(1985). |
| 16) | J.A. Swenberg, B. Short, S. Borghoff, J. Strasser, M. Charbonneau, Toxicol. Appl. Pharmacol., 97, 35-46 (1989). |
| 17) | A. Hawell, J.L. Linzell, J. Physiol., 233, 93-109 (1973). |
| 18) | S.T. Koury, M.J. Koury, M.C. Bondurant, J. Caro, S.E. Graber, Blood, 74, 645-651 (1989). |
| 19) | F.A. Nelemans, Pharmacology, 14, 73-77 (1976). |
| 連絡先 | |||
| 試験責任者: | 長尾哲二 | ||
| 試験担当者: | 代田眞理子,森村智美,田子和美 | ||
| (財)食品薬品安全センター 秦野研究所 | |||
| 〒257 神奈川県秦野市落合 729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Tetsuji Nagao (Study director) Mariko Shirota, Tomomi Morimura, Kazumi Tago | ||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano-shi, Kanagawa 257, Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||