
その結果,雄では 10 mg/kg 以上の投与により,投与後に一過性の流涎を誘発させ,50mg/kg 投与では,投与期間初期に体重増加および摂餌量を抑制した.42回反復投与後の剖検では,2 mg/kg 以上の群で腎臓重量が増加し,10 mg/kg 以上の群では肝臓重量が増加した.病理組織検査では,2 mg/kg 以上の群で腎臓の eosinophilic body および好塩基性尿細管が増加し,顆粒状円柱がみられた.また,10 mg/kg 以上の群では,小葉中心性の肝細胞肥大が観察された.剖検時の血液検査では,50 mg/kg 投与により血小板および白血球数の増加がみられ,血液生化学検査でも,50 mg/kg 投与により総蛋白,アルブミン,総コレステロール,カルシウムおよび無機リンの各濃度の増加,A/G比および塩素濃度の低下が認められた.
雌では,10 mg/kg 以上の投与により,投与期間初期に体重増加および摂餌量を抑制し,50 mg/kg 投与では,さらに妊娠期の体重増加および摂餌量を抑制し,分娩後3日に1例が死亡した.分娩後4日の剖検では,50 mg/kg 投与群の肝臓および腎臓の重量が増加傾向を示した.病理組織検査では,10 mg/kg 以上の群で小葉中心性の肝細胞肥大が観察された.
一方,生殖発生毒性に関しては,50 mg/kg までの投与量は,交尾率および受胎率に影響を示さなかった.また,妊娠期間および出産率にも影響はみられず,異常分娩も観察されなかった.哺育状態については,50 mg/kg 投与群の3例に哺育行動の異常が観察された.
出生率,産児の性比および体重には影響は認められなかったが,50 mg/kg 投与により哺育4日の新生児生存率および体重が低下傾向を示した.産児の形態異常はいずれの投与群にも観察されなかった.
これらのことから,本試験条件下では,2,2'-アゾビス(2-メチルプロパンニトリル)の反復投与毒性に関する無影響量は,雄では 2 mg/kg/day を下回る量,雌では 2 mg/kg/day であると結論される.また,生殖発生毒性に関する無影響量は,雄では 50 mg/kg/day,雌では 10 mg/kg/day であると結論される.
被験物質は,コーンオイル(ロット番号:V5P5523,ナカライテスク(株))に懸濁し,いずれの用量においても1回の投与液量が 5 ml/kg 体重になるように濃度を調整し,投与液とした.投与液は冷蔵,遮光,密閉条件下で保管し,調製後7日以内に投与した.投与液中の被験物質は,冷蔵,遮光条件下で少なくとも8日間安定であることが確認されており,試験期間中に調製した投与液には,所定量の2,2'-アゾビス(2-メチルプロパンニトリル)が均一に含有されていたことを確認した.
各動物は,基準温湿度24±1℃および50〜65%,換気回数約15回/時,照明12時間(午前7時〜午後7時)に制御された飼育室で,雄は金属製金網床ケージ(22 × 27 × 19 cm,日本ケージ(株)),雌は床敷として紙パルプ製チップ(ALPHA-dri,加商(株))を供給したラット用繁殖ケージ(35 × 40 × 18 cm,日本クレア(株))に個別に収容して飼育し,固型飼料(CE-2,日本クレア(株))および飲料水を自由に摂取させた.なお,供給した飼料,水および床敷には試験に支障を来す可能性のある混入物はなかった.
各用量の投与検体は,雄に対しては交配前14日間と交配期間14日間および交配期間終了後14日間の連続42日間,また雌に対しては交配前14日間と最長14日間の交配期間中(交尾成立まで)ならびに交尾雌では妊娠期を通して分娩後の哺育3日(分娩日=哺育0日)まで毎日1回,ラット用胃管を用いて経口投与した.毎日の投与は午前9時から午後3時の間に行い,各動物の投与液量(5 ml/kg 体重)は,雄ならびに交配前および交配期間中の雌については投与日に最も近接した時期の測定体重をもとに,また,交尾後の雌については妊娠0日(交尾確認日)の体重をもとにそれぞれ算出した.
雌雄とも全例について,飼育期間中毎日観察した.
B.体重
雄は全例について,投与1,4,8,15,22,29,36,42日および解剖日,雌は全例について,投与1,4,8,15日に測定し,投与22日までに交尾しなかった雌は,投与22日にも体重を測定した.また,交尾成立雌では,妊娠0,7,14,20日に,分娩した雌では,哺育0および4日(解剖日)に体重を測定した.
C.摂餌量
雌雄とも全例について,体重測定日と同日に餌重量を測定し,摂餌量を算出した.2週間の交配期間中の摂餌量は測定しなかった.交尾雌では妊娠0〜7、 7〜14、 14〜20日,分娩した雌では哺育0〜4 日の摂餌量を測定した.
D.交配
交配は,投与15日(投与開始日=投与1日)の夕方から最長2週間,同群内の雌雄を1対1で同居させて行った.交尾成立の確認は,毎朝,腟栓および腟スメアー中の精子の存在を調べることにより行い,交尾が確認された雌は,その日を妊娠0日と起算して雄から分離し,個別に飼育した.交配結果から,各群について交尾率〔(交尾動物数/同居動物数)× 100〕,受胎率〔(妊娠動物数/交尾動物数)× 100〕,同居開始日から交尾成立日までの日数およびその間に回帰した発情数を求めた.
E.分娩・哺育状態
各群とも交尾雌は,全例を自然分娩させた.分娩状態は,直接観察が可能なものについてのみ行い,それ以外の動物については分娩後の徴候から分娩困難や遅延などの分娩障害の有無を判断した.分娩後は,哺育状態を観察した.
F.分娩日の算定
分娩の確認は,午前9時〜11時に限定し,この時間帯に分娩が完了していることを確認した動物について,その日を分娩日と規定した.午前11時を過ぎて分娩を終了した動物については,翌日を分娩日とした.分娩を確認した全例について妊娠期間(妊娠0日から分娩日までの日数)を算定し,出産率〔(生児出産雌数/妊娠雌数)× 100〕を各群について求めた.
G.最終検査
a)雄動物
イ.剖検,器官重量測定および病理組織検査
最終投与日の投与終了後から絶食を開始し,翌日(投与43日相当日)にペントバルビタール麻酔下で放血・致死させて剖検した.その際,全例について肝臓,腎臓,副腎,精巣および精巣上体の重量を測定した.また,これらの器官のうち,精巣および精巣上体はブアン液に固定し,その他の器官ならびに胸腺,脳,心臓および脾臓は,10%ホルマリン液に固定した.これらの器官は高用量群および対照群について常法に従ってパラフィン切片とし,ヘマトキシリン-エオジン染色を行って病理組織検査を行った.また,肝臓および腎臓については,高用量群に異常が認められたため,その他の投与群についても病理組織検査を実施した.
ロ.血液検査
全例について,剖検に先立ち,ペントバルビタール麻酔下で腹部後大静脈より抗凝固剤として EDTA 処理した注射筒を用いて採血し,赤血球数(RBC),白血球数(WBC),血色素量(Hb),平均赤血球容積(MCV)および血小板数を多項目血液自動測定機(Coulter Counter Model S-PLUS IV)により測定し,ヘマトクリット値(Ht),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC)を算出した.白血球百分比は,血液塗沫標本をWright-Giemsa 染色し,光学顕微鏡下で観察して算出した.
ハ.血液生化学検査
全例について,血液検査のための採血に引き続き,抗凝固剤としてヘパリン処理した注射筒を用いて採血し,血漿を分離して遠心方式生化学自動分析装置 COBAS- FARA および全自動電解質分析装置 EA05(A&T)を用い,総蛋白濃度(ビウレット法),アルブミン濃度(BCG 法),総コレステロール濃度(COD・DAOS法),ブドウ糖濃度(グルコキナーゼG6PDH 法),尿素窒素濃度(ウレアーゼ Gl .DH 法),クレアチニン濃度(Jaffe 法),アルカリフォスファターゼ活性(パラニトロフェニルリン酸基質法),GOT 活性(SSCC法),GPT活性(SSCC法),総ビリルビン濃度(ビリルビン「ロッシュ」キットSシリーズ),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法),A/G 比(計算)について分析した.
b)雌動物
分娩した雌は哺育4日に,交尾をしたが分娩しない雌は妊娠25日相当日に,それぞれ致死量のペントバルビタールを投与後に放血・致死させ,剖検した.妊・不妊のいずれの例においても卵巣および子宮を摘出し,子宮については Salewski 法3)を応用して着床痕を染色して着床数を確認し,着床率〔(着床数/妊娠黄体数)× 100〕を算出した.卵巣は実体顕微鏡下で妊娠黄体数を数えた後,ブアン液に固定し,不妊例の卵巣については,病理組織検査を行った.また,肝臓,腎臓および副腎の重量を全例について測定し,これらの器官および胸腺,脳,心臓,脾臓および子宮は,10%ホルマリン液に固定した.これらの器官(子宮を除く)は,高用量群および対照群について常法に従ってパラフィン切片とし,ヘマトキシリン-エオジン染色を行って病理組織検査を行った.高用量群に異常が認められた肝臓,腎臓および副腎は,その他の投与群についても病理組織検査を実施した.なお,一部の動物の肝臓または腎臓については,Oil red O 染色,ベンチジン反応およびPAS 染色を行った.
哺育0日に産児数(生存児+死亡児)を調べ,分娩率〔(産児数/着床痕数)× 100〕および生児出産率〔(出産生児数/着床痕数)× 100〕を求めた.また,産児の外表奇形の有無および性別を調べ,生存児の性比〔(雄の生児数/出産生児数)× 100〕を算出した.
B.死亡児数の算定
死亡児数を毎日調べ,出生率〔(出産生児数/産児数)× 100〕および哺育4日の新生児生存率〔(哺育4日の生児数/哺育0日の生児数)× 100〕を求めた.死亡児は剖検し,胸腔および腹腔内の器官を除去した後,エタノールに固定した.
C.体重測定
哺育0日および4日に一腹単位で雌雄別に体重(litter重量)を測定し,一匹あたりの平均体重(litter重量/測定児数)を各腹について求めた.
D.剖検
哺育4日に全例をエーテル吸入により致死させ,剖検した.その際,胸腔および腹腔内の器官は,一腹ごとに10%ホルマリン液に固定し,内部器官を摘出した後の産児は,一腹ごとにエタノールに固定した.
 法8)を用いて対照群と各投与群との平均値の差の検定を行った.分散が一様でなかった場合,または分散が0となる群が存在した場合は,Kruskal-Wallis の順位検定9)を行い,群間に有意性が認められた場合に,対照群と各投与群との差についてDunnett法7)あるいはScheff
法8)を用いて対照群と各投与群との平均値の差の検定を行った.分散が一様でなかった場合,または分散が0となる群が存在した場合は,Kruskal-Wallis の順位検定9)を行い,群間に有意性が認められた場合に,対照群と各投与群との差についてDunnett法7)あるいはScheff 法8)の検定を行った.有意水準は,5%および1%とした.
法8)の検定を行った.有意水準は,5%および1%とした.
雌では,50 mg/kg 投与群の1例が,投与43日(分娩日)から削痩を呈し,投与46日(分娩後3日)に死亡した.雄では,いずれの投与群にも死亡動物は認められなかった.生存動物の一般状態については,雄では,10 mg/kg 以上の投与群において,投与後に一過性の流涎を示す動物が,用量に依存してほぼ全投与期間にわたって観察された.その他,2 mg/kg 投与群の1例に投与8日から削痩,紅涙および排便数減少が観察されたが,投与11日までに回復した.
雌では,50 mg/kg 投与群の1例に,投与後一過性の流涎が観察された.その他,対照群の1例に痂皮形成が,2 mg/kg 投与群の1例に脱毛が観察されたが,10 mg/kg 以上の投与群には,これらの変化は認められなかった.
雄では,10 mg/kg 以下の投与群の体重推移に影響は認められなかった.50 mg/kg 投与群では,投与1〜4日および投与22〜29日に体重の有意な増加抑制がみられたが,体重実測値には有意差は認められなかった.
雌では,2 mg/kg 投与群の体重推移に有意な変化は認められなかった.10 mg/kg 投与群では,投与8〜15日に体重の有意な増加抑制がみられたが,体重実測値に有意差は認められなかった.50 mg/kg 投与群では,投与4日の体重が対照群と比較して有意(p<0.01)な低値を示したが,投与8日の体重には対照群と差は認められなかった.しかし,同群では,投与15日の体重が有意(p<0.05)な低値を示し,さらに,妊娠7日以降の体重も有意(p<0.05,p<0.01)に低下した.50 mg/kg 投与群では,哺育0日の体重が,対照群と比較して有意(p<0.01)な低値を示したが,哺育4日の体重には対照群との間に差は認められなかった.


雄では,10 mg/kg 以下の投与群の摂餌量に影響は認められなかった.50 mg/kg 投与群では投与1〜4日の摂餌量が対照群と比較して有意(p<0.01)に抑制されたが,その後は対照群と同様な値で推移した.
雌では,2 mg/kg 投与群の摂餌量に対照群との間で有意差は認められなかった.10 mg/kg 以上の投与群では,投与1〜4日の摂餌量が対照群と比較して有意(p<0.05,p<0.01)に抑制され,50 mg/kg 投与群ではさらに妊娠0〜7日の摂餌量が有意(p<0.05)に抑制されたが,妊娠7日以降の摂餌量には,対照群との間に有意差は認められなかった.


A.雄
(1) 血液検査所見(Table 5)
赤血球については,2 mg/kg 投与群において平均赤血球血色素濃度が有意(p<0.05)に増加したが,その程度は生理的変動の範囲内であった.血小板については,50 mg/kg 投与群で有意(p<0.01)に増加した.白血球については,50 mg/kg 投与群においてその数が有意(p<0.01)に増加し,百分比では,10 mg/kg 以上の投与群において,好中球の有意(p<0.05,p<0.01)な増加とリンパ球の有意(p<0.05)な減少が認められた.

(2) 血液生化学検査所見(Table 6)
2 mg/kg 投与群では,カルシウム濃度が有意(p<0.05)に増加し,γ-GTP活性が有意(p<0.05)に低下したが,10 mg/kg 投与群では,いずれの検査項目についても対照群との間で有意差は認められなかった.50 mg/kg投与群においては,総蛋白,アルブミン,総コレステロール,カルシウムおよび無機リンの各濃度が,対照群と比較して有意(p<0.01)に増加し,A/G比および塩素濃度が有意(p<0.01)に低下した.その他,50 mg/kg 投与群では,クレアチニン濃度が有意(p<0.05)に増加したが,その変動の程度は軽度で毒性学的意義のない変化と思われた.

(3) 剖検所見
肝臓は,50 mg/kg 投与群において暗色調で腫大する例が多くみられ,10 mg/kg 投与群でも低頻度に認められた.腎臓は,50 mg/kg 投与群において腫大して皮質が淡色化する例がみられ,10 mg/kg 投与群でも低頻度に認められた.その他の器官に,投与に起因すると思われる所見はなかった.
(4) 器官重量(Table 7)
肝臓は,10 mg/kg 以上の投与群において,実重量および比体重値ともに対照群と比較して有意(p<0.05,p<0.01)に増加した.腎臓は,実重量および比体重値ともに用量に依存して増加する傾向がみられ,実重量は 2 mg/kg 以上,比体重値は 10 mg/kg 以上の投与群において対照群との間に有意差(p<0.05,p<0.01)が認められた.その他の器官に,対照群と各投与群との間で有意差は認められなかった.

(5) 病理組織検査所見(Table 8)
各器官における観察所見を以下に示す.
(肝臓)
50 mg/kg 投与群の全例に小葉中心性の肝細胞肥大がみられ,10 mg/kg 投与群でも肥大の程度は軽いが全例に認められた.門脈周囲性の脂肪化および小肉芽腫が対照群を含む全例に認められたが,対照群と各投与群との間に頻度および程度の差はなかった.その他,10 mg/kg 投与群の1例に胆管の嚢胞形成がみられ,50 mg/kg 投与群の1例にごく軽度な胆管増生が認められた.
(腎臓)
全ての投与群で,eosinophilic body および尿細管の再生像と思われる皮質の好塩基性尿細管が増加した.また各投与群では,壊死した細胞を含むと思われる顆粒状の円柱がみられた.その他,10 および 50 mg/kg 投与群の各1例に,蛋白性の円柱が認められ,各投与群の1例に少数の嚢胞がみられた.また,肝臓に胆管の嚢胞形成がみられた 10 mg/kg 投与群の1例では,多数の嚢胞が認められた.
(脾臓)
対照群および 50 mg/kg 投与群に褐色色素の沈着および髄外造血がみられたが,両群間に頻度および程度の差は認められなかった.
(心臓)
対照群および 50 mg/kg 投与群に心筋変性・線維化がみられたが,両群間に頻度および程度の差は認められなかった.
(精巣)
対照群および 50 mg/kg 投与群の各1例に,精子形成の低下がみられたほかに,異常はなかった.
(精巣上体)
50 mg/kg 投与群の精子形成の低下が認められた例に,精子の消失がみられたほかに,異常はみられなかった.
(脳,胸腺,および副腎)
対照群および 50 mg/kg 投与群に異常はみられなかった.


B.雌
(1) 剖検所見
死亡した 50 mg/kg 投与群の1例では,腎皮質の淡色化,胸腺および脾臓の萎縮などが認められた.その他の例では,肝臓が暗色調で腫大する例がみられた.他の器官には,投与に起因すると思われる所見はなかった.
(2) 器官重量(Table 7)
10 mg/kg 以下の投与群には,実重量および比体重値ともに対照群と比較して有意差の認められた器官はなかった.50 mg/kg 投与群では,肝臓の実重量および比体重値が対照群と比較して有意(p<0.01)に増加し,腎臓の比体重値が対照群と比較して有意(p<0.01)な高値を示した.しかし,副腎重量については,対照群との間に有意差は認められなかった.
(3) 病理組織所見(Table 8)
死亡した 50 mg/kg 投与群の1例では,肝臓に小葉中心性の肝細胞肥大がみられ,腎臓には,近位尿細管の脂肪変性(Oil red O 染色陽性)および空胞変性,尿細管の再生像と思われる皮質の多数の好塩基性尿細管,壊死細胞を含む顆粒状の円柱,ヘモグロビン円柱(ベンチジン反応陽性)および蛋白円柱(PAS 染色陽性)がみられた.脾臓および胸腺では著しい萎縮がみられた.その他の生存例における観察所見を以下に示す.
(肝臓)
50 mg/kg 投与群の全例に,小葉中心性の肝細胞肥大がみられ,10 mg/kg 投与群でも肥大の認められる例があった.また,50 mg/kg 投与群では巣状壊死や小葉中間帯の脂肪化(いずれも Oil red O 染色陽性)がみられた.その他,各群に小肉芽腫がみられたが,対照群と各投与群との間に差はみられなかった.
(腎臓)
50 mg/kg 投与群の2例に近位尿細管の空胞変性がみられ,そのうちの1例の皮質には好塩基性の尿細管がみられ,他の1例には近位尿細管の脂肪変性(Oil red O 染色陽性)がみられたが,対照群の1例にも近位尿細管の空胞変性および皮質の好塩基性尿細管は認められた.その他,自然発生によると思われる少数の皮質の好塩基性尿細管が,対照群を含む各投与群にみられた.
(脾臓)
対照群および 50 mg/kg 投与群に褐色色素の沈着および髄外造血がみられたが,両群間に頻度および程度の差は認められなかった.
(副腎)
束状帯の空胞形成の増加が,50 mg/kg 投与群の2例にみられたが,対照群および他の投与群に異常は認められなかった.
(胸腺,脳および心臓)
対照群および 50 mg/kg 投与群に異常はみられなかった.
(卵巣)
観察した不妊例に異常はなかった.
交尾率,受胎率および同居開始日から交尾成立日までの日数ならびにその間に回帰した発情数に対照群と各投与群との間で有意差は認められなかった.

2)分娩および哺育状態
分娩状態の直接観察が可能であった動物に,異常分娩は観察されなかった.また,直接観察ができなかった動物についても,異常分娩を示唆する徴候は認められなかった.10mg/kg 以下の投与群では,哺育状態に異常は認められなかった.50 mg/kg 投与群では,哺育4日までに全産児が死亡した動物が2例みられ,そのうちの1例では哺育1日に喰殺が観察され,他の1例は哺育1日から児集め,児の保温,授乳などの哺育行動がみられなかった.50 mg/kg 投与群ではさらに1例が哺育1〜2日に授乳行動を示さなかったが,哺育3日以降は回復した.
3)出産率および妊娠期間(Table 10)
出産率はすべての投与群とも100%を示し,妊娠期間についても対照群と各投与群との間で有意差は認められなかった.
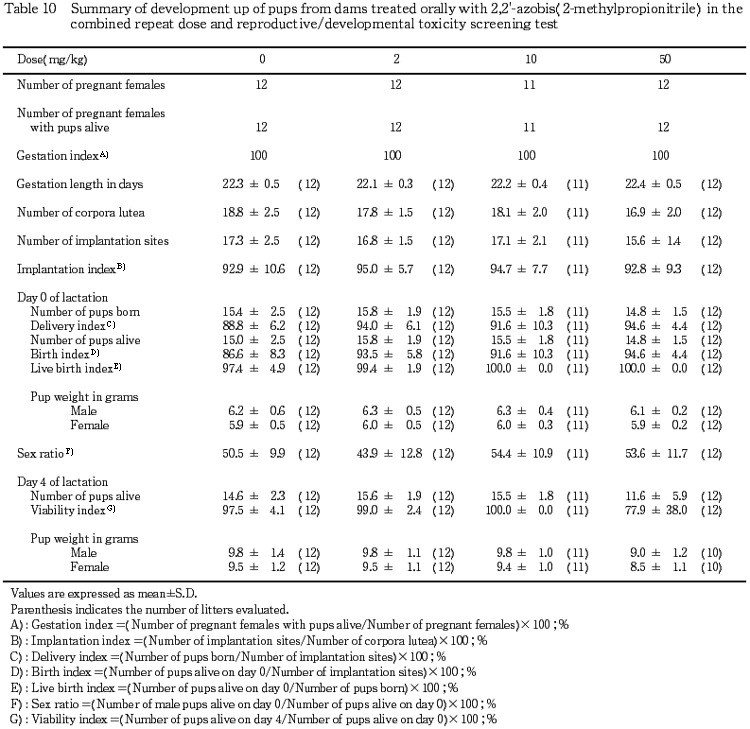
4)妊娠黄体数,着床数および着床率(Table 10)
妊娠動物の黄体数,着床数および着床率に対照群と各投与群との間で有意差は認められなかった.
10 mg/kg 以下の投与群では,哺育0および4日の生存性に対照群との間で差は認められなかった.50 mg/kg 投与群では,分娩率,生児出産率および出生率には投与の影響は認められなかったが,生後4日の新生児生存率が低下傾向を示した.性比については対照群と各投与群との間で有意差は認められなかった.
2)体重(Table 10)
10 mg/kg 以下の投与群については,対照群との間に差は認められなかった.50 mg/kg投与群では,哺育4日の体重が雌雄ともにやや低下傾向を示したが,対照群との間に有意差は認められなかった.
3)形態
出生日の生存産児に,外表奇形は観察されなかった.また,哺育4日における産児の剖検でも,異常は認められなかった.死亡児の剖検においては,対照群の1例に腎盂拡張が観察されたが,各投与群の死亡児に異常は認められなかった.
生殖学的検査では,交配したすべての動物が交尾し,投与群の受胎率にも対照群との間に差はなかった.交尾相手雌が不妊であった 50 mg/kg 投与群の雄1例では,精巣が萎縮し,病理組織検査において精子形成の低下が確認されたが,その他の雄では精巣の異常は認められず,精巣および精巣上体の重量にも対照群との間で差がなかった.さらに,対照群の1例にも精巣の萎縮がみられ,その雄の交尾相手雌も不妊であったことから,50 mg/kg 投与群にみられた精巣の萎縮は自然発生的な変化と推察された.母動物については,妊娠期の体重が 50 mg/kg 投与群において低値を示したが,妊娠期間および出産率に影響はみられず,異常分娩も観察されなかった.分娩後は,50 mg/kg 投与群の3例に哺育行動の異常が観察され,うち1例は分娩後3日に死亡した.この死亡例の剖検では,胸腺および脾臓の萎縮が認められ,病理組織検査では肝細胞肥大以外に,近位尿細管の空胞変性,尿細管再生像などがみられたが,死因に結びつく所見はなかった.近位尿細管の空胞変性は,哺育行動の異常を示した残りの2例にも認められた.50 mg/kg 投与群においては,分娩日の母体重が著しく低下していたことから,哺育行動の異常は,ABMPN 投与による体重増加抑制が引き金となった可能性は否定できないが,2,2'-アゾビス(2-メチルプロパンニトリル)との関連は明らかにされなかった.
産児に関しては,50 mg/kg 投与群において,哺育状態の悪化に起因したと考えられる哺育4日の新生児生存率および体重の低下がみられたが,出生日における生存産児数,性比および体重に影響は認められなかった.また,産児の形態異常は,いずれの投与群においても観察されなかった.
以上の成績から,本試験条件下では,2,2'-アゾビス(2-メチルプロパンニトリル)の反復投与毒性に関する無影響量は,雄に対しては 2 mg/kg 以上の投与群で腎臓に対する影響が示唆されたことから 2 mg/kg/dayを下回る量,雌に対しては 10 mg/kg 以上の投与群において体重増加抑制および肝細胞肥大がみられたことから 2 mg/kg/day と考えられ,生殖発生毒性に関する無影響量は,雄に対しては 50 mg/kg/day,雌および産児に対しては 50 mg/kg 投与群でみられた哺育行動の異常と新生児生存率の低下を考慮して 10 mg/kg/day と考えられる.
| 1) | W. B. Deichmann, H. W. Gerarde, “Toxicology of drugs and chemicals,”Academic press, New York and London, 1969, p.117. |
| 2) | V. Y. Rusin, C. A. 56, 2682f(1962). |
| 3) | E.Salewski, Naunyn-Schmiedeberg's Arch. Exp.Pathol. Pharmakol. 247, 367(1964). |
| 4) | 丹後俊郎,“医学への統計学(古川俊之監修),”朝倉書店,東京,1985. |
| 5) | 石居進,“生物統計学入門,”培風館,東京,1992. |
| 6) | 佐久間昭,“薬効評価-計画と解析,”東大出版会,東京,1977. |
| 7) | C. W. Dunnett, Biometrics 20, 482(1964). |
| 8) | H. Scheff , Biometrika, 40, 87(1953). , Biometrika, 40, 87(1953). |
| 9) | W. H. Kruskal, W. A. Wallis, J. Amer. Statist. Assoc.47, 583(1952). |
| 連絡先: | |||
| 試験責任者 | 長尾哲二 | ||
| 試験担当者 | 太田亮,森村智美,関野早苗 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257 神奈川県秦野市落合 729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Tetsuji Nagao(Study director) Ryo Ohta,Tomomi Morimura,Sanae Sekino | |||
| Hatano Research Institute,Food and Drug Safety Center | ||||
| 729-5 Ochiai,Hadano-shi,Kanagawa 257 Japan | ||||
| Tel +81-463-82-4751 | FAX +81-463-82-9627 | |||