ペンタエリスリトールテトラ(2-エチルヘキサノアート)について,細菌を用いる復帰変異試験を実施した.
試験菌株として,Salmonella typhimurium (TA100,TA98,TA1535,TA1537)およびEscherichia coli (WP2 uvrA)の5菌株を用いた.用量設定試験においてはS9 mix無添加群および添加群の各試験菌株において8.19〜5000 μg/plateの8用量を実施した.その結果,いずれの処理においても試験菌株に対する生育阻害作用および変異原性が認められず,2000 μg/plate以上の用量で析出が認められた.したがって,本試験ではS9 mix無添加群およびS9 mix添加群の各試験菌株において,析出が認められる最も低い用量を含めた78.1〜2500 μg/plateの6用量で試験を実施した.また,用量設定試験のS9 mix無添加群のTA1535のみで雑菌汚染が認められたため,本試験との再現性を確認するために,S9 mix無添加群のTA1535において78.1〜2500 μg/plateの6用量で再試験を実施した.その結果,S9 mix無添加群および添加群のいずれにおいても,溶媒対照に比べ復帰変異コロニー数の明確な増加は認められなかった.これらの試験結果は,用量設定試験,本試験および再試験において再現性が確認された.
以上の結果より,本試験条件下ではペンタエリスリトールテトラ(2-エチルヘキサノアート)は,変異原性を有しない(陰性)と結論した.
細菌を用いる復帰変異試験に広く使用されていることから,試験菌株としてヒスチジン要求性のSalmonella typhimurium TA100,TA98,TA1535およびTA1537 1)ならびにトリプトファン要求性のEscherichia coli WP2 uvrA 2)の5種類の菌株を選択した.
ネズミチフス菌は昭和58年9月9日にカリフォルニア大学のAmes BN教授から,また,大腸菌については昭和58年3月16日に国立衛生試験所(現:国立医薬品食品衛生研究所)から分与を受けた.平成15年9月16日〜9月19日に菌株の特性検査を実施し,当該試験に用いた菌株が規定の特性を保持していることを確認した.
各菌株の菌懸濁液はジメチルスルホキシド(DMSO,Merck)を添加した後,凍結保存用チューブに0.2 mLずつ分注した.これを液体窒素を用いて凍結し,超低温フリーザーに-80℃で保存した.
オリエンタル酵母工業製のテスメディアAN培地を購入し,試験に用いた.本プレートは,Vogel-Bonnerの最少培地Eを含む水溶液(0.02 %硫酸マグネシウム・7水塩,0.2 %クエン酸・1水塩,1 %リン酸二カリウム・無水塩,0.192 %リン酸一アンモニウム,0.066 %水酸化ナトリウム〔いずれも最終濃度〕)に2 %のグルコース(和光純薬工業)と1.2 %の寒天(伊那寒天BA-30A)を加え,径90 mmのシャーレに1枚当たり30 mLを分注したものである.
塩化ナトリウム0.5 w/v%を含む0.6 w/v% Bacto-agar (BD Diagnostic Systems)水溶液10容量に対し,ネズミチフス菌を用いる試験の場合,0.5 mmol/L L-ヒスチジン(関東化学)-0.5 mmol/L D-ビオチン(関東化学)水溶液を1容量加え,大腸菌を用いる試験の場合,0.5 mmol/L L-トリプトファン(関東化学)水溶液を同じく1容量加え用いた.
内容量200 mLのバッフル付三角フラスコに2.5 w/v%ニュートリエントブロス(Nutrient Broth No.2,Oxoid)溶液を25 mL分注し,これに融解した菌懸濁液を50 μL接種した.ウォーターバスシェーカー(MM-10,タイテック)を用い,37℃の条件で8時間振盪(往復振盪:100回/分)培養し,菌濃度を確認した後試験に使用した.
製造後6ヵ月以内のキッコーマン製S9 mixを試験に使用した.S9 mix中のS9は誘導剤としてフェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague- Dawley系雄ラットの肝臓から調製されたものである.S9 mixの組成を以下に示す.
| 成分 | S9 mix 1 mL中の量 | |
| S9 | 0.1 mL | |
| MgCl2 | 8 μmol | |
| KCl | 33 μmol | |
| G-6-P | 5 μmol | |
| NADPH | 4 μmol | |
| NADH | 4 μmol | |
| Na-リン酸緩衝液(pH 7.4) |
100 μmol |
被験物質のペンタエリスリトールテトラ(2-エチルヘキサノアート)(ロット番号:TOL-887)は純度98.4 % (GC%,残り1.6 %不明,各成分1 %未満)の無色透明の液体である.本剤は水に不溶であるが,アセトンに易溶である.日本精化(兵庫)から提供された被験物質を使用した.被験物質は,使用時まで室温,気密,遮光で保管した.試験終了後,被験物質提供元において残余被験物質を分析した結果,安定性に問題はなかった.
試験の都度,被験物質をモレキュラーシーブを用いて脱水処理を行ったアセトン(関東化学)を用いて溶解し,調製原液とした.調製原液を使用溶媒を用いて順次所定濃度に希釈した後,速やかに処理を行った.
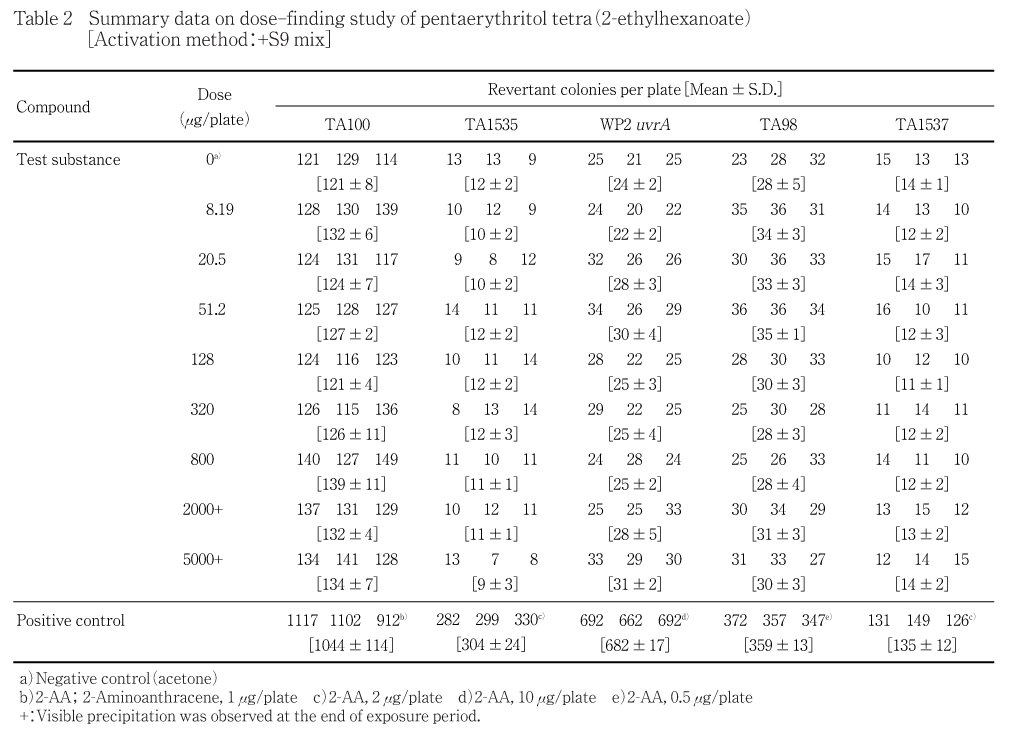
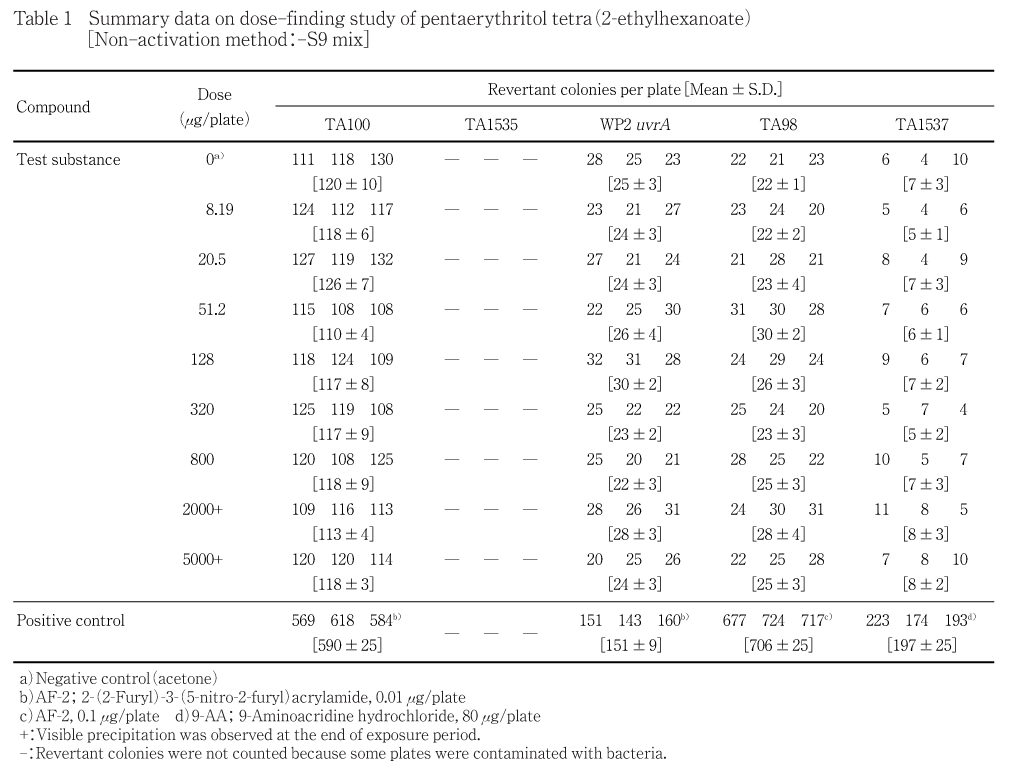
8.19〜5000 μg/plateの8用量(公比2.5)を用いて用量設定試験を実施した.その結果,S9 mix無添加群のTA1535以外の試験菌株は,いずれの用量においても,復帰変異コロニー数の明確な増加傾向は認められなかった.なお,S9 mix無添加群のTA1535の一部プレートにおいて雑菌汚染が認められたため,コロニー数を計測しなかった.また,各試験菌株のいずれの処理群においても,試験菌株に対する生育阻害作用は観察されなかった.被験物質処理時,S9 mix無添加群および添加群の2000 μg/plate以上の用量で油滴状の析出物が認められた.なお,プレインキュベーション終了後,S9 mix無添加群の2000 μg/plate以上の用量では,認められた油滴状の析出物が消失していた.コロニー数計測時,S9 mix無添加群および添加群の2000 μg/plate以上の用量では,油滴状および油膜状の析出物が認められた.
従って,本試験ではS9 mix無添加群および添加群とも,すべての試験菌株において2500
μg/plateを最高用量とし,それぞれ6用量(公比2)を設定した.
また,S9 mix無添加群のTA1535において,本試験との再現性を確認するため再試験を実施し,本試験と同じ2500 μg/plateを最高用量とした6用量(公比2)を設定した.
陽性対照物質として下記に示した調製済み陽性対照物質溶液(オリエンタル酵母工業)を使用した.
| 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド | (AF-2) | |
| アジ化ナトリウム | (NaN3) | |
| 9-アミノアクリジン塩酸塩 | (9-AA) | |
| 2-アミノアントラセン | (2-AA) |
Amesらの原法 1)の改良法であるプレインキュベーション法に準じて,S9 mix無添加群および添加群それぞれについて試験を実施した.試験管に,使用溶媒,被験物質液あるいは陽性対照物質溶液を100 μL,次いでS9 mix無添加群の場合,0.1 mol/L ナトリウム・リン酸緩衝液(pH 7.4)を500 μL,S9 mix添加群の場合,S9 mixを500 μL添加し,さらに試験菌液100 μLを加え,37℃で20分間振盪培養(プレインキュベーション)した.培養終了後,あらかじめ45℃に保温したトップアガーを2 mL添加し,混合液をプレート上に重層した.37℃の条件で48時間各プレートを培養した後,被験物質の試験菌株に対する生育阻害作用を確認するため,実体顕微鏡(×40)を用いてプレート上の試験菌株の生育状態を観察した.次いで,復帰変異により生じたコロニーを計測した.計測に際してはコロニーアナライザー(CA-11,システムサイエンス)を用いた.各濃度につき3枚のプレートを使用した.
復帰変異コロニー数が溶媒対照の2倍以上に増加し,かつ,再現性あるいは被験物質の用量に依存性が認められた場合に,陽性と判定した.
統計学的手法を用いた検定は実施しなかった.
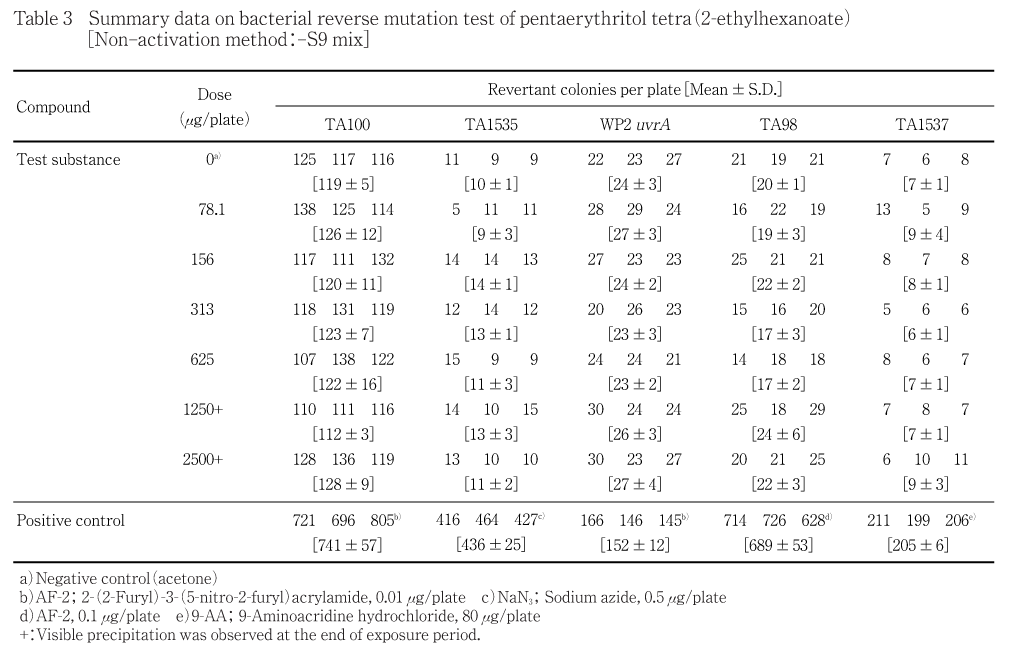
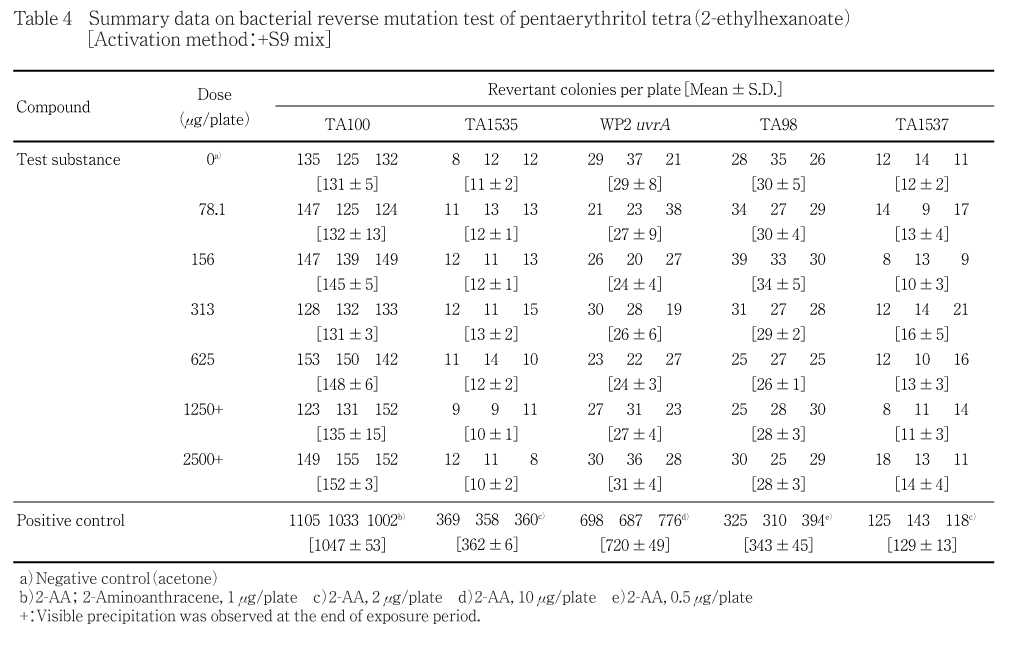
用量設定試験の結果をTable 1〜2に,本試験の結果をTable 3〜4に示した.また,用量設定試験のS9 mix無添加群のTA1535で雑菌汚染が認められ,本試験との再現性を確認するために再試験を実施し,その結果をTable 5に示した.S9 mix無添加群および添加群とも,いずれの試験菌株においてもペンタエリスリトールテトラ(2-エチルヘキサノアート)処理による復帰変異コロニー数の明確な増加傾向は認められなかった.また,各試験菌株のいずれの処理群においても試験菌株に対する生育阻害作用は観察されなかった.一方,陽性対照物質は溶媒対照群の2倍以上の復帰変異コロニーを誘発した.なお,被験物質処理時,1250 μg/plate以上の用量で油滴状の析出物が認められた.なお,プレインキュベーション終了後,1250 μg/plate以上の用量では,認められた油滴状の析出物が消失していた.コロニー数計測時,1250 μg/plate以上の用量では,油滴状および油膜状の析出物が認められた.
以上の試験結果から,当該試験条件下において,ペンタエリスリトールテトラ(2-エチルヘキサノアート)の微生物に対する遺伝子突然変異に関し,陰性と判定した.
なお,本被験物質〔ペンタエリスリトールテトラ(2-エチルヘキサノアート)〕の遺伝毒性ならびに発がん性に関する報告はない.類縁体であるPentaerythritol tetranitrateについては,2年間のラット発がん性試験で,Zymbal腺に新生物が低頻度で認められた 3).また,ペンタエリスリトールは,細菌を用いる復帰変異試験で陰性 4),CHL/IU細胞を用いた染色体異常試験で陰性 5)と報告されている.
| 1) | Maron DM, Ames BN:Revised methods for the Salmonella mutagenicity test. Mutation Res, 113: 173-215(1983). |
| 2) | Green MH, Muriel WJ:Mutagen testing using TRP+ reversion in Escherichia coli. Mutation Res, 38: 3-32(1978). |
| 3) | Bucher JR, Huff J, Haseman JK, Eustis SL, Lilja HS and Murthy AS: No evidence of toxicity or carcinogenicity of Pentaerythritol tetranitrate given in the diet to F344 rats and B6C3F1 mice for up to two years. J Appl Toxicol, 10(5):353-357(1990). |
| 4) | 澁谷徹ら:ペンタエリスリトールの細菌を用いる復帰変異試験.化学物質毒性試験報告,3:277-280 (1996). |
| 5) | 田中憲穂ら:ペンタエリスリトールのチャイニーズ・ハムスター培養細胞を用いる染色体異常試験.化学物質毒性試験報告,3: 281-283(1996). |
| 連絡先 | |||
| 試験責任者: | 益森勝志 | ||
| 試験担当者: | 古屋有佳子,田中 仁,菊池正憲, 木下裕加,永井美穂,鈴木ゆみ子, 上田摩弥,嶋田佐和子, 赤星まゆみ,仲村渠奈美子 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田市塩新田582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | |||
| Authors: | Shoji Masumori (Study Director) Yukako Furuya, Jin Tanaka, Masanori Kikuchi, Yuka Kishita, Miho Nagai, Yumiko Suzuki, Maya Ueda, Sawako Shimada, Mayumi Akahoshi, Namiko Nakandakari |
||
| Biosafety Research Center, Foods, Drugs and Pesticides (An-pyo Center) | |||
| 582-2 Shioshinden, Iwata-shi, Shizuoka, 437-1213, Japan | |||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | ||