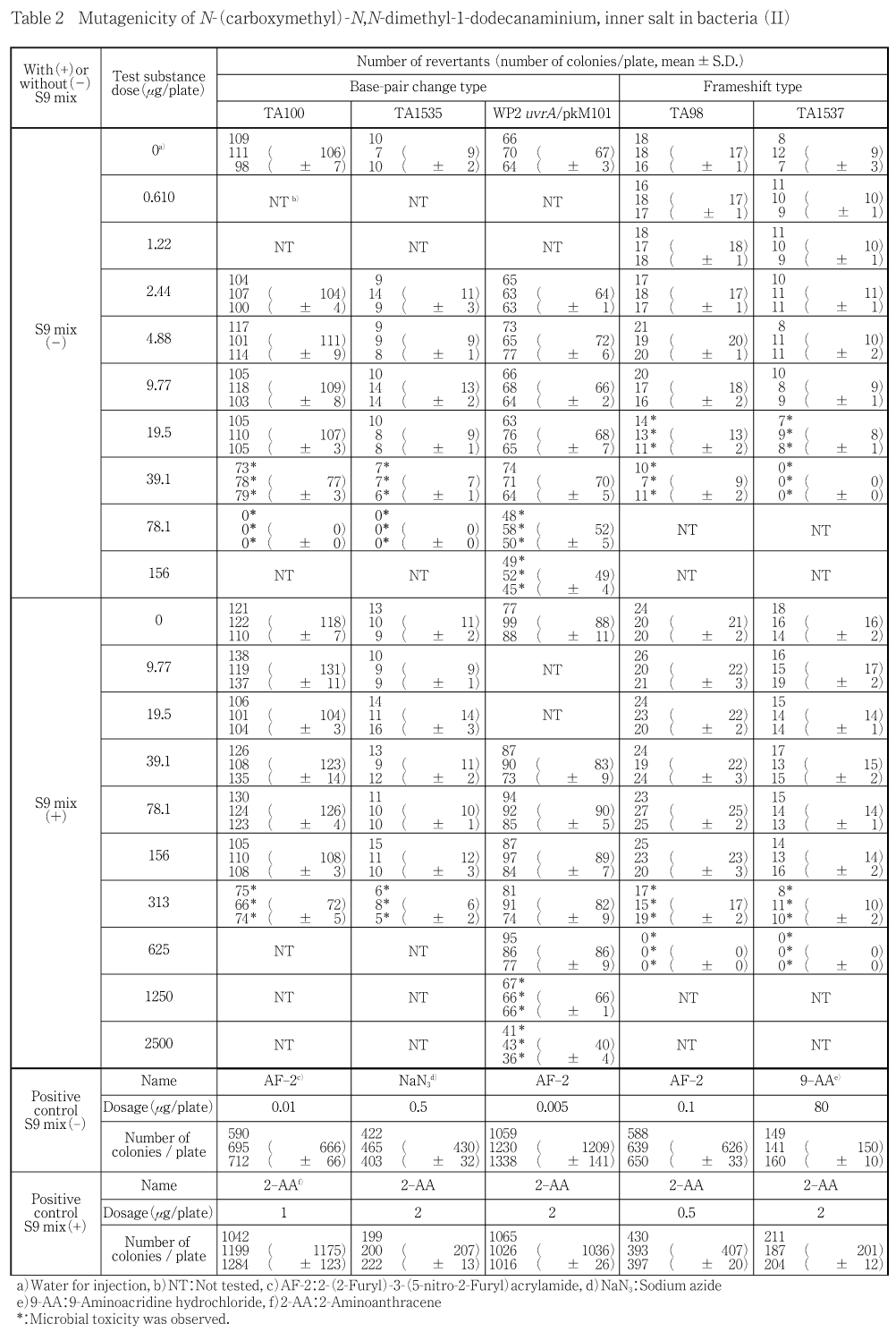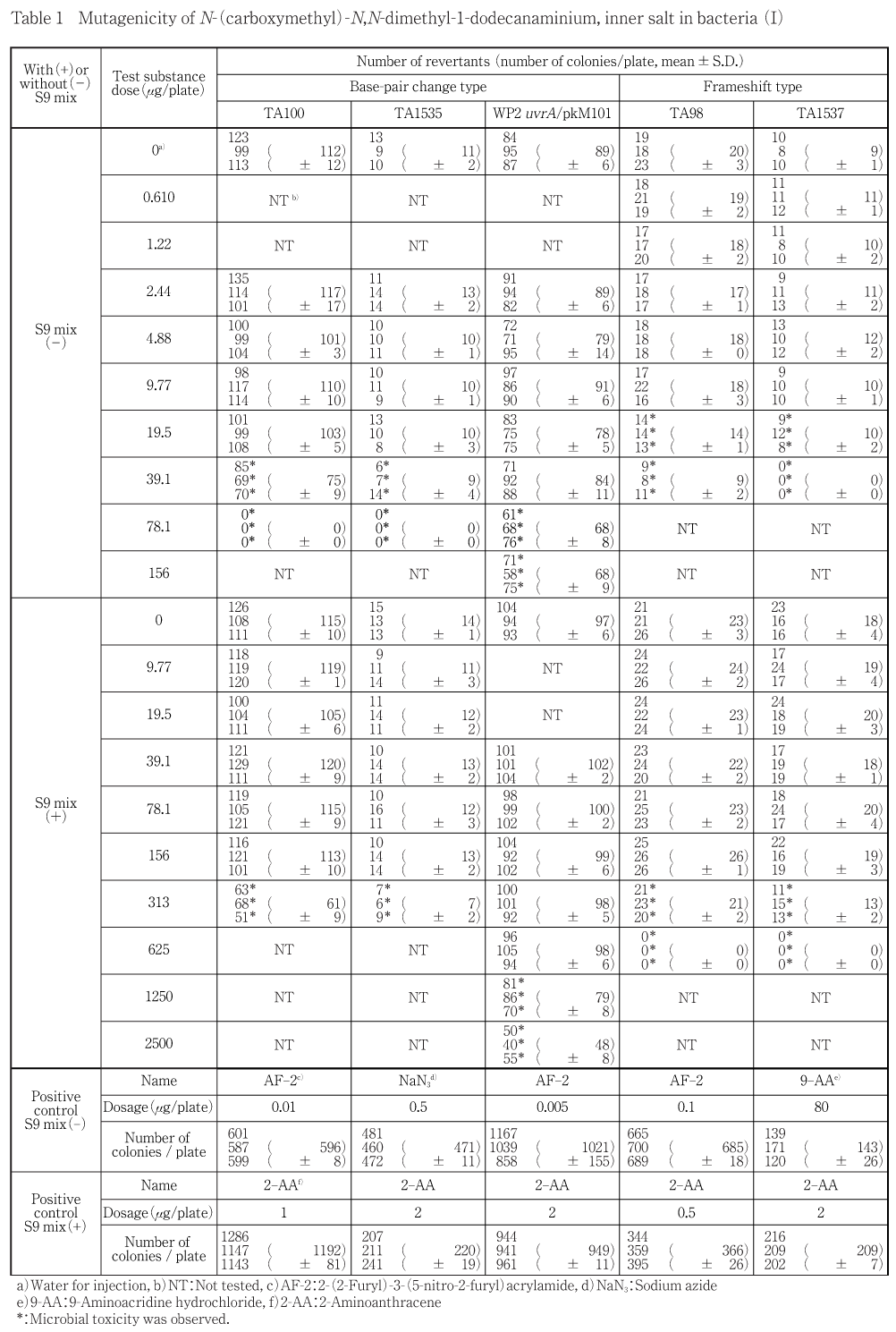
N-(カルボキシメチル)-N,N-ジメチル-1-ドデカナミニウムについてSalmonella typhimurium TA100, TA1535, TA98, TA1537およびEscherichia coli WP2 uvrA/ pKM101を用いる復帰変異試験を実施した.
予備試験の結果をもとに本試験では,S9 mix非共存下のTA100, TA1535は78.1〜2.44 μg/plate(公比2)の6用量,WP2 uvrA/pKM101は156〜2.44 μg/plate(公比2)の7用量,TA98, TA1537は39.1〜0.610 μg/plate(公比2)の7用量を,S9 mix共存下のTA100, TA1535は313〜9.77 μg/plate(公比2)の6用量,WP2 uvrA/pKM101は2500〜39.1 μg/plate(公比2)の7用量,TA98, TA1537は625〜9.77 μg/plate(公比2)の7用量をそれぞれ設定した.
2回の本試験の結果,S9 mixの有無にかかわらず,いずれの菌株においても陰性(溶媒)対照値の2倍以上を示す復帰変異コロニー数の増加は認められなかった.
以上の結果から,N-(カルボキシメチル)-N,N-ジメチル-1-ドデカナミニウムは本試験系において変異原性を有さない(陰性)と判定した.
カリフォルニア大学B.N. Ames教授より1983年5月27日に入手したSalmonella typhimurium TA98, TA100, TA1535, TA1537 1)および日本バイオアッセイ研究センターより1997年 9月18日に入手したEscherichia coli WP2 uvrA/pKM101 2)の5菌株を用いた.テスト菌株は菌懸濁液にジメチルスルホキシド(DMSO:関東化学)を加え,0.2 mLずつ小分けしてドライアイス・アセトン中で急速凍結した後,超低温槽で-80℃以下に凍結保存したものを使用した.これら菌株はアミノ酸要求性,紫外線感受性,膜変異,薬剤耐性などの遺伝的特徴を事前に調べ,特性を備えていることを確認した.
L字型試験管に2.5 %ニュートリエントブロス(Oxoid Nutrient Broth No.2, Oxoid社)溶液を10 mL分注し,これに凍結保存した菌懸濁液を解凍して20 μLを接種した.37℃で8時間振盪培養した後,濁度計を用いて菌濃度を測定し,生菌数が1×10^9/mL以上であることを確認した.
N-(カルボキシメチル)-N,N-ジメチル-1-ドデカナミニウム(ロット番号:3047,花王(東京)提供)は,純度27.1 %の微黄色透明液体である.被験物質は使用時まで室温,遮光に密閉容器で保存した.実験終了後,残余被験物質を分析した結果,安定性に問題はなかった.
注射用水(DW:大塚製薬工場)を用いて最高用量の溶液を調製した後,同溶媒で所定用量に段階希釈し,速やかに試験に使用した.被験物質の秤量に際しては純度換算(27.1 %)を実施した.
陽性対照物質として下記のものを用いた.陽性対照物質溶液は,あらかじめ所定の濃度に調製し,-80℃以下に凍結保存したものを使用した.
| AF-2 : | 2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミド | (和光純薬工業) | |
| NaN3 : | アジ化ナトリウム | (和光純薬工業) | |
| 9-AA : | 9-アミノアクリジン塩酸塩 | (Sigma-Aldrich Fine Chemicals) | |
| 2-AA : | 2-アミノアントラセン | (和光純薬工業) |
NaN3はDWに,その他はDMSOに溶解したものを使用した.
アミノ酸水溶液として,精製水を用いて0.5 mmol/L D-ビオチン,0.5 mmol/L L-ヒスチジン混合水溶液(サルモネラ用)または0.5 mmol/L L-トリプトファン水溶液(大腸菌用)を調製し,これをろ過滅菌後,冷蔵庫に保管した.精製水100 mLに対して,粉末寒天(Bacto-agar,Difco社)0.6 g,塩化ナトリウム0.5 gの割合で加え,オートクレーブで滅菌し完全に溶解させた後,上記のアミノ酸水溶液を1/10量加えて混和し,約45℃に保温した.
クリメディアAM-N培地(オリエンタル酵母工業)を購入し,使用した.なお,培地1 Lあたりの組成は下記のとおりである.
| 硫酸マグネシウム・七水塩 | 0.2 g | |
| クエン酸・一水塩 | 2 g | |
| リン酸二カリウム・無水塩 | 10 g | |
| リン酸一アンモニウム | 1.92 g | |
| 水酸化ナトリウム | 0.66 g | |
| グルコース | 20 g | |
| 寒天(伊那寒天BA-30 A) | 15 g |
径90 mmのシャーレ1枚あたり30 mLを流して固めてある.
S9 mix 1 mLあたり以下の組成で調製し,使用時まで氷中に保存した.
| S9* | 0.1mL | |
| 塩化マグネシウム | 8 μmol | |
| 塩化カリウム | 33 μmol | |
| D-グルコース6-リン酸 | 5 μmol | |
| b-NADPH | 4 μmol | |
| b-NADH | 4 μmol | |
| ナトリウム-リン酸緩衝液(pH 7.4) | 100 μmol | |
| 滅菌精製水 | 残量 |
*: 購入したS9(キッコーマン)を使用した.このS9は,7週齢の雄のSD系ラットにフェノバルビタールと5,6-ベンゾフラボンを併用投与して作製した肝ホモジネートの9000×g遠心上清分画である.
試験はプレインキュベーション法で実施した.
滅菌した試験管に被験物質溶液を0.1 mL,0.1 mol/Lナトリウム-リン酸緩衝液(pH 7.4)を0.5 mLおよび菌懸濁液を0.1 mL加え,37℃で20分間振盪培養した.S9 mixを共存させる場合には,0.1 mol/Lナトリウム-リン酸緩衝液の代わりにS9 mixを0.5 mL添加した.プレインキュベーション後,トップアガー2 mLを上記の混合液に加え混和し,最少グルコース寒天平板培地上に重層した.重層したトップアガーが凝固した後,37℃で48時間培養した.
実体顕微鏡を用いて菌叢の生育状態を観察し,被験物質による抗菌性の有無を調べた後,目視により被験物質の沈殿の有無を確認した.プレート上の復帰変異コロニー数を自動コロニーカウンターで計測した.予備試験は各用量につき1枚のプレートを使用した.本試験は各用量につき3枚のプレートを使用し,再現性を確認するため2回実施した.また,被験物質溶液の代わりに陰性対照物質(溶媒)および各菌株毎の陽性対照物質を用いて,被験物質群と同様の操作を行う対照群を設けた.
いずれかの試験菌株で,S9 mixの有無にかかわらず,被験物質用量の増加にともなって復帰変異コロニー数(平均値)が陰性(溶媒)対照値の2倍以上に増加し,さらにその増加に再現性が認められる場合に,当該被験物質は変異原性を有する(陽性)と判定した.なお,試験結果の判定には統計学的手法は用いなかった.
予備試験をSalmonella typhimurium TA100, TA1535, TA98, TA1537 およびEscherichia coli WP2 uvrA/ pKM101を用いて5000, 1250, 313, 78.1, 19.5, 4.88, 1.22 μg/plateの7用量で実施した結果,S9 mixの有無にかかわらず,いずれの菌株においても復帰変異コロニー数の増加は認められなかった.また,S9 mix非共存下ではTA100, TA1535, WP2 uvrA/pKM101の78.1 μg/plate以上,TA98, TA1537の19.5 μg/plate以上で,共存下ではTA100, TA1535, TA98, TA1537の313 μg/plate以上,WP2 uvrA/pKM101の1250 μg/plate以上で抗菌性が認められた.なお,S9 mixの有無にかかわらず,いずれの被験物質処理群においてもプレート上に沈殿物は認められなかった.従って本試験では,S9 mix非共存下のTA100, TA1535は78.1, 39.1, 19.5, 9.77, 4.88, 2.44 μg/plateの6用量,WP2 uvrA/pKM101は156, 78.1, 39.1, 19.5, 9.77, 4.88, 2.44 μg/plateの7用量,TA98, TA1537は39.1, 19.5, 9.77, 4.88, 2.44, 1.22, 0.610 μg/plateの7用量を,共存下のTA100, TA1535は313, 156, 78.1, 39.1, 19.5, 9.77 μg/plateの6用量,WP2 uvrA/pKM101は2500, 1250, 625, 313, 156, 78.1, 39.1 μg/plateの7用量,TA98, TA1537は625, 313, 156, 78.1, 39.1, 19.5, 9.77 μg/plateの7用量をそれぞれ設定した.
試験の結果をTable 1, 2に示した.本試験を2回実施した結果,S9 mixの有無にかかわらず,いずれの菌株においても陰性(溶媒)対照値の2倍以上を示す復帰変異コロニー数の増加は認められなかった.また,S9 mix非共存下ではTA100, TA1535の39.1 μg/plate以上,WP2 uvrA/pKM101の78.1 μg/plate以上,TA98, TA1537の19.5 μg/plate以上で,共存下ではTA100, TA1535の313 μg/plate,WP2 uvrA/pKM101の1250 μg/plate以上,TA98, TA1537の313 μg/plate以上で抗菌性が認められた.なお,S9 mixの有無にかかわらず,いずれの被験物質処理群においてもプレート上に沈殿物は認められなかった.
なお,S9 mix非共存下および共存下において陽性対照が各菌株に誘発した復帰変異コロニー数は,各菌株の陰性対照の復帰変異コロニー数と比較して,明らかに2倍を超えて増加し,陽性の結果を示した.
以上の結果から,N-(カルボキシメチル)-N,N-ジメチル-1-ドデカナミニウムは本試験系において変異原性を有さない(陰性)と判定した.
なお,N-(カルボキシメチル)-N,N-ジメチル-1-ドデカナミニウムは当試験施設で並行して実施したほ乳類培養細胞を用いる染色体異常試験では陰性の結果が報告されている3).また,類似化合物であるL-Arginine L-gultamate 4)は,細菌を用いる復帰変異試験で陰性の結果が報告されている.
| 1) | Maron DM, Ames BN:Revised methods for the Salmonella mutagenicity test. Mutation Res, 113: 173-215(1983). |
| 2) | Green MHL, Muriel WJ:Mutagen testing using Trp+ reversion in Escherichia coli. Mutation Res, 38: 3-32(1976). |
| 3) | 成見香瑞範ら:N-(カルボキシメチル)-N,N-ジメチル-1-ドデカナミニウムのチャイニーズ・ハムスター培養細胞を用いる染色体異常試験.化学物質毒性試験報告,13:109-112(2006). |
| 4) | 石館基(監修):「微生物を用いる変異原性試験データ集」エル・アイ・シー,東京(1991)p. 41. |
| 連絡先 | |||
| 試験責任者: | 榎本佳明 | ||
| 試験担当者: | 榎本佳明,清水優子,網代真希子 | ||
| (株)三菱化学安全科学研究所 鹿島研究所 | |||
| 〒314-0255 茨城県神栖市砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | |||
| Authors: | Yoshiaki Enomoto(Study director) Yoshiaki Enomoto, Yuko Shimizu, Makiko Ajiro |
||
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory | |||
| 14 Sunayama, Kamisu-shi, Ibaraki, 314-0255 Japan | |||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | ||