4,4'-メチレンジフェノールは,特殊ポリカーボネートや特殊エポキシ樹脂の原料として用いられている.その毒性については刺激性を有し,ラットにおける急性毒性試験の報告で雄ラットのLD50は経口投与で4950 mg/kgである1).今回,4,4'-メチレンジフェノールの安全性確認のための資料を得ることを目的としてラットにおける28日間反復経口投与毒性試験(回復14日間)を,雌雄の Sprague-Dawley系ラットを用いて実施した.雌雄とも4群構成とし,1群には媒体である0.1 %Tween 80添加0.5 %カルメロースナトリウム水溶液を,他の3群には被験物質を,それぞれ60,250および1000 mg/kgの用量で28日間反復強制経口投与した.試験には雌雄とも各群5匹ならびに回復試験用に対照群および1000 mg/kg投与群各5匹を加えた計60匹の動物を使用した.
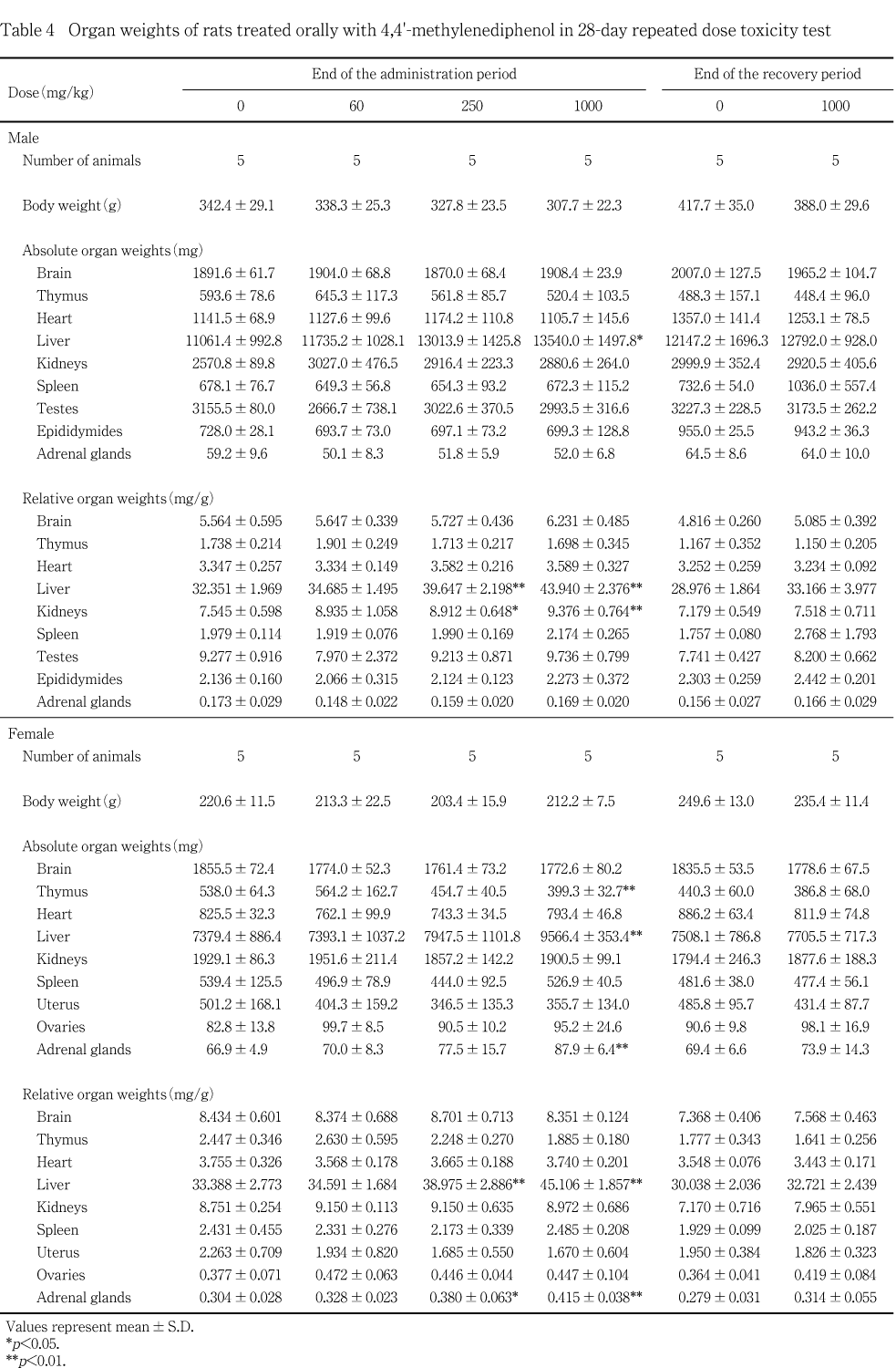
死亡例はなく,投与期間中,1000 mg/kg投与群の雌雄で投与初日に摂餌量の減少がみられ,雄の1000 mg/kg投与群で体重増加抑制が投与第4日から15日まで認められた.一般状態では,1000 mg/kg投与群の雌雄で投与後に腹臥位姿勢,うずくまり,自発運動の低下,歩行失調および閉眼がみられた.これらの一般状態の異常は大多数の例では投与初日に認められ,投与第7日以降はみられなかった.また,詳細な臨床観察では,被験物質投与によると思われる変化は認められなかった.血液生化学検査では,雌雄の250 mg/kg 以上の投与群で総コレステロール濃度に有意な減少が認められ,雌ではA/G比の低下とアルカリ性フォスファターゼ活性の上昇にも有意差が認められた.さらに,雌の1000 mg/kg 投与群ではg-グルタミルトランスペプチダーゼ活性が有意に上昇し,トリグリセライド濃度の増加とアスパラギン酸アミノトランスフェラーゼ活性の低下が認められた.病理学検査では,肝臓の相対重量が250 mg/kg以上の雌雄の投与群で増加しており,そのうち1000 mg/kg投与群の雌雄では小葉中心性の肝細胞肥大が認められ,また,雌では250 mg/kg以上の投与群で副腎の相対重量が増加し,皮質に束状帯細胞のび慢性肥大が観察された.回復期間終了時には,肝臓および副腎のこれらの変化は認められなかった.
以上の結果,本試験条件下における4,4'-メチレンジフェノールの無作用量は,雌雄とも60 mg/kg/dayと考えられた.
被験物質は,本州化学工業(和歌山)より提供された4,4'-メチレンジフェノール(ロット番号:930903,純度99.91 %)を入手後,試験開始まで室温で保管し,使用した.被験物質の安定性は,受領前および返却後(試験終了後)に提供元で被験物質の品質試験を実施することにより確認した.
検体調製では,被験物質の各濃度を乳鉢で粉砕後,媒体を加えて所定濃度の懸濁液を調製した.媒体には,注射用水(光製薬)を溶媒として0.1 %Tween 80(和光製薬)添加0.5 %に調製したカルメロースナトリウム(丸石製薬)水溶液を使用した.
投与検体は,冷蔵条件下で8日間の安定性が確認されているので1週間に1回の頻度で調製し,使用時まで冷蔵庫にて保管した.また,投与検体中に含まれる被験物質の含量および均一性は,秦野研究所において確認した.
試験には,4週齢で購入し,検疫と飼育環境への馴化を兼ねて8日間予備飼育した雌雄のSprague-Dawley系[Crj:CD(SD)IGS,SPF]ラット(日本チャールス・リバー)各30匹を使用した.
群分けは,投与開始日前日の体重に基づいて体重別層化無作為抽出法により行った.各群の動物数は,雌雄とも対照群および高用量群を各10匹とし,低および中用量群を各5匹とした.
動物は,温度21.0〜25.0℃,湿度40.0〜75.0 %,換気回数約15回/時および照明12時間(7時〜19時点灯)に設定された飼育室内で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2,日本クレア)と水道水(秦野市水道局給水)を自由に摂取させて飼育した.
本試験の投与量は,先に実施した予備試験の結果を基に決定した.即ち,4,4'-メチレンジフェノールを0,250,500および1000 mg/kgの用量で雌動物に7日間反復経口投与した結果,250 mg/kg以上の投与群で自発運動の低下が観察され,1000 mg/kg投与群ではよろめき歩行および腹臥位姿勢も認められた.しかし,これらの症状は投与初日のみの変化か,あるいは投与の経過に伴い発現しなくなった.また,250 mg/kg以上の投与群では総コレステロール濃度の低下傾向がみられたほか,1000 mg/kg投与群では有意な体重増加抑制が認められた.剖検においては,各群に被験物質の影響と考えられる所見はみられなかったことから,本試験の投与用量は1000 mg/kgを高用量とし,以下,公比約4で除して250および60 mg/kgを中および低用量に設定した.
投与経路は経口とし,1日1回,28日間,ラット用胃管を用いて強制的に投与した.投与容量は 10 mL/kgとし,雌雄とも最近時の体重をもとに個体別に投与液量(mL)を算出した.なお,回復期間は14日間とした.
毎日(投与期間中は投与前および投与約2〜3時間後),全例の生死を含む一般状態の観察を行った.
スコアリング法による詳細な臨床観察を,投与前および投与開始後は回復期間終了日まで1週間に1回,ブラインドで行った.観察は,ケージ越しで,姿勢・体位,自発運動,発声,振戦,痙攣について観察し,ハンドリング時では,取り出し易さ,扱い易さ,心拍動,体温,被毛,皮膚色,可視粘膜,流涙,眼球突出,瞳孔径,流涎について観察し,さらに作業台上の観察で,姿勢・体位,探索行動,身づくろい,発声,挙尾反応,歩行,常同行動,奇妙な行動,振戦,痙攣,呼吸数,立毛,眼裂,排尿回数,排便回数,接触に対する反応,撤去反応,耳介反射を観察した.また,投与第4週には,刺激に対する反応性の観察として,聴覚刺激に対する反応では驚愕反応,視覚刺激に対する反応では視覚定位,瞳孔反射,固有感覚刺激に対する反応では正向反射を合わせて観察した.
体重は,投与第1週には3回,その後は毎週2回の頻度で測定したほか,投与期間終了日,回復期間終了日および剖検日にも測定した.摂餌量は毎週1回の頻度で測定した.
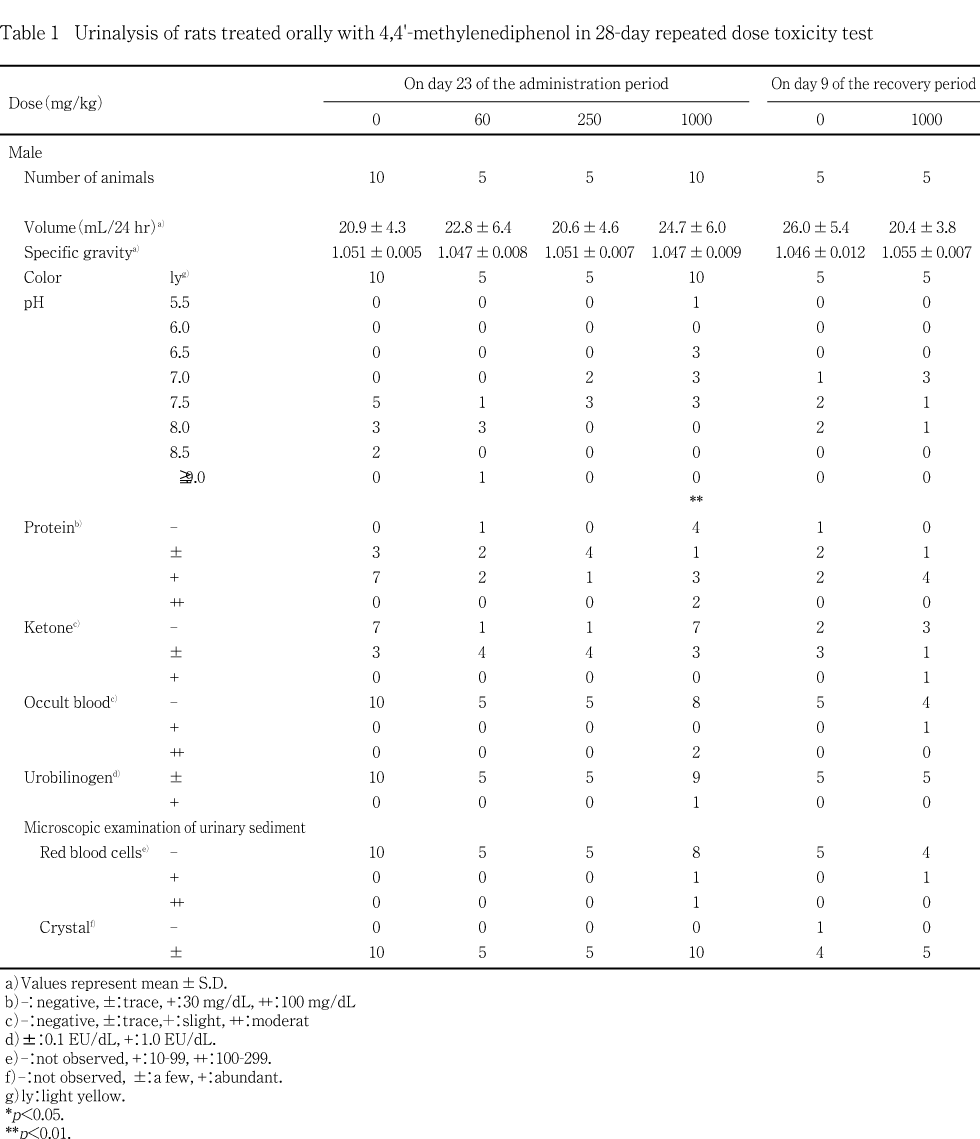
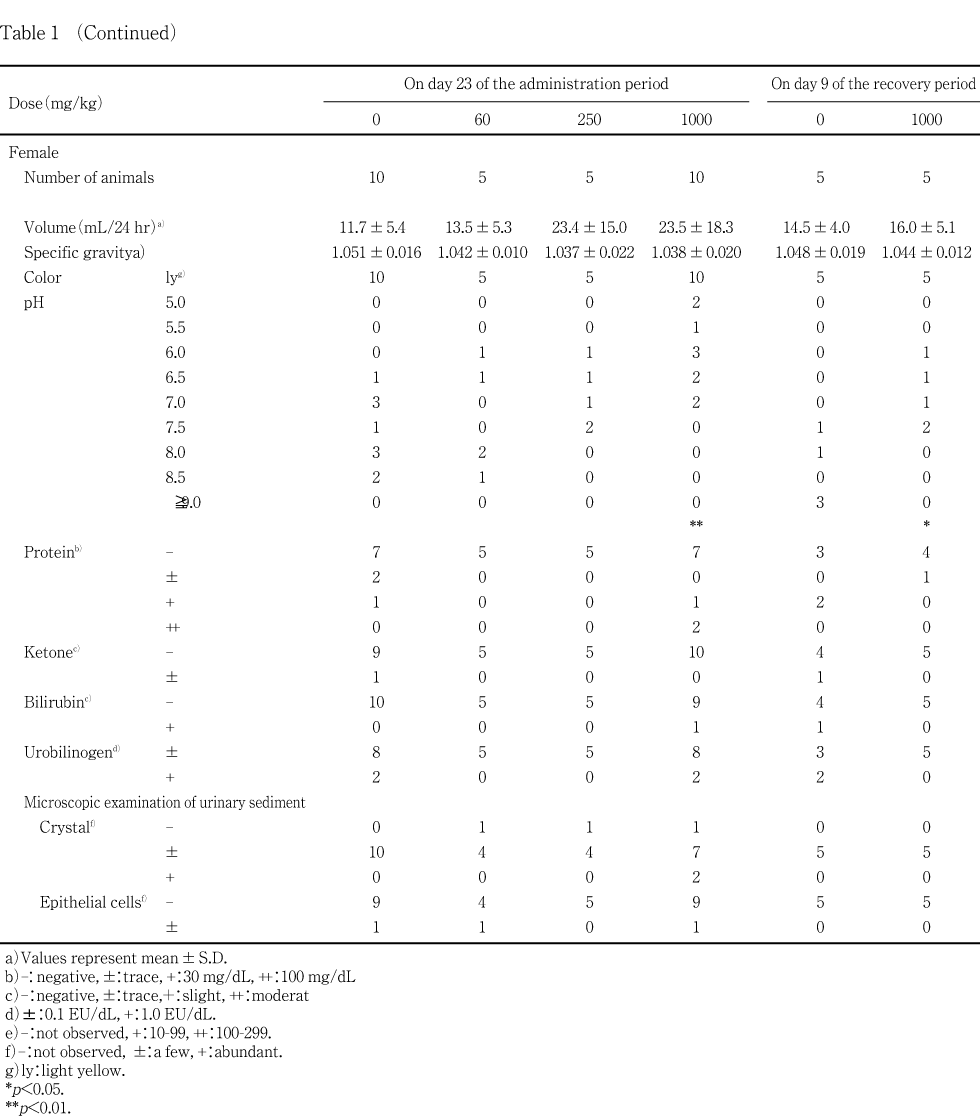
投与第4週および回復期間第2週に全例を代謝ケージに収容して蓄尿し,約4および24時間の時点で採尿した.この4時間尿を用いて試験紙法(クリニテック200+,バイエル・三共)によりpH,潜血,蛋白,糖,ケトン体,ウロビリノーゲンおよびビリルビンの定性試験を行い,光学顕微鏡により沈渣を,視診により色調および混濁度を検査した.さらに,24時間尿の重量を天秤測定し,1 mLの重量から得られた比重で除して24時間における尿量を算出した.
投与期間ないし回復期間終了日から翌日の剖検日にかけて18から24時間絶食させた後,ペントバルビタールナトリウムで麻酔し,腹部後大静脈から,血液学検査用としてクエン酸ナトリウムおよびEDTA-2 Kを抗凝固剤として採血し,次いで,血液生化学検査用として抗凝固剤にヘパリンを用いて採血した.採血は,対照群,低,中および高用量群の順序で,1匹ずつ動物番号の若い方から選択して行った.
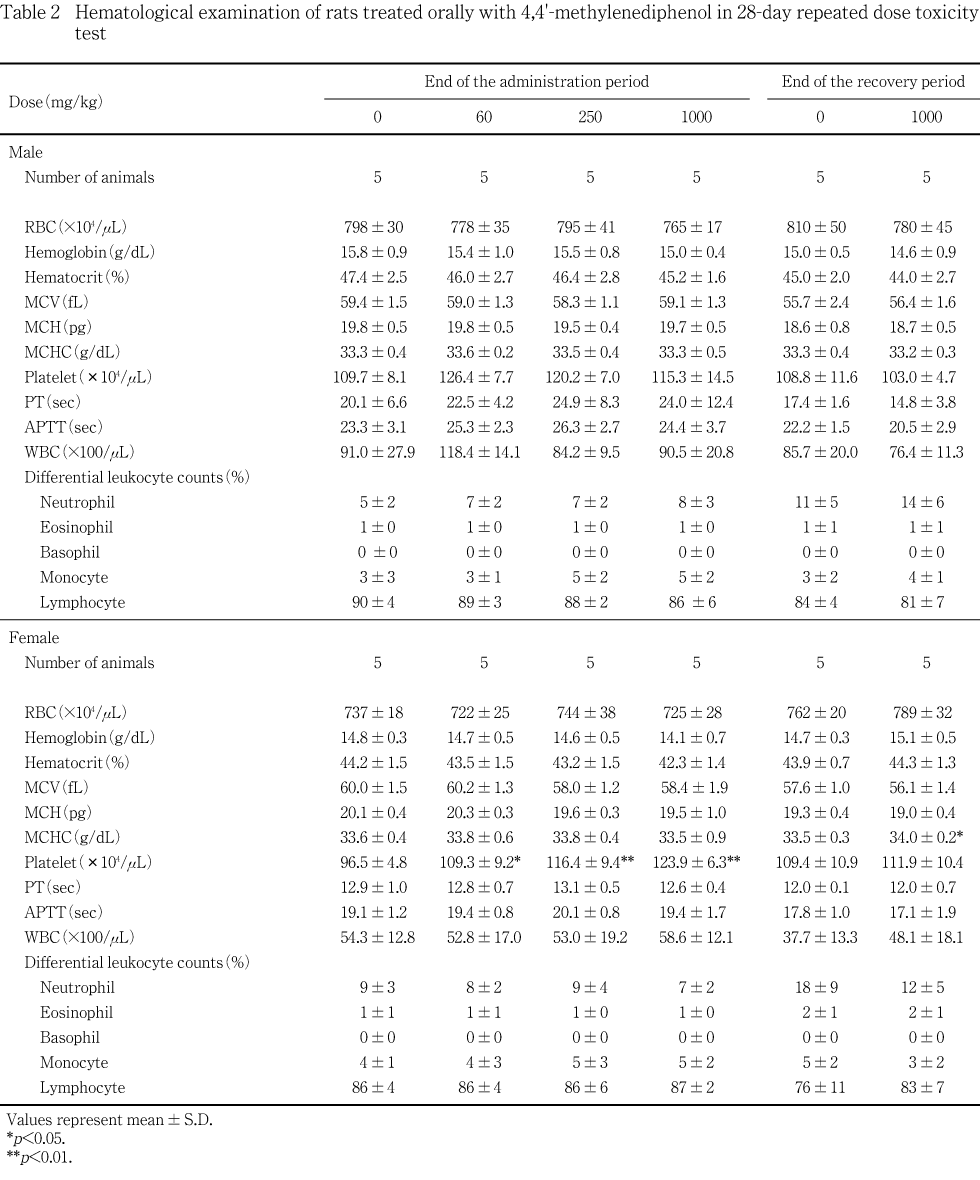
血液自動分析装置(CELL-DYN3500SL,ダイナボット)を用いて,電気抵抗法により赤血球数,平均赤血球容積,血小板数を測定し,白血球数はフローサイトメトリー・レーザー光散乱法/電気抵抗法で,白血球分類はフローサイトメトリー・レーザー光散乱法で,血色素量は吸光度法により測定し,これらを基にヘマトクリット値,平均赤血球血色素量および平均赤血球血色素濃度を算出した.また,全自動血液凝固測定装置(CA-1000,東亜医用電子)を用いて,プロトロンビン時間および活性部分トロンボプラスチン時間を光散乱検出法により測定した.
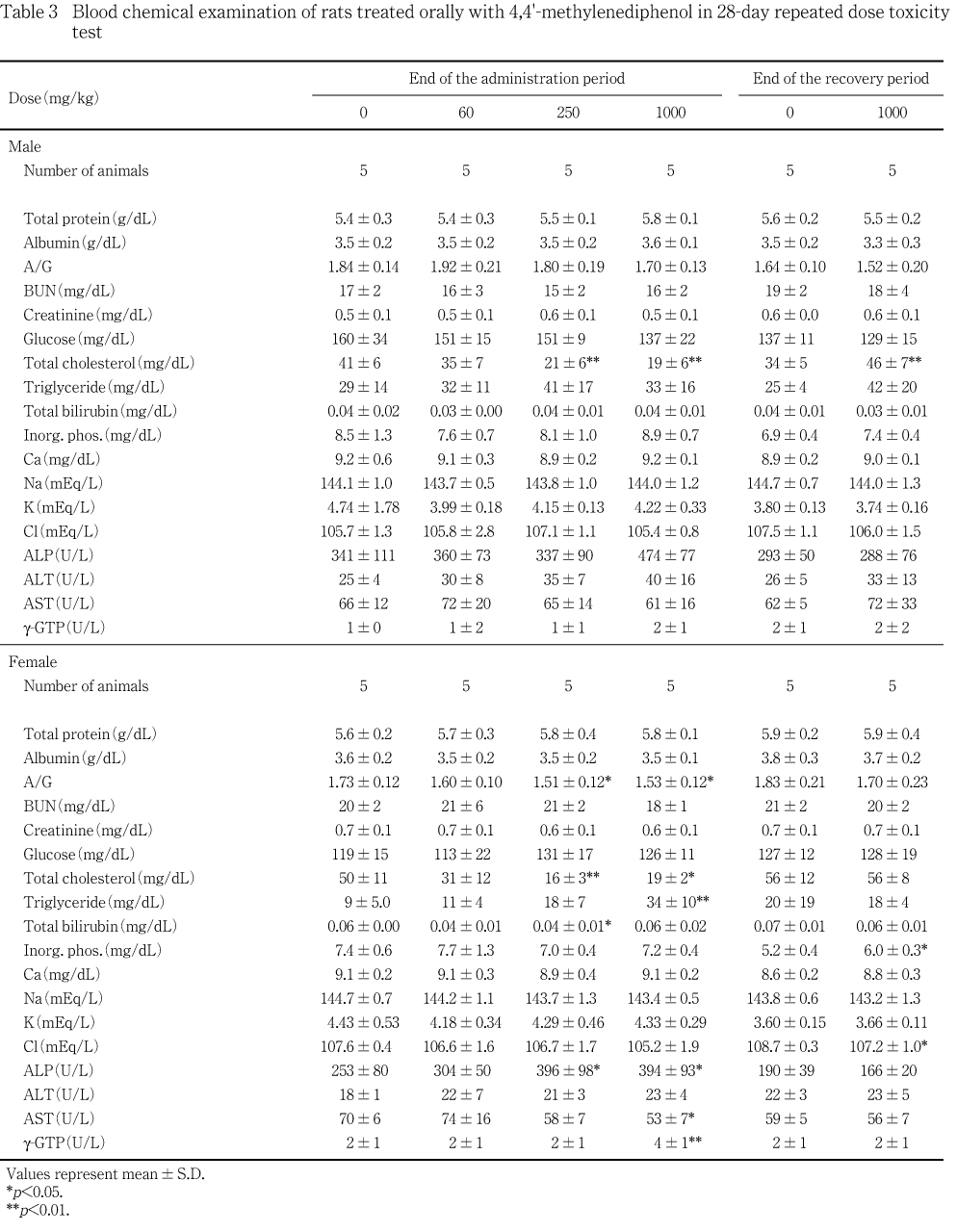
遠心方式生化学自動分析装置(COBAS-MIRA plus,ロシュ・ダイアグノステックス)を用いて総蛋白濃度はビウレット法で,アルブミン濃度はBCG法で,総コレステロール濃度はコレステロールオキシダーゼ・HDAOS法で,グルコース濃度はヘキソキナーゼ・G-6-PDH法で,尿素窒素濃度はウレアーゼ.G1DH法で,クレアチニン濃度はJaff事@で,アルカリ性フォスファターゼ(ALP)活性はGSCC 法で,アスパラギン酸アミノトランスフェラーゼ(AST)活性はIFCC法で,アラニンアミノトランスフェラーゼ(ALT)活性はIFCC法で,g-グルタミルトランスペプチダーゼ(g-GTP)活性はIFCC法で,トリグリセライド濃度はGPO・HDAOS法(グリセリン消去法),で,総ビリルビン濃度はアゾビリルビン変法で,無機リン濃度はモリブデン酸直接法で,カルシウム濃度はOCPC 法で測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度をイオン電極法により測定した.
採血終了後,必要に応じて腋窩動脈を切断して放血屠殺した後,器官および組織を肉眼的に観察した.また,各動物の脳,胸腺,心臓,肝臓,腎臓,脾臓,副腎,精巣,精巣上体,子宮,卵巣の重量を測定し,各器官重量を剖検日の体重で除してそれぞれの相対重量を算出した.次いで,脳,脊髄,心臓,肺(気管支を含む),気管,肝臓,腎臓,脾臓,胃,小腸(回腸,パイエル板を含む),大腸(結腸),前立腺,精嚢(凝固線を含む),卵巣,子宮,腟,膀胱,甲状腺,副腎,大腿骨および骨髄,腸間膜リンパ節,下顎リンパ節,胸腺,坐骨神経を0.1Mリン酸緩衝10 %ホルマリン溶液に,精巣,精巣上体をブアン液に浸漬固定した.固定後,対照群および高用量群の標本については,パラフィン包埋して薄切し,ヘマトキシリン・エオジン染色標本を作製し,光学顕微鏡を用いて組織学的に検査した.また,60および250 mg/kg投与群においても変化の認められた器官を同様に検査した.
体重,摂餌量,半定量検査を除く尿検査ならびに血液学検査,生化学検査の値および器官重量については,群ごとに平均値および標準偏差を求めた.また,3群以上の被験物質投与群について対照群と比較する場合は,Bartlettの方法による分散の一様性の検定の後,一元配置型の分散分析あるいはKruskal-Wallisの順位検定を行い,Dunnett型の検定法で多重比較を行った.2群間で比較する場合には, F-検定を行い, Studentのt検定法あるいはAspin-Welchのt検定法を用いて有意差検定を行った.その他,尿の半定量的検査成績については,m×nの分割表を用いるx^2検定を行い,Dunnett型の検定法により多重比較を行った.病理組織学検査所見のグレード分けしたデータについては,Mann-WhitneyのU検定(両側検定)を行い,陽性グレードの合計値はFisherの直接確率片側検定を行った.なお,いずれの検定も有意水準を5 %とした.
投与期間および回復期間中に死亡例はなかった.
投与初日に,1000 mg/kg投与群の雌雄のほとんどの例で,投与後に腹臥位姿勢からうずくまりおよび自発運動の低下を示した.この時,歩行失調,閉眼を伴う例も認められた.これらの症状は投与後約3時間には回復したが,雌の1例では3時間以後も継続した.投与第2日では,腹臥位姿勢またはうずくまりと自発運動の低下が1000 mg/kg投与群の雌雄に各4例認められ,雄においては投与第3日以降,認められなかった.一方,雌1例では腹臥位姿勢と自発運動の低下が投与第5日まで見られ,投与第6日には2例で認められたが,これらの症状は投与第7日以降認められなかった.
また,投与直後に一過性の流涎が1000 mg/kg 投与群の雌で投与第6日から,雄では投与第8日からみられ,投与期間中に雄で8例,雌で9例に認められた.なお,これらの中には投与直前からの流涎も雌雄各2例にみられた.250 mg/kg投与群にも一過性の流涎が投与期間中,雄2例,雌3例に認められた.その他には,雌の1000 mg/kg 投与群の8例,250 mg/kg投与群の1例に下腹部の被毛の汚れが認められ,1000 mg/kg 投与群では計3例で回復期間の第3日までみられた.
試験期間中に週一回の頻度で行ったスコアリング法による観察では,ケージ越しからの観察,作業台上の観察および接触に対する反応で投与期間中および回復期間中に対照群と各被験物質投与群に差は認められなかった.ハンドリング時では,250および1000 mg/kg投与群で一般状態の観察時に認められた雌雄での流涎と雌に投与第2週から下腹部の被毛の汚れが認められた.その他に対照群と各被験物質投与群に差は認められなかった.
投与第4週に行った刺激に対する反応性の観察では,いずれの観察項目にも対照群と各被験物質投与群に差は認められなかった.
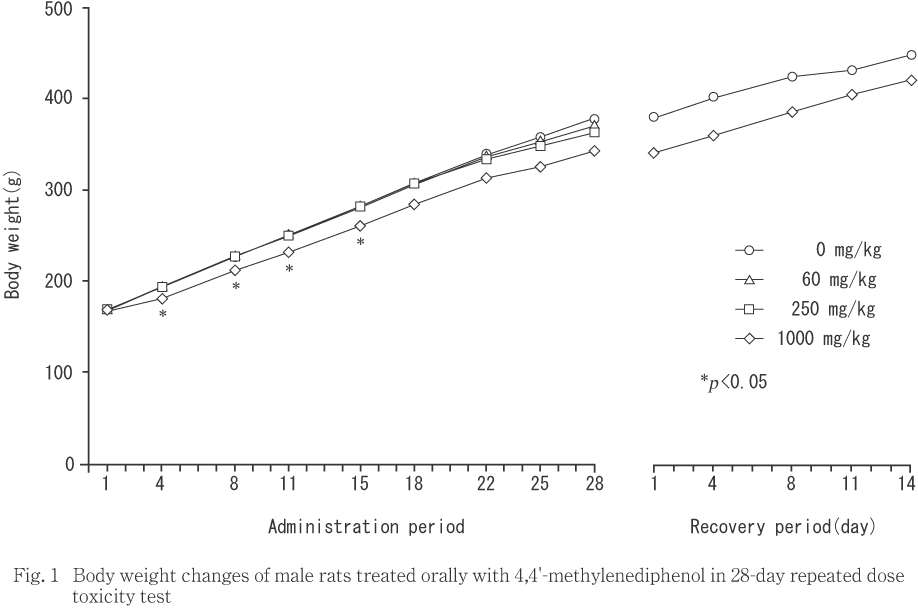
投与期間中,1000 mg/kg 投与群の雄に,投与第4日から15日まで体重増加に有意な抑制がみられた.回復期間中,雌雄共に被験物質投与群と対照群との間で体重推移に差は認められなかった.

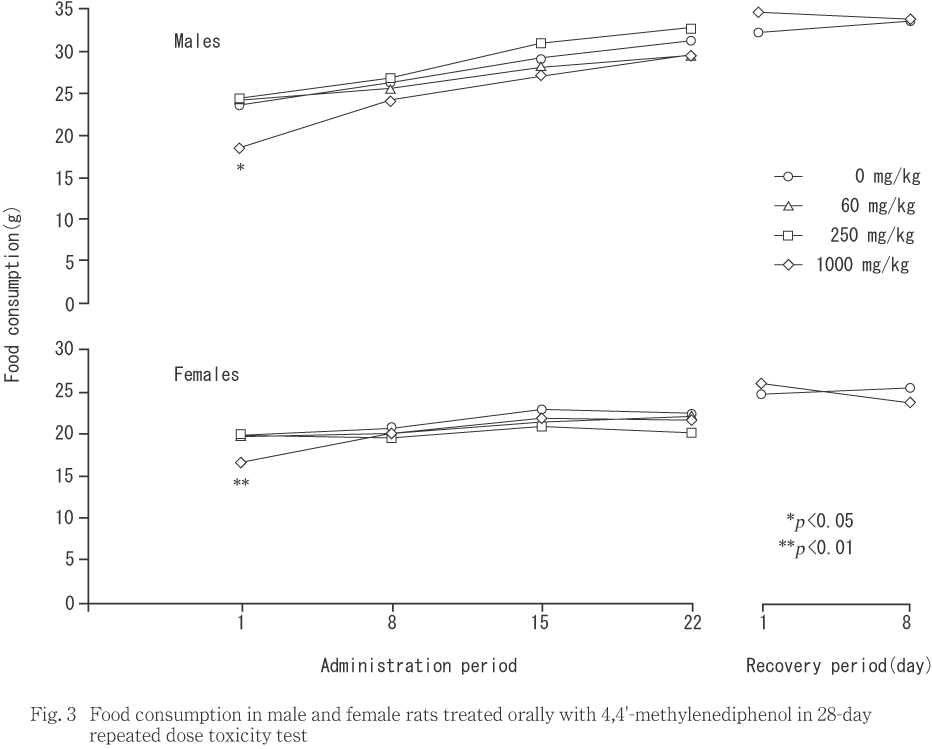
1000 mg/kg投与群の雌雄において,投与初日に摂餌量の有意な減少がみられた.
回復期間中では,雌雄ともに摂餌量に有意な差は認められなかった.
投与第4週の検査で1000 mg/kg投与群の雌雄に尿pH の有意な低下が認められ,雌では回復期間終了週の検査においても有意な低下がみられた.1000 mg/kg投与群の雌雄において認められたこと,また,1000 mg/kg投与群の雄において腎臓の相対重量が有意に増加していたことから被験物質投与の影響が考えられるが,尿pHは種々の要因を受け変動しやすいことから2),その原因については明らかではなかった.また,雄で潜血反応陽性が1000 mg/kg 投与群において投与第4週の検査で2例と回復期間終了週の検査で1例に認められ,これらの例では,沈渣においても赤血球が確認された.しかし,病理組織学検査では,これらを関連づけるような異常所見は認められなかった.その他に投与期間終了週および回復期間終了週の検査では,被験物質投与群と対照群との間に明らかな変化は認められなかった.
投与期間終了時の検査では,雌の各被験物質投与群で血小板数に有意な増加がみられた.雌ラットの血小板数の生理的範囲が,101.8 ± 19.6 ×10^4/μL3)に対して本試験では,対照群の値が 96.5 ± 4.8 × 10^4/μLと低い傾向であった.しかし,用量依存的な変化が認められるため被験物質の影響も考えられるが病理組織学検査でこれに関連づけられるような所見は認められず,また,他の血液検査値に異常もみられないことから原因は不明であった.
回復期間終了時の検査では,1000 mg/kg 投与群の雌の平均赤血球血色素濃度に有意差が認められたが,投与期間終了時にはみられないことから,被験物質投与と関連のない変化と判断した.その他には対照群と比較して雌雄いずれにおいても有意な差は認められなかった.
投与期間終了時では,1000および250 mg/kg投与群の雌雄で総コレステロール濃度に有意な減少が認められ,さらに,雌の1000 mg/kg投与群ではg-GTP活性およびALP活性が有意に上昇し,トリグリセライド濃度の増加とAST活性およびA/G比の低下が認められた.また,雌の250 mg/kg 投与群においてもA/G比の低下とALP活性の上昇に有意差が認められた.雌の250 mg/kg 投与群でみられた総ビリルビン濃度の低下は,用量依存的変化もなく被験物質投与の影響ではないと考えた.
回復期間終了時の検査では,1000 mg/kg投与群の雄の総コレステロール濃度の増加と雌の無機リン濃度の増加および塩素濃度の減少が有意に認められたが,生理的変動の範囲内であった.その他には,対照群と比較して雌雄いずれにおいても有意な差は認められなかった.
投与期間終了時では,雌雄の肝臓が1000 mg/kg投与群で実重量および相対重量に,250 mg/kg投与群では相対重量に有意な増加が認められた.さらに雌では副腎が1000 mg/kg投与群で実重量および相対重量が,250 mg/kg投与群では相対重量が有意に増加した.雄では1000および250 mg/kg投与群で腎臓の相対重量が有意に増加した.
回復期間終了時の剖検では,対照群と比較していずれの器官重量にも変化は認められなかった.
投与期間終了時屠殺例では,1000 mg/kg投与群の雄1例に肝臓の腫大が認められた.
回復期間終了時屠殺例では,1000 mg/kg投与群の雄で1例に脾臓の腫大が認められたほかに,異常所見は認められなかった.
投与期間終了時屠殺例では,以下に示す変化が観察された.
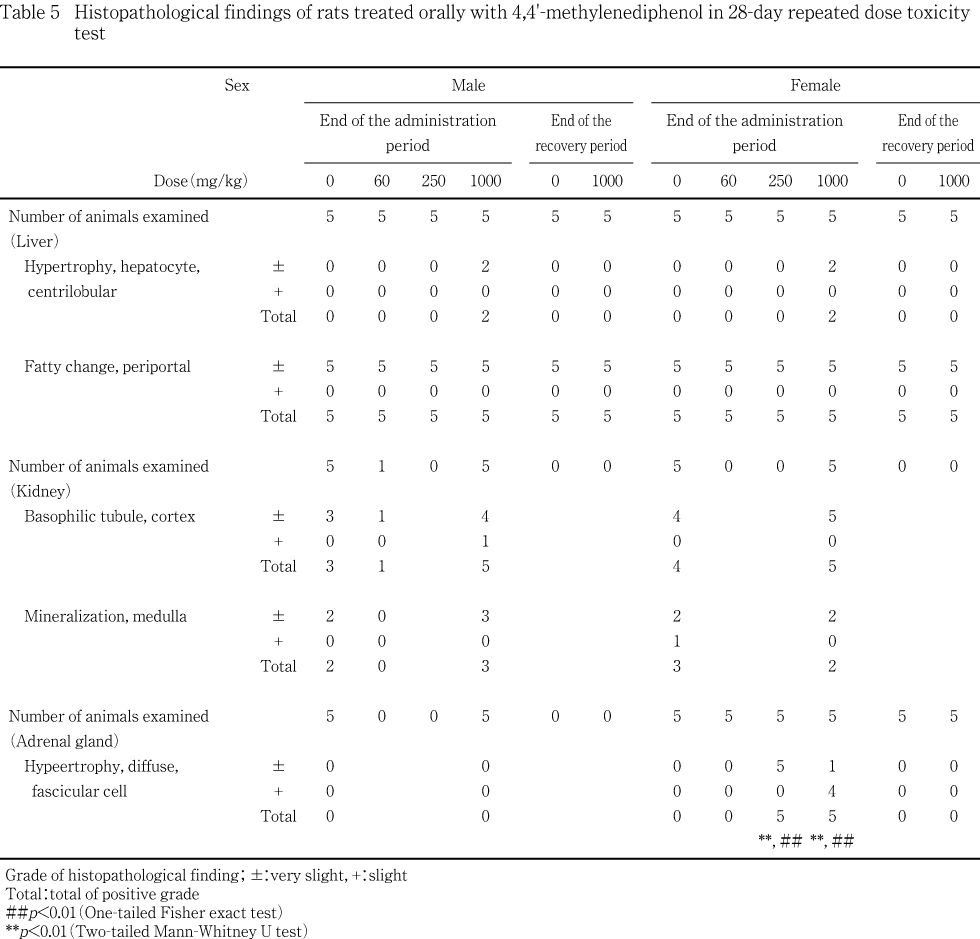
肝臓では,1000 mg/kg 投与群の雌雄各2例に小葉中心性の肝細胞肥大が観察された.また,全例に門脈周囲性の肝細胞の脂肪化が観察されたが,対照群と各被験物質投与群との間には程度の差は認められなかった.
副腎では,1000および250 mg/kg投与群の雌全例の皮質に,束状帯細胞のび慢性の肥大が観察され,そのうち1000 mg/kg投与群の変化の程度は,250 mg/kg投与群に比較して増強する傾向が認められた.一方,雄の1000 mg/kg投与群および対照群には,異常所見は認められなかった.
腎臓では,皮質に塩基性尿細管が 1000 mg/kg投与群の雌雄全例,対照群の雄3例,雌4例,髄質に鉱質沈着が1000 mg/kg投与群の雄3例,雌2例,対照群の雄2例,雌3例に観察されたが,いずれの所見も対照群と1000 mg/kg投与群の間に程度の明らかな差は認められなかった.
回復期間終了時屠殺例では,投与期間終了時に1000 mg/kg投与群の雌雄の肝臓に認められた小葉中心性の肝細胞肥大および雌の副腎の皮質にみられた束状帯細胞のび慢性肥大は認められなかった.
肝臓では,1000 mg/kg投与群と対照群の雌雄全例に門脈周囲性の脂肪化が観察されたが,対照群と1000 mg/kg投与群の間に程度の差は認められなかった.
4,4'-メチレンジフェノールを60,250および1000 mg/kgの用量で雌雄のSprague-Dawley系ラットに28日間反復経口投与した結果,体重では,雄の1000 mg/kg 投与群で投与第4日から15日まで増加の抑制が認められ,摂餌量では,雌雄とも投与第1日に減少がみられた.しかし,これらは以後,順調に回復した.一般状態では,1000 mg/kg投与群の雌雄で,投与後に腹臥位姿勢,うずくまり,自発運動の低下,歩行失調および閉眼が認められた.しかし,これらの症状がみられたのは,投与初日に多く,ほとんどの例ではこれ以降,認められなかった.その他,250,1000 mg/kg投与群で認められた一過性の流涎は,投与直前にもみられていること,および本被験物質が刺激性を有することから物理的刺激による反応性の流涎と考えられた.
病理学検査では,肝臓重量が250 mg/kg投与群以上の雌雄で増加し,1000 mg/kg投与群の雌雄に,小葉中心性の肝細胞肥大が認められた.さらに,血液生化学検査では,雌の1000 mg/kg投与群に,g-GTP活性の有意な上昇とAST 活性の有意な低下,トリグリセライド濃度の増加およびA/G比の減少,250 mg/kg投与群以上でALP活性の有意な上昇もみられた.これらの変化の内,肝臓重量の増加,小葉中心性の肝細胞肥大およびg-GTP 活性の有意な上昇は,本被験物質の類似物質であるメチレンジフェノールのラットを用いる28日間反復経口投与毒性試験4)においても,同様の変化が認められていることから,被験物質投与の影響によるものと考えられた.しかし,AST活性,トリグリセライド濃度,A/G比,ALP活性の変化については,前記の類似物質であるメチレンジフェノールの試験においては認められなかったが,本被験物質投与の影響が考えられた.また,雌では250 mg/kg以上の投与群で副腎の相対重量が有意に増加し,皮質に束状帯細胞のび慢性の肥大が観察された.血液生化学検査では,総コレステロール濃度の低下が,雌の 250 mg/kg 以上の投与群でみられた.これらの変化も,前記のメチレンジフェノールの試験4)で認められたことから,被験物質投与の影響によるものと考えられた.肝臓および副腎のこれらの変化は,回復期間終了時には認められなかった.
以上のように4,4'-メチレンジフェノールの28日間反復投与によって引き起こされた毒性作用は,雌雄の250 mg/kg以上の投与群で認められた肝臓重量の増加および雌の250 mg/kg以上の投与群で認められた,副腎皮質の束状帯細胞のび慢性肥大と総コレステロール濃度の低下であった.従って以上の成績より,4,4'-メチレンジフェノールの28日間反復経口投与毒性試験における無作用量は雌雄とも60 mg/kg/dayと考えられた.
| 1) | Smyth JHF, Carpenter CP et al.:American Industrial Hygiene Association Journal, 23:95- 107(1962). |
| 2) | 谷本義文:「実験動物の血液・尿生化学」ソフトサイエンス,東京(1988)p.123. |
| 3) | 田嶋嘉雄(監):「実験動物の生物学的特性データ」ソフトサイエンス,東京(1989)p.103, 161. |
| 4) | 須藤雅人ら:メチレンジフェノールのラットを用いる28日間反復経口投与毒性試験.化学物質毒性試験報告,8(1):949-961(2001). |
| 連絡先 | |||
| 試験責任者: | 関 剛幸 | ||
| 試験担当者: | 加藤博康 | ||
| 7食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Takayuki Seki(Study Director) Hiroyasu Kato | ||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||