 法),総ビリルビン(ジアゾ色素法),グルタミン酸オキザロ酢酸トランスアミナーゼ(Karmen改良法),グルタミン酸ピルビン酸トランスアミナーゼ(Karmen改良法),g-グルタミルトランスペプチダーゼ(Szasz 改法),カリウム(電極法),塩素(電極法),カルシウム(アルセナゾIII色素法)および無機リン(モリブデン酸アンモニウム法)を測定した.
法),総ビリルビン(ジアゾ色素法),グルタミン酸オキザロ酢酸トランスアミナーゼ(Karmen改良法),グルタミン酸ピルビン酸トランスアミナーゼ(Karmen改良法),g-グルタミルトランスペプチダーゼ(Szasz 改法),カリウム(電極法),塩素(電極法),カルシウム(アルセナゾIII色素法)および無機リン(モリブデン酸アンモニウム法)を測定した.
以上の結果から,本試験条件下における2,4-ジクロロニトロベンゼンの反復投与毒性に関する無影響量は,雌雄とも 8 mg/kg/day未満と判断される.また,雄の生殖に及ぼす影響は 200 mg/kg/day投与によっても認められず,無影響量は 200 mg/kg/dayと推察される.雌の生殖および児動物の発生・発育に及ぼす影響は 200 mg/kg/day投与で認められ,無影響量は 40 mg/kg/day と判断される.
被験物質は,コーンオイル(ナカライテスク(株))に溶解し,1.6,8 および40 mg/mlの濃度になるよう各群の投与液を調製した.調製後は,使用時まで冷暗条件下で密閉保管した.調製液中の被験物質は,1.6 mg/mlの場合,冷暗条件下で少なくとも 8日間安定であることが確認されている.
投与液の濃度分析は,調製開始時に調製した各群のバッチから無作為にサンプルを抽出し実施した.その結果,設定濃度の102〜105%の範囲で調製されおり,ほぼ所定量の 2,4-ジクロロニトロベンゼンが含有されていたことを確認した.
動物は,温度22〜26℃,湿度45〜65%,換気回数15回/時間,照度 150〜300 lux,照明時間12時間(午前 7時点灯,午後 7時消灯)に設定されたバリアシステムの飼育室で飼育した.アルミ製前面・床ステンレス網目飼育ケージに動物を 1匹ずつ収容し飼育した.妊娠18日以降の母動物は哺育 4日までアルミ製前面・床ステンレス網目飼育ケージに哺育トレーおよび巣作り材料(アルファードライ)を入れて飼育した.
飼料は,オリエンタル酵母工業(株)製造のNMF固型飼料(放射線滅菌飼料)を使用し,飼育期間中自由に摂取させた.飲水は,水道水を自由に摂取させた.供給した飼料,水および巣作り材料には試験に支障を来す可能性の考えられる夾雑物の混在はなかった.
投与経路は,OECDガイドラインに準じて強制経口投与とした.投与容量は,体重 100 g当り 0.5 mlとし,個体別に測定した最新体重に基づいて算出を行い,胃ゾンデを用いて毎日1回強制経口投与した.対照群にはコーンオイルのみを同様に投与した.
雄の投与期間は,交配前14日間と交配期間の14日間および交配期間終了後17日間の連続45日間とした.雌の投与期間は,交配前14日間と交配期間中(交尾成立まで最長14日間)ならびに交尾成立後の妊娠期間を通じて分娩後の哺育 3日まで(41〜46日間)とした.なお,交尾の成立しなかった雌は交配期間終了後の解剖前日までの45日間とした.
新生児は哺育 0日に出産児数(生存児+死亡児)を調べ,分娩率[(総出産児数/着床数)×100]および出生率[(出産生児数/総出産児数)×100] を求めた.生存児については性別を判定するとともに外表異常の有無を調べた.また,哺育 0および 4日に雌雄別の同腹児重量を測定し,雌雄別 1 匹当たりの平均重量を算出した.哺育 4日の新生児の同腹児重量を測定後に新生児全例をエ−テル麻酔により屠殺し,主要器官の肉眼観察を行った.なお,哺育期間中の死亡児についても同様に主要器官の肉眼観察を行った.また,新生児の 4日生存率[(哺育 4日生児数/出産生児数)× 100]を求めた.
a)血液学検査
検査はEDTA-3Kを添加した初血について,THMS H 6000 (テクニコン社)を用いて白血球数(WBC: 暗視野板法),赤血球数(RBC: 暗視野板法),ヘマトクリット値(HCT: 全赤血球の容積より補正),ヘモグロビン量(HGB: シアンメトヘモグロビン法),平均赤血球容(MCV:RBC, HCT より算出),平均赤血球血色素量(MCH:HGB, RBC より算出),平均赤血球血色素濃度(MCHC:HGB, HCT より算出),血小板数(PLT: 暗視野板法)および白血球百分率(フローサイトケミストリー法)を測定した.網赤血球(RC)比率の算定については網赤血球染色用ガラス毛細管キャピロット(テルモ(株))で染色後,血液塗抹標本を作製し鏡検した.
b)血液生化学検査
検査はクリーンシール((株)ヤトロン)に血液を採取し,30 分間放置後 3,000 r.p.m. 7 分間遠心分離して得た血清について,多項目生化学自動分析装置CentrifiChem ENCORE II(ベーカー社)および EKTACHEM 700N(コダック社)を用いて総蛋白(ビューレット法),アルブミン(B.C.G.法),A/G (計算値),血糖(グルコースオキシダーゼ法),尿素窒素(ウレアーゼ改良法),クレアチニン(Jaff 法),総ビリルビン(ジアゾ色素法),グルタミン酸オキザロ酢酸トランスアミナーゼ(Karmen改良法),グルタミン酸ピルビン酸トランスアミナーゼ(Karmen改良法),g-グルタミルトランスペプチダーゼ(Szasz 改法),カリウム(電極法),塩素(電極法),カルシウム(アルセナゾIII色素法)および無機リン(モリブデン酸アンモニウム法)を測定した.
法),総ビリルビン(ジアゾ色素法),グルタミン酸オキザロ酢酸トランスアミナーゼ(Karmen改良法),グルタミン酸ピルビン酸トランスアミナーゼ(Karmen改良法),g-グルタミルトランスペプチダーゼ(Szasz 改法),カリウム(電極法),塩素(電極法),カルシウム(アルセナゾIII色素法)および無機リン(モリブデン酸アンモニウム法)を測定した.
剖検では主要器官の肉眼的観察を行い,皮膚,乳腺,リンパ節,唾液腺,胸骨,大腿骨(骨髄を含む),胸腺,気管,肺および気管支,心臓,甲状腺および上皮小体,舌,食道,胃,十二指腸,小腸,大腸,肝臓,膵臓,脾臓,腎臓,副腎,膀胱,精嚢,前立腺,精巣,精巣上体,卵巣,子宮,膣,眼球,ハーダー腺,脳,下垂体および脊髄を10%中性緩衝ホルマリン液で固定した.
b) 雄動物
45日間投与した日の夕方から餌を除き,約16時間の絶食させた翌日にエ−テル麻酔下で安楽死させた.剖検では主要器官の肉眼的観察を行い,胸腺,肝臓,腎臓,精巣および精巣上体重量を測定し器官重量・体重比(相対重量)を求めた.また,全動物の重量測定器官に加えて脳,心臓,脾臓,副腎,精嚢,前立腺,下垂体および病変部組織を10%中性緩衝ホルマリン液で固定した.なお,精巣および精巣上体はブアン氏液で固定した.
c) 自然分娩した雌
哺育 4日にエーテル麻酔下で放血安楽死させた.剖検では主要器官の肉眼的観察を行った後,胸腺,肝臓,腎臓および卵巣重量を測定し器官重量・体重比(相対重量)を求めた.また,全動物の重量測定器官に加えて脳,心臓,脾臓,副腎,下垂体および病変部組織を10%中性緩衝ホルマリン液で固定した.剖検時に黄体数および着床数を調べ,着床率[(着床数/妊娠黄体数)× 100]求めた.
d) 交尾の成立しなかった雌
45日間投与した翌日にエーテル麻酔下で放血安楽死させた.剖検では主要器官の肉眼的観察を行い,皮膚,乳腺,リンパ節,唾液腺,胸骨,大腿骨(骨髄を含む),胸腺,気管,肺および気管支,心臓,甲状腺および上皮小体,舌,食道,胃,十二指腸,小腸,大腸,肝臓,膵臓,脾臓,腎臓,副腎,膀胱,卵巣,子宮,腟,眼球,ハーダー腺,脳,下垂体および脊髄を10%中性緩衝ホルマリン液で固定した.
e) 死産児のみを娩出した雌および全児死亡の認められた雌
分娩確認日または生存児すべての死亡または喰殺が確認された日にエーテル麻酔下で放血安楽死させた.剖検では主要器官の肉眼的観察を行った後,皮膚,乳腺,リンパ節,唾液腺,胸骨,大腿骨(骨髄を含む),胸腺,気管,肺および気管支,心臓,甲状腺および上皮小体,舌,食道,胃,十二指腸,小腸,大腸,肝臓,膵臓,脾臓,腎臓,副腎,膀胱,卵巣,子宮,腟,眼球,ハーダー腺,脳,下垂体および脊髄を10%中性緩衝ホルマリン液で固定した.
皮膚,乳腺,リンパ節,唾液腺,胸骨,大腿骨(骨髄を含む),胸腺,気管,肺および気管支,心臓,甲状腺および上皮小体,舌,食道,胃,十二指腸,小腸,大腸,肝臓,膵臓,脾臓,腎臓,副腎,膀胱,精嚢,前立腺,精巣,精巣上体,卵巣,子宮,膣,眼球,ハーダー腺,脳,下垂体および脊髄について実施した.
b) 妊娠を成立させた雄
全例の脳,胸腺,心臓,肝臓,腎臓,脾臓,副腎,精巣および病変部組織について実施した.
c) 自然分娩した雌
全例の脳,胸腺,心臓,肝臓,腎臓,脾臓,副腎,卵巣および病変部組織について実施した.
d) 交尾の成立しなかった雌雄
全例の脳,胸腺,心臓,肝臓,腎臓,脾臓,副腎,腟,子宮,卵巣,精巣,精巣上体,精嚢,前立腺および下垂体について実施した.
e) 死産児のみを娩出した雌および全児死亡の認められた雌
皮膚,乳腺,リンパ節,唾液腺,胸骨,大腿骨(骨髄を含む),胸腺,気管,肺および気管支,心臓,甲状腺および上皮小体,舌,食道,胃,十二指腸,小腸,大腸,肝臓,膵臓,脾臓,腎臓,副腎,膀胱,卵巣,子宮,腟,眼球,ハーダー腺,脳,下垂体および脊髄について実施した.
 の多重比較検定で対照群と各投与群間の有意差を検定した.Bartlettの等分散検定で不等分散の場合は Kruskal-Wallis の順位検定を実施した.有意で各群の標本数が同数の場合は Dunnettの順位検定,各群の標本数が異なる場合は Scheff
の多重比較検定で対照群と各投与群間の有意差を検定した.Bartlettの等分散検定で不等分散の場合は Kruskal-Wallis の順位検定を実施した.有意で各群の標本数が同数の場合は Dunnettの順位検定,各群の標本数が異なる場合は Scheff の順位検定で対照群と各投与群間の有意差を検定した.出産率,交尾率および受胎率についてはX^2 検定 9,10) を用いた.剖検所見で認められた肝臓の肥大および腎臓の肥大ならびに病理組織学検査で認められた肝臓および腎臓の異常所見についてはFisherの直接確率検定法10) を用いた.なお,哺育期間中の新生児に関する成績は 1母体当りの平均を 1標本とした.有意水準は* :P< 0.05 および**:P< 0.01 の 2段階とした.
の順位検定で対照群と各投与群間の有意差を検定した.出産率,交尾率および受胎率についてはX^2 検定 9,10) を用いた.剖検所見で認められた肝臓の肥大および腎臓の肥大ならびに病理組織学検査で認められた肝臓および腎臓の異常所見についてはFisherの直接確率検定法10) を用いた.なお,哺育期間中の新生児に関する成績は 1母体当りの平均を 1標本とした.有意水準は* :P< 0.05 および**:P< 0.01 の 2段階とした.








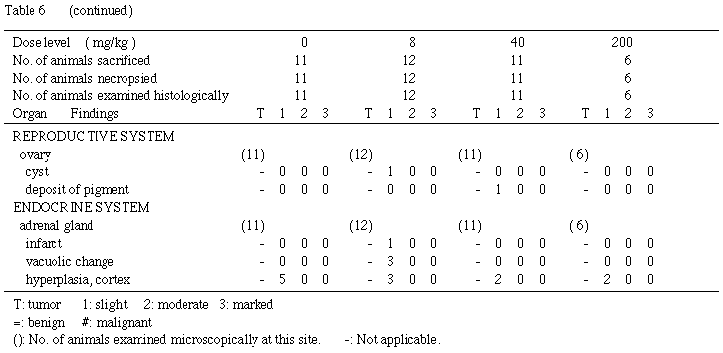
交尾不成立の動物は,雄の対照群および 40 mg/kg 群で各 1例,雌の対照群および 40mg/kg群で各1 例であり,雄では精巣および精巣上体の萎縮が 40 mg/kg 群の 1例に観察された.雌では異常所見は観察されなかった.
死産児のみを娩出した雌および哺育 4日までに全児死亡が認められた雌は 200 mg/kg群で 5例であり,肝臓の肥大が 2例,胸腺の萎縮,肺の赤色斑/区域,胃の潰瘍および白色斑/区域,小腸の潰瘍,大腸の白色斑/区域,肝臓の淡明化,腎臓の黒色化および瘢痕,卵巣の嚢胞,副腎の肥大が単発性に観察された.
その他、妊娠を成立させた雄および哺育 4日の母動物で観察された所見は、発現率も低く投与に関連する変化とは考えられなかった。
妊娠を成立させた雄では,脾臓の中等度の色素沈着が200 mg/kg 群で12例中10例に観察され,肝臓では細胞分裂像が8 および200 mg/kg 群でそれぞれ 1および 5例に,単細胞壊死が 200 mg/kg群で 7例に,また,肝細胞腫脹が 200 mg/kg群で 2例に観察された.腎臓では硝子滴変性が 200 mg/kg群で 6例に観察された.その他認められた所見は,対照群と被験物質投与群との間で発現数の差はなかった.
哺育 4日の母動物では,肝臓の単細胞壊死および肝細胞腫脹が 200mg/kg 群でそれぞれ 4および 5例に観察された.腎臓では好塩基性化が 200 mg/kg 群で 5例に,空胞化が 8 mg/kg以上の投与群で 2から 4例に,細胞分裂像は 40 および 200 mg/kg群でそれぞれ 1例に,また,壊死が 40 および 200 mg/kg群でそれぞれ 1および 2例に観察された.その他認められた所見は,対照群と被験物質投与群との間で発現数の差はなかった.
交尾不成立の動物は雄の対照群および 40 mg/kg 群で各 1例,雌の対照群および 40 mg/kg 群で各 1例であり,雄では脾臓の中等度の色素沈着,肝臓の細胞浸潤,精巣および精巣上体の萎縮が 40mg/kg 群で,前立腺の細胞浸潤が対照群で,また,副腎の空胞化が対照群および 40 mg/kg 群で観察された.雌では肝臓の細胞浸潤,腎臓の好塩基性化および子宮の細胞浸潤が 40 mg/kg 群で,脾臓の中等度の色素沈着が対照群および 40 mg/kg 群で観察された.
死産児のみを娩出した雌および全児死亡の認められた雌は200 mg/kg 群で5例であり,脾臓の中等度の色素沈着,胸腺の萎縮および乳腺の増生が全例に観察された.その他,胃,十二指腸および大腸の潰瘍が単発性または少数例に,肝臓では肝細胞腫脹が 4例に,変性,壊死および単細胞壊死が単発性に観察された.腎臓では壊死,蛋白様円柱,好塩基性化,硝子滴変性,細胞分裂像,尿細管腔の拡張,空胞化および線維化が単発性または少数例に観察された.また,副腎の硬塞が少数例に観察された.





血液学検査では,8 mg/kg 以上の投与群で赤血球数が低値を40および 200 mg/kg群でヘマトクリット値およびヘモグロビン量が低値を,網赤血球比率が高値を示し,軽微ながら貧血傾向が認められた.血液生化学検査では,40および 200 mg/kg群でγ-GTPが高値を,クレアチニンが低値を,さらに200mg/kg 群で総ビリルビンが高値を示し,肝臓に対する被験物質投与の影響が示唆された.また,40および 200 mg/kg群で総蛋白およびアルブミンが,さらに 200 mg/kg群で A/Gが高値を示した.
器官重量は,雄の 200 mg/kg群で肝臓,腎臓の実重量および相対重量がともに増加し,雌についても同群で肝臓,腎臓の実重量および相対重量が増加または増加傾向を示した.肝臓および腎臓重量の増加に関連する剖検所見として,雌雄の 200 mg/kg群で肝臓の肥大が,雄の 200 mg/kg 群で腎臓の肥大が観察された.その他,被験物質投与に起因すると考えられる所見として,胸腺の萎縮または副腎の肥大が雌の被験物質投与群で観察された.肝臓の黄色化が雄の 8 mg/kg群で 2例に観察されたが被験物質投与との関連は明らかでなかった.組織学的には,肝臓に肝細胞腫脹および単細胞壊死が観察された.核分裂像は雄の 200 mg/kg 群に多く観察され,これらの所見は剖検所見で指摘された肝臓の肥大を裏付ける変化と考えられた.腎臓では,雄に尿細管上皮の硝子滴変性,雌に好塩基性化がいずれも 200 mg/kg 群にやや多く観察された.肝臓および腎臓に観察されたこれらの病変はいずれも被験物質投与に起因するものと考えられた.さらに雌では少数例ではあるが,尿細管上皮の壊死が 40および 200 mg/kg群にそれぞれ 1および 2例観察され,細胞分裂を伴うものであった.また,空胞化は 8 mg/kg以上の投与群に観察されており,被験物質投与の影響に性差のあることが示唆され,雌では妊娠状態における要因も関与していることが考えられる.200 mg/kg 群において死産児のみを娩出した雌および全児死亡の認められた雌では,脾臓の中等度の色素沈着,胸腺の萎縮,肝細胞腫脹が4〜5例に,胃,十二指腸および大腸の潰瘍,肝臓の変性・壊死および単細胞壊死,腎臓の尿細管上皮の壊死,好塩基性化,蛋白様円柱,硝子滴変性,細胞分裂像,尿細管腔の拡張,空胞化および線維化など多彩な病変が少数例に観察された.いずれも被験物質投与の影響に加え,妊娠の関与が示唆された.なお,類似物質であるニトロベンゼンやジニトロベンゼンにおいて,精細管上皮のセルトリ細胞に直接障害を及ぼすことが報告されているため,対照群の10例および 200 mg/kg群の12例について精巣のHEおよび PAS染色標本を作製し,ステージVIIIの精細管の精上皮細胞数を測定した結果,精祖細胞,プレレプトテン期精母細胞,パキテン期精母細胞,ステップ 8精子細胞およびセルトリ細胞数は対照群と比較して差はなく,精巣毒性は認められなかった.
以上のことから,2,4-ジクロロニトロベンゼンの反復投与により,雌の 200 mg/kg群で体重増加抑制が,雄の40および 200 mg/kg群で貧血傾向,総蛋白,アルブミンおよびγ-GTPの高値およびクレアチニンの低値,さらに 200 mg/kg群で総ビリルビンおよび A/Gの高値,肝臓および腎臓重量の増加,肝臓または腎臓の肥大が認められた.病理組織学検査では,雄の200 mg/kg群および雌の8 mg/kg以上の投与群で肝臓および腎臓を中心とした異常所見が認められ,本剤における標的器官は肝臓および腎臓と考えられた.従って,無影響量は雌雄ともに 8 mg/kg/day未満と判断される.
分娩時観察では,200 mg/kg 群で一部の新生児を娩出した後に死亡した動物が 1例観察された.また,200 mg/kg 群で死産児のみを娩出した動物が 2例および哺育期間中に全児死亡の認められた動物が 3例観察され,出産生児数の減少,出生率,新生児の哺育 4日生存率および分娩率の低値または低値傾向ならび死産児数の増加傾向が認められたことから,分娩あるいは哺育機能の障害を惹起する可能性が示唆された.なお,妊娠期間および分娩時間では被験物質投与による影響は認められなかった.
新生児の外表検査で認められた異常はいずれも単発性であり,自然発生性の所見と考えられた.また,新生児の体重も哺育 4日まで順調に増加し,死産児,死亡児および哺育 4日の剖検でも被験物質投与による影響は認められなかった.
以上のことから,2,4-ジクロロニトロベンゼン による雄の生殖に及ぼす影響は,200 mg/kg/day 投与によっても認められず,無影響量は 200 mg/kg/dayと判断される.雌の生殖に及ぼす影響および児動物の発生・発育に及ぼす影響は,200 mg/kg 群で死産児のみを娩出した雌および哺育期間中の全児死亡が認められたことから,無影響量は 40 mg/kg/day と判断される.
| 1) | "Critical Reviews in Toxicology," Vol.11, CRC Press 1983. |
| 2) | T.E. Cody, S. et al. "1,3-Dinitrobenzene: Toxic effects in vivo and in vitro," J.Toxiciol.Environ.Health, 7, 829 (1981) |
| 3) | J.A. Bond et al. "Induction of hepatic and testicular lesions in Fischer-344 rats by single oral doses of nitrobenzene," Fundam. Appl.Toxicol., 1, 389(1981). |
| 4) | T.T.Mclaren et al. "Effect of age on seminiferous tubule protein secretion and the adverse effects of testicular toxicants in the rat," Int.J.Andr., 16, 370(1993). |
| 5) | L.D. Russell, R.A. Ettlin, A.P.S. Hikim, E.D. Clegg "Histological and histopathological evaluation of the testis," Cache River Press, Florida, 1990, pp. 1-118 |
| 6) | 高橋道人, 三森国敏, 古川文夫, 井上実, 松井元, "精巣毒性評価のための精細管アトラス," ソフトサイエンス社, 東京, 1994. |
| 7) | OECD Guidelines for Testing of Chemicals:Extended Steering Group Document. Vol.3, 1990. |
| 8) | C.G. Shayne, S.W. Carrol, "Statics and Experimental Design For Toxicologists," Telford Press, 1986. |
| 9) | 佐久間昭, "薬効評価Ⅰ−計画と解析−," 東京大学出版会, 東京, 1977. |
| 10) | 石居 進, "生物統計学入門," 培風館, 東京, 1975. |
| 連絡先 | |||
| 試験責任者: | 萩田孝一 | ||
| 試験担当者: | 田中亮太,渡 修明, 庄子明徳,廣内康彦, 小林和雄 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-12 静岡県磐田郡福田町塩新田字荒浜582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | |||
| Authors: | Koichi Hagita(Study director), Ryota Tanaka, Nobuaki Watari, Akinori Shoji,Yasuhiko Hirouchi, Kazuo Kobayashi | ||
| Biosafety Research Center, Foods, Drugs and | |||
| Pesticides(An-pyo Center), Japan 582-2 Shioshinden | |||
| Arahama, Fukude-cho, Iwata-gun, Shizuoka, 437-12, Japan | |||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | ||