イソチオシアン酸メチルの培養細胞に及ぼす細胞遺伝学的影響について,チャイニーズ・ハムスター培養細胞(CHL/IU細胞)を用いて染色体異常試験を実施した.
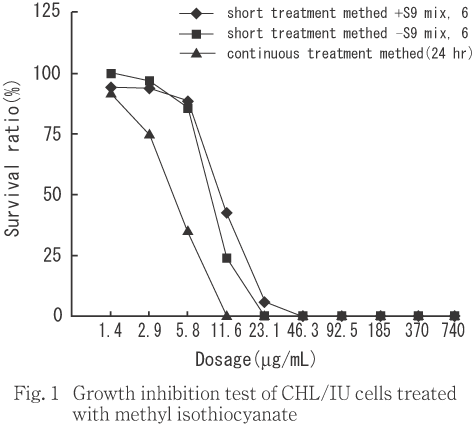
染色体異常試験に用いる濃度を決定するため,740 μg/mL(10mM相当)を最高濃度として細胞増殖抑制試験を行った結果,50 %細胞増殖抑制濃度は,短時間処理法のS9 mix添加では9.4 μg/mL,S9 mix無添加では8.6 μg/mLであった.一方,連続処理法(24時間処理)では4.1 μg/mLであった.このことから試験濃度は,短時間処理法のS9 mix添加および無添加では20 μg/mL,連続処理法では10 μg/mLを最高濃度とし,以下公比2で5濃度設定した.
試験の結果,短時間処理法のS9 mix添加では10 μg/mL以上,S9 mix無添加では5 μg/mL以上,また,連続処理法では2.5 μg/mL以上で明らかな構造異常が認められた.倍数性細胞の誘発作用は,短時間処理法および連続処理法のいずれの処理群においても認められなかった.また,媒体として用いた無水エタノールは無処置対照群と同様な値を示し,試験系に及ぼす影響は認められなかった.
以上の結果より,イソチオシアン酸メチルは,上記の試験条件下で染色体異常誘発性を有する(陽性)と結論する.
イソチオシアン酸メチル(ロット番号:TWR4288,和光純薬工業(大阪))は,黄褐色燈明の液体,純度:99.8 %,水,ジメチルスルホキシドに不溶,エタノール,クロロホルムに混和で,通常の取り扱いにおいては安定である.被験物質は冷蔵・遮光下で保管した.
被験物質は無水エタノール(ワコーケミカル)に用時混和して最高濃度原液を調製し,その後,無水エタノールで順次希釈して所定の濃度の被験物質調製液を調製した.被験物質調製液は,すべての試験において培養液の1.0 vol%になるように加えた.
実験終了後,残余被験物質について供給元で分析した結果,実験期間中は安定であったことが確認された.
大日本製薬から入手したチャイニーズ・ハムスター由来のCHL/IU細胞を,解凍後継代10代以内で試験に用いた.
Eagle-MEM粉末(GIBCO)を処方に従って調製し,非働化(56℃,30分)した仔牛血清(GIBCO)を最終濃度で10 vol%になるように加えた培養液を用いた.
2×10^4個/5 mL培養液のCHL/IU細胞をディッシュ(径6 cm,CORNING)に播き,37℃のCO2インキュベーター(5 % CO2)内で培養した.
短時間処理法では,細胞播種3日後に被験物質調製液を加え,S9 mix添加および無添加で6時間処理し,処理終了後,新鮮な培養液でさらに18時間培養した.また,連続処理法では,細胞播種3日後に被験物質調製液を加え,24時間処理した.
S9(オリエンタル酵母工業)は,誘導剤としてフェノバルビタールおよび5,6-ベンゾフラボンを投与したSprague-Dawley系雄ラットの肝臓から調製されたものを購入し,製造後6ヵ月以内に使用した.添加量は培養液に対して5 vol%とした.
染色体異常試験における被験物質の処理濃度を決定するため,被験物質の細胞増殖に及ぼす影響を調べた.被験物質のCHL/IU細胞に対する増殖抑制作用は,血球計測盤を用いて各群の細胞数を計測し,陰性(溶媒)対照群に対する割合をもって指標とした.
その結果,50 %細胞増殖抑制濃度は,短時間処理法のS9 mix添加では9.4 μg/mL,S9 mix無添加では8.6 μg/mLであった.連続処理法では4.1 μg/mLであった(Fig.1).
細胞増殖抑制試験の結果により,染色体異常試験における被験物質の処理濃度は,短時間処理法のS9 mix添加および無添加では20 μg/mL,連続処理法では10 μg/mLを最高濃度とし,以下公比2で5濃度設定した.対照として,陰性(溶媒)対照,無処置対照および陽性対照を設けた.
陽性対照として,短時間処理法のS9 mix添加にはジメチルニトロサミン(DMN,和光純薬工業)を500 μg/mL,S9 mix無添加にはマイトマイシンC(MMC,協和醗酵工業)を0.1 μg/mL,連続処理法にはMMCを0.05 μg/mLの濃度で用いた.
いずれの処理群も,各濃度3枚のディッシュに処理し,2枚を染色体標本作製,1枚を細胞増殖抑制計測用に用いた.

培養終了2時間前にコルセミド(GIBCO)を最終濃度として約0.2 μg/mLとなるように添加した.染色体標本の作製は常法に従って行った.スライド標本は各ディッシュにつき3枚作製した.作製した標本を2 vol%ギムザ染色液で15分間染色した.
各ディッシュ当たり100個,すなわち1濃度当たり200個の分裂中期像を顕微鏡下で観察した.標本はすべてコード化し,盲検法で観察を行った.染色体の分析は,日本環境変異原学会・哺乳動物試験分科会による分類法1)に基づいて行い,染色体型あるいは染色分体型の切断,交換などの構造異常と倍数性細胞の有無について観察した.
構造異常を有する細胞あるいは倍数性細胞の出現頻度を,石館ら2)の基準に従って判定した.染色体異常を有する細胞の出現頻度が5 %未満を陰性(-),5 %以上10 %未満を疑陽性(±),10 %以上を陽性(+)とした.
なお,構造異常はギャップのみを有する細胞を含めない(-gap)場合について判定した.
また,統計学的手法を用いた検定は実施しなかった.
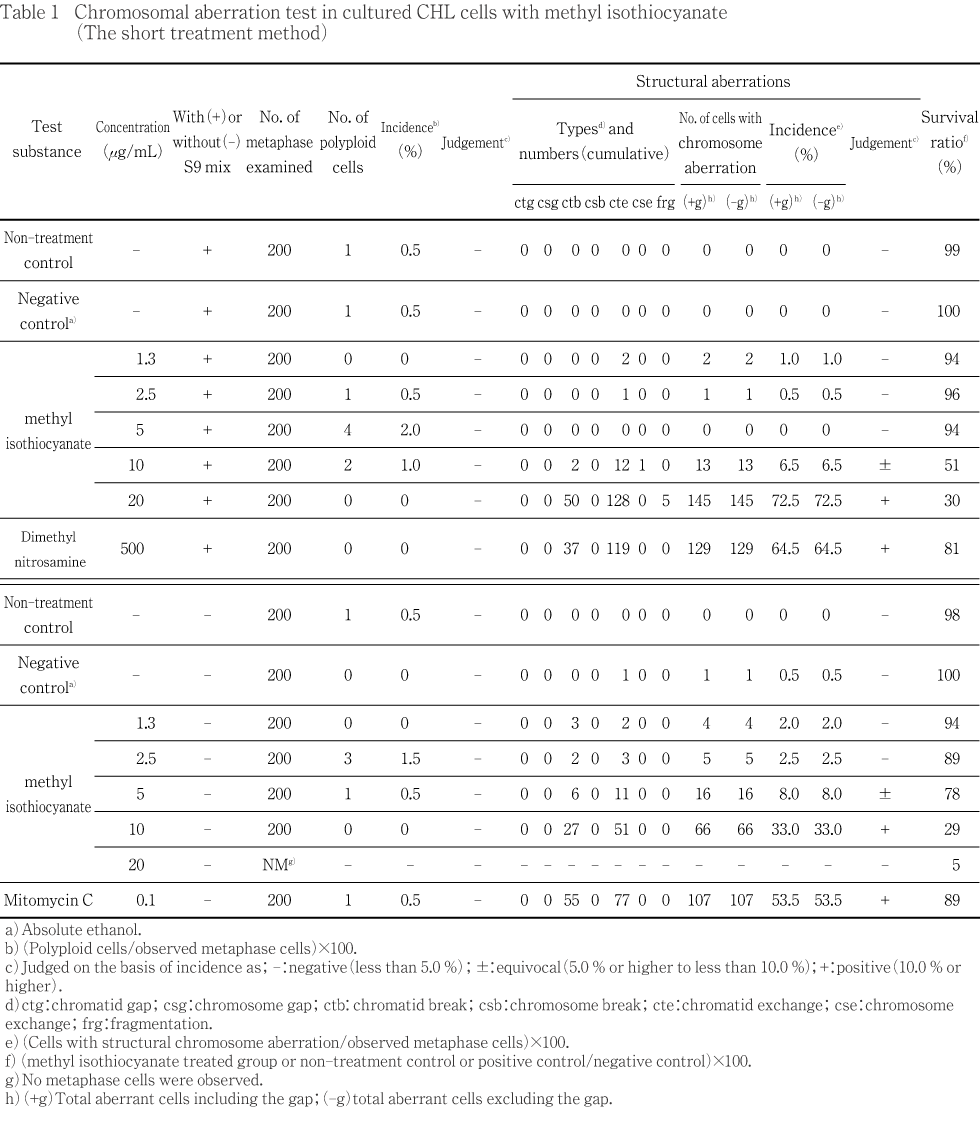
短時間処理法による試験結果をTable 1に示した.染色体構造異常の出現頻度は,S9 mix添加の10,20 μg/mLにおいてそれぞれ6.5 %,72.5 %,S9 mix無添加の5,10 μg/mLにおいてそれぞれ8.0 %,33.0 %であった.一方,倍数性細胞の誘発作用はS9 mix添加および無添加とも認められなかった.
また,陽性対照として用いたDMN(S9 mix添加)およびMMC(S9 mix無添加)では,染色体構造異常の顕著な誘発が認められた.
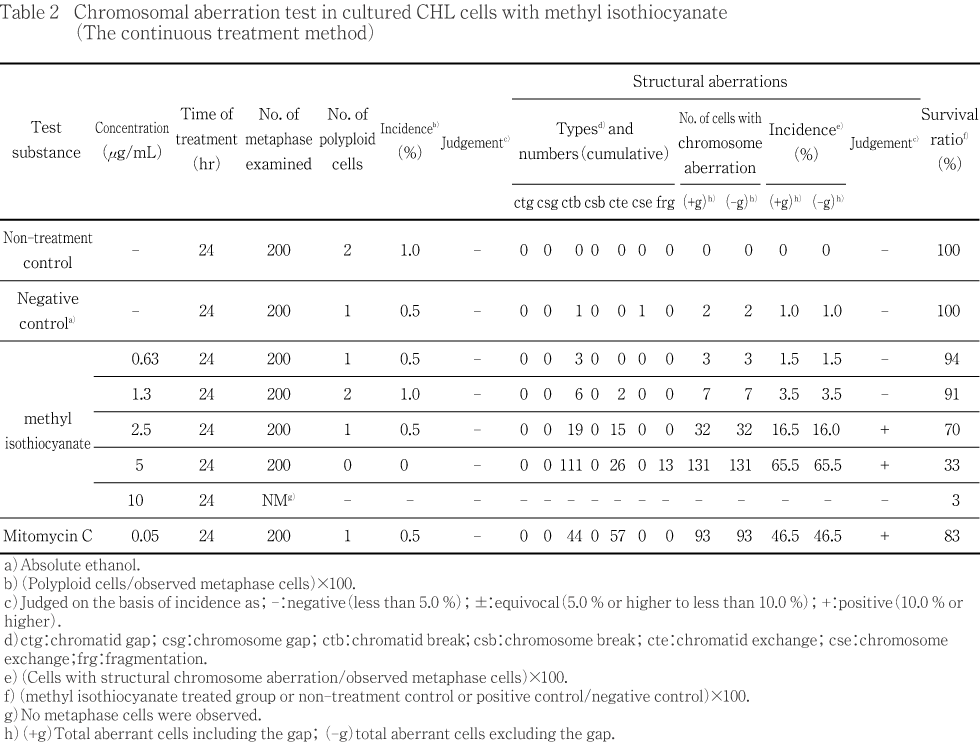
連続処理法による試験結果をTable 2に示した.染色体構造異常の出現頻度は,2.5,5 μg/mLにおいて16.0 %,65.5 %であった.一方,倍数性細胞の誘発作用は認められなかった.
また,陽性対照として用いたMMCでは,染色体構造異常の顕著な誘発が認められた.
短時間処理法および連続処理法とも,溶媒として用いた無水エタノールは,無処置対照群と同様な誘発頻度を示し,試験系に及ぼす影響は認められなかった.
本被験物質のD20値およびTR値を求めたところ,それぞれ0.0013 mg/mL,3200 mg/mLとなり,染色体異常誘発性は強いものと考えられた.
以上の結果から,本試験条件下においてイソチオシアン酸メチルは染色体異常誘発性を有する(陽性)と結論する.
なお,本被験物質は,B.subtilisを用いたDNA修復試験,S.typhimurium/E.coliを用いた復帰変異試験,ヒトリンパ球を用いた染色体異常試験,マウスを用いた小核試験で陰性,培養細胞(CHL/IU)を用いた染色体異常試験において陽性の報告がある3).
| 1) | 日本環境変異原学会・哺乳動物試験分科会(編):「化学物質による染色体異常アトラス」朝倉書店,東京(1988)pp.16-37. |
| 2) | 祖父尼俊雄(監修):「〈改定〉染色体異常試験データー集」エル・アイ・シー,東京(1987)p.23. |
| 3) | Nihon Shering/Shionogi Pharm.:J Pesticide Sci, 15:297-304(1990). |
| 連絡先 | |||
| 試験責任者: | 三輪芳久 | ||
| 試験担当者: | 小林梨沙 | ||
| ㈱日本バイオリサーチセンター羽島研究所 | |||
| 〒501-6251 岐阜県羽島市福寿町間島6-104 | |||
| Tel 058-392-6222 | Fax 058-392-1284 | ||
| Correspondence | |||
| Authors: | Yoshihisa Miwa(Study director) Risa Kobayashi | ||
| Nihon Bioresearch Inc. | |||
| 104, 6-chome, Majima, Fukuju-cho, Hashima, Gifu, 501-6251, Japan. | |||
| Tel +81-58-392-6222 | Fax +81-58-392-1284 | ||