
なお、本試験は化審法ガイドライン(1986年)に従って実施した。また、化審法GLP(1984年)を満足している。
500 mg/kg群において、雌で投与13日および投与終了後4日にそれぞれ1例が死亡した。病理組織学的検査の結果、グリソン鞘周囲肝細胞の壊死が認められ、死因は肝障害によるものと推察された。また、雌雄ともに自発運動量減少、流涎、体重増加抑制、摂餌量減少、飲水量増加、尿量の増加傾向、血清カリウムの増加、肝臓の重量増加、グリソン鞘周囲肝細胞の腫大および細胞質の好酸性化、十二指腸の拡張および粘膜の肥厚が認められた他、雄で平均赤血球血色素量の減少、プロトロンビン時間の短縮および血清アルカリフォスファターゼの低下、雌で尿pHの上昇、血小板数の増加および活性化部分トロンボプラスチン時間の短縮が認められた。投与休止により肝臓および十二指腸の組織学的変化は消失し、その他の変化についても消失あるいは回復傾向が認められた。
100 mg/kg以下の群では被験物質投与に起因する変化は認められなかった。
以上の結果から、本試験条件下におけるジシクロヘキシルカルボジイミドの無影響量は雌雄とも100 mg/kgと考えられる。
今回、ラットを用いてジシクロヘキシルカルボジイミドの経口投与による28日間反復投与毒性試験を実施し、生体への毒性学的影響について検討したので報告する。
動物入荷後9日間馴化し、健康状態が良好なことを確認した後、5週齢で投与を開始した。
投与開始前に動物を体重別層化無作為抽出法により群分けした後、イヤーパンチを用いて群および個体を識別した。投与開始時の体重範囲は、雄が170〜197g、雌が137〜158gであった。
実験動物用床敷(ベータチップ:日本チャールス・リバー株式会社)を敷いたポリカーボネート製ケージ(265W×426D×200Hmm)に1ケージ当り2匹(同性)で収容し、スチール製架台上で飼育した。ステンレス製の固型飼料用給餌器およびポリカーボネート製の給水瓶(700ml)を用いた。
ケージ(含床敷)、給餌器および給水瓶は、週1回の頻度でオートクレーブ滅菌したものと交換した。
投与液の安定性については当研究所において分析し、冷暗所下で調製後11日間は安定であることを確認した。

| a) | 赤血球数 | レーザー光散乱法 |
| b) | 白血球数 | 同上 |
| c) | 血小板数 | 同上 |
| d) | ヘモグロビン濃度 | シアンメトヘモグロビン法 |
| e) | ヘマトクリット値 | ミクロヘマトクリット法 |
| f) | 白血球百分率 | ライト染色塗抹標本について測定 |
| g) | 網状赤血球数 | ニューメチレンブルー染色後ライト染色した塗抹標本について測定 |
| h) | プロトロンビン時間(PT) | Quick一段法 |
| i) | 活性化部分トロンボ(APTT) プラスチン時間 | 活性化セファロプラスチン法 |
| j) | 平均赤血球容積(MCV) | a)、e)より算出 |
| k) | 平均赤血球血色素量(MCH) | a)、d)より算出 |
| l) | 平均赤血球血色素濃度(MCHC) | d)、e)より算出 |
a)〜d)は自動血液分析装置(ELT-8/ds:オルソインスツルメンツ社)、e)はヘマトクリット用遠心機(MC-201:株式会社日立製作所)、f)、g)は血液細胞自動分析装置(MICROX HEG-70A:立石電機株式会社)、h)、i)は血液凝固計(KC-10:アメルング社)により測定した。
| a) | 総蛋白 | Biuret法 |
| b) | アルブミン | BCG法 |
| c) | A/G比 | a)およびb)より算出 |
| d) | グルコース | 酵素-UV法(GK-G6PDH法) |
| e) | トリグリセライド | 酵素法(LPL-GK-G3PO-POD法) |
| f) | 総コレステロール | 酵素法(CES-CO-POD法) |
| g) | 尿素窒素 | 酵素-UV法(Urease-GLDH法) |
| h) | クレアチニン | Jaffe法 |
| i) | カルシウム | O-CPC法 |
| j) | 無機リン | UV法 |
| k) | GOT(AST) | UV-Rate法(SSCC改良法) |
| l) | GPT(ALT) | UV-Rate法(SSCC改良法) |
| m) | γ-GTP | γ-グルタミル・p-ニトロアニリド基質法(SSCC改良法) |
| n) | ALP | p-ニトロフェニルリン酸基質法(GSCC改良法) |
| o) | ナトリウム | イオン選択電極法 |
| p) | カリウム | イオン選択電極法 |
| q) | クロライド | イオン選択電極法 |

a)〜g)は尿分析器(クリニテック10:株式会社マイルス・三共)、j)、k)は全自動炎光光度計(FLAME-30C/AD-3型:株式会社日本分光メディカル)、l)はクロライドメーター(Model 925:コーニングメディカル株式会社)、m)は尿比重計(ユリコン-S:株式会社アタゴ)により測定した。
採取した器官のうち、28日後解剖動物の対照および高用量群の心臓、肝臓、腎臓、脾臓、副腎、および尿沈渣から変化が疑われた精巣、ならびに剖検で被験物質による変化が認められた十二指腸について、常法に従ってヘマトキシリン・エオジン染色標本を作製し鏡検した。また、剖検時に異常が認められた器官についても検査した。
この結果、被験物質に起因した変化が雌雄の肝臓および十二指腸に認められたため、これらの器官については低、中用量群および回復後解剖動物も検査した。
 の方法により平均値あるいは順位の多重比較検定を行った。尿の定性検査および尿沈渣については、Armitageのχ^2検定を用いた。
の方法により平均値あるいは順位の多重比較検定を行った。尿の定性検査および尿沈渣については、Armitageのχ^2検定を用いた。
死亡動物ではこの他に、うずくまり、横たわり、つま先立ち歩行、歩行失調、間代性痙攣、呼吸緩徐およびあえぎが認められた。
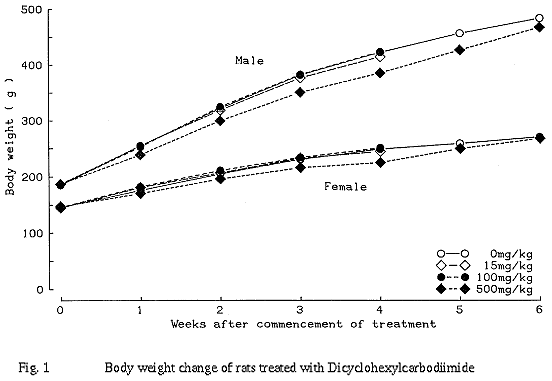


回復期間終了時には変化は認められなかった。
回復期間終了時には雄でアルカリフォスファターゼの上昇が認められた。
その他、雄の無機リンで増加がみられたが、生理的変動範囲内の変化であった。
なお、500 mg/kg群で雌雄とも尿蛋白およびケトン体の減少が認められたが、尿量増加により希釈されたために得られた二次的変化と考えられる。また、雄の尿沈渣でも精子数の減少が認められたが、精巣の病理組織学的検査では異常がなかったことから、同様に尿量増加に伴った見掛け上の変化と考えられる。
回復期間の検査では変化は認められなかった。
回復後解剖動物において、雌では肝臓重量に増加が認められたが、対照群との差は軽減していた。雌の副腎重量が減少したが、対体重比では差はなかった。
その他、腎臓皮質における褪色巣、嚢胞形成、肝臓における限局性黄色化、肺における褐色/暗赤色斑が少数例で認められたが、偶発病変と考えられる。
死亡動物2例における主な変化として、胃の腺胃粘膜の菲薄化および限局性の暗赤色化、脾臓における濾胞の萎縮、胸腺の萎縮が認められた。また、心房の拡張、肺のうっ血および水腫、胃の膨満、膵臓間質の水腫、胸腺の出血、膀胱内での黒色尿の貯留が、投与期間中および回復期間中死亡動物のいずれかで認められた。





その他、心臓における限局性心筋変性、腎臓間質における限局性リンパ球浸潤、髄質における嚢胞形成、腎尿細管上皮の好塩基性変化および硝子滴の出現、肝臓における胆管周囲結合織の好中球浸潤、限局性脂肪化、肺における肺胞腔内への限局性出血が少数例に発現したが、用量依存性は認められず、偶発病変と考えられる。
死亡動物2例における主な組織学的変化は、肝臓におけるグリソン鞘およびその周囲肝細胞の壊死とそれに伴う炎症性変化、腺胃部における限局性の粘膜壊死および胸腺、脾臓の退縮であった。肝臓については、投与期間中死亡例でグリソン鞘周囲の肝細胞は壊死、消失し、グリソン鞘から壊死巣にかけてマクロファージ、好中球、リンパ球の浸潤が認められた。回復期間中の死亡例では、グリソン鞘およびその周囲の実質は線維化し、残った肝細胞の核は腫大、核小体は明瞭であった。腺胃部では両例ともに粘膜上皮から固有層にかけて出血を伴った壊死巣が散見された。胸腺は、胸腺細胞の壊死に出血および泡沫細胞の浸潤を伴った急性退縮の像を呈していた。脾臓では、濾胞のリンパ球の減少が認められた。その他、肺のうっ血、腎臓の尿細管上皮における硝子滴の出現および空胞化、膵臓間質の水腫が投与期間中および回復期間中死亡動物のいずれかで認められた。

500 mg/kg群において、雌雄ともに自発運動量減少、流涎、体重増加抑制、摂餌量減少および飲水量増加など被験物質の影響が認められた。さらに雌では2例が歩行失調、横たわり、間代性痙攣、呼吸緩徐およびあえぎ等の重篤な症状を示し、1例は投与期間中、もう1例は回復期間中に死亡した。
病理学的検査において、500 mg/kg群の肝臓および十二指腸で被験物質に起因した変化が雌雄ともに認められた。
肝臓では器官重量の増加とともに組織学的検査でグリソン鞘周囲の肝細胞腫大ならびに細胞質の好酸性化が認められた。肝細胞は組織の障害に対して高い再生能力を有し、再生肝細胞は形態学的に核および核小体の腫大、2核の肝細胞の増加等で特徴付けられている1)。死亡動物では肝細胞の壊死とそれに伴う炎症性変化が認められ、死因は肝障害によるものと推察された。これらのことを考え合わせると、今回肝臓において認められた腫大/好酸性化した肝細胞は、被験物質によって選択的に障害されたグリソン鞘周囲肝細胞の再生性変化であると考えられる。
一方、十二指腸では剖検時に拡張が認められ、組織学的には粘膜の肥厚として観察された。十二指腸粘膜の肥厚および過形成は、被験物質の直接的な増殖刺激や投与物質による粘膜障害後の修復等さまざまな要因で起こりうる2)。本被験物質は皮膚および眼粘膜に対し刺激性を有しており、単回経口毒性試験においても消化管粘膜にうっ血、出血あるいはびらん等、刺激性を示唆する変化が認められている。これらのことから、十二指腸粘膜の変化は被験物質の有する刺激性により生じたものと推察される。
死亡例で認められた腺胃部粘膜の限局性壊死も十二指腸粘膜と同様の被験物質の刺激によるものかもしれないが、胸腺の急性退縮像より強いストレスが生じていたことが示唆され、ストレス時にしばしば生じる腺胃部粘膜の限局性壊死である可能性も考えられる。
これら肝臓および十二指腸の変化は雌雄ともに100および15 mg/kg群では認められなかった。また、回復期間終了後には完全に消失していたことから回復性は良好であると考えられる。
血液生化学的検査において、500 mg/kg群の雄でアルカリフォスファターゼの低下が認められた。本酵素は小腸にも由来しており、その消化吸収活動により変動するものであることから、被験物質による十二指腸への障害と関連した変化である可能性が考えられる。回復期間終了後に雄で増加がみられたが、増加を裏付ける肝・胆道疾患あるいは骨疾患を示唆する変化はなかったことから、投与期間中の影響に対する腸管の回復過程におけるリバウンド現象である可能性が考えられる。
その他に500 mg/kg群で認められた変化はいずれもわずかな変動であることから、軽度の影響あるいは毒性学的意義に乏しい変化と考えられる。
被験物質に起因する変化は、回復期間終了時には消失あるいは回復傾向が認められたことから、投与休止により回復する変化と考えられる。15および100 mg/kg群では被験物質の影響は認められなかった。
以上の結果から、本試験条件下におけるジシクロヘキシルカルボジイミドの無影響量は雌雄とも100 mg/kgと考えられる。
| 1) | H.W. Altmann, "Drug-Induced Pathology : Drug-induced Liver Reactions, " ed by E.Grundmann, Springer-Verlag, Berlin, Heidelberg, New York, 1980, pp. 73-76. |
| 2) | Greves, P.M.B "Histopathology of Preclinical Toxicity Studies : Small intestine," Elsevier, Amsterdam, New York, Oxford, 1990, pp. 346-348. |
| 連絡先: | |||
| 試験責任者 | 松浦郁夫 | ||
| (株)三菱化成安全科学研究所鹿島研究所 | |||
| 〒314 -02 茨城県鹿島郡波崎町砂山 14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence: | |||
| Matsuura, Ikuo | |||
| Mitsubishi-Kasei Institute of Toxicological and | |||
| Environmental Sciences, Japan | |||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, | |||
| 314-02, Japan | |||
| Tel 81-479-46-2871 | Fax 81-479-46-2874 | ||