����¸����ʪ����������Ū������ɾ�����뤿�ᡤO,O'-�������른����������0(���ޤ�1.0 vol% Tween 80��ޤ�0.5 w/v% CMC-Na���ϱդΤ���Ϳ)��30��100�����300 mg/kg/day���åȤθ�����14��������۴��֡�ǥ�����֤����Ӯ��4���ޤ�Ϣ³�����и���Ϳ����ȿ����Ϳ�������������ȯ�������˵ڤܤ��ƶ���Ƥ�������ޤ�����Ϳ��λ�����������оȷ������300 mg/kg���λ�ͺ��5��ˤĤ���14���ִѻ����³���������ˤ�������β������ˤĤ��Ƥ⸡Ƥ������
����Ϳ������˻��300 mg/kg����6��λ�˴ưʪ�����2���������˶ưʪ��ǧ���줿��������ưʪ��˶���긫������ȿ��긫����ʻ���ˤϡ���ƻ�ε�����ɤˤ����©��Ⱦò��ɾ㳲��ȼ�����ܾ��֤ΰ���������ब�ͤ���줿��
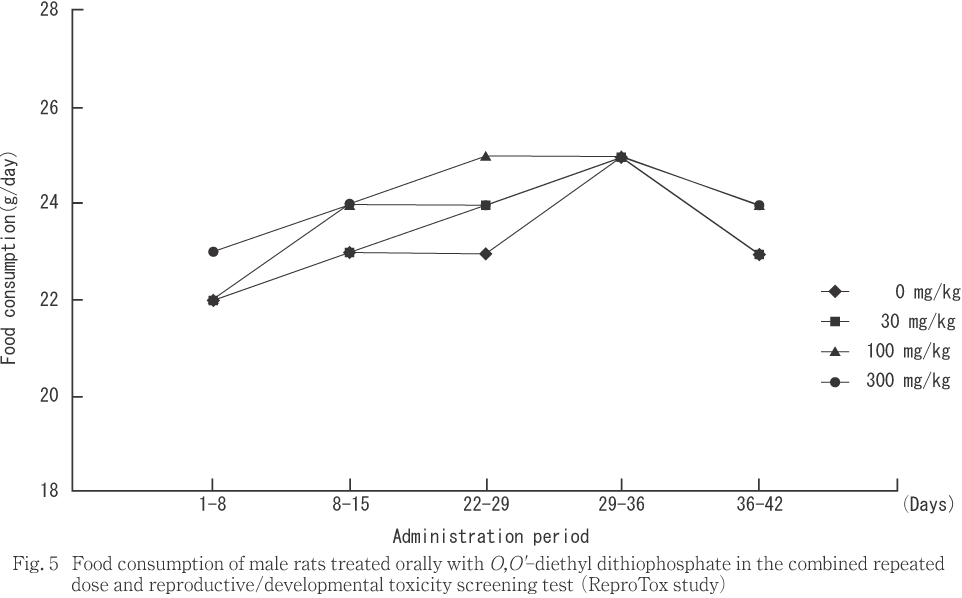
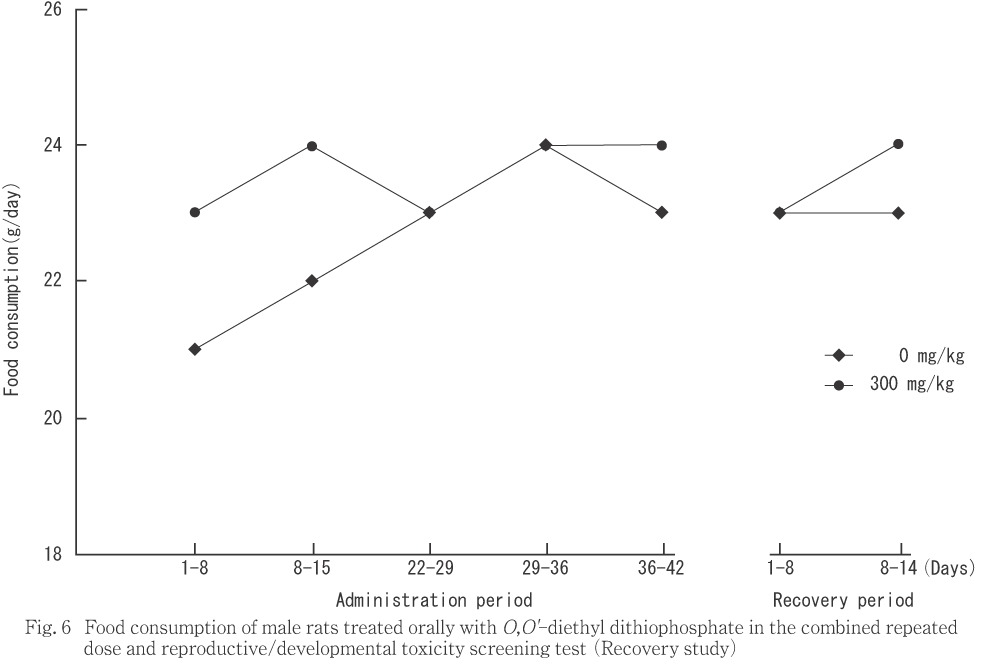
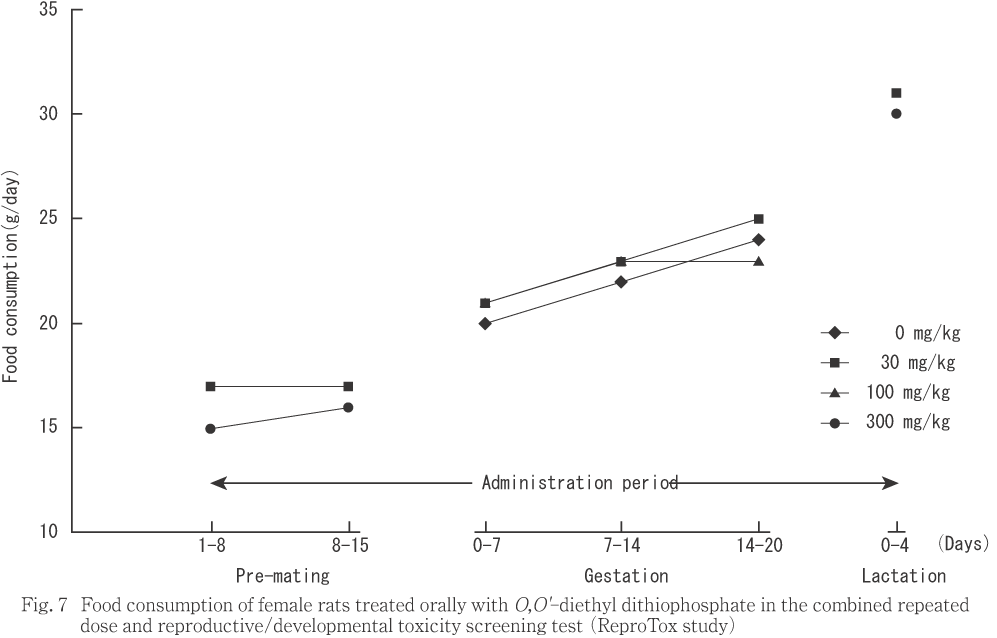
���︳ʪ����Ϳ�˵���������̾��֤��Ѳ��Ȥ��ơ���ͺ��30 mg/kg�ʾ����Ϳ����ή����ͺ��300 mg/kg�������ؤ��ѻ����줿��
���νŤǤϡ�300 mg/kg����ͺ�Ǥ���Ϳ���֤��̤��ơ���Ǥϸ�������Ϳ���֤��ν�����������ǧ���졤�︳ʪ����Ϳ�αƶ����������줿��
���ݱ��̤Ǥϡ���ͺ�Ȥ���︳ʪ����Ϳ�αƶ���ǧ����ʤ��ä���
����ǽ�ѻ����縡���Ǥϡ��ܺ٤ʾɾ��ѻ��ǻ�ͺ�Ȥ��100�����300 mg/kg���ǰ��̾��֤�Ʊ�ͤ�ή��ưʪ�������ä�ǧ���줿���ޤ������300 mg/kg���ǰ�ư�̤η��٤ʸ�����ưʪ�������ä�ǧ���졤Ʊ������Ϳ���ֽ�λ�������Ӯ��4���μ�ȯ��ư�̤����ͤ������Ȥ��顤�︳ʪ����Ϳ�˵�������ȹͤ����뼫ȯ��ư���㲼��ǧ���줿����ư����ȿ���δѻ�����Ӱ��Ϥˤ��︳ʪ����Ϳ�Ȥαƶ���ǧ����ʤ��ä���
����ճظ����Ǥϡ�ͺ����Ϳ���ֽ�λ���ˤ�����300 mg/kg���ǥإ⥰���ӥ��̤�����ַ��������ͤ������������ֽ�λ���Ǥϡ�300 mg/kg����������������������ͤ��������Ӯ��5���θ����Ǥ�300 mg/kg���Ƿ쾮�Ŀ������ͤ�������β������ֽ�λ���Ǥϡ�300 mg/kg���ǥإ⥰���ӥ��̤����ͤ����������٤��Ѳ��Ǥ���������Ū�յ����㤤�ȹͤ���줿��
����նŸ�ǽ�����Ǥϡ���ͺ�Τ�����λ����ˤ��︳ʪ����Ϳ�˵�������ȹͤ������Ѳ���ǧ����ʤ��ä���
����������ظ����ˤ����ơ�ͺ����Ϳ���ֽ�λ������ӻ��Ӯ��5����300 mg/kg�������������ͷ����������Ӯ��5���θ����ˤ��������Ƥ���Ϳ���ǥ�����ƥ顼�������ͤ������ޤ���300 mg/kg���ǥ��ꥦ�ब���ͤ�������β������ֽ�λ���Ǥϡ�300 mg/kg���ǥ��륫��ۥ��ե������������ͤ�����
��Ǣ�����Ǥϡ�ͺ����Ϳ���ֽ�λ����100�����300 mg/kg���ǥ��ȥ��������㤬���ä����������٤��Ѳ��Ǥ����︳ʪ����Ϳ�Ȥδ�Ϣ�����餫�Ǥʤ��ä���
������ƥ顼�����������Ǥϡ���Ϳ���ֽ�λ����ͺ��300 mg/kg������ӻ��100����� 300 mg/kg����Ǿ������ƥ顼�����������ͤ�����
�������ظ����Ǥϡ������긫�Ȥ��Ƥ�100�����300 mg/kg��������㳲���ѻ����줿�����ҷ�����������δѻ���100 mg/kg���Υץ��ץȥƥ�������˦����ӥѥ��ƥ�������˦�Υ���ȥ��˦���������Ψ�����ͤ������ޤ���300 mg/kg�����ȿ�����������㳲�ϥ���ȥ��˦�㳲�˵��������Ѳ��Ǥ��뤳�Ȥ����ꤵ�줿�������Ѳ��ϡ�300 mg/kg���β������ֽ�λ���ˤ����Ƥ�������Ǥ��뤳�Ȥ����ٱ������뤤�Ͽʹ������Ѥȹͤ����롥
���ﴱ���̤Ǥ�300 mg/kg���������������ν��̤��㲼����ͺ����Ϳ���ֽ�λ���˶������̤�100�����300 mg/kg���ǹ��ͤ������ޤ���Ӯ��5���λ��300 mg/kg���ǿ�¡����ӿ�¡���̤����ͤ�����
�������ظ�����ǧ���줿��������������������ΰ����Dz������ϳ�ǧ�Ǥ��ʤ��ä���������¾���Ѳ��ϲ������Ƥ�����
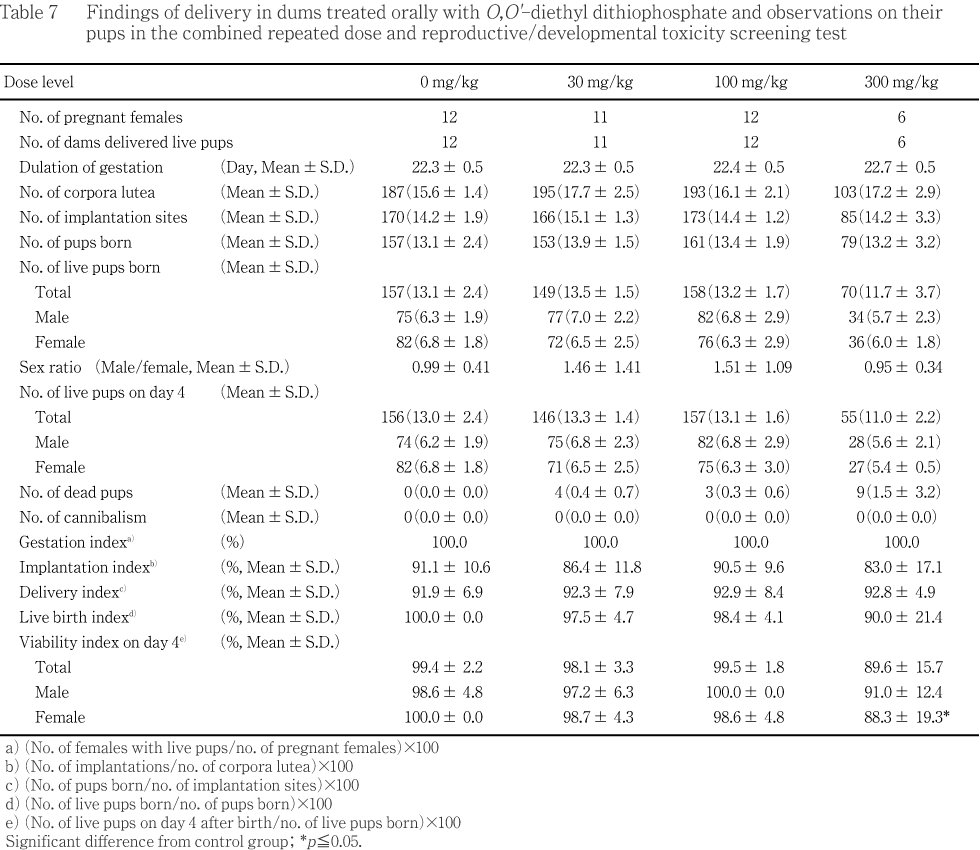
��ʿ������������Ӹ���ǽ���︳ʪ����Ϳ�αƶ���ǧ����ʤ��ä���300 mg/kg����ǥ������Ω��Ƚ�ꤵ�줿ͺ2��ˤ������ȿ��ظ����������������ѻ����졤�������Ѳ���ǥ������Ω�����ʤ��ä������Ǥ���ȿ仡���줿��ʬ�ڻ��ѻ��Ǥϡ�ʬ�ھ��֤ΰ۾�Ϥ��������Ϳ���Ǥ�ǧ����ʤ��ä����������γ�ɽ���������Ӯ��4����˶���Ǥϰ۾��ǧ����ʤ��ä���300 mg/kg���ǽ�������Ӯ��4�����ν����ä��������졤��������4������¸Ψ�ˤ�ͭ�դ����ͤ�ǧ���졤�︳ʪ����Ϳ�ˤ���������ȯ���˳����������줿������¾��ǥ�����֡�ǥ�����ο�������徲�����︳ʪ����Ϳ�αƶ���ǧ���줺���л��������л������������椪��ӽл�Ψ�ˤ�ƶ���ǧ����ʤ��ä���
���ʾ�Τ��Ȥ��顤O,O'-�������른�����������ܻ��ﲼ�ˤ�����̵�ƶ���(NOEL)�ϻ�ͺ�Ȥ��30 mg/kg/day̤����Ƚ�Ǥ��줿��
������ǽ�˵ڤܤ��ƶ���100�����300 mg/kg/day��Ϳ������������ǧ���줿���Ȥ���ͺ��̵�ƶ��̤�30 mg/kg/day�����300 mg/kg/day��Ϳ�Ǥ�ƶ���ǧ���줺300 mg/kg/day��Ƚ�Ǥ��줿����ưʪ��ȯ����ȯ��˵ڤܤ��ƶ���300 mg/kg/day��Ϳ�ǻ������4����¸Ψ��ͭ�դ����ͤ����Ӯ��4�����ν�����������ǧ���졤̵�ƶ��̤�100 mg/kg/day��Ƚ�Ǥ��줿��
��O,O'-�������른��������(�¸�����������¤��Lot No. ASK5069������98.9 wt%��ʬ����186.24)�ϰ��Ŀ��α��ΤǤ��ꡤ���ѻ��ޤ��︳ʪ���ݴɸ�(��Ž�)����¸��������;�︳ʪ������¤���Ǻ�ʬ�Ϥ��뤳�Ȥˤ�ꡤ�ܥ��åȤ���Ϳ���������Ǥ��ä����Ȥ��ǧ�������︳ʪ����1.0 vol% Tween 80��ޤ�0.5 w/v%����ܥ�������륻��������ʥȥꥦ��(CMC-Na)���ϱ�(CMC-Na:�¸��������ȡ������ѿ�:��������Tween 80:�ʥ��饤�ƥ���)�˷�������6��20�����60 mg/mL����Ϳ�դ�Ĵ����������Ϳ�դ���Ϳ�ޤ���Ž����¸����Ĵ����7������˻��Ѥ������︳ʪ����1.0 vol% Tween 80��ޤ�0.5 w/v% CMC-Na���ϱդǤΰ������ϡ�1�����200 mg/mL��ǻ�٤ˤĤ���7������¢��¸�弼������24���֤ϰ���Ǥ��뤳�Ȥ��ǧ������
����Ϳ�դ�ǻ��/�Ѱ���ʬ�Ϥϡ����Ӻǽ�Ĵ������Ĵ���������Ƥλ������Ϳ�դˤĤ��ƹԤä������η�̡�����ϰ���(����ǻ�٤Ρ� 15 %���⡤��ư����10 %�ʲ�)�Ǥ��ä���
����ˤϡ����ܥ��㡼�륹����С����������������8�����Sprague-Dawley(Crj:CD(SD)IGS��SPF)��ͺ��å�48ɤ����ӻ��å�58ɤ����Ѥ�������������ưʪ��7���ָ��֡��벽���餷���塤8���֤�ͽ��������νſ�ܤ���Ӱ��̾��֤˰۾郎ǧ����ʤ��ä���Τ�10����Ƿ�ʬ�����ƻ���Ѥ�������ʬ�������νŤϡ�ͺ��317��385 g�����208��247 g���ϰϤǤ��ä���
��ưʪ�ϡ�����24 �� 3�����55 �� 20 %���������15��/���֡�����150��300 lux����������12����(����7�����������7������)�˴������줿�Хꥢ�����ƥ�λ��鼼�ǥ���������̡������ƥ�쥹���ܻ��饱������1ɤ���ļ��Ƥ����餷����ǥ��18���ʹߤ���ưʪ��Ӯ��4���ޤǥ���������̡������ƥ�쥹���ܻ��饱������Ӯ��ȥ졼������������(����ե졼�������ܥ��㡼�륹����С���¤)������ƻ��餷����
�������ϡ����ꥨ�������¤��CRF-1�Ƿ�����(�������Ƕݻ���)����Ѥ�����������漫ͳ���ݼ褵����������ϡ���ƻ���ͳ���ݼ褵������
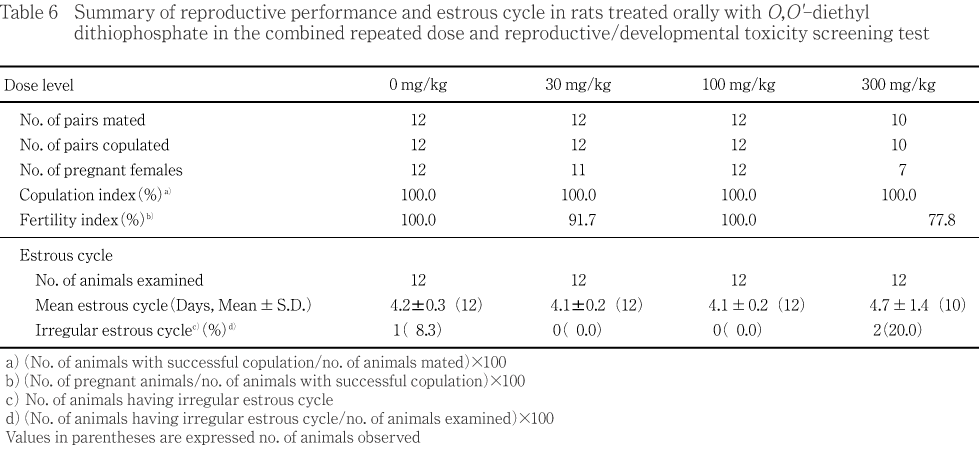
��ưʪ����Ϳ���������νŤ��Ȥ����̲�����̵������ˡ�ˤ��ͺ��1���������12ɤ������оȷ�����ӹ����̷��˳�17ɤ���㤪��������̷��˳�12ɤ��ʬ��������ͺ�Ȥ����������Ȥ���1��������12ɤ���ۤ���ͺ����Ϳ��λ�塤�оȷ��ȹ����̷��γ�5ɤ����ȴ���Ʋ�����������Ѥ�����������������ưʪ�Ȥ��̤˲���������Ȥ����оȷ��ȹ����̷��˳�5ɤ���ۤ������ʤ�����Ϸ�ʬ������8���֤��������ѻ���Ԥ����������������ͭ����ưʪ��ʬ�����Ѥ�����
��MSDS�˵��ܤ���Ƥ������︳ʪ���Υ�åȤˤ���������и������η��(LD50:4510 mg/kg)�ͤˤ��ơ�0��30��100��300�����1000 mg/kg�����̤�2������Ϳͽ�����»ܤ��������η�̡�1000 mg/kg���Ǥ�ͺ��5/5�㤪��ӻ��2/5�㤬��˴����(ͺ��������˶1��ޤ�)���ޤ������̾��֤��Ѳ��Ȥ��ơ���ͺ��ή�����Ӥα��졤���𤪤�ӻͻ�������β��㲼����Ʒ�����۲��⡤����Ϸ줪��Ӽ�ȯ��ư�㲼���ѻ����줿����ͺ�Ȥ���νŤ���������������ݱ��̤��㲼��ǧ���줿����ճظ����Ǥϡ������¸����ַ������إ⥰���ӥ��̡��إޥȥ���å��͡�ʿ���ַ��쿧���̡�ʿ���ַ��쿧��ǻ�٤���ӥ��ѵ���Ψ�����ͤ쾮�Ŀ�����ӹ������Ψ�����ͤ������ޤ������ַ��Ψ�����ͷ�����������������ظ����Ǥϡ������¸��������쥹�ƥ����롤���ӥ��ӥ���˥ߥΥȥ�ե��顼����g-���륿�ߥ�ȥ�ڥץ������������륷���ࡤ̵�����ӥ��ꥦ�ब���ͤޤ��Ϲ��ͷ���������������֥ߥ�A/G�����륫��ե����ե�����������ӱ��Ǥ����ͤ������ﴱ���̤Ǥϡ������¸��Ǵ�¡���̤ι��ͤ���Ӷ������̤����ͤ�ǧ���줿�������ظ����Ǥϡ��︳ʪ����Ϳ�αƶ���������긫�Ȥ��ƻ����¸��˺��顤���ߤ����礢�뤤������/��褪������ߤ�������ѻ����줿��300 mg/kg���Ǥϡ����̾��֤��Ѳ��Ȥ��ơ���ͺ��ή���ѻ����줿��ͺ���νŤ�����������ǧ���줿����ճظ����Ǥϡ��ַ������إ⥰���ӥ��̤���ӥإޥȥ���å��ͤ�ͺ�����ͷ���������ͤ������ޤ������ַ��Ψ��ͺ�ǹ��ͤ�ǹ��ͷ�����������������ظ����Ǥϡ���ͺ�������쥹�ƥ����뤬���ͤ������������ͤ������ޤ���ͺ�Υ���֥ߥ��Ǣ�����Ǥ����͡�������ӥ��ӥ��ͤ������������äơ��ܻ�Ǥ����餫������ħ��������뤳�Ȥ�ͽ�ۤ��졤Ĺ������Ϳ���֤Ǥ��˴ưʪ��¿ȯ���ʤ��ȹͤ�����300 mg/kg/day������̤Ȥ����ʲ�������3�ǽ�����100�����30 mg/kg/day���椪��������̤����ꤷ����
����Ϳ���̤ϡ��ν�100 g������0.5 mL�Ȥ�������������Ӹ��۴��֤ʤ�Ӥ˸��۴��ֽ�λ�����Ϳ���֤λ�ͺ�Ǥϡ������̤�¬�ꤷ���ǿ��νŤ˴�Ť��ƻ��Ф������ޤ���ǥ�����֤����Ӯ�������λ�ϡ�ǥ��0��7��14��20�����Ӯ��0����¬�ꤷ���������νŤ˴�Ť��ƻ��Ф�������Ϳ�դϡ��ߥ���Ǥ��Ѥ���1��1�����и���Ϳ�������оȷ��ˤ�1.0 vol% Tween 80��ޤ�0.5 w/v% CMC-Na���ϱդΤߤ���Ϳ������
����Ϳ���֤ϡ�ͺ�ϸ�����14���֤ȸ��۴���14���֤���Ӹ��۴��ֽ�λ��14���֤�Ϣ³42���֤Ȥ�������ϸ�����14���֤ȸ��۴�����(��Ĺ4����)����Ӹ����������ǥ�����֤��̤���ʬ�ڸ��Ӯ��4���ޤ�(42��46����)�Ȥ������ޤ���������ʬ�ڤ��ʤ����ǥ��25���β�˶�����ޤ�(40����)�Ȥ�������β��������ưʪ��ͺ��Ʊ��Ϣ³42���֤Ȥ�����
����ͺ�Ȥ⡤����ˤĤ��ƻ����������2��ʾ�(���������椪���˶������1��)�Ԥ����۾浪��ӻ�˴��̵ͭ��Ͽ������
��ͺ����Ϳ1(��Ϳ������)��8��15��22��29��36��42�����43��(˶�������뤤�ϲ���1��)��¬�ꤷ����Ϳ1����42���ޤǤ��ν������̤Ф��������������ͺ�ϡ���Ϳ��λ�����1��8��14�����15��(˶����)��¬�ꤷ������1����14���ޤǤ��ν������̤Ф�����
�������Ϳ1(��Ϳ������)��8�����15����¬�ꤷ����Ϳ1����15���ޤǤ��ν������̤Ф������ޤ���������λ�ϡ�ǥ��0��7��14�����20���ˡ�ʬ�ڤ������ʬ�ڸ�0��4�����5��(˶����)��¬�ꤷ�����줾��ǥ��0����20�������ʬ�ڸ�0����4���ޤǤ��ν������̤Ф�������������λ�ϡ����������ͺ��Ʊ����¬�ꤷ����Ϳ1����42������Ӳ���1����14���ޤǤ��ν������̤Ф�����
��ͺ����Ϳ1(��Ϳ������)��8��15��22��29��36�����42��(˶������)�˱½��̤�¬�ꤷ��¬�������鼡��¬�����ޤǤ��ݱ��̤���ʿ��1���ݱ��̤Ф���ȤȤ����Ϳ1����15���������Ϳ22����42���ޤǤ������ݱ��̤Ф��������������ͺ�ϡ���Ϳ��λ�����1��8�����14��(˶������)��¬�ꤷ��¬�������鼡��¬�����ޤǤ��ݱ��̤���ʿ��1���ݱ��̤Ф���ȤȤ�˲���1����14���ޤǤ������ݱ��̤Ф�����
�������Ϳ1(��Ϳ������)��8�����15���˱½��̤�¬�ꤷ��¬�������鼡��¬�����ޤǤ��ݱ��̤���ʿ��1���ݱ��̤Ф���ȤȤ����Ϳ1����15���ޤǤ������ݱ��̤Ф������ޤ��������������ǥ��0��7��14�����20���ˡ�ʬ�ڤ������ʬ�ڸ�0�����4���˱½��̤�¬�ꤷ��¬�������鼡��¬�����ޤǤ��ݱ��̤���ʿ��1���ݱ��̤Ф���ȤȤ��ǥ��0����20���ޤǤ������ݱ��̤Ф�������������λ�ϡ����������ͺ��Ʊ���˱½��̤�¬�ꤷ��¬�������鼡��¬�����ޤǤ��ݱ��̤���ʿ��1���ݱ��̤Ф���ȤȤ����Ϳ1����42������Ӳ���1����14���ޤǤ������ݱ��̤Ф������ʤ������۴������Ʊ��ưʪ���ݱ��̤�¬�ꤷ�ʤ��ä���
����ǽ�ѻ����縡��������¸ưʪ�ˤĤ��ƹԤä��������ϡ���Ϳ���������Ϳ30ʬ�夫�鳫�Ϥ������ʲ��ε�ǽ�ѻ����縡�����⡤�ܺ٤ʾɾ��ѻ��Ϸ�ʬ������1����Ϳ���ϸ�Ͻ�1��Ԥä�(�������֤�ޤ�)���������������������ǥ��7�����14����ʬ�ڤ������Ӯ��4���˹Ԥä�����λɷ���Ф��뱿ư����ȿ���δѻ�������¬�ꤪ��Ӽ�ȯ��ư��¬��ϡ�ͺ�ϳƷ�5��(�оȷ�����ӹ����̷��ϲ��������5�㡤�㤪��������̷���ưʪ�ֹ�μ㤤���5��)�ˤĤ�����Ϳ42������Ӳ���14���˹Ԥä������ưʪ�ֹ�μ㤤��˳Ʒ�5��ˤĤ���ʬ�ڸ�4���˹Ԥä�����������λ����Ϳ42������Ӳ���14���˹Ԥä�����ʬ�����ξܺ٤ʾɾ��ѻ��ϡ���ưʪ�ֹ�μ㤤��˼»ܤ�������Ϳ������θ����ϡ����ˤ�긡���λ����Ӥ��Ф�ʤ��褦��θ���ƹԤä���
���ܺ٤ʾɾ��ѻ��Ǥϡ���������λ����ˤĤ��ƴѻ��������夨���������߹�ư����ڻ����Ӱ۾�ȯ����̵ͭ���ǧ������Ͽ�������ޤ�������������ưʪ����Ф����Ф��פ��������פ����۾�ȯ�����ڶ�ĥ��Ω�ӡ����Ӥξ��֡����۾��֡�������ή�ޡ�ή���Ƶۡ���塤�Ļ�Ǵ�졤Ǣ���ؤ���ӥ�����ץ����ˤĤ��ƴѻ�������Ͽ����������˥����ץ�ե���������֤������30 cm�ι⤵����ζ�������ȿ�ͤ�ѻ�����ưʪ�����Ϥ�����������3ʬ�֥����ץ�ե��������Ǥ�ưʪ�θƵۡ���Ĵ��ư����ڻ������������ԡ���۾���۾��֡���Ʊ��ư���۾��ư���۾�ȯ���������٤���Ӱ�ư�̤ˤĤ��ƴѻ�����Ω���夬������æʵ����������Ǣ������������Ͽ������
��Ʒ��ȿ�͡��ܶ�ȿ��������ȿ����İ��ȿ��������˳�ȿ����������Ͽ������
�������ΰ��ϤˤĤ��Ƥϥǥ�����ץå���ץ륲����(�����������˥����)���Ѥ��Ƥ��줾��2��¬�ꤷ��ʿ���ͤ�Ͽ������
��CAS(���λ���)���Ѥ��Ƹ��̤�¬�ꤷ�����嵭a)����c)��θ�����λ��(��Ϳ����40ʬ)��¬��Ϥ������ǡ����μ����ֳ֤�1ʬ��Ȥ��������֤�10ʬ���1���֤Ȥ�����¬��Ķ��ϡ��������������֡�¬�꼼��������٥�ϥۥ磻�ȥΥ���ȯ������PA-1(�����ʵ���)�Ǥ��褽70 dB���ݤ�������������NA20(RION)���Ѥ���¬�ꤷ����Ͽ������
�����ۤϸ�����14���֤��������ѻ���Ԥä����Ʊ�����ͺ��1��1�Ǻ�Ĺ4������Ʊ�蘆�����������γ�ǧ�ϡ�Ʊ�蘆������ī�����ޤ���絹�������ҳ�ǧ�ˤ��Ԥ�����������ǧ���줿��Ϥ�������ǥ��0���Ȥ�������˴��������˸��ۤ��Ȥ߹礻���Ǥ��ʤ��ä�ͺ�ˤĤ��Ƥϡ����ۤ����뤳�Ȥʤ������Τޤ���Ϳ��³����¾��ͺ��Ʊ�ͤ˰��ä����������ѻ��ϸ�����ǧ���ޤǹԤ���ȯ������鼡��ȯ����ޤǤδ֤������������������Ȥ���ʿ���������Ф������ޤ����������ѻ�������ΰ۾�������(4�ޤ���5���ʳ���������)ȯ��Ψ[(�۾�����������ưʪ��/�ѻ���ưʪ��)�� 100]�Ф��������۷�̤���Ʒ��ˤĤ��Ƹ���Ψ[(����ưʪ��/Ʊ��ưʪ��)�� 100]�Ф������ʤ�����������λ�ϡ��������ѻ�����Ӹ��ۤ�»ܤ��ʤ��ä���
��ǥ��ưʪ�����Ƽ���ʬ�ڤ�����������ʬ�ڻ���ʬ�ھ��֤δѻ���Ԥä���ʬ�ڤγ�ǧ��ǥ��20����25���θ���8��30ʬ��10���δ֤˹Ԥ������λ����Ӥ�ʬ�ڤ���λ���Ƥ��뤳�Ȥ��ǧ����ưʪ�����ʬ�ڤϤ���ưʪ��ʬ�ڴ�λ�ޤ��Ԥ�����������Ӯ��0���Ȥ���������10������ʬ�ڤϤ�������������Ӯ��0���Ȥ������ޤ���ǥ������(Ӯ��0����ǯ��������ǥ��0����ǯ������������)������Ψ[(����ưʪ��/����ưʪ��)�� 100]���л�Ψ[(�����л����/ǥ�����)�� 100]���徲Ψ[(�徲����/ǥ�����ο�)�� 100]��ʬ��Ψ[(���л�����/�徲����)�� 100]������Ψ[(�л�������/���л�����)�� 100]�Ф�����ǥ��25���θ���9���ޤǤ�ʬ�ڤΤߤ��ʤ�ưʪ��������˶�����徲����ǧ����ʤ���硤ǥ������Ω��Ƚ�ꤷ����Ӯ��5������ưʪ��������˶�������ο�������徲������Ĵ������Ū�˰۾��̵ͭ��Ĵ�٤���
���������ˤĤ��Ƥ�Ӯ��0���˽л�����(��¸��+��˴��)��Ĵ�١����̤�Ƚ�ꤷ������(ͺ/��)�Ф���ȤȤ�ˡ���ɽ�۾��̵ͭ��Ĵ�٤����ޤ���Ӯ��0�����4���˻�ͺ�����̤��νŤ�¬�ꤷ��1ʢ�λ�ͺ��ʿ���νŤФ�����Ӯ��4�����ν�¬��塤�����ƥ���첼������³ڻव�����ﴱ���ȿ�������ѻ���Ԥä���Ӯ�������λ�˴���ϥ֥���դ˸��ꤷ���ﴱ���ȿ�������ѻ���»ܤ������ޤ�����������4������¸Ψ[(Ӯ��4��������/�л�������)�� 100]�Ф�����
����ճظ�������նŸ�ǽ��������ӷ�������ظ�����ͺ����Ӽ���ʬ�ڤ������˶����(ͺ:��Ϳ43������:Ӯ��5��)�˳Ʒ���ưʪ�ֹ�μ㤤���5�㡤��ͺ�β��������˶����(����15��)������ˤĤ��Ƽ»ܤ������η줹��������ꡤưʪ����16�����俩��������
��ưʪ���ƥ�����峫ʢ����ʢ����ư̮����η줷����
�����ŸǺ�(EDTA-2 K)����η�ɥ��ѥå�-E(�ѿ岽�ع���)�˿������μ褷�������ճظ�������ADVIA120(�Х�����)���Ѥ��������(WBC:�ե��������ȥ�ȥ)���ַ���(RBC:�Ż�����ˡ)���إ⥰���ӥ���(HGB:�������ȥإ⥰���ӥ�ˡ)���إޥȥ���å���(HCT:RBC��MCV��껻��)��ʿ���ַ������(MCV:�Ż�����ˡ)��ʿ���ַ��쿧����(MCH:HGB��RBC��껻��)��ʿ���ַ�忧��ǻ��(MCHC:HGB��HCT��껻��)���쾮�Ŀ�(PLT:�Ż�����ˡ)������ɴʬΨ(�ե��������ȥ�ȥ)��������ַ��Ψ(Reticulocyte:RNA����ˡ)��¬�ꤷ����
������ɴʬΨ�����Ҥε����¬�ꤷ���������ӷ������ɸ�ܤ���������ᥤ����������ɡ����ॶ����������¸������
�����ŸǺ�(3.13 %��������ʥȥꥦ����ϱ�)����η�ɥ٥Υ������ȭ�(�ƥ��)�˷�դ�μ褷���塤3000 r.p.m.��13ʬ�ֱ�ʬΥ�����������������Ѥ���������ư��նŸ�����¬������STA Compact(������)���Ѥ��ƥץ��ȥ���ӥ����(PT:Ǵ���Ѳ���������)����ӳ�������ʬ�ȥ���ܥץ饹�������(APTT:Ǵ���Ѳ���������)��¬�ꤷ����
���η�ɥ��ѥå�SQ(�ѿ岽�ع���)�˷�դ�μ褷���塤3000 r.p.m.��7ʬ�ֱ�ʬΥ�����������������Ѥ�����¿���������ؼ�ưʬ��������Ω7170(��Ω�����)���Ѥ���������(T. protein:Biuretˡ)������֥ߥ�(Albumin:BCGˡ)��A/G(����)������(Glucose:HK-G-6-PDHˡ)����������(Triglyceride: GK-GPOͷΥ���ꥻ������õ�ˡ)�������쥹�ƥ�����(T. cholesterol:���쥹�ƥ����륪����������HDAOSˡ)��Ǣ������(BUN:���쥢����GLDHˡ)�����쥢���˥�(Creatinine:����ˡ)�����ӥ��ӥ�(T. bilirubin:�Хʥ��������ˡ)�������ѥ饮������ߥΥȥ�ե��顼��(AST:����-UVˡ)������˥ߥΥȥ�ե��顼��(ALT:����-UVˡ)�����륫��ۥ��ե�������(ALP:P-�˥ȥ��ե��˥�������ˡ)��������ƥ顼��(ChE:�襦���֥��������������ˡ)��g-���륿�ߥ�ȥ�ڥץ�������(Gamma-GTP:L-g-���륿�ߥ�-3-����ܥ���-4-NAˡ)�����륷����(Calcium: MXBˡ)��̵�����(I. phosphorus: PNP-XDHˡ)�������������(T. bile acid:���ǥ��������ˡ)���Ų��¬������EA06R(��������ɥƥ���)���Ѥ��ƥʥȥꥦ��(Sodium:�����������Ŷ�ˡ)�����ꥦ��(Potassium: �����������Ŷ�ˡ)����ӱ���(Chloride:�����������Ŷ�ˡ)��¬�ꤷ����
����Ϳ���ֽ�λ���ˡ��Ʒ����줾��5���ͺưʪ�ˤĤ��Ƹ�����Ԥä���
����¡����ξ�ﲼ�Ǻ�Ǣ���������Ѥ���3����Ǣ(����10��������1���ޤ�)�����24����Ǣ(����10��������������10���ޤ�)��μ褷����
��3����Ǣ���Ѥ���pH�����졤���������ȥ��Ρ��ӥ��ӥ�ӥ����ӥ�Ρ�����������������ˤ�N-�ޥ�ƥ����ƥ��å���SG(�Х����� ��ǥ�����)���Ѥ���Ƚ���Ǣʬ������CLINITEK500(�Х�����)�ǹԤä���
��24����Ǣ���Ѥ���Ǣ��(����)����ӿ�Ĵ(�ܻ�)�������塤Ǣ����1500 r.p.m.��5ʬ�ֱ�����������ӻ��֤�ʬΥ�������������Ѥ��ƾ�Ҥ��Ų��¬������EA06R�ǥʥȥꥦ�ࡤ���ꥦ�प��ӱ��Ǥ�¬�ꤷ���������Ǣ�̤��Ѥ��ƥʥȥꥦ�ࡤ���ꥦ�प��ӱ��Ǥ��������̤Ф������ޤ���Auto&stat OM-6030(�������쥤�ե����ȥ)��Ǣ��Ʃ��(ɹ���߲�ˡ)��¬�ꤷ����
����������»ܤ���ưʪ�����Ǿ�Υ�����ƥ顼��(ChE)������¬�ꤷ������˶����Ǿ���̤�¬�ꤷ���塤Ǿ�κ�Ⱦʬ��μ褷�ƽ��̤�¬�ꤷ��Ͽ����������¬��塤Ǿ�κ�Ⱦʬ����-80�����¸����������ƥ顼��������¬�ꤷ����¬��ϡ��ƥ��˥���AA��(�ƥ��˥���)���Ѥ��ƥ襦����������������������Ȥ���DTNBˡ�ǹԤä���
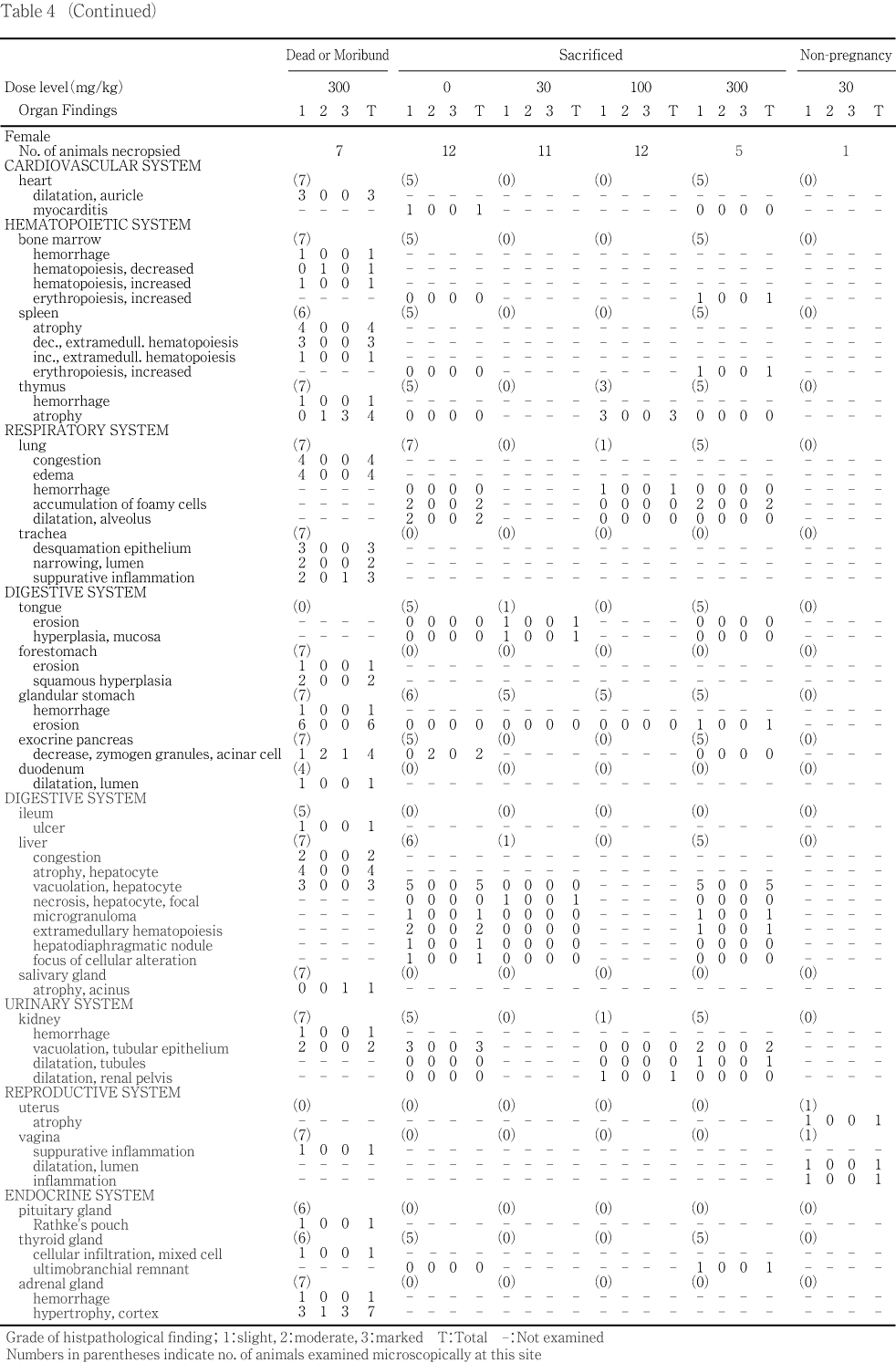
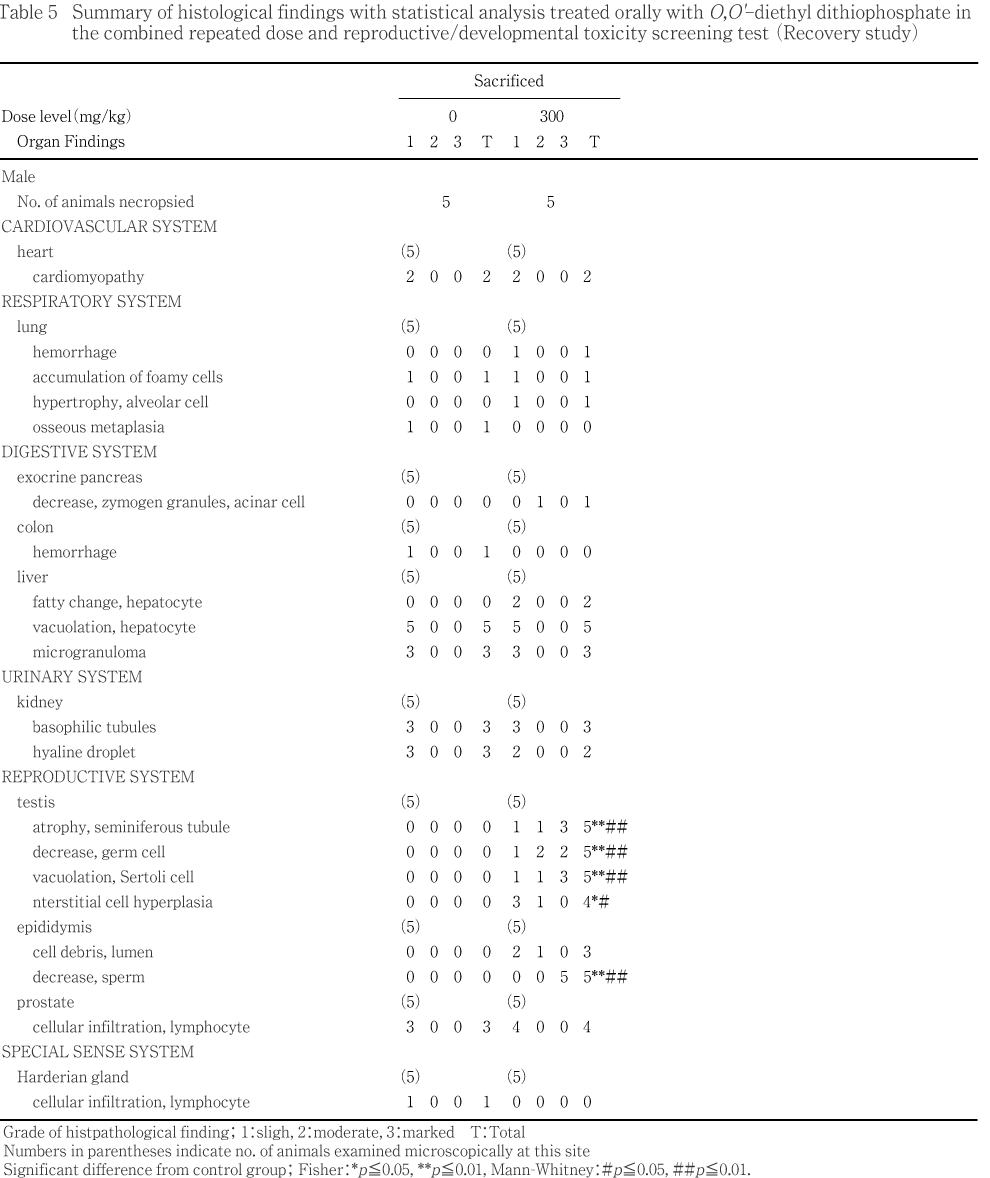
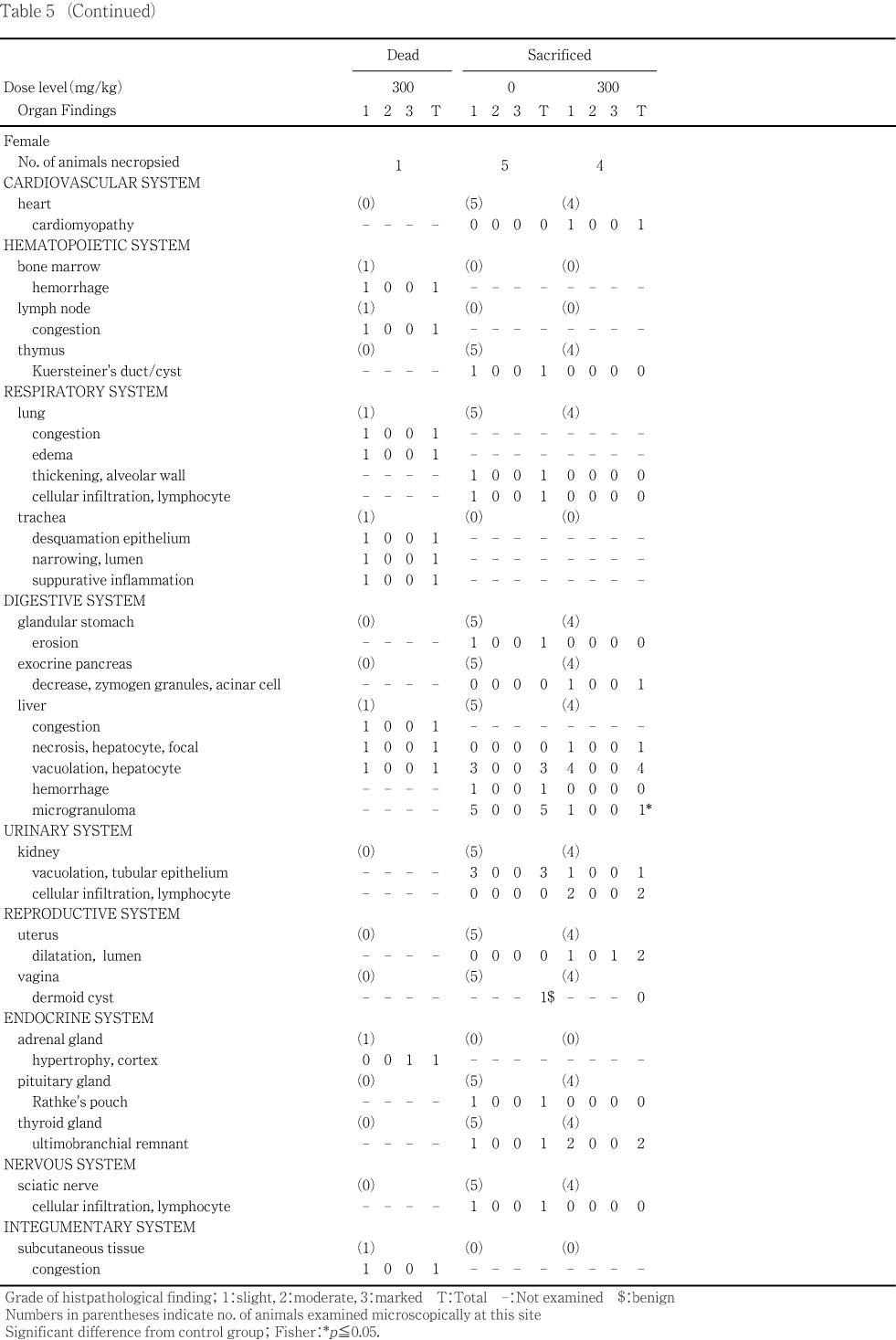
����˶�Ǥ�ưʪ�γ��ѡ����С�ɡ�������Ƭ���С����ʡ�Ǿ������Կ�γ��Ѥ������̡����С�ʢ�Ф���ӹ��ФȤ�����¡���������ȿ�����Ӵﴱ�������������ﴱ�ˤĤ��Ƥϡ��ä����դ�ʧ���������������Ƥ�����Ū�۾�ˤĤ��ơ����̡��礭�����Ť��ʤɤ�Ͽ�������ޤ�����˶�������Ƥ�ưʪ�ˤĤ������桤������������(IJ���졤����)���ñ���(�岼����������)�����������ܹ�������(���������ܹ�)�����������ɡ���(���ɻ٤�ޤ�:��¦��������)����¡���þ��������龮�Ρ��塤��ƻ���ߡ������IJ����IJ����IJ(�ѥ������Ĥ�ޤ�)����IJ����IJ��ľIJ����¡���¡���¡����¡�����ա��������ǹ����Ω�������㡤�ҵܡ�絡����(����Ф�ޤ�)���ϡ���������Ǿ(��Ǿ����Ǿ������ޤ�:������ƥ顼������¬��ưʪ�ϱ�Ⱦʬ�Τ߸���)�������Ρ��Կ�(����������������)���������Ф��������ǰ۾����Ѥ�ǧ���줿�ﴱ���ȿ���10 vol%�����˾ץۥ�ޥ��դˡ����㤪���������Τ�֥���դ������ꤷ���塤10 vol%�����˾ץۥ�ޥ��դ˸��ꤷ����
�����̤�¬�ꤷ���ﴱ�ˤĤ��Ƥϡ��ﴱ����/�ν���(���н���)��˶�������νŤ���Ӵﴱ���̤��黻�Ф���[(�ﴱ����/˶�������ν�)�� 100]���ʤ���������ƥ顼�����������Τ��ᡤǾ�ν���¬���ǽ�˼»ܤ�����
q����˴ưʪ(300 mg/kg���λ�6��)������λ�ưʪ(300 mg/kg���λ�2��)
����˴ưʪ��ȯ�����˶�ޤ���¢�ˤ���¸������Ū�Ѳ����ɻߤ��뤿�ᡤ��뤷�ʤ��褦�ˤ������λ�ưʪ�ϥ����ƥ���첼�Ǻη�塤����³ڻव����˶������������ǧ��˻�˴����300 mg/kg���λ�4����⡤�ҵ����Ĵ���徲��ǧ����ʤ��ä�2��ˤĤ��Ƥ�ǥ������Ω��Ƚ�ꤷ�����ʤ���ǥ��1���������������˻�˴����1���ǥ��Ƚ�꤬�Բ�ǽ�Ǥ��ä����ᡤ����ưʪ��ǥ�����֤Υǡ����Ͻ��פ˴ޤ�ʤ��ä���
w��ͺưʪ
��42������Ϳ���������˥����ƥ���첼�Ǻη�³ڻव�������ﴱ���ȿ�������ѻ���Ԥä��塤Ǿ���������ñ������þ�������¡����¡����¡���¡�����ա����㤪���������ν��̤�¬�ꤷ�����þ����ϸ����¬�ꤷ����
e������ʬ�ڤ�����
��Ӯ��4���ޤ���Ϳ���������˥����ƥ���첼�Ǻη�³ڻव�������ﴱ���ȿ�������ѻ���Ԥä��塤Ǿ���������ñ������þ�������¡����¡����¡���¡�����դ����������̤�¬�ꤷ�����ʤ���˶�����˲��ο�������徲������Ĵ�٤���
r������ʬ�ڤ�ǧ����ʤ���(30 mg/kg����1��)
��ǥ��25���������������ˡ������ƥ���첼������³ڻव�����ﴱ���ȿ�������ѻ���Ԥä����ҵ����Ĵ�١��徲����ǧ����ʤ��ä�����ǥ������Ω��Ƚ�ꤷ����
t�����������ͺ
������14���������˥����ƥ���첼�Ǻη�塤����³ڻव�����ﴱ���ȿ�������ѻ���Ԥä��塤Ǿ���������ñ������þ�������¡����¡����¡���¡�����ա����㤪���������ν��̤�¬�ꤷ�����þ����ϸ����¬�ꤷ����
y����������λ�
������14���������˥����ƥ���첼�Ǻη�塤����³ڻव�����ﴱ���ȿ�������ѻ���Ԥä��塤Ǿ���������ñ������þ�������¡����¡����¡���¡�����դ����������̤�¬�ꤷ�����þ����ϸ����¬�ꤷ����
�������˳�������ưʪ�ˤĤ��������ȿ��ظ�����»ܤ�����
���ȿ��Ͼ�ˡ�˽��äƥѥ�ե������Ҥ���������إޥȥ���������������������������Ǥ����Ѥμ��ࡤ���٤ˤĤ��Ƶ�Ͽ������
���ʤ�������ˤĤ��Ƥ�PAS���إޥȥ��������������ӥإޥȥ���������������������塤�إޥȥ����������������ɸ�ܤǰ���Ū���Ѥ�����w��r�����t�ˤĤ��Ƥ�PAS���إޥȥ����������ɸ�ܤ����ҷ�����������(���ޤ��ϭ�)������1)��
q����˴ưʪ(300 mg/kg���λ�6��)������λ�ưʪ(300 mg/kg���λ�2��)
��������ﴱ�ˤĤ��Ƽ»ܤ�����
w��ǥ������Ω������ͺ
���оȷ��ȹ����̷��γ�5���������ﴱ�������������˶������ǧ���줿����ʳ��ΰ۾��������ȿ��ˤĤ��Ƽ»ܤ�����
e������ʬ�ڤ�����
���оȷ��ȹ����̷��γ�5���������ﴱ�������������˶������ǧ���줿����ʳ��ΰ۾��������ȿ��ˤĤ��Ƽ»ܤ�����
r��ǥ������Ω�����ʤ��ä�ͺ�����ǥ������Ω�λ�
��ͺ���ñ��������㡤������Ρ���ǹ�������Ω��������Ӱ۾��������ȿ�������ñ�����絡��ҵܤ��������ˤĤ��Ƽ»ܤ�����
t����������λ�ͺ
��������ﴱ�ˤĤ��Ƽ»ܤ�����
���ޤ���w�ˤĤ��ƤϹ����̷��ΰߡ����㤪���������Τ��︳ʪ����Ϳ�αƶ�������줿���ᡤ�����δﴱ�ˤĤ��Ƥ��㤪��������̷����5�㤺�ĸ�����»ܤ�����e�ˤĤ��ƤϹ����̷��ΰߤ��︳ʪ����Ϳ�αƶ�������줿���ᡤ�㤪��������̷���ߤ��5�㤺�ĸ�����»ܤ�����
���νš��ν������̡��ݱ��̡������ݱ��̡�ʿ�������������ο����徲������ǥ�����֡��л�����������������桤�徲Ψ������Ψ��ʬ��Ψ����ɽ�۾�ȯ��Ψ����������4������¸Ψ��FOB������(���ϡ���ȯ��ư�̡�Ω���夬������æʵ�������Ǣ���)����ճظ����͡���նŸ�ǽ�����͡���������ظ����͡�������ƥ顼�����������͡�Ǣ������(Ǣ�̤����Ǣ��Ʃ��)���ﴱ���̤�������н��̤ˤĤ��Ƥϼ�ưȽ�������˽������ǽ��Bartlett����ʬ������2)��»ܤ�������ʬ���ξ���Dunnett��¿����Ӹ���3)���оȷ��ȳ���Ϳ���֤�ͭ�պ����ꤷ����Bartlett����ʬ�����������ʬ���ξ���Steel�θ���4)���оȷ��ȳ���Ϳ���֤�ͭ�պ����ꤷ����
���л�Ψ������Ψ����Ӽ���Ψ�ˤĤ��Ƥ�x^2������Ѥ�����
���۾�������ȯ��Ψ��Ω���夬�ꡤæʵ�������Ǣ������ܺ٤ʾɾ��ѻ��ʤ�Ӥ˼�λɷ���Ф��뱿ư����ȿ���δѻ��γƹ��ܡ�˶���긫����������ȿ��긫��ȯ��Ψ�ˤĤ��Ƥ�Fisher��ľ�ܳ�Ψ����ˡ5)�Ǹ��ꤷ���������ȿ��긫�Τ������٤�������ǧ���줿�긫�ϡ�(�ޥ��ʥ�)��1����+1��2����+2��3����+3��4���˳�����Ƥ�Mann-Whitney��U�����»ܤ��������ҷ�����������Υ���ȥ��˦������γƥ��ơ����κ�˦��Ψ�ˤĤ��Ƥ�Mann-Whitney��U�����»ܤ�����
�����̾��֤ν긫�ˤĤ��Ƥ����ײ��ϤϹԤ�ʤ��ä���
��ͭ�տ���Bartlett����ʬ������ˤĤ��Ƥ�5 %������¾�θ����5 %�����1 %��ξ¦����Ǽ»ܤ�����������������ưʪ����1���ˤĤ�2��ʲ��ξ�硤ͭ�պ�����ϹԤ�ʤ��ä���
���ʤ���Ӯ�������ν������˴ؤ������Ӥ�1�����������ʿ�Ѥ�1ɸ�ܤȤ��ƽ��פ�����
����Ϳ������˻��300 mg/kg����6�㤬��˴����2�㤬�λ���֤ˤʤä�����������˶�����������ưʪ�λ�˴�ϡ���Ϳ5��12�����20���˳�1�㡤ǥ��1�����12���˳�1�㡤Ӯ��0����1��ǧ���줿���ޤ���������˶ưʪ�ϡ�ǥ��13����2��ǧ���줿��ͺ�ˤϻ�˴��ϴѻ�����ʤ��ä���
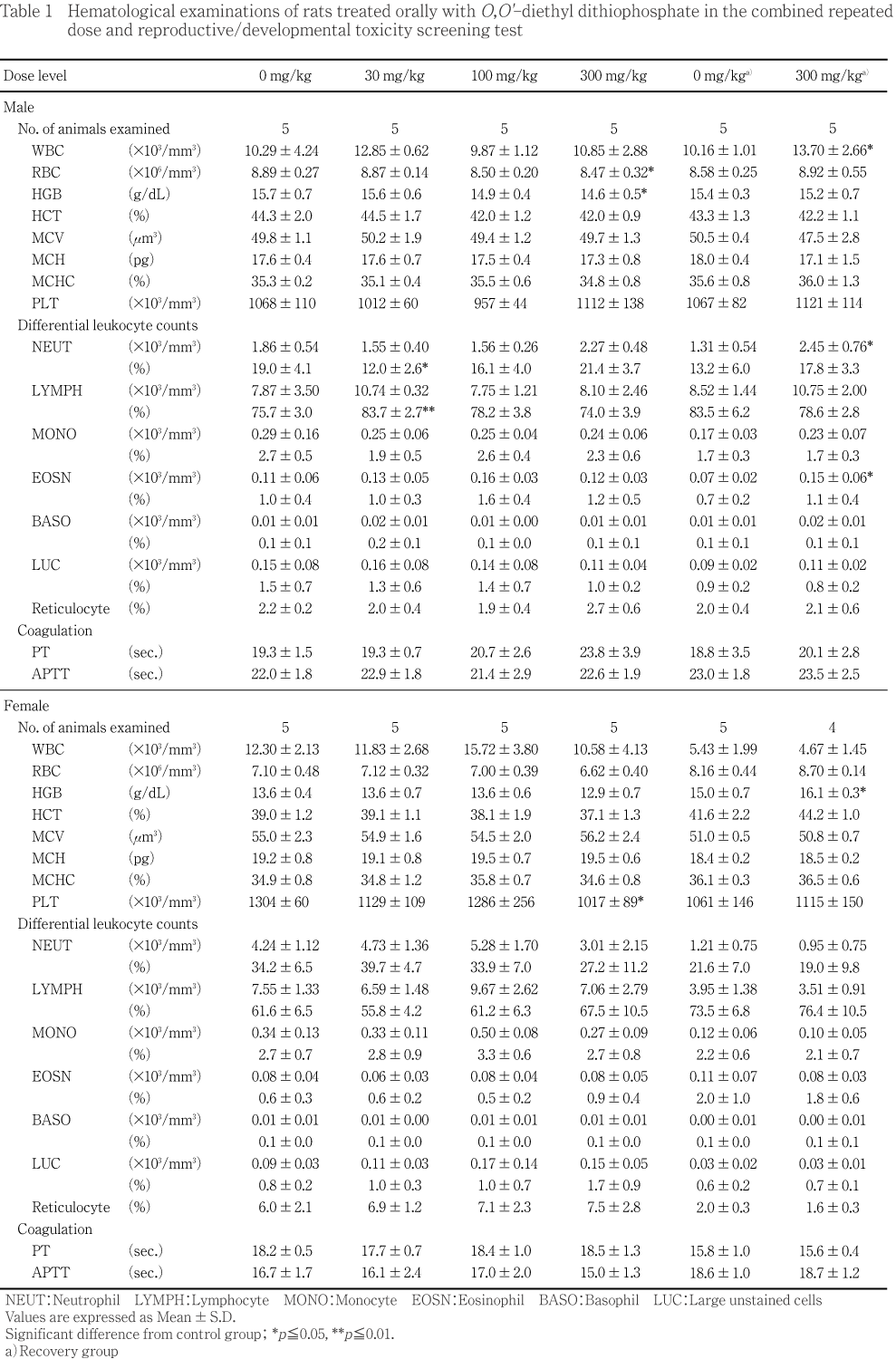
�����̾��֤��Ѳ��Ȥ��ơ�ͺ�Ǥ���Ϳ��30��60ʬ��ή��30��100�����300 mg/kg���Ǥ��줾��2��10�����9��˴ѻ����줿���ޤ������ؤ�30�����300 mg/kg���Ǥ��줾��1�����3��˴ѻ����줿������¾���������оȷ���1�㡤��ʬ��ʪ���оȷ������300 mg/kg���dz�1��˴ѻ����줿��300 mg/kg���β�������ˤ����Ƥ���Ϳ�������ή��������ؤ��ѻ����줿��������������ˤϰ��̾��֤��Ѳ���ǧ����ʤ��ä���
����Ǥ���Ϳ���֤��̤�����Ϳ��30��60ʬ��ή��30��100�����300 mg/kg���Ǥ��줾��2��8�����7��˴ѻ����줿����˴�����3��ϻ�˴���������ʰ��̾��֤��Ѳ��ϴѻ�����ʤ��ä�����¾�λ�˴�㤪���������˶��ˤϺ��顤Ω�ӡ����Ӥα��졤�����۲��⡤�β��㲼��ʢ�����������ء������ء��۾�Ƶ۲����Ƶ�¥��������ӸƵۺ����������Ⱦ��֤ΰ������ɾ���ǧ���줿���۾�Ƶ۲��ϡ���¸���3��(���������1���ޤ�)�ˤ�ñȯ����ǧ���줿������¾����ʬ��ʪ���оȷ���1�㡤���ؤ�30 mg/kg����1�㡤ή�ޤ���ӻ��۾郎100 mg/kg���dz�1��˴ѻ����줿��300 mg/kg���β�������ˤ����Ƥ���Ϳ�������ή���۾�Ƶ۲����β��㲼����ӸƵۺ��ѻ����줿��������������ˤϰ��̾��֤��Ѳ���ǧ����ʤ��ä���
��ͺ�Ǥϡ��оȷ������300 mg/kg������Ϳ15���ʹ���Ϳ���ֽ�λ���ޤ����ͷ�����ǧ���졤��Ϳ1����42�����ν������̤����ͷ���������300 mg/kg���β�������ˤ����Ƥ���Ϳ��������ν������̤����ͷ��������������֤Ǥ��оȷ�������νŤ����ͤǿ�ܤ��������ν������̤ˤϺ���ǧ����ʤ��ä���
����Ǥϡ��оȷ������300 mg/kg������Ϳ8�����15�������ͷ�����ǧ���졤��Ϳ1����15�����ν������̤����׳�Ū��ͭ�դ����ͤ�����ǥ�����֤����Ӯ����֤Ǥ��оȷ����︳ʪ����Ϳ�Ʒ��Ȥδ֤����׳�Ū��ͭ�դʺ���ǧ����ʤ��ä���300 mg/kg���β�������ˤ����Ƥ���Ϳ��������ν������̤����ͷ��������������֤Ǥ��оȷ�������νŤ����ͤǿ�ܤ��������ν������̤ˤϺ���ǧ����ʤ��ä���

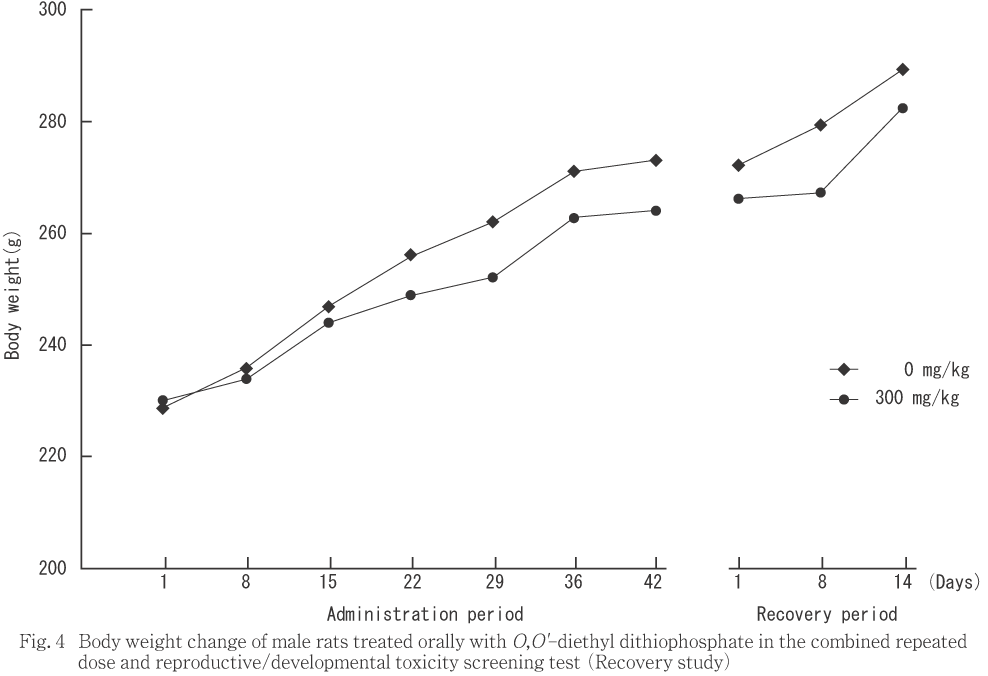
����ͺ�Ȥ�ˡ���Ϳ���֤���Ӳ������֤��̤����оȷ����︳ʪ����Ϳ�Ʒ��Ȥδ֤����׳�Ū��ͭ�պ���ǧ����ʤ��ä���
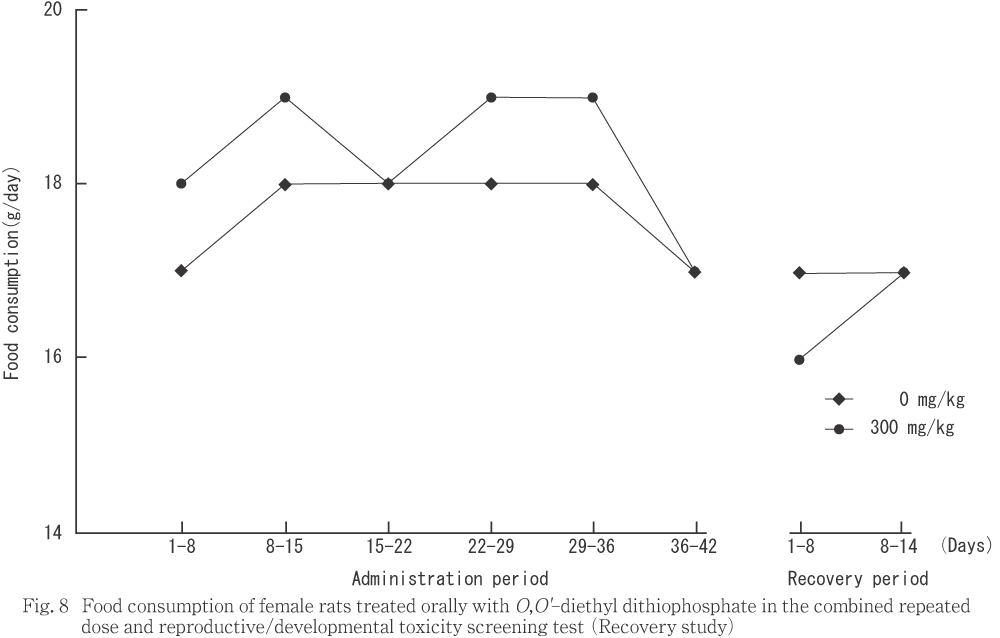
���ܺ٤ʾɾ��ѻ��ˤ����ơ��︳ʪ����Ϳ�αƶ��ȹͤ������Ѳ��Ȥ��ơ�ͺ�Ǥϡ����������ѻ��ˤ�������Ϳ���֤θ�Ⱦ��ή�ʤ���ưʪ����100�����300 mg/kg����ͭ�դ˸��������դ˷��٤�ή��ưʪ����ͭ�դ����ä���������¾��ͭ�դ�ȯ���������������긫��ǧ���줿�������̤˴�Ϣ���ʤ�����Ӥ����Ѳ��ǤϤʤ������뤤���оȷ����ͤ���ȯŪ�˹⤫�ä����Ȥ˵��������Ѳ��Ǥ��ä����������֤Ǥϡ��嵭���٤�ή��ưʪ��ǧ����ʤ��ä���
����Ǥϡ����������ѻ��ˤ�����ǥ��7���˷��٤�ή��ưʪ����100 mg/kg����ͭ�դ����ä������ޤ��������ץ�ե��������δѻ��ˤ�����300 mg/kg������Ϳ10���˰�ư�̤η��٤ʸ�����ưʪ����ͭ�դ����ä���������¾��ͭ�դ�ȯ���������������긫��ǧ���줿�������̤˴�Ϣ���ʤ������뤤��������Ū�˰յ��Τʤ��Ѳ��Ǥ��ä�����������Ǥϡ��︳ʪ����Ϳ���˴ط�����ȹͤ������Ѳ���ǧ����ʤ��ä���
����λɷ���Ф��뱿ư����ȿ���δѻ��Ǥϡ���ͺ�Ȥ���︳ʪ����Ϳ�αƶ��ȹͤ�����ȿ�����Ѳ���ǧ����ʤ��ä���
��ͺ����Ϳ���ֽ�λ������Ӳ������ֽ�λ���������Ϳ���ֽ�λ������Ӳ������ֽ�λ���ʤ�Ӥ�Ӯ��4���Τ�����ˤ����Ƥ��оȷ����︳ʪ����Ϳ�Ʒ��Ȥδ֤����褪��Ӹ��ΰ��Ϥ˺��Ϥߤ��ʤ��ä���
��ͺ�Ǥϡ��������ֽ�λ����300 mg/kg����¬�곫�ϸ�20��30ʬ�μ�ȯ��ư�̤��оȷ�����Ӥ���ͭ�դʹ��ͤ���������������Ѳ��Ǥ��ꡤ��Ϳ���ֽ�λ����Ʊ���ˤ��Ѳ���ǧ����ʤ��ä���
����Ǥ�300 mg/kg����Ӯ��4����¬�곫�ϸ�10��20ʬ�����¬��1���֤����פμ�ȯ��ư�̤����줾��ͭ�դ����ͤ�����Ϳ���ֽ�λ����¬�곫�ϸ�0��10ʬ�����10��20ʬ�μ�ȯ��ư�̤����줾��ͭ�դ����ͤ������������ֽ�λ����Ʊ���ˤ��Ѳ���ǧ����ʤ��ä���
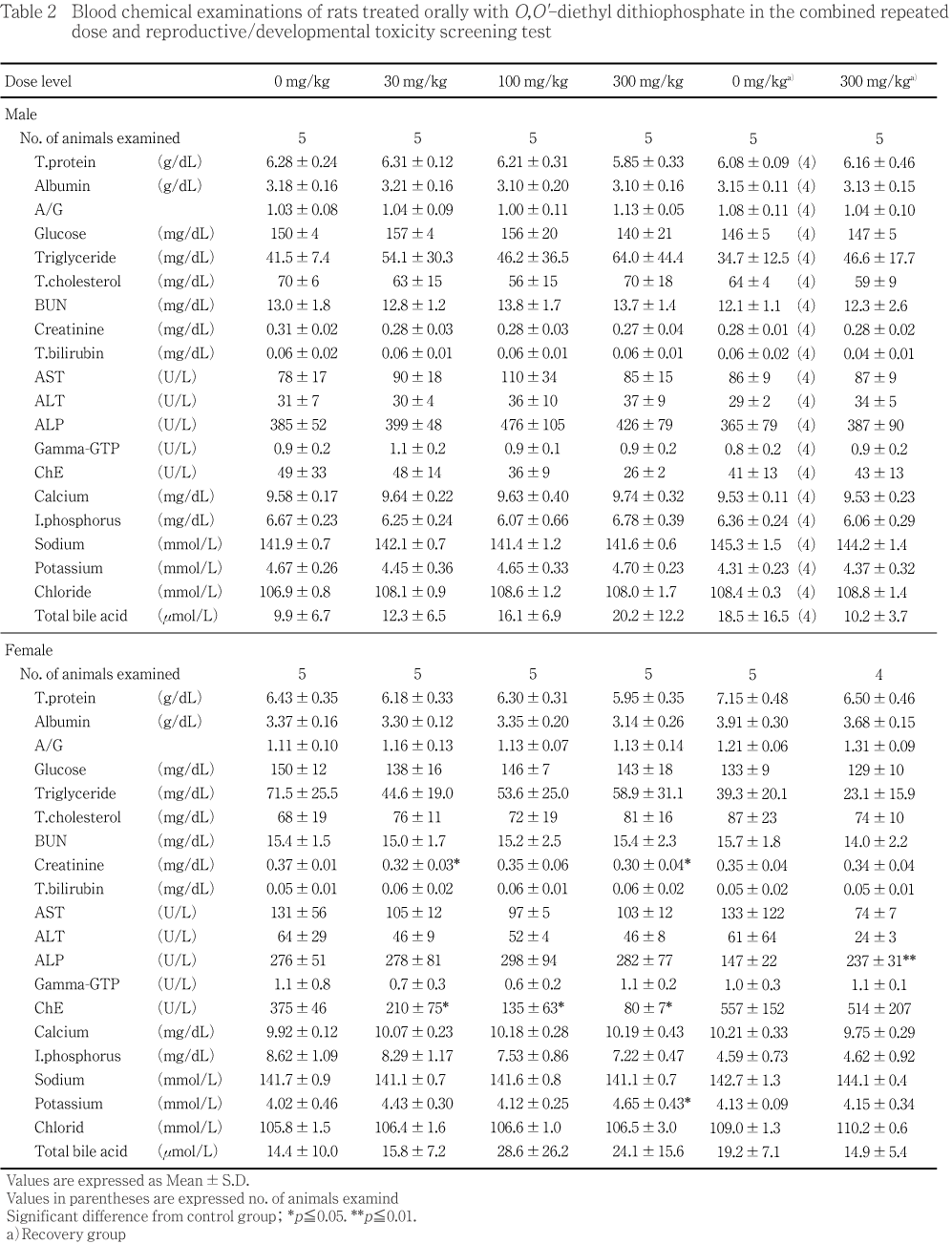
��ͺ�η�ճظ����Ǥϡ���Ϳ���ֽ�λ�����оȷ������300 mg/kg���ǥإ⥰���ӥ��̤�����ַ��������׳�Ū��ͭ�դ����ͤ������ޤ���30 mg/kg���ǹ������Ψ��ͭ�դ����͡����ѵ���Ψ��ͭ�դʹ��ͤ����������̤��б����ʤ��Ѳ��Ǥ��ä����������ֽ�λ���Ǥϡ�300 mg/kg�������������������ͭ�դʹ��ͤ������ޤ���Ʊ���ǹ��������ͭ�դʹ��ͤ��������������Ѳ��Ǥ��ä���
����η�ճظ����Ǥϡ�Ӯ��5�����оȷ������300 mg/kg���Ƿ쾮�Ŀ���ͭ�դ����ͤ������������ֽ�λ���Ǥϡ�300 mg/kg���ǥإ⥰���ӥ��̤�ͭ�դʹ��ͤ�����
����նŸ�ǽ�����Ǥϡ���ͺ�Ȥ����Ϳ���ֽ�λ������Ӳ������ֽ�λ���Ǥ�����θ������ܤˤ��оȷ����︳ʪ����Ϳ�Ʒ��Ȥδ֤˺���ǧ����ʤ��ä���
��ͺ�Ǥϡ���Ϳ���ֽ�λ�����оȷ������300 mg/kg�������������ͷ����������������ֽ�λ���Ǥϡ�������θ������ܤˤ��оȷ���300 mg/kg���Ȥδ֤˺���ǧ����ʤ��ä���
����Ǥϡ�Ӯ��5�����оȷ���������Ƥ��︳ʪ����Ϳ���ǥ�����ƥ顼�������׳�Ū��ͭ�դ����ͤ������ޤ���300 mg/kg���ǥ��ꥦ�बͭ�դʹ��ͤ���������ͺ��Ʊ�ͤ����ͷ�������������ˡ�30�����300 mg/kg���ǥ��쥢���˥�ͭ�դ����ͤ��������������Ѳ��Ǥ��ä����������ֽ�λ���Ǥϡ�300 mg/kg���ǥ��륫��ۥ��ե���������ͭ�դʹ��ͤ�����
��ͺ�Ǥϡ���Ϳ���ֽ�λ������Ӳ������ֽ�λ���ˤ����ơ��оȷ������300 mg/kg����Ǿ������ƥ顼�����������׳�Ū��ͭ�դ����ͤ���Ǿ������ƥ顼���˳�Ψ�Ϥ��줾��14.6�����4.6 %�Ǥ��ä���
����Ǥϡ�Ӯ��5���ˤ�����100�����300 mg/kg����Ǿ������ƥ顼��������ͭ�դ����ͤ���Ǿ������ƥ顼���˳�Ψ�Ϥ��줾��13.8�����30.3 %�Ǥ��ä����������ֽ�λ���Ǥ��оȷ���300 mg/kg���Ȥδ֤˺���ǧ����ʤ��ä���
���Ʒ��Υ��ȥ���������ο��ϡ��оȷ���30��100�����300 mg/kg���Ǥ��줾��2��3��5�����5��Ǥ��ꡤ100�����300 mg/kg���ǥ��ȥ��������㤬���ä������ޤ���30 mg/kg����1�㤬����3+��������������Τߤ��Ѳ��Ǥ��ꡤ100�����300 mg/kg����ǧ����ʤ����Ȥ����ȯŪ���Ѳ��ȹͤ���줿������¾�θ������ܤ��︳ʪ����Ϳ�ˤ��ȹͤ������Ѳ���ǧ����ʤ��ä���
��ͺ����Ϳ���ֽ�λ���Ǥϡ��������оȷ������100 mg/kg���Ǽ½��̡�300 mg/kg���Ǽ½��̤�������н��̤����׳�Ū��ͭ�դʹ��ͤ����������300 mg/kg���Ǵ�¡���¡����ӿ�¡�����н��̤�ͭ�դʹ��ͤ����ñ��������������Τμ½��̤�ͭ�դ����ͤ���������¾��100 mg/kg����Ǿ�μ½��̤�ͭ�դʹ��ͤ����������̤˴�Ϣ���ʤ��Ѳ��Ǥ��ä����������ֽ�λ���Ǥϡ�300 mg/kg�������㤪���������Τμ½��̤�������н��̤�ͭ�դ����ͤ�����¡�����н��̤����ͤ�����
����Ǥϡ�Ӯ��5����300 mg/kg���ǿ�¡�μ½��̤�������н��̤�ͭ�դʹ��ͤ�����¡�����н��̤�ͭ�դʹ��ͤ������������ֽ�λ���Ǥϡ��������¬��ﴱ�ˤ��оȷ���300 mg/kg���Ȥδ֤˺���ǧ����ʤ��ä���
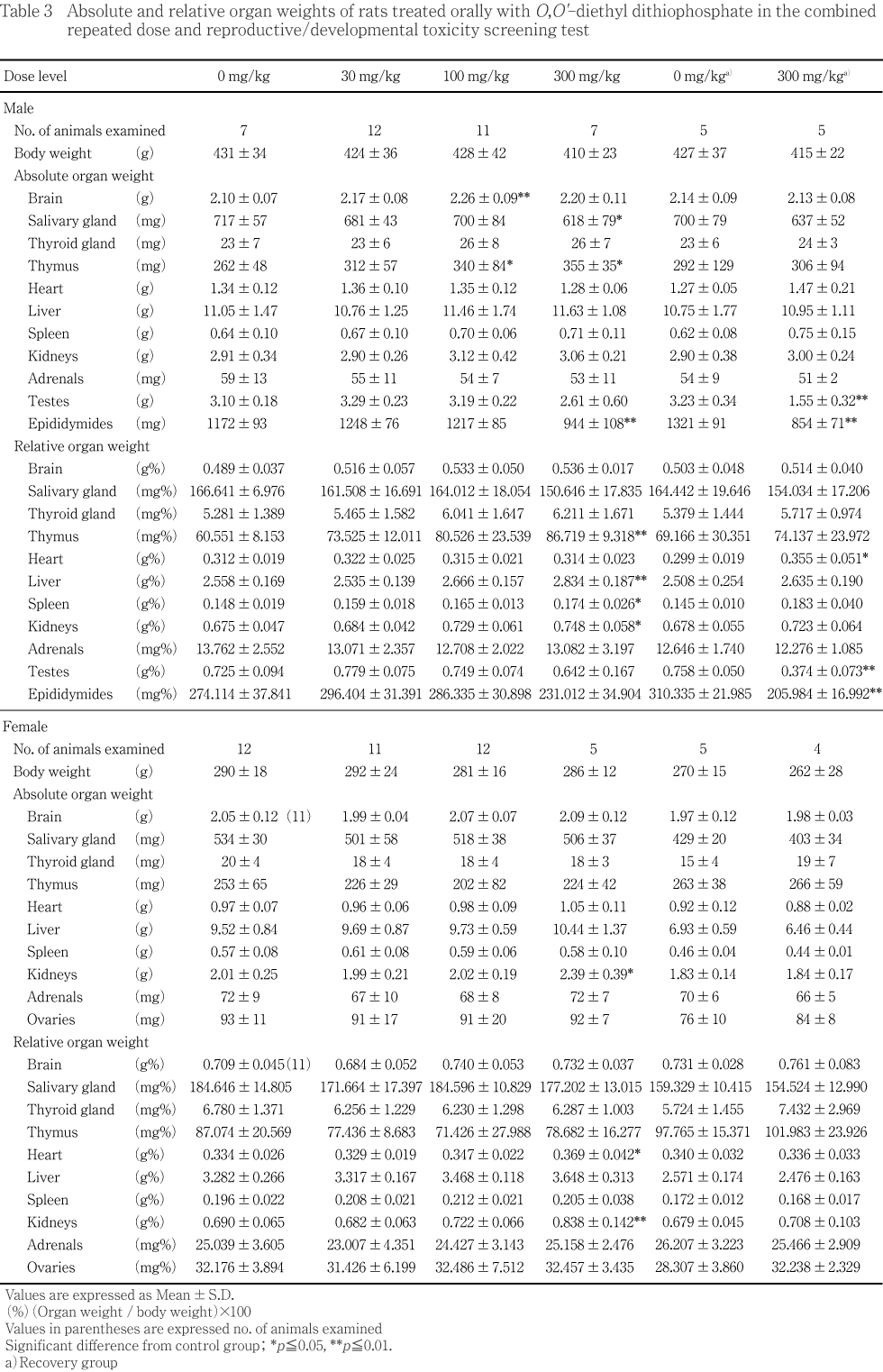
����˴��������˶����ưʪ��300 mg/kg���λ�Τߤ�ǧ���줿���ߤ���ľIJ����Ĺ�ˤ錄�륬���ˤ����г�ĥ����ħŪ������긫�Ǥ��ꡤ�︳ʪ����Ϳ�ˤ���ð�Ū���Ѳ��ȹͤ���줿���ä��ơ��¡����Ӷ����ΰ�̤���4���ǧ���줿������ˡ��٤��ֿ���������ֿ���/����ߤι�����/��褬2�㡤�ٵ���1���ǧ���줿¾����������𤪤���ֿ���/��衤�鲼�νз줪����ֿ�����ʢ����з졤��¡���ֿ���/��衤絤ι�������ʪ�ʤɽз����ΤȤ���۴ľ㳲�ʤ�Ӥ˾ò��ɤ���г�ĥ�˵��������ɤ����������1���ǧ���줿�������ν긫�Ͼ������ȯ���ȤϤ���Ʊ�����̵���֥�åȤˤϵ����Ѳ��Ǥ��뤳�Ȥ���Ʊ�ͤ��︳ʪ����Ϳ��ľ��Ū���뤤�ϴ���Ū�ƶ��ȹͤ���줿���ߤη���ˤĤ��Ƥϡ������̤�¸�ߤ������ȿ��ȿ�Ĵ�˰㤤���ʤ�ľ��1 mm�ʲ��η��������ѤǤ����︳ʪ����Ϳ�˵��������Ѳ��ȤϹͤ��ʤ��ä����ޤ��������������Ϳ20���ǻ�˴����300 mg/kg����1��ˤ����Ƥ�Ʊ�ͤ��٤��ֿ���/��衤�ߤι�����/��褪����鲼���ֿ�����ǧ���졤����˲��ܥ�������ֿ����ʤ�Ӥ˴�¡������/����ȼ�äƤ�����
����Ϳ���ֽ�λ����ͺ��˶���Ǥϡ�ǥ������Ω������300 mg/kg����1��������ξ¦����̤�ǧ���줿��Ʊ���Ѥ�Ʊ�����̵���֥�åȤˤϤۤȤ�ɴѻ�����ʤ����ѤǤ��ꡤ��Ҥ���������ֽ�λ����Ʊ��ͺ��������Ѥ���Ψ�ˤߤ��Ƥ��뤳�ȡ��ʤ�Ӥˤ����ȿ��������︳ʪ����Ϳ�αƶ��ȹͤ���줿���︳ʪ����Ϳ���˴ѻ����줿����¾�ν긫�Ϥ������1��Τߤ�ȯ�������¶����η��٤����ѤǤ��ꡤ����ȯ�������̤Ȥδ�Ϣ�Ϥʤ��ä���
���������ֽ�λ����ͺ�Ǥ�300 mg/kg���������̤�4���ǧ���졤ͭ�դ�ȯ���������ä�����ξ¦����ȯ���Ǥ��ꡤȯ������¿�����Ȥ����︳ʪ����Ϳ�αƶ��ȹͤ���줿�����㤪���������ΰʳ��˴ѻ����줿����¾�ν긫��Ʊ�����̵���֥�åȤˤ��Ф���ǧ��������Ѥ�ȯ���������٤ʤ�Ӥ˷��ֳ�Ū��ħ�˺����ʤ����Ȥ��鼫��ȯ�����Ѥȹͤ���줿��
������ʬ�ڤ�����Ӳ������ֽ�λ���λ�˴ѻ����줿�긫�ϡ���������оȷ��Τߤ�ȯ����1��Τߤ�ȯ�����뤤�����̤Ȥδ�Ϣ�Τʤ�ȯ��������
��ǥ������Ω�����ʤ��ä�ͺ��30 mg/kg����1�㤪���300 mg/kg����2��Ǥϰ۾�긫��ǧ����ʤ��ä���������ǥ������Ω�λ�Ǥϻҵܤ����絤�Ǵ�դ���α�ˤ����г�ĥ��ǧ���줿������ϻ�ưʪ�����ð�Ū�˴ѻ������긫�Ǥ��롥��
���������ν��㲼�ȤȤ�ˡ�ʢ��������ȼ�äƿ��ढ�뤤��������˶����4��Ǥϡ����ߤ��뤤�����ߤˤӤ��ǧ���졤���Τ�����2��Ǥ�����Ǵ��������ѻ����줿�������1��Ǥϲ�IJ�ˤ����礬ǧ���줿���ޤ������ढ�뤤�Ͽ��ˤ��������˶��Ǥϡ�������¡��ʬ������˼��˦�Υ��⡼������γ�θ������κ�˦�ΰ�̤����ꡤ�����ΰ�̡��¡�ˤ������¤����㲼��������˦�ΰ�̡�����ˤ�����¤����㲼���٤Τ��÷졦����ѻ����줿��
���������νŸ�����ȼ�鷺�˵����ηв��Ȥäƻ�˴����3��ǤϤ�����ⵤ�ɤ������ʵ����α�ɤ�ǧ���쵤�ɤξ������Υ������Фˤ�Ǵ�դ���ӹ�������ΤȤ������бդ���α���Ƥ��ꡤ������Ф����Ƥ����������ȼ�ä�������٤Τ��÷쎥���������������礬ǧ���줿¾��2��˿����γ�ĥ����3������ߤΤӤ���ꡤ1��Ǥ��¡�ο�¤�졤�����¤�줬�ष�����ä�������ȤȤ���¡�Υ�����˦�ΰ�̤�ǧ���줿���ޤ��������������Ϳ20���˻�˴����300 mg/kg����1��Ǥ�¾�εष��ưʪ��Ʊ�ͤ��٤Τ��÷졦��𡤵��ɤα�ɡ�������Υ�������ж������ʤ�Ӥ������������˲ä�������νз졤���ܥ����ᤪ��Ӵ�¡�Τ��÷�ʤ�Ӥ˴κ�˦�������ʤɤ��ѻ����줿��
���ʤ����������������Ū����г�ĥ��ǧ���줿��IJ�������IJ��Ǵ������ѤϤʤ��ä�������¾�˶�ȯ�긫�Ȼפ����Ѳ��Ȥ��ơ���¡��Ǣ�ٴɤζ�˦������¡��������դνз졤統ꡤ�����ΤΥ�ȥ�ǹ����¡�ξ����ձ��Ӵκ�˦�ζ�˦���ʤɤ��ѻ����줿��
����Ϳ���ֽ�λ����ǥ������Ω������ͺ�����Ӯ��5���λ�Ǥ��︳ʪ����Ϳ�˵��������Ѳ��Ȥ��ơ�300 mg/kg����ͺ2�㡤��1������ߤΤӤ��ǧ���줿�ۤ���ͺ�Ǥ����������ǥ���ȥ��˦�ζ�˦�����ѻ����졤���Τ���1������ٴɤΰ�̤�ȼ�äƤ���������ȶ���ͺ�������������δ�������Ҥ��������Ƥ��ꡤ2��Ǥ�����������������������˦�Ȼפ����˦���֤���α��ǧ���줿���ʤ����������Ѳ��Ϥ�����������̷�����������̷��ˤϴѻ�����ʤ��ä���
��ǥ������Ω�����ʤ��ä�30 mg/kg����1����ȿ���Ū�۾�ϴѻ����줺��ǥ������Ω�θ����������Ǥ��ä���������300 mg/kg����2��Ǥϡ�����˥���ȥ��˦�ζ�˦����������Τˤ�����ɹ�������Ҹ�������Ӻ�˦�Ķ��νи����ѻ����졤1��Ǥ϶ɽ�Ū�ǤϤ��ä������ٴɤΰ�̤�ȼ�äƤ������Ȥ��餳�����Ѳ���ǥ������Ω�����ʤ��ä������Ǥ��ä���ǽ�����⤤��ǥ������Ω�λ�Ǥϻҵܤΰ�̡�絤���г�ĥ����ӱ�ɤ����ꡤ�������Ѳ�����ǥ�θ����ȹͤ���줿��
������¾����ͺ�Ȥ���оȷ����뤤��300 mg/kg���˷������ȿ���Ū�Ѳ����ѻ����줿����������������ߤǴѻ�����뼫��ȯ�����Ѳ��Ǥ��ꡤȯ��Ψ�ˤ��оȷ��ȹ����̷��Ȥδ֤˺����ߤ��ʤ����Ȥ��顤�︳ʪ����Ϳ�Ȥϴ�Ϣ�Τʤ��Ѳ��Ǥ����Ƚ�Ǥ���롥�ʤ���ͺ�ι����̷���1��ˡ������˸¶ɤ������ڱ���¡������ȼ�ä��������˦������ꤳ���ȼ�ä����˼��˦�Υ��⡼������γ�θ�����ǧ���줿��������������Ū�յ������餫�ˤ��뤳�ȤϽ���ʤ��ä���
���������ֽ�λ���Ǥϡ��︳ʪ����Ϳ�˵��������Ѳ��Ȥ��ơ�300 mg/kg����ͺ���������˥���ȥ��˦�ζ�˦����ȼ�ä����ٴɤΰ�̤����ꡤ���Τ���4��Ǥϴֺ�˦(�饤�ǥ��åҺ�˦)�β������ǧ���졤������Ѳ�����Ϳ���ֽ�λ�������˶������������Ƥ���������ȶ���ͺ������������������������Ҥ��������Ƥ��ꡤ3��Ǥ�����������������������˦�Ȼפ����˦���֤���α��ǧ���줿���ޤ�����Ǵ�¡������������ȯ����ͭ�դ˸������Ƥ�������������Ū�˰յ��Τ����Ѳ��ǤϤʤ��ä�������¾����ͺ�Ȥ���оȷ����뤤�Ϲ����̷��˷������ȿ���Ū�Ѳ����ѻ����줿����������������ߤǴѻ�����뼫��ȯ�����Ѳ��Ǥ��ꡤȯ��Ψ�ˤ��оȷ���300 mg/kg���Ȥδ֤˺����ߤ��ʤ����Ȥ��顤�︳ʪ����Ϳ�Ȥϴ�Ϣ�Τʤ��Ѳ��Ǥ����Ƚ�Ǥ���롥
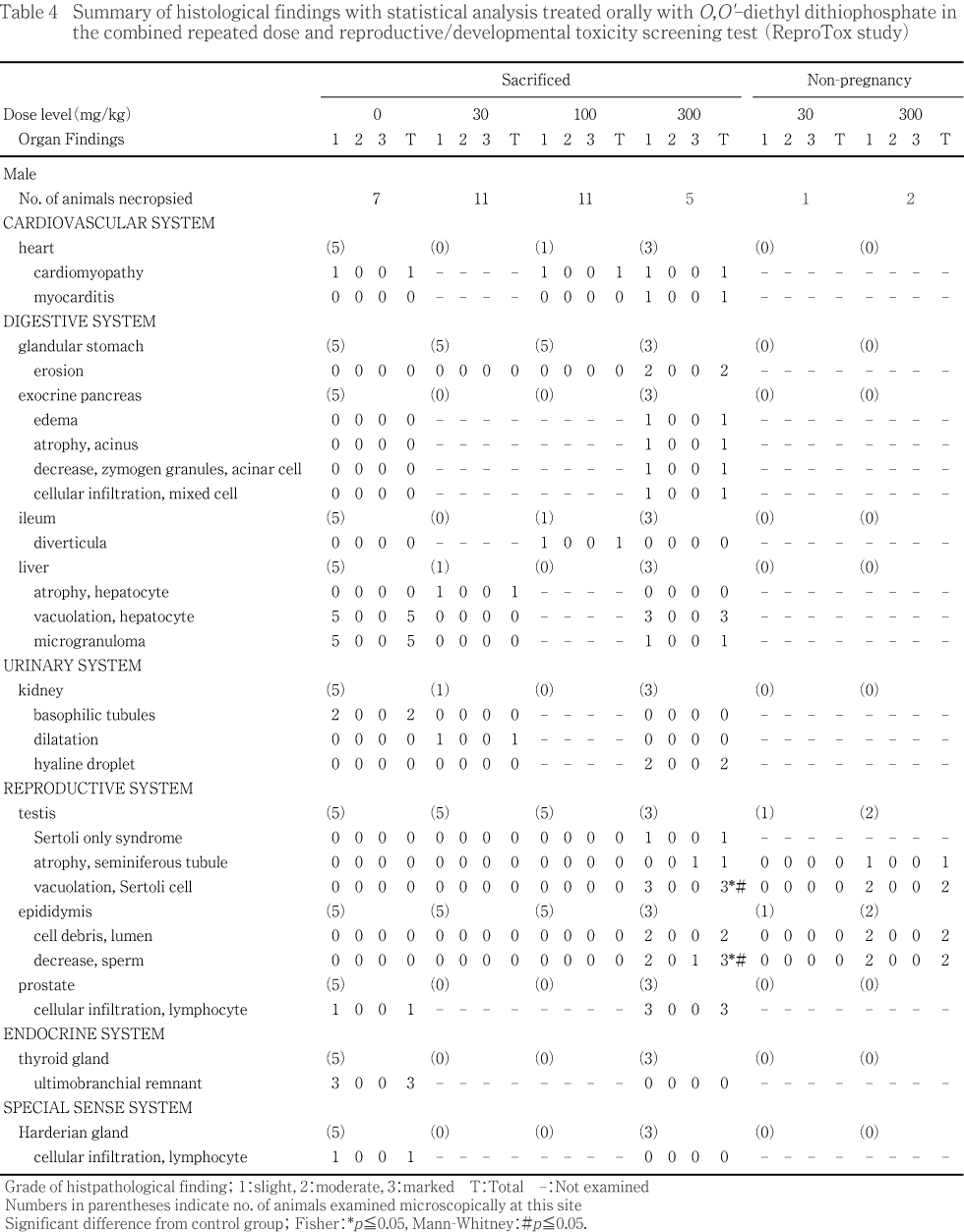
��������������ҷ�����������δѻ��Ǥϡ�100 mg/kg�����оȷ�����٥���ȥ��˦������Υץ��ץȥƥ�������˦����ӥѥ��ƥ�������˦�Τ��줾�����Ψ��ͭ�դ����ͤ�����ǥ������Ω�����ʤ��ä�30 mg/kg����1�㤪���300 mg/kg����2��⤽�줾��κ�˦�����оȷ���Ʊ���٤Ǥ��ä����ʤ�������Ū��ξ¦�������̤Τߤ�줿300 mg/kg��ͺ��1��Ǥϡ���������������������Ѳ��������ä����Ȥ������ҷ�����������Υ��ơ���ʬ�ब����ʤ��ä������ɾ���оݤ������������
���������ֽ�λ����300 mg/kg���Ǥ�����Ū��ξ¦���ΰ�̤��ߤ�졤�ȿ���Ū�ˤ�����㳲�������Ǥ��ä����������Ū�˰�̤��ʤ��ä�1�������ƳƼ��˦�Υ�����Ȥ��Ԥ��ʤ��ä����������äơ�ɾ���Ǥ��ʤ��ä���
���оȷ���ޤ����Ƥ���Ϳ�������㤬�������������ۤ�30 mg/kg����1�㤪���300 mg/kg����2�㤬��Ω��������Ψ�Ϥ��줾��91.7�����77.8 %�Ǥ��ꡤ¾�η��ǤϤ������100 %�Ǥ��ä���
���������ѻ��Ǥϡ��۾���������ưʪ���оȷ������300 mg/kg���Ǥ��줾��1�����2���ǧ���줿����300 mg/kg����1��ϵ�ǥ���ξ��֤���ΤǤ���۾�������ȯ��Ψ�ˤ⺹��ǧ����ʤ��ä����ޤ���ʿ���������ˤ��оȷ����︳ʪ����Ϳ�Ʒ��Ȥδ֤˺���ǧ����ʤ��ä���
���оȷ���ޤत�������Ϳ���Ǥ�ʬ�ھ��֤˰۾�ϴѻ�����ʤ��ä����Ʒ���ǥ�����֡����ο����徲�������л���������ӽл��������Ϥۤ�Ʊ�ͤ��ͤ����л�Ψ���徲Ψ��ʬ��Ψ������Ψ���������˷��ֺ���ǧ����ʤ��ä�����������4������¸Ψ���оȷ������300 mg/kg�������׳�Ū��ͭ�դ����ͤ���Ʊ����ͺ����������ӻ�ͺ���碌����������4������¸Ψ�����ͷ���������Ӯ��0���˻�˴����30��100�����300 mg/kg���Ǥ��줾��4��3�����9��˴ѻ����줿����300 mg/kg����9�����8���Ʊ��ʢ�Ǥ��ꡤ������ưʪ��ʬ��ľ��˻�˴���Ƥ������������Ϥ�����η��ˤ�ѻ�����ʤ��ä���
���������γ�ɽ�����Ǥϡ��۾�긫��ǧ����ʤ��ä���
���ν��Ѳ��Ǥϡ�300 mg/kg����Ӯ��4�����νŤ��оȷ������ͺ��ͭ�դ����͡�������ͷ�����ǧ���줿��
��Ӯ�������λ�˴����˶���Ǥϡ��۾�긫��ǧ����ʤ��ä���
��Ӯ��4����˶���Ǥϡ��ߤ��ֿ���/��褬300 mg/kg����ͺ��4��˴ѻ����졤�оȷ������ͭ�դ�ȯ���������ä�ǧ���줿�������������ν긫��4����3�㤬Ʊ��ʢ��ǧ���줿��ΤǤ��ä�������¾���٤γ쿧��/��衤��ⳳ�ĥ��Ǣ�ɳ�ĥ��Ǿ�γ쿧��/��褢�뤤������η����ͺ���оȷ���ޤ�Ʒ���ñȯ�����뤤�Ͼ�����˴ѻ����줿��
����Ϳ������˻��300 mg/kg����6��λ�˴ưʪ�����2���������˶ưʪ��ǧ���줿��������ưʪ�λ�˴���뤤��������˶�˻��в�Ȥ��ơ��ä������ʰ��̾ɾ����Ѳ����ʤ��ह����Ƚ������νŤ��㲼��ʢ��������ȼ�ä����Ⱦ��֤���������2�ĤΥ����פ�ʬ����줿�����Ԥηв��Ȥäƻ�˴������Ǥϡ������긫�Ȥ��Ƥ�����ⵤƻ(����)��Ǵ������˦����Υ��ȼ�ä������ʵ�����ɤ����ꡤ��ƻ�����бդˤ�ꡤ���������������Ƥ������������äơ���������μ�ʻ���ϵ�ƻ�ε�����ɤˤ����©��ȹͤ���줿��������Ԥηв��é�äƻ�˴������ϡ��������ߤ��뤤�ϲ�IJ�ˤӤ�����礬ǧ���졤�¡�γ�ʬ������˼��˦�Υ��⡼������γ�θ����ȴ�¡��Ϥ���Ȥ�����Ĥ��δﴱ�˰�̤�ǧ���줿���Ȥ��顤�ò��ɾ㳲��ȼ�����ܾ��֤ΰ�������ʻ���ȹͤ���줿�������ν긫���顤���︳ʪ���ϡ��ɽ�ɷ�����ͭ���Ƥ��ꡤ���Τ���˷и�Ū���ݼ褷�����Ͼò��ɾ㳲�ˡ��ޤ��ò�������ʪ�ε�ή�ʤɤˤ�굤ƻ������ä����ˤϵ�ƻ�˵�����ɤ�浯�����Ƶ۾㳲�˻���Τȹͤ���줿������¾���¡����Ӷ����ΰ�̤�ȼ�äƤ���������ǤϤʤ����Ȥ��顤���ѡ�¤���Ϥؤ�ľ��Ū�ʱƶ�����ΤǤϤʤ��������֤�����ưʪ�ˤߤ�줿���ð�Ū���Ѳ��Ǥ����ǽ�����⤤��
�����̾��֤��Ѳ��Ȥ��ơ���ͺ��30 mg/kg�ʾ����Ϳ����ή���ѻ����줿��ή�����̤˴�Ϣ����ȯ��������뤤��ȯ�����������ä��Ƥ��뤳�ȡ��ޤ���2������Ϳͽ����ˤ����Ƥ�100 mg/kg�ʾ����Ϳ���Ǵѻ�����Ƥ��뤳�Ȥ����︳ʪ����Ϳ�αƶ��ȹͤ���줿���︳ʪ���϶�����ʪ���Ǥ��ꡤή�Ϥ��λɷ����˵���������ΤȤ�ͤ���줿����ͺ��300 mg/kg����ǧ���줿���ؤ�����Ͼ��ʤ���Τθ�Ҥ���ͳ�����︳ʪ����Ϳ�αƶ��ȹͤ���줿��30 mg/kg����ǧ���줿���ؤϻ�ͺ�������1��Τߤ�ȯ���Ǥ��ꡤ�︳ʪ����Ϳ�Ȥδ�Ϣ�����餫�ǤϤʤ��ä���
���νŤǤϡ�300 mg/kg����ͺ�Ǥ���Ϳ���֤��̤��ơ���Ǥϸ�������Ϳ���֤��ν�����������ǧ���졤�︳ʪ����Ϳ�αƶ����������줿��
���ݱ��̤Ǥϡ���ͺ�Ȥ���︳ʪ����Ϳ�αƶ���ǧ����ʤ��ä���
����ǽ�ѻ����縡���Ǥϡ��ܺ٤ʾɾ��ѻ��ǻ�ͺ�Ȥ��100�����300 mg/kg���ǰ��̾��֤�Ʊ�ͤ�ή��ưʪ�������ä�ǧ���줿���ޤ������300 mg/kg������Ϳ������˰�ư�̤η��٤ʸ�����ưʪ�������ä�ǧ���졤Ʊ������Ϳ���ֽ�λ�������Ӯ��4���μ�ȯ��ư�̤����ͤ���������鼫ȯ��ư���㲼���︳ʪ����Ϳ�˵��������Ѳ��ȹͤ���줿��
���������Ǥϡ�ͺ����Ϳ���ֽ�λ���η�ճظ����ˤ�����300 mg/kg���ǥإ⥰���ӥ��̤�����ַ��������ͤ����Ϸ�Ǥ���ȹͤ���줿�������Ѳ���2������Ϳͽ����ˤ����Ƥ�ǧ����Ƥ��ꡤ�︳ʪ����Ϳ�ˤ���Τȹͤ���줿���������ֽ�λ���Ǥϡ�300 mg/kg����������������������ͤ�����������Ѳ��Ǥ���ȹͤ���줿�����Ӯ��5���θ����Ǥ�300 mg/kg���Ƿ쾮�Ŀ������ͤ��������������Ǥ��뤬�︳ʪ����Ϳ�αƶ��ȹͤ���줿����β������ֽ�λ���Ǥϡ�300 mg/kg���ǥإ⥰���ӥ��̤����ͤ����������٤��Ѳ��Ǥ���������Ū�յ����㤤�ȹͤ���줿��
����նŸ�ǽ�����Ǥϡ���ͺ�Τ�����λ����ˤ��︳ʪ����Ϳ�˵�������ȹͤ������Ѳ���ǧ����ʤ��ä���
����������ظ����ˤ����ơ�ͺ����Ϳ���ֽ�λ������ӻ��Ӯ��5����300 mg/kg�������������ͷ������������������Ǥ��ä���2������Ϳͽ����ˤ����Ƥ⤽���Ѳ���ǧ����Ƥ��ꡤ�︳ʪ����Ϳ�αƶ��ȹͤ���줿�����Ӯ��5���θ����ˤ��������Ƥ���Ϳ���ǥ�����ƥ顼�������ͤ����︳ʪ����Ϳ�αƶ��ȹͤ���줿���������ʤ��顤����������ƥ顼���ε�ǽ�������Ǥ��뤬��������ư���ο�����ã�ˤϤʤ�δ�Ϳ�⤷�Ƥ��ʤ����Ȥ��Τ��Ƥ���6)��������ư�����̤�ɾ���ˤĤ��Ƥϸ�Ҥ���Ǿ������ƥ顼�����������ˤ�ä�ɾ���������ޤ���300 mg/kg���ǥ��ꥦ�ब���ͤ����︳ʪ����Ϳ�αƶ��ȹͤ���줿�������������Ǥ��ä�����β������ֽ�λ���Ǥϡ�300 mg/kg���ǥ��륫��ۥ��ե������������ͤ��������������֤Τߤ��Ѳ��Ǥ��뤳�Ȥ����︳ʪ����Ϳ�Ȥϴ�Ϣ�Τʤ��Ѳ���Ƚ�Ǥ�����
��Ǣ�����Ǥϡ�ͺ����Ϳ���ֽ�λ����100�����300 mg/kg���ǥ��ȥ��������㤬���ä����������٤��Ѳ��Ǥ����︳ʪ����Ϳ�Ȥδ�Ϣ�����餫�Ǥʤ��ä���
��������ƥ顼�����������Ǥϡ���Ϳ���ֽ�λ����ͺ��300 mg/kg������ӻ��100�����300 mg/kg����Ǿ������ƥ顼�����������ͤ����︳ʪ����Ϳ�αƶ��ȹͤ���줿���������Ѳ����顤Ǿ������ƥ顼���������˳�����뤳�Ȥˤ�ꡤ������ư���ο�����ã�Ϥؤαƶ�������ȹͤ���줿��������ƥ顼������������ͭ�����ޤ���ɽŪ�������ɾ��Ȥ���ή����Ӳ�Ρ���夲���뤳�Ȥ���7)��ή��300 mg/kg����ǧ���줿���ؤ��︳ʪ���Υ�����ƥ顼�����������˴�Ϣ�����Ѳ��ȹͤ���줿���������ʤ��顤�����Ѳ��ϵ����ˤ���������ȹͤ���줿��
�������ظ����Ǥϡ������긫�Ȥ��Ƥ�300 mg/kg��������㳲���ѻ����줿������Ϳ���ֽ�λ����˶��ˤ����ơ����餫�����ٴɰ�̤��뤤���������˦�㳲��ǧ����ʤ���ˤ����Ƥ⥻��ȥ��˦�ζ�˦�����ѻ�����Ƥ��뤳�Ȥ��顤����㳲�ϥ���ȥ��˦�㳲�˵��������Ѳ��Ǥ��뤳�Ȥ����ꤵ��롥�ʤ��������Ѳ��ϡ���������ˤ����Ƥ�������Ǥ��뤳�Ȥ��顤�ٱ������뤤�Ͽʹ������Ѥȹͤ����롥�����������ν��̤⤳���ȿ�Ǥ��Ʋ������ֽ�λ���ˤ�����Τʸ�����ǧ���줿���ޤ������ҷ�����������δѻ��ˤ�����100 mg/kg���ǥץ��ץȥƥ�������˦����ӥѥ��ƥ�������˦�Υ���ȥ��˦���������Ψ���㲼�������������Ѳ����︳ʪ�������������������Τȹͤ���줿���ʤ������������300 mg/kg����1��Ȳ��������300 mg/kg����4��ˤĤ��Ƥ����ҷ�����������Υ�����Ȥ��Ǥ��ʤ��ä�������¾��ͺ��300 mg/kg���Ǵ�¡���¡����ӿ�¡�����н��̤ι��͡��ñ����μ½��̤����ͤ��νŤ����ͤ˵��������Ѳ��ȹͤ���줿������˲������ֽ�λ���ο�¡�����н��̤ι��ͤ��νŤ����ͤ˵��������Ѳ��ȹͤ���줿���ޤ����������̤�100�����300 mg/kg���ǹ��ͤ������̤˴�Ϣ�����Ѳ��Ǥ��뤳�Ȥ����︳ʪ����Ϳ�αƶ����������줿���������������������Ǥ��ä���Ӯ��5���λ��300 mg/kg���ǿ�¡����ӿ�¡���̤ι��ͤ��︳ʪ����Ϳ�αƶ�������줿��
�������ظ�����ǧ���줿��������������������ΰ����Dz���������ǧ�Ǥ��ʤ��ä���������¾���Ѳ��ϲ������Ƥ�����
���ʾ�Τ��Ȥ��顤O,O'-�������른����������30 mg/kg/day�ʾ����Ϳ�ˤ���ͺ��ή����˷���������ƥ顼�������ͤ�ǧ���줿���������äơ��ܻ��ﲼ�ˤ�����O,O'-�������른����������ȿ����Ϳ�ˤ��̵�ƶ��̤ϻ�ͺ�Ȥ�˳�ǧ�Ǥ���30 mg/kg/day̤����Ƚ�Ǥ��줿��
��ʿ������������Ӹ���ǽ���︳ʪ����Ϳ�αƶ���ǧ����ʤ��ä���300 mg/kg����ǥ������Ω��Ƚ�ꤵ�줿ͺ2��ˤĤ��ơ������ȿ��ظ���������˥���ȥ��˦�ζ�˦����������Τˤ�����ɹ�������Ҹ�������Ӻ�˦�Ķ��νи����ѻ����졤1��Ǥ϶ɽ�Ū�ǤϤ��ä������ٴɤΰ�̤�ȼ�äƤ������Ȥ��餳�����Ѳ���ǥ������Ω�����ʤ��ä������Ǥ���ȿ仡���줿��Ʊ���Ǥ����ҤΤ��Ȥ����餫������������ǧ����Ƥ��ꡤ�������ֽ�λ����������ꥻ��ȥ��˦�ζ�˦�����ʤ�Ǥ������Ȥ�����Ϳ���֤α�Ĺ��ȼ��ǥ�������㲼�����Τȹͤ���줿��
��ʬ�ڻ��ѻ��Ǥϡ�ʬ�ھ��֤ΰ۾�Ϥ��������Ϳ���Ǥ�ǧ����ʤ��ä����������γ�ɽ���������Ӯ��4����˶���Ǥϰ۾��ǧ����ʤ��ä���300 mg/kg���ǿ�������Ӯ��4�����ν����ä��������졤��������4������¸Ψ�ˤ�ͭ�դ����ͤ�ǧ���졤�︳ʪ����Ϳ�ˤ�뿷������ȯ���˳����������줿��
����¾��ǥ�����֡�ǥ�����ο�������徲���ˤ��︳ʪ����Ϳ�αƶ���ǧ���줺���л��������л������������椪��ӽл�Ψ�ˤ�ƶ���ǧ����ʤ��ä���
���ʾ�Τ��Ȥ��顤O,O'-�������른��������������ǽ�˵ڤܤ��ƶ���100�����300 mg/kg/day��Ϳ������������ǧ���줿���Ȥ���ͺ��̵�ƶ��̤�30 mg/kg/day�����300 mg/kg/day��Ϳ�Ǥ�ƶ���ǧ���줺300 mg/kg/day��Ƚ�Ǥ��줿����ưʪ��ȯ����ȯ��˵ڤܤ��ƶ���300 mg/kg/day��Ϳ�ǻ�������4������¸Ψ��ͭ�դ����ͤ����Ӯ��4�����ν�����������ǧ���졤̵�ƶ��̤�100 mg/kg/day��Ƚ�Ǥ��줿��
| 1) | �ⶶƻ��(��):����������ɾ���Τ�������ٴɥ��ȥ饹�����եȥ������ҡ����(1994)pp.15-20�� |
| 2) | Snedecor GW, Cochran WG:��Statistical Methods��, 8th ed., Iowa State University Press, Ames(1989) pp.251-252�� |
| 3) | Yoshida M:Exact probabilities associated with Tukey's and Dunnett's multiple comparisons procedures in imbalanced one-way ANOVA. Japanese Soc Comp Stat, 1:111-122(1988). |
| 4) | Steel RGD:A multiple comparison rank sum test: Treatments versus control. Biometrics, 15: 560-572(1959). |
| 5) | Hollander M, Wolfe DA: Nonparametric Statistical Methods, Second edition, John Wiley & Sons, New York(1999)pp.124-129�� |
| 6) | ��������������ɿ��ʲ��زݴƽ�:�ֿ�����λ�α�����ˤ���������ɾ���θ�§����ˡ�����ܿ��ʱ����������(1998)pp.65-66�� |
| 7) | ���ܥȥ������������ز�Ѱ����Խ�:�֥ȥ�������������ī�ҽ�Ź�����(2002)pp.116-117. |
| Ϣ���� | |||
| ���Ǥ��: | ����μ�� | ||
| �ô����: | �ڸ�μ�ҡ����������ҡ��������̡����ڰ����ҡ��Ҹ����顤���Ŀ������ֲ��ػˡ�����α���ҡ����桡�� | ||
| 7�����������ʰ�����ɾ������ | |||
| ��437-1213���Ų������ķ�ʡ��Į�����Ļ�����582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | |||
| Authors: | Ryota Tanaka(Study director) Ryoko Kido, Kumiko Masuyama, Tomomichi Moriyama, Asako Tsuneki, Takechi Makihara, Maki Sibata�� Atsushi Shiga, Rumiko Miyajima, Kiyoshi Imai | ||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-Pyo Center) | |||
| 582-2 Shioshinden Arahama, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan | |||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | ||