5-エチリデン-2-ノルボルネンのラットを用いる経口投与簡易生殖毒性試験
Preliminary Reproduction Toxicity Screening Test of
5-Ethylidene-2-norbornene by Oral Administration in Rats
要約
5-エチリデン-2-ノルボルネンは,高分子ゴム改質剤,塗料,接着剤などの製造に使用されている1).毒性に関する情報としては,ラットの経口投与によるLD50値は2527 mg/kg2)で,皮膚や粘膜に刺激性を有する報告3)などがあるが,生殖発生毒性については知られていない.今回,SDラット(1群雌雄各12匹)に4,20および100 mg/kgの用量を交配前14日から交配を経て雄は計45日間,雌は妊娠,分娩を経て哺育3日まで経口投与し,反復投与毒性および生殖発生毒性について検討した.
1. 反復投与毒性
100 mg/kg群において,雄で死亡が投与25および36日にそれぞれ1例認められ,雌雄とも投与開始後7日から剖検時まで体重増加の抑制および摂餌量の減少が認められた.また,雄では肝臓の相対重量の増加および暗褐色化がみられ,病理組織学的には小葉中心性肝細胞肥大および肝細胞の空胞化などが認められた.
2. 生殖発生毒性
親動物では,100 mg/kg群において,交尾率,受胎率,出産率,黄体数,分娩状態および哺育行動には被験物質に起因する変化は認められなかったが,妊娠期間の延長,着床数の低値傾向,着床率および分娩率の減少が認められた.
児動物では,100 mg/kg群において,総出産児数,出産生児数および哺育4日の生児数に低値が認められた.
その他,性比,出生率,新生児の4日の生存率,剖検所見および外表に被験物質に起因する変化は認められなかった.
以上の結果より,5-エチリデン-2-ノルボルネンの反復投与毒性に関する無影響量は雌雄とも20 mg/kg/day,生殖発生毒性に関する無影響量についても親動物および児動物ともに20 mg/kg/dayと考えられた.
方法
1. 被験物質
5-エチリデン-2-ノルボルネン[(株)サン・ペトロケミカル,茨城,Lot No. 7K03,純度99.5 %]は,融点-80℃以下,沸点147℃,蒸気圧6 mmHg/25℃,水との反応性はなく,320℃以上で異常発熱し,光で着色,水に0.01 g以下/100 g(25℃)溶解し,有機溶剤に易溶の不快臭がある無色透明な液体である.被験物質は酸化劣化を防止するため窒素シールを行い,密閉,冷蔵,遮光下で保管した.なお,被験物質は試験期間中安定であったことが確認された.被験物質はコーン油に溶解させ,投与に供するまで冷蔵・遮光保存し,調製後8日以内に使用した.投与開始前に投与液中の被験物質の調製後8日間の安定性および濃度を確認した.
2. 試験動物および飼育条件
日本チャールス・リバー(株)から入手した雌雄のSDラット[Crj:CD(SD)IGS]を6日間検疫・馴化後,試験に供した.投与開始前日に体重別層化無作為抽出法により,1群につき雌雄各12匹を振り分けた.投与開始時の週齢は雌雄とも9週齢,体重範囲は雄が320〜356 g,雌が203〜237 gであった.
検疫・馴化期間を含めた全飼育期間中,温度22±2℃,湿度55±15 %,換気約12回/時,照明12時間/日(7:00〜19:00)に設定した飼育室を使用した.動物は実験動物用床敷(ベータチップ:日本チャールス・リバー(株))を敷いたポリカーボネート製ケージに,群分け後は1匹,交配期間は雌雄各1匹,哺育期間は1腹で収容し,飼育した.
動物には,オートクレーブ滅菌した実験動物用固型飼料(CRF-1:オリエンタル酵母工業(株))および孔径5 μmのフィルターで濾過後,紫外線照射した水道水をそれぞれ自由に摂取させた.
3. 投与量および投与方法
SDラットの雌雄を用いて,被験物質を30,100および300 mg/kgの用量で14日間経口投与した結果,100 mg/kg以上の群の雌雄で体重の増加抑制あるいは減少,肝臓重量の増加がみられ,さらに300 mg/kg群では摂餌量の減少も認められた.以上の結果から,本試験では高用量を100 mg/kgとし,以下公比5で中用量を20 mg/kg,低用量を4 mg/kgとした.また,媒体(コーン油)のみを投与する対照群を設けた.
投与期間は,雌雄とも交配前14日間,交配期間および雄は剖検前日までの計45日間,雌は交尾成立後,妊娠,分娩を経て哺育3日(交尾確認日を妊娠0日,分娩確認日を哺育0日とする)までの計40〜45日間とし,テフロン製胃ゾンデを用いて1日1回,午前中に強制経口投与した.投与液量は5 mL/kgとし,至近測定日の体重を基に算出した.
4. 反復投与毒性に関する観察・検査
1) 一般状態
全例について生死,外観,行動等を投与前および投与後に毎日観察した.
2) 体重および摂餌量
体重は,雌雄とも投与開始日,投与開始後3,7,14日およびその後は週1回,交尾した雌は妊娠0,7,14,20日および哺育0,4日に測定した.また,雄では投与開始日の体重を基準に,雌では交配前期間,妊娠期間,哺育期間について,それぞれ投与開始日,妊娠0日,哺育0日の体重を基準に体重増加量を算出した.摂餌量は,交配期間を除き体重測定日に測定した.
3) 病理学検査
雌雄とも最終投与日の翌日に,全生存動物についてペントバルビタールナトリウムの腹腔内投与による麻酔下で腹大動脈の切断・放血により安楽死させて剖検し,肝臓,精巣および精巣上体の重量を測定した.また,解剖日の体重を基に相対重量(対体重比)を算出した.さらに,これらの器官に加えて,精のう,前立腺,卵巣,子宮,膣,全新生児が死亡した母動物の乳腺および肉眼的異常部位を採取し,10 %中性リン酸緩衝ホルマリン液で固定後保存した.ただし,死亡動物以外の精巣および精巣上体はブアン液で固定した.
病理組織学検査は,雌雄の対照群および100 mg/kg群の肝臓,精巣および精巣上体,全動物の肉眼的異常部位,非妊娠雌の卵巣について,常法に従いヘマトキシリン・エオジン染色標本を作製して鏡検した.なお,雄の肝臓で被験物質に起因する変化が認められたため,4および20 mg/kg群の雄の肝臓についても検査した.また,100 mg/kg群の代表例の肝臓は脂肪(オイルレッドO)染色標本を作製し,鏡検した.
5.生殖発生毒性に関する観察・検査
1) 生殖機能
交配前の投与期間終了後,各群内で雄1雌1の交配対を設け,昼夜同居させ,毎日午前中に雌の膣垢を採取し,ギムザ染色して鏡検した.膣栓形成あるいは膣垢標本中に精子が認められた場合を交尾成立とし,その日を妊娠0日とした.交尾した対は雌雄を分離し,以後の検査に供した.これらの結果から,交尾所要日数(交配開始後,交尾成立までに要した日数),交尾成立までに逸した発情期の回数,交尾率[(交尾動物数/同居動物数)×100],受胎率[(受胎動物数/交尾動物数)×100]を算出した.
2) 分娩・哺育状態
交尾が確認された雌は全例を自然分娩させ,分娩状態を観察した.午前9時の時点で分娩が完了している動物を当該日分娩とし,その日を哺育0日とした.その後,新生児を生後4日(哺育4日)まで哺育させ,授乳,営巣,食殺の有無等の哺育状態を毎日観察した.
母動物は,哺育4日の剖検時に卵巣,子宮を摘出し,黄体数および着床数を検査した.分娩しなかった雌は交尾確認後26日に剖検し,肉眼的に着床が認められない動物の子宮は10 %硫化アンモニウム水溶液に浸漬して着床の有無を確認した.これらの結果から,妊娠期間(妊娠0日から出産が確認された日までの期間),出産率[(生児出産雌数/受胎雌数)×100],着床率[(着床数/黄体数)×100],分娩率[(総出産児数/着床数)×100]を算出した.
3) 新生児の観察・検査
(1) 新生児の観察
哺育0日に出産児数(出産生児数,死産児数),性別および外表異常の有無を検査した.その後,一般状態,死亡の有無を哺育4日まで毎日観察した.哺育0および4日の生存児数から出生率[(出産生児数/総出産児数)×100],新生児の4日の生存率[(哺育4日生児数/出産生児数)×100]を算出した.
(2) 体重
哺育0および4日に全生存児を個体ごとに測定した.また,哺育0日の体重を基準に体重増加量を算出した.
(3) 剖検
哺育4日に全生存児の口腔を含む外表を検査した後,親動物と同様にして安楽死させ,剖検した.死亡動物は食殺等で検査に耐えないものを除き,10 %中性リン酸緩衝ホルマリン液に浸漬・固定後,実体顕微鏡下で剖検した.
6. 統計解析
計量データについては,パラメトリックデータはBartlett法による等分散性の検定を行い,分散が一様の場合は一元配置分散分析を行った.分散が一様でない場合およびノンパラメトリックデータはKruskal-Wallisの検定を行った.群間に有意な差が認められた場合はDunnett法またはDunnett型の多重比較を行った.計数データのうち,病理組織所見はa×bのχ^2検定を行い,有意差が認められた場合はArmitageのχ^2検定により対照群と各被験物質投与群間の比較を行った.その他の計数データはFisherの直接確率法により検定した.有意水準は5 %とし,新生児に関するデータは各母動物ごとに算出した平均値を標本単位とした.
結果
1. 反復投与毒性
1) 死亡動物
死亡が,100 mg/kg群の雄で投与開始後25日および36日にそれぞれ1例認められた.
2) 一般状態
投与直後の流涎が100 mg/kg群の雌雄で投与開始後16日以降から投与終了時まで数例に散見されたが,いずれも投与後約30分には回復したことや被験物質が皮膚や粘膜に対し刺激性を有することが知られている3)ことなどから,被験物質の物理化学的な刺激作用によって生じたものと思われ,反復投与による毒性を示唆する変化ではないと考えられた.その他,前肢の脱毛が対照群,4および20 mg/kg群で散見されたが,100 mg/kg群で認められなかったことから,被験物質との関連はないと判断した.
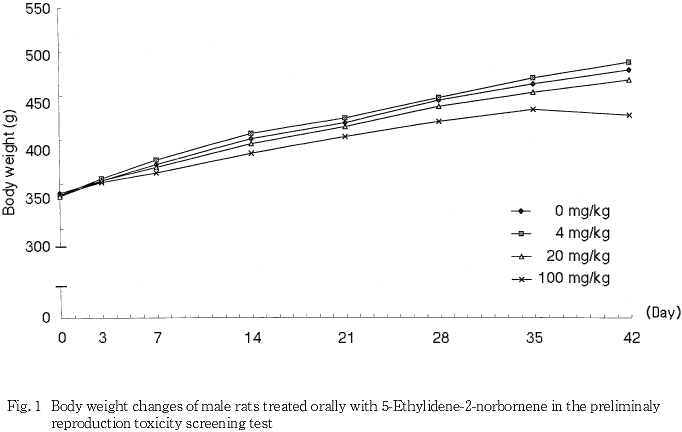
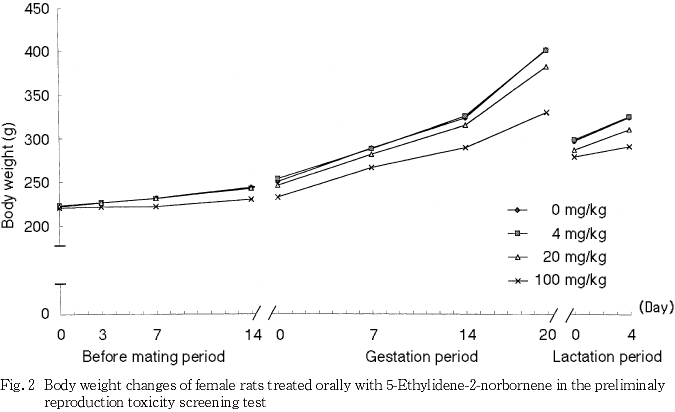
3) 体重(Fig. 1, 2)
100 mg/kg群の雌雄で投与開始後7日から剖検時まで体重増加の抑制がみられ,体重および体重増加量に対照群と比較して有意な差が散見された.その他,4 mg/kg群の雄で投与開始後7日の体重増加量が対照群と比較して有意な高値を示したが,以降は有意な変化は認められなかった.
4) 摂餌量
100 mg/kg群の雌雄で投与開始後7日から剖検時まで摂餌量の減少がみられ,対照群と比較して有意な差が散見された.4および20 mg/kg群の雌雄では対照群との間に有意な差は認められなかった.
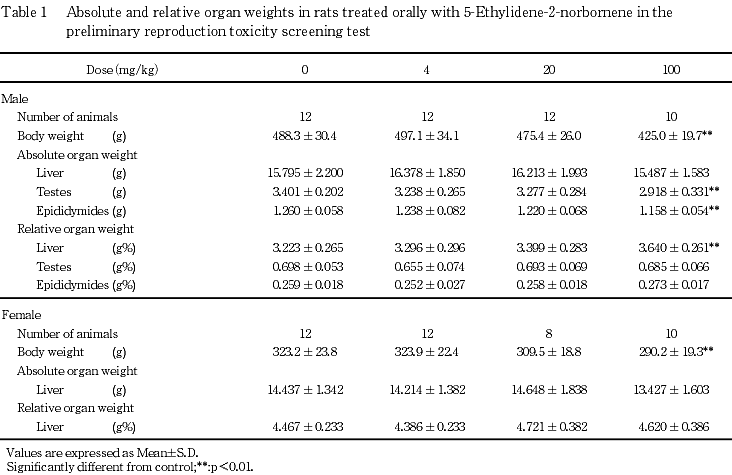
5) 器官重量(Table 1)
100 mg/kg群の雄で肝臓の相対重量の高値,精巣および精巣上体の絶対重量の低値がみられ,それぞれ対照群と比較して有意な差を示した.雌の肝臓では,対照群と被験物質投与群との間に有意な差は認められなかった.4および20 mg/kg群の雌雄ではいずれの器官においても対照群との間に有意な差は認められなかった.
6) 剖検所見
投与期間終了時の動物では,100 mg/kg群の雄9例に肝臓の暗褐色化がみられ,このうち2例で肝臓表面の顆粒状化およびフィブリンの析出が認められ,さらに,1例では葉間の癒着を伴っていた.また,100 mg/kg群の雌雄各1例に心室の拡張,胸腺および肺の水腫,雄1例に胸腺の出血点および肺の褐色化が認められた.その他,対照群および4 mg/kg群で肝横隔膜面結節および片側精巣表面の出血点などが散発的に認められたが,100 mg/kg群で認められなかったことから,被験物質との関連はないと判断した.
死亡した動物では,2例に肺および肝臓のうっ血がみられ,1例に胸腺の白濁および出血点が認められた.なお,20 mg/kg群で全新生児が死亡した母動物には異常は認められなかった.
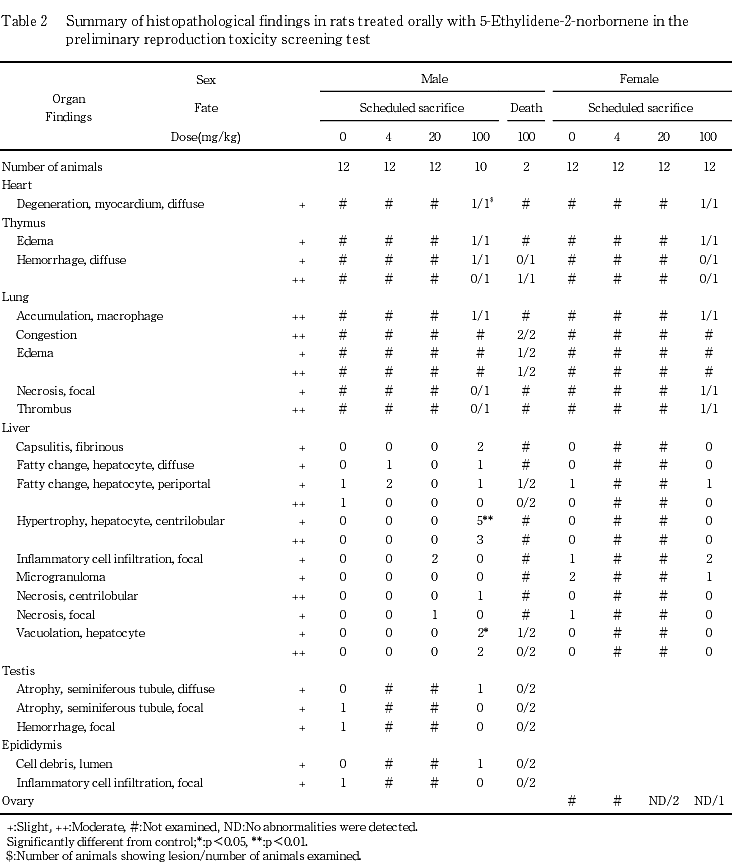
7) 組織所見(Table 2)
被験物質に起因する変化が100 mg/kg群の雄の肝臓で認められた.投与期間終了時の動物では,雄の100 mg/kg群の8例に小葉中心性肝細胞肥大,4例に小葉中心部から中間帯の肝細胞の空胞化,2例に線維素性肝皮膜炎,1例に小葉中心性肝細胞壊死が認められ,肥大肝細胞はくもり硝子様を呈していた.また,代表例の肝臓に対する脂肪染色標本で上述の空胞の大部分は白く抜けてみえたが,一部に陽性の微小滴状物を含む空胞も認められた.
剖検時に心臓,胸腺および肺に肉眼的変化の認められた100 mg/kg群の雌雄各1例では,心筋線維のび漫性変性,胸腺間質の水腫,肺胞内マクロファージの集積が共通してみられ,さらに,雄1例に胸腺のび漫性出血,雌1例に肺の巣状壊死と血栓が認められた.
100 mg/kg群の死亡例では,1例に肝臓の小葉中間帯肝細胞の空胞化,2例に肺のうっ血と水腫,1例に胸腺のび漫性出血が認められた.
その他,対照群を含む各群で肝臓における肝細胞の脂肪化,炎症性細胞浸潤,小肉芽腫および巣状壊死,精巣の精細管萎縮および巣状出血,精巣上体管内の変性精細胞および炎症性細胞浸潤などが散発的に認められたが,100 mg/kg群で多発する傾向は認められなかったことから,被験物質との関連はないと判断した.なお,非妊娠動物の卵巣には異常は認められなかった.
2. 生殖発生毒性
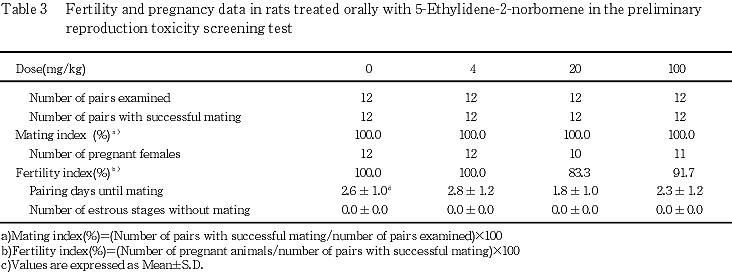
1) 生殖機能(Table 3)
交尾は各群の全例で成立し,交尾率,交尾所要日数,交尾成立までに逸した発情期の回数および受胎率とも対照群との間に有意な差は認められなかった.
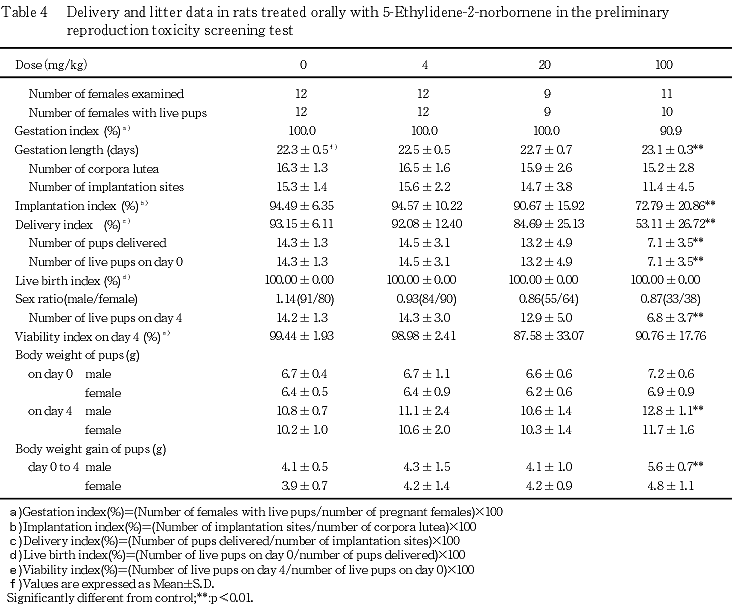
2) 分娩・哺育状態(Table 4)
100 mg/kg群の妊娠期間が対照群と比較して有意な延長を示したが,分娩状態に異常は認められなかった.また,100 mg/kg群の黄体数に変化はみられなかったが,着床率,総出産児数および分娩率に対照群と比較して有意な低値が認められた.100 mg/kg群の着床数(11.4)には有意な差はみられなかったが,対照群(15.3)ならびに当研究所の背景データ(平均16.0,最小-最大15.0-17.8,1991-1996年)と比較して低値の傾向であった.
哺育状態では,20 mg/kg群の1例で哺育2日に全新生児の死亡がみられたが,他の被験物質投与群で全新生児の死亡が多発する傾向はみられなかったことから,被験物質との関連はないと判断した.その他,対照群を含む各群いずれの母動物にも哺育行動に異常は認められなかった.
3) 新生児に及ぼす影響
(1) 生存率(Table 4)
100 mg/kg群の総出産児数,出産生児数および哺育4日の生児数に対照群と比較して有意な低値が認められた.その他,性比,出生率および新生児の4日の生存率に被験物質投与群と対照群との間に有意な差は認められなかった.
(2) 外表および一般状態
対照群を含む各群の新生児の外表および一般状態に異常は認められなかった.
(3) 体重(Table 4)
雄では,100 mg/kg群で哺育0日の体重に有意な差はみられないが高値の傾向がみられ,哺育4日の体重および体重増加量に対照群と比較して有意な高値が認められた.雌では,対照群と被験物質投与群との間に有意な差は認められなかった.
(4) 剖検
哺育4日の生存児では,20 mg/kg群の1腹の3例に膀胱結石がみられたが,被験物質投与群に多発する傾向はみられなかったことから,被験物質との関連はない変化と判断した.その他,対照群を含む各群の死亡児に異常は認められなかった.
考察
1. 反復投与毒性
反復投与による影響について,雌雄とも100 mg/kg群で投与開始後7日から剖検時まで体重増加の抑制および摂餌量の減少が認められた.また,100 mg/kg群の雄では肝臓の相対重量の増加および暗褐色化などがみられ,病理組織検査では小葉中心性肝細胞肥大が主要な変化として認められ,肥大肝細胞はくもり硝子様変化を示した.この様な組織像は一般に種々の化学物質の投与によって薬物代謝酵素が誘導された場合に発現する生体の適応反応と考えられており4-5),また,同様の変化が同被験物質のラットを用いた吸入暴露試験6)においても認められていることから,被験物質による同質の変化と思われる.これに対し肝細胞の空砲化は適応の範囲を越えた細胞障害性の変化であり,被験物質の影響がより強く現れた結果と推察される.なお,100 mg/kg群の生存例の雌雄各1例にみられた心筋線維の変性を伴った心室の拡張,胸腺間質の水腫,肺胞内マクロファージの集積および雄2例の死亡例にみられた肺のうっ血と水腫などから被験物質の全身循環への影響も考えられるが,一部の例にのみ限られており,その詳細は不明であった.
2. 生殖発生毒性
親動物の検査において,100 mg/kg群で黄体数に変化は認められなかったが,着床数の低値傾向,着床率および総出産児数の減少がみられ,着床数に対する総出産児数の割合である分娩率が53.11 %と減少した.総出産児数の減少は着床前および着床後の死亡胚の増加が原因と考えられ,被験物質による胚・胎児への影響が推察される.
100 mg/kg群で妊娠期間が23.1日と有意な延長を示したが,当研究所の背景データ(平均22.4日,最小-最大21-23日,1991-1996年)と比較して正常範囲内のわずかな変動で,分娩状態に異常は認められなかった.産児数の少ないものは分娩が遅れるという傾向は従来から知られている7)ことから,100 mg/kg群の妊娠期間のわずかな延長は,出産児数が対照群の約半数の6.5と減少したことも一因と考えられる.さらに,新生児の観察で出産児数と哺育4日の生児数の減少,哺育0および4日の出生児の体重の高値がみられたが,出産児数と児体重とは逆相関関係がある7)ことから,出産児の体重の高値は出産児数の減少が原因と考えられる.なお,死産児数や出生率,新生児の4日の生存率,剖検所見および外表に異常は認められなかったことから,被験物質による出生後の新生児の成長には影響ないものと考えられる.
以上のように,本試験では反復投与による一般毒性学的影響として,100 mg/kg群で雄2例が死亡し,雌雄で体重増加の抑制および摂餌量の減少,雄で肝臓の重量の増加ならびに肝細胞の肥大および空砲化などが認められたことから,本試験条件下における反復投与毒性に関する無影響量は雌雄とも20 mg/kg/dayと判断される.また,生殖に及ぼす影響として,100 mg/kg群で妊娠期間の延長,総出産児数,分娩率および着床率の低下などが認められたことから,親動物および児動物の無影響量は20 mg/kg/dayと判断される.
文献
| 1) | 化学工業日報社編"新化学インデックス1994,"化学工業日報社,東京,1993, p. 91. |
| 2) | Registry of Toxic Effects of Chemical Substances 1985-86 Edition Vol.1. |
| 3) | B. Ballantyne, et al., J. Appl.Toxicol., 17(4), 211(1997). |
| 4) | C. Gopinath, D. E. Prentice and D. J. Lewis, "Atlas of Experimental Toxicological Pathology," eds. by C. Gopinath, D. E. Prentice and D. J. Lewis, MTP Press, Lancaster, 1987, pp. 43-60. |
| 5) | J. A. Popp and R. C. Cattley, "Handbook of Toxicologic Pathology," eds. by W. M. Haschek, C. G. Rousseaux, Academic Press, San Diego, 1991, pp. 279-314. |
| 6) | B. Ballantyne, et al., J. Appl. Toxicol., 17(4), 197(1997). |
| 7) | 泉水直人,梅村建夫,水野秀夫,家畜繁殖誌,20(4), 125(1975). |
| 連絡先 |
| 試験責任者: | 東川国男 |
| 試験担当者: | 青山涼子,土谷 稔,鈴木美江 |
| (株)三菱化学安全科学研究所鹿島研究所 |
| 〒314-0255 茨城県鹿島郡波崎町砂山14 |
| Tel 0479-46-2871 | Fax 0479-46-2874 | |
| Correspondence |
| Authors: | Kunio Higashikawa(Study director)
Ryoko Aoyama, Minoru Tsuchitani,Yoshie Suzuki |
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory |
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-0255, Japan. |
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | |






