2-ペンチルアントラキノンのチャイニーズ・ハムスター肺由来細胞(CHL/IU細胞)を用いる染色体異常試験を実施した.
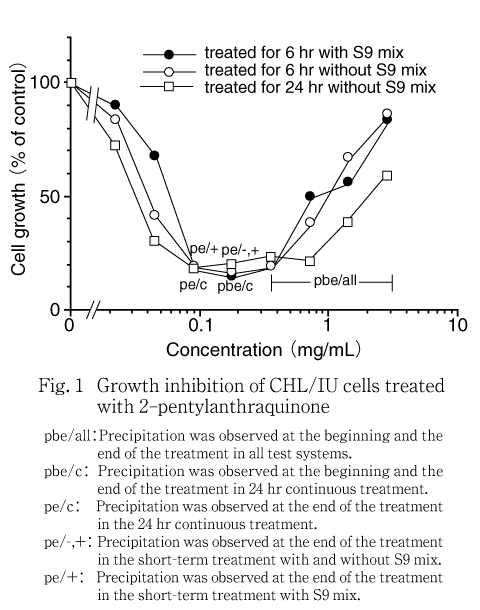
S9 mix非存在下および存在下で短時間処理(6時間処理後18時間の回復時間)および24時間連続処理(S9 mix非存在下)で,濃度に依存して急激に増殖率が低下した.50 %の増殖抑制濃度はそれぞれ0.040 mg/mL,0.060 mg/mLおよび0.034 mg/mLと推定された.
これらの結果に基づき,S9 mix非存在下および存在下の短時間処理ともに,50 %増殖抑制濃度の約1.5倍の濃度を最高処理濃度とし,公比1.5で5段階の濃度群(S9 mix非存在下:0.012〜0.060 mg/mL,S9 mix存在下:0.018〜0.090 mg/mL)を設定し,染色体異常試験を実施した.
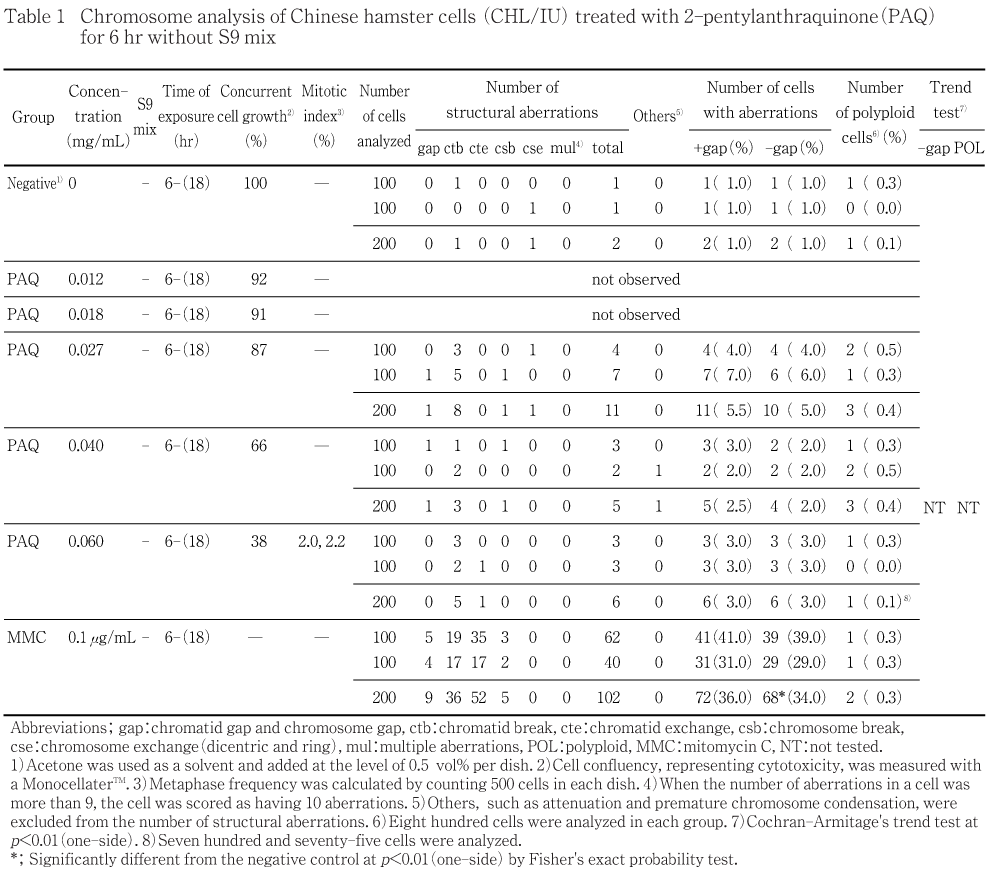
細胞増殖率および分裂指数より,S9 mix非存在下および存在下ともに0.027,0.040,0.060 mg/mLの3濃度について染色体分析を行った.
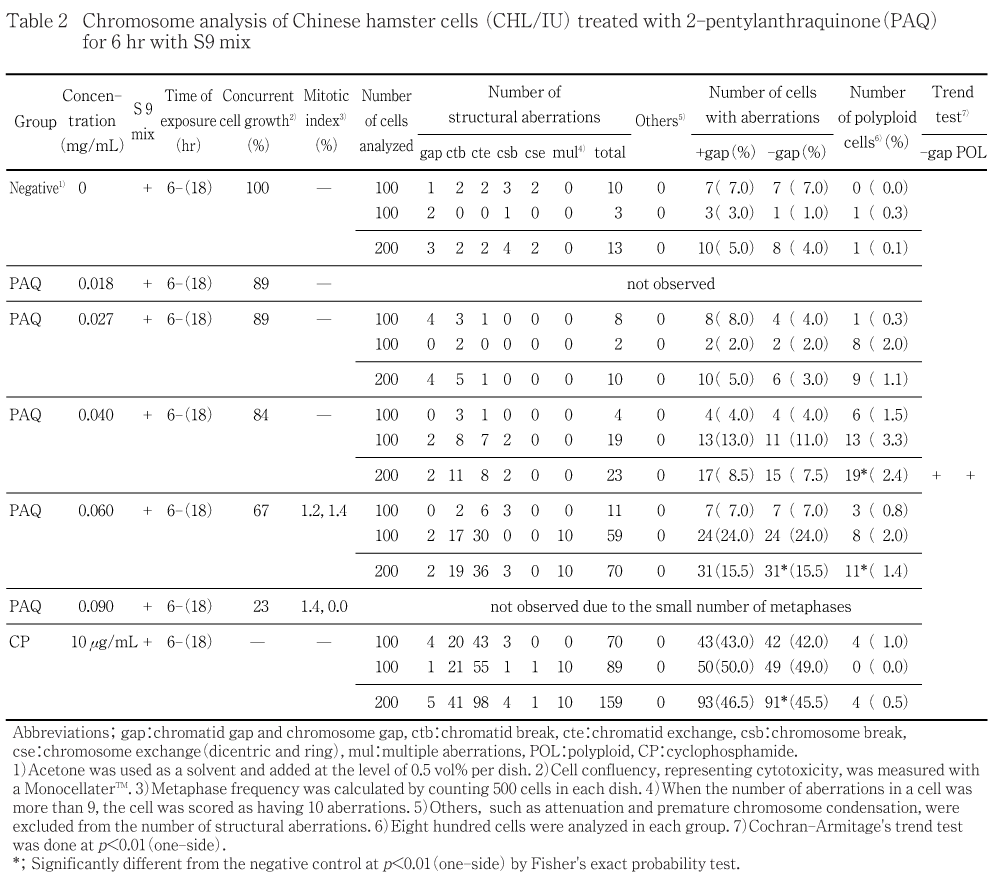
その結果,S9 mix非存在下で短時間処理した場合は,染色体の構造異常を有する細胞および倍数性細胞の統計学的な有意差は認められなかった.一方,S9 mix存在下で短時間処理した場合においては,濃度に依存して構造異常を有する細胞が増加し,高濃度群(0.060 mg/mL)において,統計学的な有意差が認められた(15.5 %).また倍数性細胞については中濃度群(0.040 mg/mL)および高濃度群(0.060 mg/mL)で倍数性細胞の統計学的な有意差が認められた(2.4 %および1.4 %).
以上の結果より,2-ペンチルアントラキノンは,本試験条件下でCHL/IU細胞に染色体異常を誘発する(陽性)と結論した.
CHL/IU細胞はチャイニーズ・ハムスター,肺由来で,リサーチ・リソースバンク(JCRB)から入手(1988年2月,入手時:継代4代,現在23代)した.試験には,解凍後継代10代以内で試験に用いた.仔牛血清(CS,Cansera International)を10 vol%添加したイーグルMEM(日水製薬)培養液を用い,CO2インキュベーター(37℃,5 % CO2)内で培養した.
S9(キッコーマン)は,フェノバルビタールと5,6-ベンゾフラボンを投与した雄Sprague-Dawley系ラットの肝臓から調製したものを購入し,S9 mixは使用時に調製した。各成分の最終濃度はS9 5 vol%,グルコース-6-リン酸(Sigma Chemical)0.83 mmol/L,b-ニコチンアミドアデニンジヌクレオチドリン酸(オリエンタル酵母工業)0.67 mmol/L,MgCl2 0.83 mmol/L,KCl 5.5 mmol/L,HEPES緩衝液(pH 7.2)0.67 mmol/Lとした.
被験物質である2-ペンチルアントラキノン 〔ロット番号:01-13001-50,山本化成(福岡)〕は純度:98.6 %(GC,不純物としてフリーアントラセン0.5 %を含む),淡黄色固化固体である.被験物質は使用時まで密閉容器に入れ,冷蔵(2〜8℃)で保管した.また,被験物質は実験期間中安定であったことが,被験物質提供者において確認された.
被験物質は用時調製して試験に用いた.溶媒はアセトン(和光純薬工業)を用いて原液を調製した(細胞増殖抑制試験では560 mg/mL,染色体異常試験では18 mg/mL).ついで原液を溶媒で順次希釈して所定の濃度の被験物質調製液を作製した.被験物質調製液は,すべての試験において培養液の0.5 vol%になるように加えた.なお,被験物質を溶媒に溶解させた際,発熱,発泡,変色などの変化はなかった.
陽性対照群については,S9 mix非存在下および存在下の短時間処理では,マイトマイシンC(MMC,協和醗酵工業)およびシクロホスファミド(CP,Sigma Chemical)溶液を日局注射用水(大塚製薬工場)で調製し,最終濃度がそれぞれ0.1 μg/mLおよび10 μg/mLとなるように添加した.
4×10^3個/mLのCHL/IU細胞懸濁液をディッシュ(直径6 cm)あたり5 mL(2×10^4個)加え,CO2インキュベーター内で3日間培養した.その後,短時間処理では,血清入りの培地によりS9 mix非存在下および存在下で6時間処理し,リン酸緩衝塩類溶液で洗浄,新鮮な培養液でさらに18時間培養した.また,連続処理では,新鮮培地と交換後,被験物質を加え,24時間処理した.
染色体異常試験に用いる被験物質の処理濃度を決定するため,被験物質の細胞増殖におよぼす影響を調べた.
いずれの処理条件においても,2.8 mg/mL(10 mmol/L)を最高処理濃度とし,0.022〜2.8 mg/mLの濃度範囲(公比2,8濃度)で処理を行い,各用量2枚のディッシュを用いた.なお,処理開始時において,短時間処理した場合には0.35 mg/mL以上の濃度で,連続処理した場合には0.18 mg/mL以上の濃度で肉眼観察による沈殿が認められた.処理終了時にはS9 mix非存在下で短時間処理した場合,0.18 mg/mL以上,S9 mix存在下で短時間処理した場合および24時間連続処理した場合には,0.088 mg/mL以上で肉眼観察による沈殿が認められた.
培養終了後,10 vol%ホルマリン溶液で細胞を固定し,0.1 %クリスタルバイオレット液で染色した.単層培養細胞密度計(MonocellaterTM,オリンパス販売)を用い,溶媒を添加した陰性対照群と比較した各処理群の相対増殖率を計測した.処理系列は陰性対照群と被験物質処理群とした.
その結果,S9 mix非存在下および存在下で短時間処理した場合には,50 %の増殖抑制濃度はそれぞれ0.040 mg/mLおよび0.060 mg/mLと推定された(Fig. 1).また,24時間連続処理した場合,50 %の増殖抑制濃度は0.034 mg/mLと推定された(Fig. 1).

細胞増殖抑制試験の結果より,S9 mix非存在下および存在下の短時間処理ともに,50 %増殖抑制濃度の約1.5倍の濃度を最高処理濃度とし,公比1.5で5段階の濃度群(S9 mix非存在下:0.012,0.018,0.027,0.040,0.060 mg/mL,S9 mix存在下:0.018,0.027,0.040,0.060,0.090 mg/mL)を設定した.
染色体異常試験においては,各用量4枚のディッシュ(陽性対照群では2枚)を用いた.陽性対照群以外では2枚のディッシュを用い染色体標本を作製し,別の2枚については単層培養細胞密度計により細胞増殖率を測定した.処理系列は陰性対照群,陽性対照群および被験物質処理群とした.
培養終了の2時間前に,コルセミドを最終濃度が0.1 μg/mLになるように培養液に加えた.染色体標本の作製は常法に従って行った.スライド標本は各ディッシュにつき6枚作製した.作製した標本は3 vol%ギムザ溶液で染色した.
細胞増殖率と分裂指数を細胞毒性の指標として,20 %以上の相対増殖率で,かつ2ディッシュともに0.5 %以上の分裂指数を示した最も高い濃度を観察対象の最高濃度群とし,観察対象の3濃度群を決定した.その結果(Table 1,2),観察可能な最高濃度は,S9 mix非存在下および存在下の短時間処理ともに0.060 mg/mLであったことから,この濃度を高濃度群として3濃度群を観察対象とした.
作製したスライド標本のうち,1つのディッシュから得られた異なるスライドを,4名の観察者がそれぞれ処理条件が分からないようにコード化した状態で分析した.染色体の分析は,日本環境変異原学会・哺乳動物試験分科会(MMS)1)による分類法に基づいて行い,染色体型あるいは染色分体型のギャップ,切断,交換などの構造異常の有無と倍数性細胞(染色体数が38本以上)の有無について観察した.また構造異常については1群200個,倍数性細胞については1群800個の分裂中期細胞を分析した.
染色体異常(ギャップを除く)を有する細胞の出現頻度について,陰性対照群と被験物質処理群および陽性対照群間でフィッシャーの直接確率法 2)により,有意差検定を実施した(p<0.01,片側).また,フィッシャーの直接確率法により有意差が認められた群を有する処理条件については,用量依存性に関してコクラン・アーミテッジの傾向性検定 3) (p<0.01,片側)を行った.これらの検定結果を参考とし,生物学的な観点からの判断を加味して染色体異常誘発性の評価を行った.
2-ペンチルアントラキノンをS9 mix非存在下で短時間処理した場合,いずれの濃度群においても染色体の構造異常を有する細胞および倍数性細胞の統計学的な有意差は認められなかった(Table 1).なお,高濃度群(0.060 mg/mL)では強い増殖抑制のために800個の分裂中期細胞について倍数性細胞の分析を行うことが出来なかった.一方,S9 mix存在下で短時間処理した場合には,濃度に依存して染色体の構造異常を有する細胞の出現率が増加し,高濃度群(0.060 mg/mL)では統計学的に有意な増加(15.5 %)が認められ,陽性の結果が得られた(Table 2).また,倍数性細胞についても,中濃度群(0.040 mg/mL)および高濃度群(0.060 mg/mL)で統計学的に有意な増加(それぞれ2.4 %および1.4 %)が認められ,陽性の結果が得られた(Table 2).なお,2-ペンチルアントラキノンにより誘発された倍数性細胞には,核内倍加した細胞が多く観察された.
陽性の結果が得られたS9 mix存在下の短時間処理についてD20値 4)を求めたところ,構造異常については0.098 mg/mLとなった.倍数性細胞については0.76 mg/mLとなったが,染色体分析を行った最高濃度(0.060 mg/mL)の10倍以上の濃度であることから対象外となった.
陽性対照物質として用いたMMCは,S9 mix 非存在下で短時間処理した場合において染色体の構造異常を誘発し(Table 1),CPはS9 mix存在下で短時間処理した場合において染色体の構造異常を誘発した(Table 2).これらの陽性対照物質の結果より,本実験系の成立が確認された.
なお,2-ペンチルアントラキノンについては,当研究所で実施した細菌を用いる復帰変異試験で陽性の結果が得られている5).また,2-ペンチルアントラキノンの基本骨格と考えられるAnthraceneや2-ペンチルアントラキノンのペンチル基がエチル基あるいはアミノ基に置換した2-Ethylanthraquinoneや2-Aminoanthraquinoneについても染色体異常試験で陽性の結果が報告されている6-8).これらのことから,Anthraceneを基本骨格とする化合物は直接あるいは代謝活性化されて染色体異常誘発作用を示すと考えられる.
以上の結果より,2-ペンチルアントラキノンは,本試験条件下でCHL/IU細胞に染色体異常を誘発すると結論した.
| 1) | 日本環境変異原学会・哺乳動物試験分科会(編):「化学物質による染色体異常アトラス」朝倉書店,東京(1988)pp.16-37. |
| 2) | 吉村功(編):「毒性・薬効データの統計解析,事例研究によるアプローチ」サイエンティスト社,東京(1987)pp.76-78. |
| 3) | 吉村功,大橋靖夫(編):「毒性試験講座14,毒性試験データの統計解析」地人書館,東京(1992)pp. 218-223. |
| 4) | 石館基(監修):「微生物を用いる変異原性試験データ集」,エル・アイ・シー,東京(1991)pp.70-71, pp.84-85, pp.234-235, pp.324-325. |
| 5) | 須井哉ら:2-ペンチルアントラキノンの細菌を用いる復帰変異試験.化学物質毒性報告,13:304-308 (2006). |
| 6) | 祖父尼俊雄(監修):「染色体異常試験データ集」改訂1998年版,エル・アイ・シー,東京(1999)p.60. |
| 7) | 中嶋圓ら:2-エチルアントラキノンのチャイニーズ・ハムスター培養細胞を用いる染色体異常試験.化学物質毒性試験報告,8:196-199(2001). |
| 8) | 労働安全衛生法有害性調査精度に基づく既存化学物質変異原性試験データ集,社団法人化学物質安全・情報センター,東京(1986)pp.504-505. |
| 連絡先 | |||
| 試験責任者: | 山影康次 | ||
| 試験担当者: | 山影康次,浅田 晋,高橋俊孝, 若栗 忍,中川ゆづき,橋本恵子, 三枝克彦,加藤初美 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Kohji Yamakage (Study director) Kohji Yamakage, Shin Asada, Toshitaka Takahashi, Shinobu Wakuri, Yuzuki Nakagawa, Keiko Hashimoto, Katsuhiko Saegusa, Hatsumi Kato |
||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||