2-アミノ-2-エチル-1,3-プロパンジオールの遺伝子変異誘発性の有無を検討するため,ネズミチフス菌Salmonella typhimurium(以下,S.typhimuriumと略す)TA100,TA98,TA1535,TA1537及び大腸菌Escherichia coli(以下,E.coliと略す)WP2 uvrAの5菌株を用いて復帰変異誘発試験を実施した.
試験は濃度設定試験及び本試験を実施し,非代謝活性化系及び代謝活性化系存在下の条件で,プレインキュベーション法で実施した.被験物質の溶媒には注射用水を用いた.なお,被験液の処理用量は濃度設定試験で0.305〜5000 μg/plateの範囲で8用量,本試験で156〜5000 μg/plateの範囲で6用量を設定した.
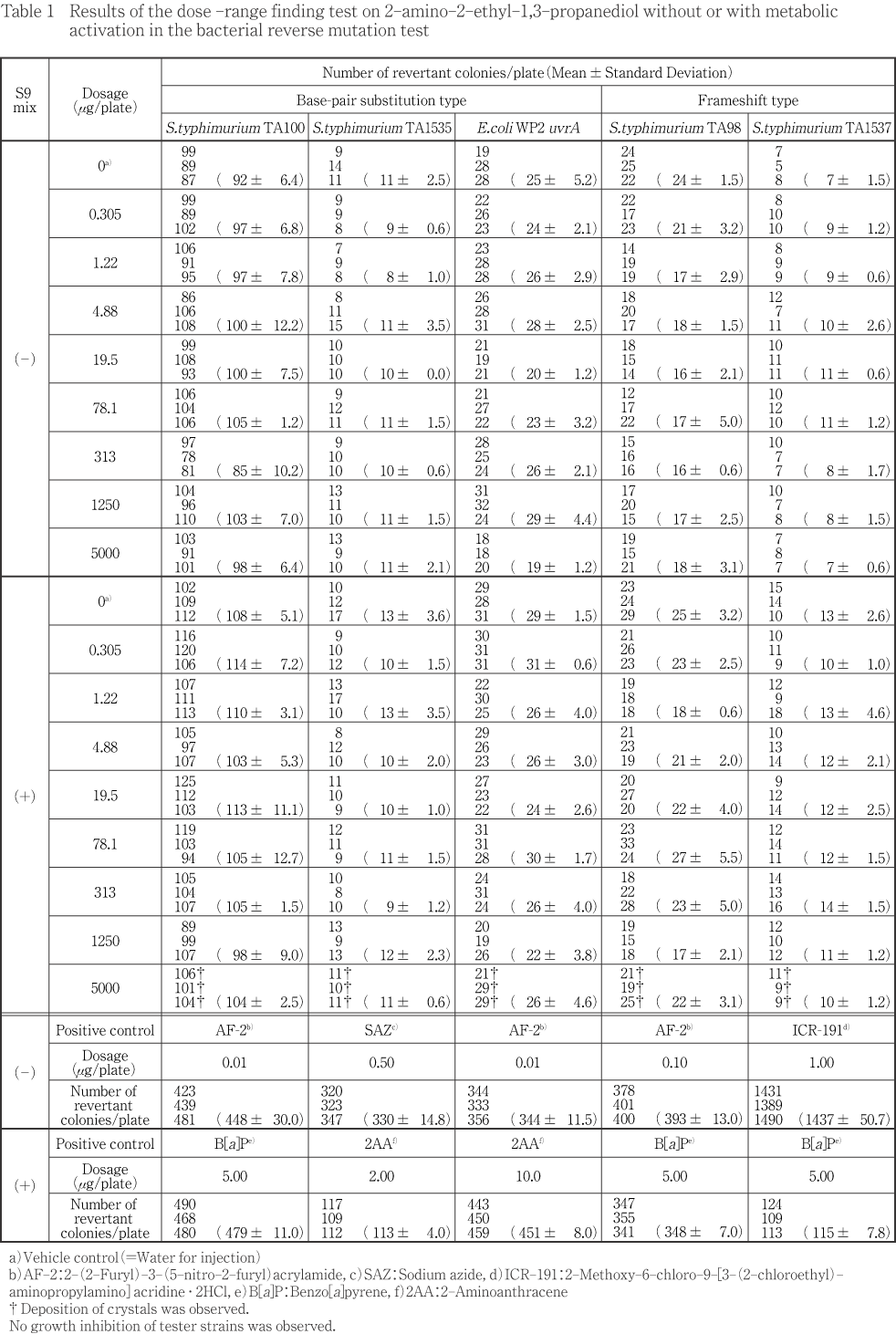
濃度設定試験において,菌株の種類に関わらず,代謝活性化系存在下で最高用量5000 μg/plateで白色結晶物の析出が認められた.同様に,本試験においても,菌株の種類に関わらず,代謝活性化系存在下で2500 μg/ plate以上の被験物質処理群で白色結晶物の析出が認められた.なお,非代謝活性化系存在下においては濃度設定試験及び本試験ともに,菌株の種類に関わらず,全被験物質処理群で沈殿及び結晶物の析出は認められなかった.また,菌株に対しての増殖抑制は濃度設定試験及び本試験の全被験物質処理群において,菌株の種類及び代謝活性化の有無に関わらず,認められなかった.一方,溶媒対照と比較して2倍以上かつ用量依存的な復帰変異コロニー数の増加は濃度設定試験及び本試験の全被験物質処理群において,菌株の種類及び代謝活性化の有無に関わらず,認められなかった.
以上の結果より,本試験条件下において2-アミノ-2-エチル-1,3-プロパンジオールは細菌に対して復帰変異誘発性を示さない(陰性)と判定した.
試験菌株としてヒスチジン要求性のS. typhimurium (TA100,TA98,TA1535,TA1537)並びにトリプトファン要求性のE. coli WP2 uvrAの5種類を選択した.
これらの菌株はいずれも1997年10月9日に国立医薬品食品衛生研究所・変異遺伝部から入手した.試験菌株は-80℃設定の超低温フリーザで保存したものを用いた.各菌株は,アミノ酸要求性,紫外線(UV)感受性,膜変異(rfa)及びアンピシリン耐性因子pKM101(プラスミド)の有無について調べ,特性が維持されていることを確認した.
試験に際して,解凍した菌液をニュートリエントブロスNo.2(UNIPATH LTD.)を入れた培養用三角フラスコに一定量を接種し,37℃で約8時間振盪培養したものを検定菌液とした.なお,分光光度計を用いて660 nmの吸光度を測定し,試験菌液の増殖を確認した.
最少グルコース寒天平板培地はオリエンタル酵母工業から購入し,試験に用いた.本プレート組成は,Vogel- Bonnerの最少培地Eを含む水溶液(最終濃度:0.02 %硫酸マグネシウム7水塩,0.2 %クエン酸1水塩,1 % リン酸二カリウム無水塩,0.192 %リン酸一アンモニウム,0.06 %水酸化ナトリウム)に2 %グルコース(和光純薬工業)及び1.5 %の寒天(伊那食品工業)を加え,径90 mmの滅菌シャーレ当たり30 mLを分注して固めたものである.
0.6 w/v%寒天粉末(Difco)及び0.6 w/v%塩化ナトリウム(和光純薬工業)の組成の軟寒天を調製し,これに,S. typhimurium用には0.5 mmol/L D-ビオチン(和光純薬工業)及び0.5 mmol/L L-ヒスチジン(和光純薬工業)水溶液,E. coli用には0.5 mmol/L L-トリプトファン(ナカライテスク)水溶液を1/10容量加え,トップアガーとした.
フェノバルビタール及び5,6-ベンゾフラボンを7週齢投与したSprague-Dawley系雄ラットに腹腔内投与した肝臓から調製されたS9並びに補酵素をオリエンタル酵母工業から購入し,S9 mixを調製した.
2-アミノ-2-エチル-1,3-プロパンジオール(ロット番号:HDE01,製造元:東京化成工業,東京)は純度99.4 wt%,微黄色透明の粘性の液体で,冷暗所に保存した.
溶媒は,注射用水(日本薬局方,大塚製薬工場)を用いた.被験物質を溶媒で希釈して原液(50.0 mg/mL)を調製し,次いで順次溶媒で希釈して各濃度の被験液を調製した.
濃度設定試験は,最高用量を5000 μg/plateとして注射用水により以下公比4で7段階希釈した計8用量を設定した.本試験では,濃度設定試験において菌株及び代謝活性化の有無にかかわらず,菌の増殖抑制が認められなかったため,原液の最高用量を5000 μg/plateとして以下公比2で5段階希釈した計6用量を設定した.
陽性対照物質として下記に示した5種類の化学物質を使用した.
| 2-(2-furyl)-3-(5-nitro-2-furyl)acrylamide | (AF-2,和光純薬工業) |
| Sodium azide | (SAZ,和光純薬工業) |
| 2-methoxy-6-chloro-9-[3-(2-chloroethyl)-amino- propylamino] acridine・2HCl |
(ICR-191,Polysciences) |
| 2-aminoanthracene | (2AA,ナカライテスク) |
| Benzo[a]pyrene | (B[a]P,ナカライテスク) |
AF-2,ICR-191,2AA,B[a]Pは ジメチルスルホキシド(試薬特級,和光純薬工業)を用いて溶解し,SAZは,注射用水(日本薬局方,大塚製薬工場)により溶解し,目的濃度に調製した.
Amesらの原法の改良法1, 2)であるプレインキュベーション法に準じて,非代謝活性化群及び代謝活性化群それぞれについて試験を実施した.試験管に,使用溶媒,被験液あるいは陽性対照物質溶液を100 μL,次いで非代謝活性化群の場合,0.1mol/Lナトリウム-リン酸緩衝液(pH7.4)を500 μL,代謝活性化群の場合,S9 mixを500 μL添加した.さらに,試験菌液を100 μL加え,37℃で20分間振盪培養(プレインキュベーション)した.培養終了後,あらかじめ45℃に保温したトップアガーを2 mL添加し,混合液をプレート上に重層した.37℃で48時間培養した後,被験物質の試験菌株に対する生育阻害及び沈殿/結晶の析出の有無を実体顕微鏡を用いて観察した.次いで,復帰変異により生じたコロニーを計数した.計数に際しては白色の結晶物が析出したため,肉眼により手動で計数した.各濃度につき3枚のプレートを使用した.
復帰変異コロニー数が溶媒対照のほぼ2倍以上に増加し,かつ,再現性あるいは被験物質の用量に依存性が認められた場合に,陽性と判定した.なお,判定に際しては統計学的処理は行わなかった.
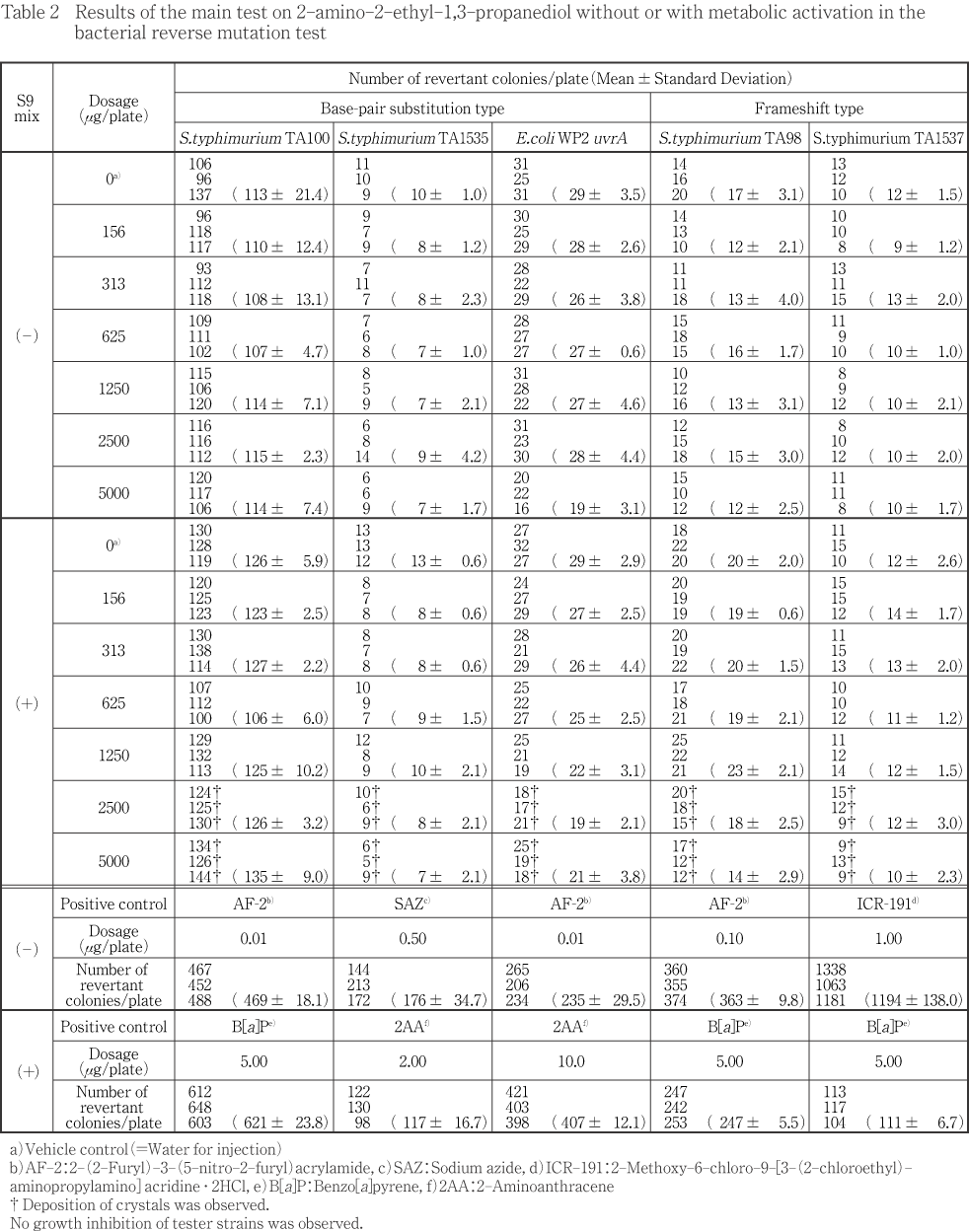
濃度設定試験の結果をTable 1に,本試験の結果をTable 2に示した.
濃度設定試験の結果,菌株の種類に関わらず,代謝活性化系存在下で最高用量5000 μg/plateで白色結晶物の析出が認められた.同様に,本試験においても,菌株の種類に関わらず,代謝活性化系存在下で2500 μg/plate以上の被験物質処理群で白色結晶物の析出が認められた.なお,非代謝活性化系存在下では濃度設定試験及び本試験ともに,菌株の種類に関わらず,全被験物質処理群で,沈殿及び結晶物の析出は認められなかった.そして,菌株に対しての増殖抑制は濃度設定試験及び本試験の全被験物質処理群において,菌株の種類及び代謝活性化の有無に関わらず,認められなかった.また,溶媒対照と比較して2倍以上かつ用量依存的な復帰変異コロニー数の増加は濃度設定試験及び本試験の全被験物質処理群において認められなかった.
一方,陽性対照群では各菌株の溶媒対照群に比較して2倍以上の復帰変異コロニーを誘発した.更に,各菌株の代謝活性化及び非代謝活性化における溶媒対照及び陽性対照の復帰変異コロニー数は当試験実施施設における背景データと比較し異常と考えられる数値が認められず,試験は適切に実施されたものと考えられた.
なお,化学構造的に本被験物質と類似物質であるtert-butyl hydroperoxide(CAS Registry No. 75-91-2)は,染色体異常試験3)で陽性の結果が,isopropyl alchol (CAS Registry No. 67-63-0)は細菌を用いる復帰変異試験4)及び姉妹染色分体交換試験5)で陰性の結果が,ace- tone cyanohydrin(CAS Registry No. 75-86-5)は細菌を用いる復帰変異試験6)で陰性の結果がそれぞれ報告されている.
以上の試験結果より,本試験条件下において2-アミノ-2-エチル-1,3-プロパンジオールは細菌に対して遺伝子変異誘発能を有さない(陰性)と判定した.
| 1) | Maron DM, Ames BN:Revised methods for the Salmonella mutagenicity test. Mutation Res, 113:173-215(1983). |
| 2) | Matsushima T, Sugimura T, Nagao M et al. : Factors modulating mutagenicity in microbial tests. In メShort-Term Test Systems for Detecting Carcinogensモ, eds. Norpoth KH, Garner RC(eds.), Springer, Berlin(1980)pp.273-285. |
| 3) | Ochi T:Effects of iron chelators and glutathione depletion on the induction and repair of chromoso- mal aberrations by tert-butyl hydroperoxide in cul- tured Chinese hamster cells. Mutation Res, 213:243-248(1989). |
| 4) | Shimizu H, Suzuki Y, Takemura N, Goto S Matsushita H:Results of microbial mutation test for forty-three industrial chemicals. Sangyo Igaku, 27:400-419(1985). |
| 5) | Von der Hude W, Scheutwinkel M, Gramlich U et al.:Genotoxicity of three-carbon compounds evalu- ated in the SCE test in vitro. Environ Mutagen, 9:401-410(1987). |
| 6) | Zeiger E, Anderson B, Haworth S et al.:Salmonella mutagenicity tests:Ⅳ:results from the testing of 300 chemicals. Environ Mol Mutagen, 11(Suppl 12):1-157(1988). |
| 連絡先 | |||
| 試験責任者: | 望月 肇 | ||
| 試験担当者: | 中村香織,高部道仁 | ||
| ㈱ボゾリサーチセンター | |||
| 〒412-0039 静岡県御殿場市かまど1284 | |||
| Tel & Fax 0550-82-9922 | |||
| Correspondance | |||
| Authors: | Hajime Mochizuki(Study Director) Kaori Nakamura, Michihito Takabe | ||
| Bozo Research Center Inc.,1284 Kamado, Gotemba-shi, Shizuoka, 412-0039, Japan | |||
| Tel & Fax +81-550-82-9922 | |||