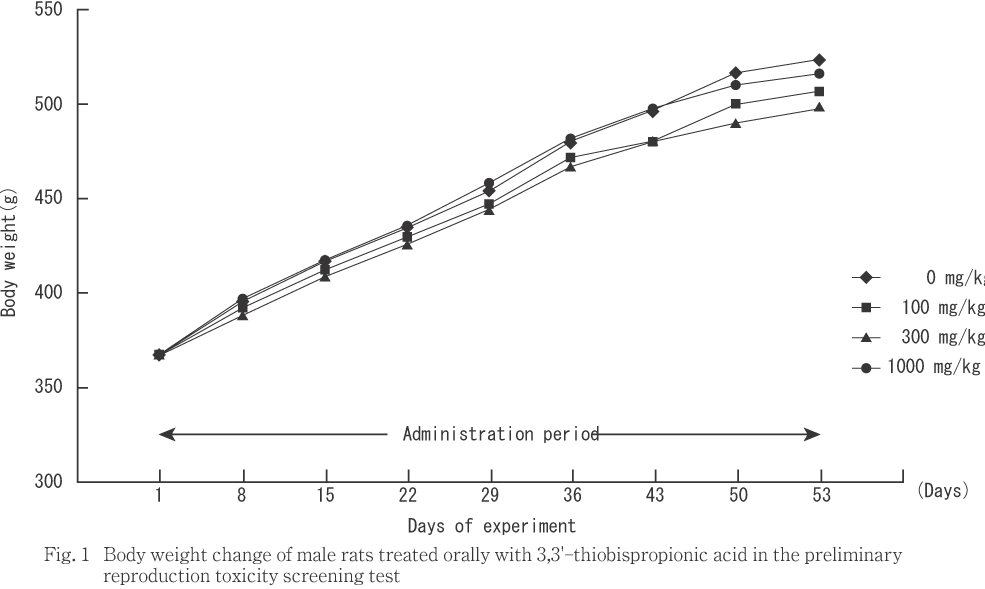
今回,3,3'-チオビス(プロピオン酸)の100,300および1000 mg/kgをCrj:CD(SD)IGS系ラットに交配前14日間および交配期間14日間を通じて経口投与し,さらに雄では交配期間終了後24日間,雌では妊娠期間を通じて分娩後の哺育3日まで連続投与し,生殖・発生に及ぼす影響について検討した.
1000 mg/kg群で雄1例および雌2例に被験物質投与の影響と考えられる死亡動物が観察された.雌雄とも被験物質投与に起因する一般状態の変化は認められなかった.
体重および摂餌量では,雄に対しては被験物質投与の影響は認められなかった.雌に対しては1000 mg/kg群で低値傾向が認められ,被験物質投与の影響が示唆された.
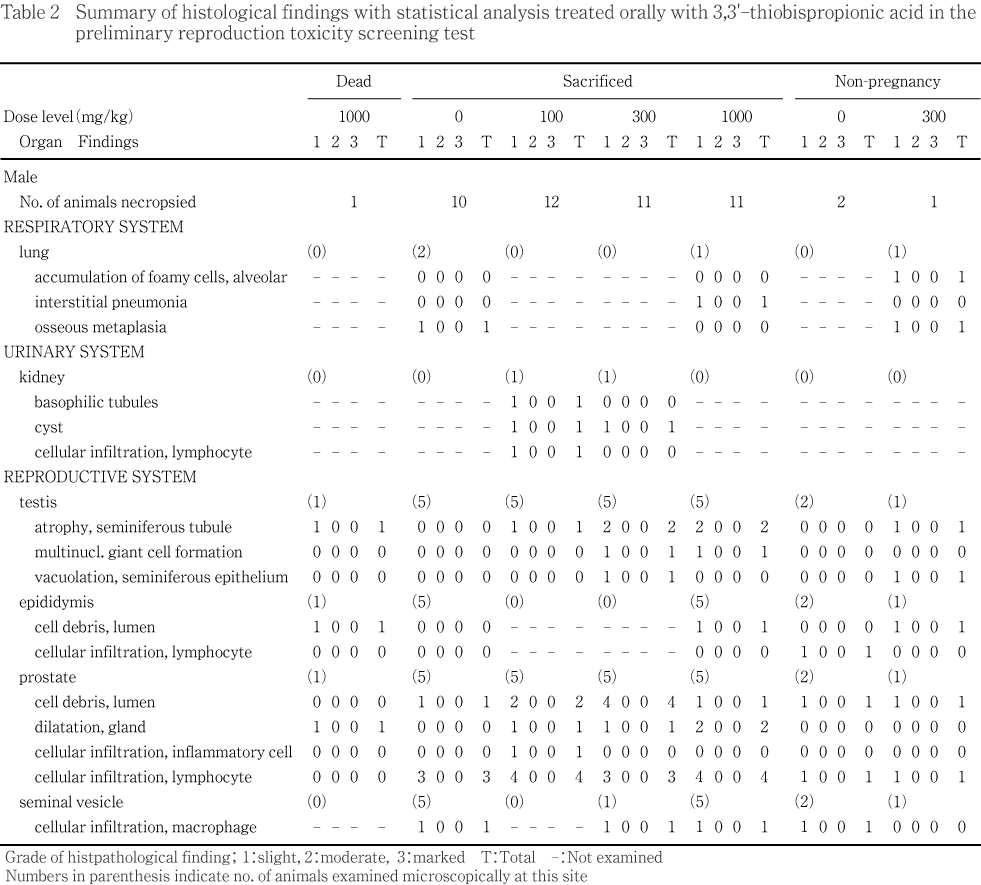
雌雄とも器官重量には被験物質投与の影響は認められなかった.病理学検査では組織学検査において,雄の300 mg/kg以上の投与群で精巣に対する毒性変化として精細管萎縮,精上皮空胞化および多核巨細胞形成が認められ,また,用量関連性は明確ではないが前立腺に対する変化も認められた.なお,1000 mg/kg群の精子形成サイクルには被験物質投与の影響は認められなかった.
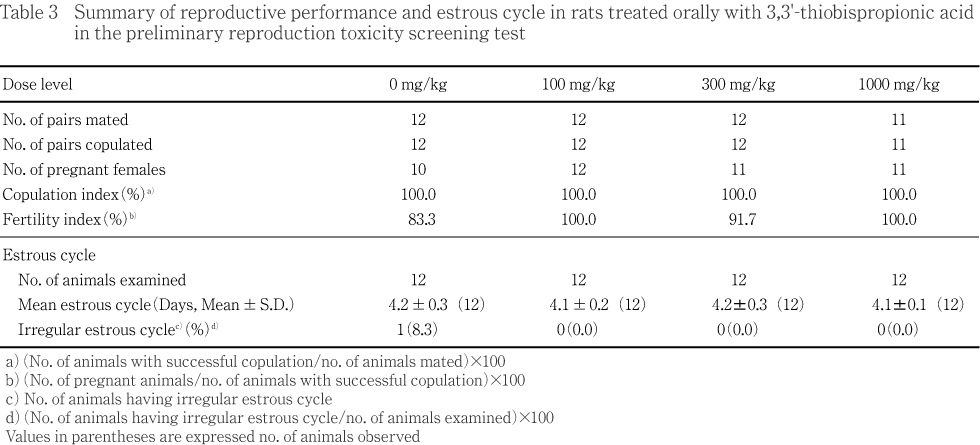
平均性周期日数および交尾能に被験物質投与の影響は認められず,被験物質投与による異常性周期も観察されなかった.対照群および300 mg/kg群の2および1組では受胎が認められなかった.300 mg/kg群の雄については組織学検査で精巣の精細管萎縮等の異常所見が認められ,300または1000 mg/kg群の他の雄で精巣等の生殖関連器官で異常所見が認められていることを考慮すると,受胎能に関する被験物質投与の影響が示唆された.
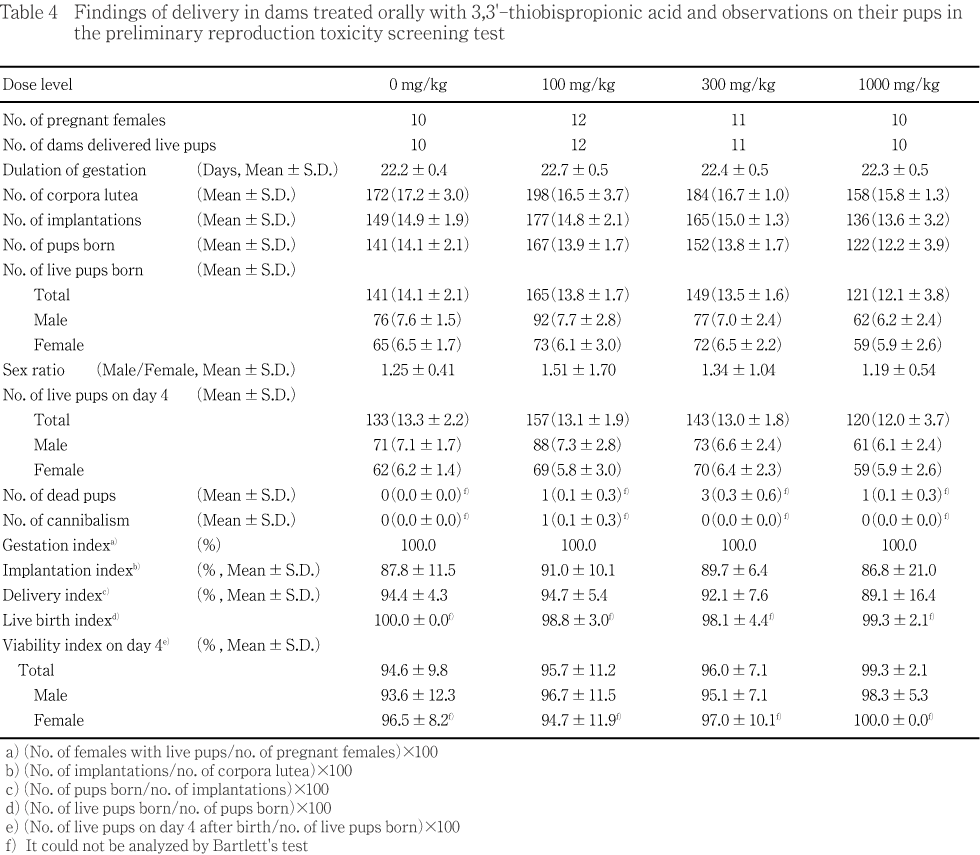
分娩時観察では全例が正常に分娩し,妊娠期間,妊娠黄体数,着床痕数,出産児数,出産生児数,性比,着床率,出産率,出生率および分娩率に被験物質投与の影響は認められなかった.
雌雄の新生児の生存性および出生後0および4日の体重推移,新生児の外表,死亡児および分娩後4日の剖検にも被験物質投与による影響は認められなかった.
以上のように,本試験条件下では3,3'-チオビス(プロピオン酸)の1000 mg/kg/dayの反復投与により雌雄で死亡動物が,雌で体重および摂餌量の低値傾向が認められた.雄の300 mg/kg以上の投与群では組織学検査においていくつかの精巣に対する異常所見が認められた.したがって,親動物に対する無影響量は雄で100 mg/kg/day,雌で300 mg/kg/dayと判断された.
生殖能に及ぼす影響については雄で300 mg/kg/day投与により受胎能に関する影響が疑われたことから,無影響量は100 mg/kg/dayと判断された.雌の生殖能に及ぼす影響および児動物の発生に及ぼす影響は認められず無影響量はいずれも1000 mg/kg/dayと判断された.
3,3'-チオビス(プロピオン酸)[MRCユニテック(青森),純度99.4 %,Lot No. RU-383]は白色の結晶粉末であり,使用時まで室温で遮光して密閉容器に保管した.残余被験物質を製造元で再分析することにより,本ロットが投与期間中安定であったことを確認した.
被験物質は0.5 w/v%カルボキシメチルセルロースナトリウム(CMC-Na)水溶液に懸濁し,10,30および100 mg/mLの濃度になるよう各群の投与液を調製した.投与液の調製は7日に1回以上行い,投与まで冷暗所に保管した.また,媒体中の被験物質は,1および100 mg/mLの濃度では8日間冷蔵(約4℃)保存後室温放置24時間は安定であることを確認した.
投与液の濃度分析は,初回調製時および最終調製時に調製した全ての被験物質投与群の投与液について行った.その結果,基準範囲内(± 10 %以内)であった.
試験には,日本チャールス・リバーから購入した生後8週齢のSprague-Dawley(Crj:CD(SD)IGS,SPF)系雌雄ラットを使用した.購入した動物は7日間検疫・馴化飼育した後,体重推移および一般状態に異常が認められなかったものを10週齡で群分けして試験に用いた.群分け時の体重は,雄で335〜399 g,雌で208〜241 gの範囲であった.
動物は,温度24 ± 3℃,湿度55 ± 20 %,換気回数15回/時間,照度150〜300 lx,照明時間12時間(午前7時点灯,午後7時消灯)に設定されたバリアシステムの飼育室でアルミ製前面・床ステンレス網目飼育ケージに1匹ずつ収容し飼育した.妊娠18日以降の母動物は哺育4日までアルミ製前面・床ステンレス網目飼育ケージに哺育トレーおよび巣作り材料(サンフレーク,日本チャールス・リバー製造)を入れて飼育した.
飼料は,オリエンタル酵母製造のCRF-1固形飼料(放射線滅菌飼料)を使用し,飼育期間中自由に摂取させた.飲水は,水道水を自由に摂取させた.
動物は投与開始日の体重をもとに無作為抽出法により1群あたり雌雄各12匹を振り分けた.
本被験物質の予備試験「3,3'-チオビス(プロピオン酸)のラットを用いる簡易生殖毒性試験-2週間投与予備試験」を0,30,100,300および1000 mg/kgの用量で実施した.その結果,1000 mg/kg投与によっても明らかな毒性影響は認められなかった.従って,本試験ではガイドラインで上限用量に設定されている1000 mg/kgを高用量とし,以下公比約3で除し300および100 mg/kgを設定した.
投与液量は,体重100 gあたり1.0 mLとし,交配前および交配期間中の雌雄および交尾不成立の雌では,個体別に測定した最新体重に基づいて算出を行った.また,妊娠および哺育期間中の雌は,妊娠0,7,14,20および哺育0日に測定した個体別体重に基づいて算出を行った.胃ゾンデを用いて毎日1回(7日/週)強制経口投与した.対照群には0.5 w/v%CMC-Na水溶液のみを同様に投与した.
投与期間は,雄は交配前14日間と交配期間14日間および交配期間終了後24日間の連続52日間とした.雌は交配前14日間と交配期間中(最長5日間)および交尾成立雌は妊娠期間を通じて分娩後の哺育3日まで(41〜45日間)とした.また,交尾後分娩しなかった雌は妊娠25日の解剖前日まで(40〜44日間)とした.
雌雄とも,一般状態の観察は毎日行い,異常および死亡の有無を記録した.
雄は投与1(投与開始日),8,15,22,29,36,43,50および53日(剖検日)に測定し,投与1から53日までの体重増加量を算出した.
雌は投与1(投与開始日),8および15日に測定し,投与1から15日までの体重増加量を算出した.また,交尾が確認された雌は,妊娠0,7,14および20日に,分娩した雌は哺育0および4日(剖検日)に測定し,それぞれ妊娠0から20日および哺育0から4日までの体重増加量を算出した.死亡動物については発見時にも測定した.
雄は投与1(投与開始日),8,15,22,29,36,43,50および52日(剖検前日)に餌重量を測定し,測定日から次の測定日までの摂餌量を求め平均1日摂餌量を算出するとともに投与1から15日および投与22から52日までの累積摂餌量を算出した.
雌は投与1(投与開始日),8および15日に餌重量を測定し,測定日から次の測定日までの摂餌量を求め平均1日摂餌量を算出するとともに投与1から15日までの累積摂餌量を算出した.また,交尾が確認された雌は妊娠0,7,14および20日に,分娩した雌は哺育0および4日に餌重量を測定し,測定日から次の測定日までの摂餌量を求め平均1日摂餌量を算出するとともに妊娠0から20日までの累積摂餌量を算出した.
なお,交配期間中の雌雄同居動物は摂餌量を測定しなかった.
交配は交配前14日間の性周期観察を行った雌と同群内の雄を1対1で最長5日間毎晩同居させた.交尾の確認は,毎朝,腟栓または腟垢中の精子確認により行い,交尾が確認された雌はその日を妊娠0日とした.
雌が死亡したために交配の組み合わせができない雄については,交配させることなく,そのまま投与を続け,他の雄と同様に扱った.
性周期観察は交尾確認日まで行い,発情期から次の発情期までの間の日数を性周期日数として平均性周期を算出した.また,性周期観察期間中の異常性周期(4または5日以外の性周期)発現率[(異常性周期を示す雌動物数/観察雌動物数)×100]を算出した.
交配結果から各群について交尾率[(交尾動物数/同居動物数)×100]を算出した.
妊娠動物は全て自然分娩させた.自然分娩時に分娩状態の観察を行った.分娩の確認を妊娠20から25日の午前8時30分〜10時の間に行い,この時間帯に分娩が完了していることを確認した動物および分娩を開始した動物は分娩完了まで待ち,その日を哺育0日とした.午前10時を過ぎて分娩を開始した場合は翌日を哺育0日とした.また,妊娠期間(哺育0日の年月日から妊娠0日の年月日を減じた日数),受胎率[(受胎動物数/交尾動物数)×100],出産率[(生児出産雌数/妊娠雌数)×100],着床率[(着床痕数/妊娠黄体数)×100],分娩率[(総出産児数/着床痕数)×100],出生率[(出産生児数/総出産児数)×100]を算出した.妊娠25日の午前9時までに分娩のみられない動物は病理解剖し,着床痕の認められない場合,妊娠不成立と判定した.哺育4日に母動物は病理解剖し,黄体数および着床痕数を調べ肉眼的に異常の有無を調べた.
新生児は哺育0日に出産児数(生存児+死亡児)を調べ,性別を判定し,性比(雄/雌)を算出するとともに,外表異常の有無を調べた.また,哺育0および4日に雌雄個体別の体重を測定し,1腹の雌雄別平均体重を算出した.哺育4日の体重測定後,エーテル麻酔下で放血安楽死させ,器官・組織の肉眼的観察を行った.死産児および哺育期間中の死亡児はブアン液に固定し,器官・組織の肉眼的観察を実施した.また,新生児の4日の生存率[(哺育4日生児数/出産生児数)×100]を算出した.
剖検では器官・組織の肉眼的観察を行い,前立腺,精嚢,卵巣,子宮,腟および肉眼観察で異常病変が認められた器官・組織を10 vol%中性緩衝ホルマリン液に固定した.精巣および精巣上体はブアン液で前固定した後,10 vol%中性緩衝ホルマリン液に固定した.
52日間投与した翌日,エーテル麻酔下で放血安楽死させ,器官・組織の肉眼観察を行った後,精巣および精巣上体重量を測定した.解剖日の体重を基に器官重量・体重比(相対重量)を算出した.また,全動物について精嚢,前立腺および肉眼観察で異常病変が認められた器官・組織を10 vol%中性緩衝ホルマリン液に固定した.精巣および精巣上体はブアン液で前固定した後,10 vol%中性緩衝ホルマリン液に固定した.
哺育4日に,エーテル麻酔下で放血安楽死させ,器官・組織の肉眼観察を行った後,卵巣重量を測定した.解剖日の体重を基に相対重量を算出した.また,全動物について卵巣,子宮,腟および肉眼観察で異常病変が認められた器官・組織を10 vol%中性緩衝ホルマリン液に固定した.なお,剖検時に黄体数および着床痕数を調べた.
妊娠25日に,エーテル麻酔下で放血安楽死させ,器官・組織の肉眼観察を行った後,卵巣,子宮および腟を10 vol%中性緩衝ホルマリン液で固定した.着床痕が認められない動物は妊娠不成立と判定した.
全固定器官について実施した.
対照群と高用量群の各5例については全固定器官,および全群の剖検時に認められた異常病変部組織について実施した.精巣と前立腺については被験物質投与の影響が疑われたため,低および中用量群の各5例についても検査を実施した.
対照群と高用量群の各5例については全固定器官,および全群の剖検時に認められた異常病変部組織について実施した.
全固定器官について実施した.
なお,精巣についてはPAS・ヘマトキシリン染色およびヘマトキシリン・エオジン染色した後,ヘマトキシリン・エオジン染色標本で一般的病変を検査し,PAS・ヘマトキシリン染色標本で精子形成サイクル(ステージⅦまたはⅧ)を検査した1).
体重,体重増加量,摂餌量,累積摂餌量,平均性周期,黄体数,着床痕数,妊娠期間,出産児数,死産児数,性比,着床率,出生率,分娩率,外表異常発現率,新生児の4日の生存率,器官重量および相対重量については自動判別方式2)に従い,最初にBartlettの等分散検定を実施した.等分散の場合はDunnettの多重比較検定3)で対照群と各投与群間の有意差を検定した.Bartlettの等分散検定で不等分散の場合はSteelの検定4)で対照群と各投与群間の有意差を検定した.
出産率,交尾率および受胎率についてはx^2検定を用いた.
異常性周期発現率,剖検所見および病理組織所見の発生率についてはFisherの直接確率検定法で検定した.
病理組織所見のうち程度の増強が認められた所見は-を「1」,+1を「2」,+2を「3」,+3を「4」に割り当ててMann-WhitneyのU検定を実施した.
有意水準はBartlettの等分散検定については5 %,その他の検定は5および1 %の両側検定で実施した.但し,供試動物数が1群につき2例以下の場合,有意差検定は行わなかった.なお,哺育期間中の出生児に関する成績は1母体当たりの平均を1標本として集計した.
死亡動物が雄の1000 mg/kg群で投与49日に1例,雌の1000 mg/kg群で投与15日および妊娠6日に各1例に認められた.
一般状態の変化として,雄では流涎が1000 mg/kg群で5例に観察されたが,症状の発現が投与後30〜60分頃の一過性であったため明らかな被験物質投与の影響とは考えなかった.死亡動物では,鼻分泌物,体温低下,緩徐呼吸,立毛,被毛の汚れ,眼瞼下垂および呼吸困難が死亡する数日前から認められた.その他,発現頻度から偶発的な発生と考えられる所見として,外傷および痂皮が100 mg/kg群で1例に観察された.
雌では流涎,被毛の汚れ,腹部膨満および眼瞼下垂が1000 mg/kg群で同一の1例に観察されたが,妊娠期間の中頃に1あるいは2日程度発現した後は正常状態に回復していることから,被験物質投与の影響とは判断しなかった.死亡動物では,流涎,眼瞼下垂,異常呼吸音,自発運動低下,体温低下,被毛の汚れ,腹臥位および腹部膨満が1例に認められた.他の死亡動物には異常は認められなかった.その他,自然発生性と考えられる所見として,硬結(頸部)および脱毛が対照群で1例,歯異常が1000 mg/kg群で1例に観察された.
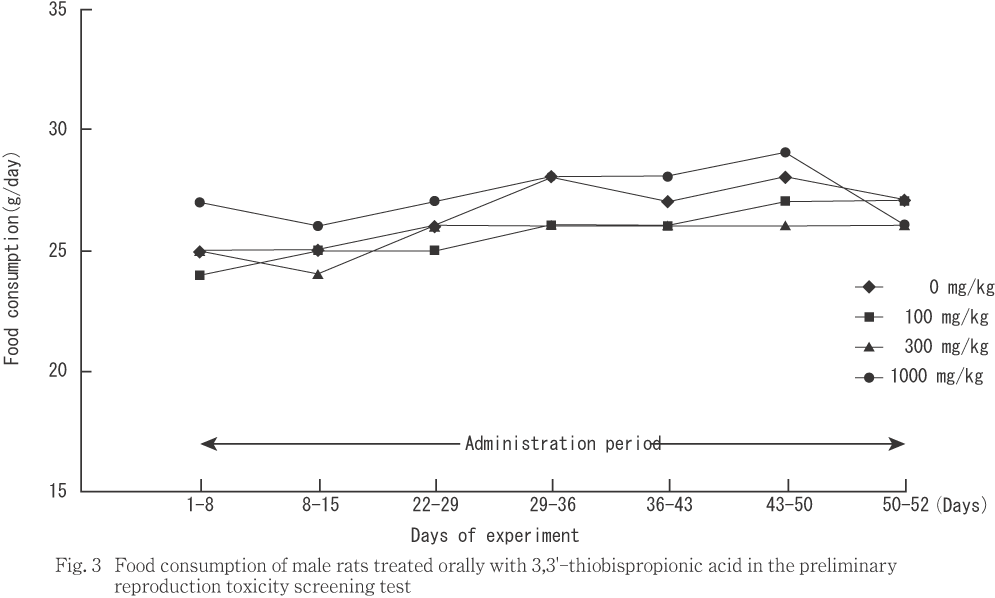
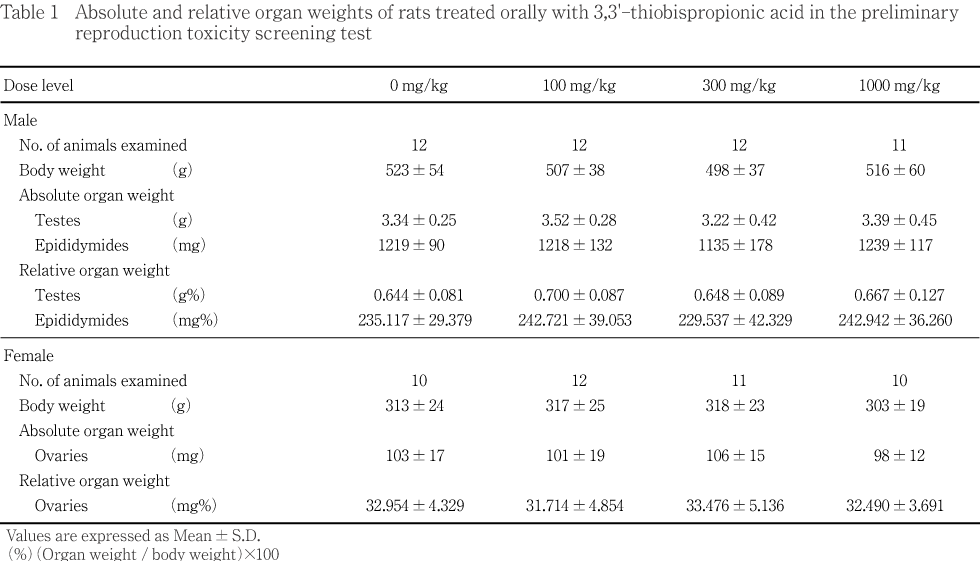
雄では,投与期間を通じて,対照群と被験物質投与群との間に統計解析で有意差は認められなかった.
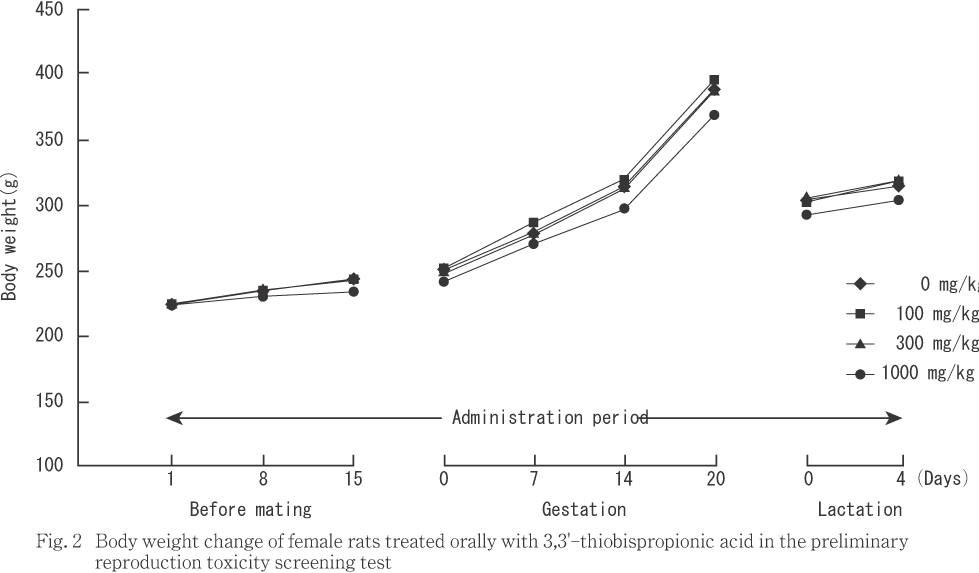
雌では,対照群に比べ1000 mg/kg群で投与1から15日の体重増加量,妊娠期間後半(妊娠14日以降)の体重値および妊娠0から20日の体重増加量に統計解析で有意差は認められないものの,低値傾向が認められた.1000 mg/kg群では妊娠期間から継続して哺育期間でも体重値が対照群に比べ低値傾向を示したが,哺育期間中の体重増加量には差は認められなかった.

雄では,投与期間を通じて,対照群と被験物質投与群との間に統計解析で有意差は認められなかった.
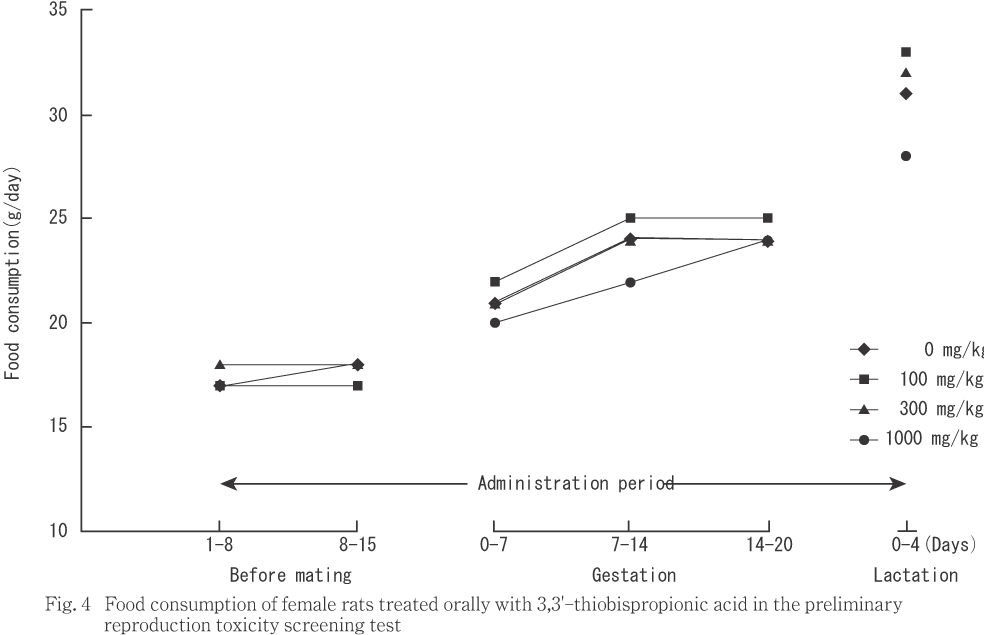
雌では,対照群に比べ1000 mg/kg群で投与1から15日,妊娠0から20日の累積摂餌量および分娩後0から4日の平均1日摂餌量に統計解析で有意差は認められないものの,低値傾向が認められた.
雌雄ともにいずれの測定器官にも対照群と被験物質投与群との間に統計解析で有意差は認められなかった.
1000 mg/kg群で認められた死亡動物では,雌雄で胃および大腸の内腔拡張,雄で小腸の内腔拡張,雌で肺の赤色化,胃の黒色斑/区域および小腸の黒色斑/区域が単発的に観察された.
妊娠を成立させた雄では,肺の褐色斑/区域および白色斑/区域,腎臓の嚢胞および精嚢の萎縮が単発的に観察されたが,対照群に比べ,被験物質投与群で発現数が統計解析で有意に増加した所見は認められなかった.
対照群および300 mg/kg群で2および1例に認められた妊娠を成立させなかった雄では,300 mg/kg群の動物で精巣および精巣上体の萎縮,肺の白色斑/区域が観察された.
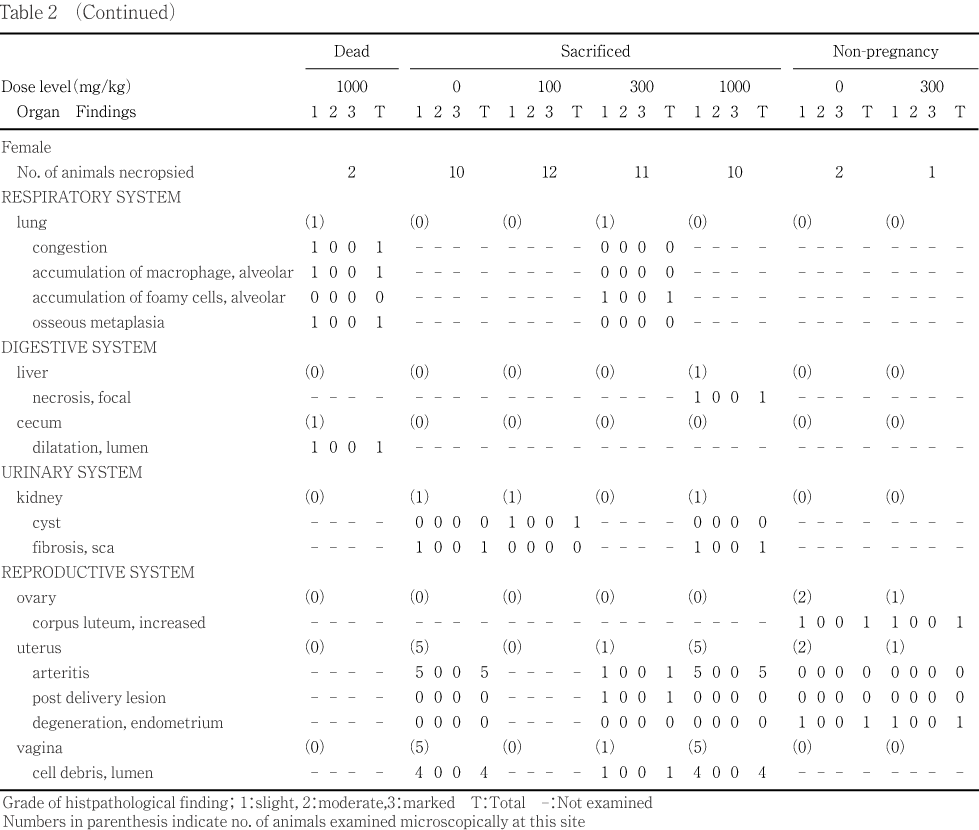
分娩後4日に計画解剖した雌では,腎臓の瘢痕,肝臓の褐色斑/区域,肺の結節,子宮の結節および腟の赤色化が単発的に観察されたが,対照群に比べ,被験物質投与群で発現数が有意に増加した所見は認められなかった.
妊娠不成立の雌では,肉眼異常所見は認められなかった.
1000 mg/kg群で認められた死亡動物では,雄で精巣の精細管萎縮,精巣上体の管内細胞残屑および前立腺の腺腔拡張が,雌で肺の鬱血,肺胞内マクロファージ集簇および骨化生,盲腸の内腔拡張が単発的に観察された.
妊娠を成立させた雄では,対照群,100,300および1000 mg/kg群で精巣の精細管萎縮がそれぞれ0,1,2および2例,前立腺の腺腔拡張が0,1,1および2例に観察され,統計解析で有意差は認められないものの,1000 mg/kg群で多く観察された.また,精細管内における多核巨細胞形成は300および1000 mg/kg群で各1例に観察された.その他,対照群を含む全ての投与群で前立腺の管内細胞残屑,リンパ球浸潤および精嚢の混合細胞浸潤が多数例に,被験物質投与群では精巣の精上皮空胞化,精巣上体の管内細胞残屑および前立腺の混合細胞浸潤が単発的に観察された.剖検時に異常病変が認められた組織では,肺の骨化生,肺の局所的な間質性肺炎,腎臓の嚢胞,リンパ球浸潤および尿細管好塩基化が単発的に観察された.
対照群および300 mg/kg群で2および1例に認められた妊娠を成立させなかった雄のうち,肺の肺胞内泡沫細胞集簇および骨化生,精巣の精細管萎縮および精上皮空胞化,精巣上体の管内細胞残屑が300 mg/kg群,前立腺の管内細胞残屑およびリンパ球浸潤が対照群および300 mg/kg群,精巣上体のリンパ球浸潤および精嚢の混合細胞浸潤が対照群でいずれも単発的に観察された.
分娩後4日に計画解剖した雌では,対照群を含む投与群で子宮の動脈炎および腟の管内細胞残屑が多数観察されたが,発現数に対照群と被験物質投与群との間で有意差は認められなかった.また,剖検時に異常病変部位が観察された子宮の結節および腟の赤色化は,子宮の分娩後病変および腟の管内細胞残屑であった.その他,肺における肺胞内泡沫細胞集簇,肝臓の巣状壊死,腎臓の嚢胞および瘢痕性線維化が単発的に観察された.
妊娠不成立の雌では,卵巣の黄体増加および子宮の子宮内膜変性が,対照群および300 mg/kg群で各1例に観察された.
精子形成サイクルの観察では,対照群および1000 mg/kg群の精巣についてステージⅦ〜Ⅷの精細管の精上皮細胞数を測定した結果,精祖細胞(type A),プレレプトテン期精母細胞,パキテン期精母細胞および円形精子細胞数のいずれにも有意な差は認められなかった.また,妊娠を成立させなかった雄動物について精子形成サイクルを観察した結果,それぞれの細胞数は他の観察動物と同程度であった.
対照群を含む全ての投与群で交尾率は100 %であったが,対照群および300 mg/kg群で2および1例が受胎せず,受胎率はそれぞれ83.3および91.7 %であった.その他の群ではいずれも100 %であった.
性周期観察では,異常性周期を示す動物が対照群で1例に認められた.異常性周期発現率および平均性周期では,対照群と被験物質投与群との間で統計解析で有意差は認められなかった.
対照群を含むいずれの投与群でも分娩状態に異常は観察されなかった.1000 mg/kg群で着床痕数,出産児数,出産生児数および分娩率が,統計解析で有意差は認められないものの低値傾向を示した.各群の妊娠期間,黄体数,出産率,着床率,出生率,性比および生後4日生存率に対照群と被験物質投与群との間に差は認められなかった.出生後0日の死亡児が100,300および1000 mg/kg群で少数例に,また,喰殺児が100 mg/kg群で1例観察された.
新生児の外表検査では,腹壁ヘルニアが100 mg/kg群の雄で1例に認められたが,1000 mg/kg群では発現が認められなかったことから被験物質投与の影響とは考えなかった.
体重変化では,出生後0および4日とも対照群と被験物質投与群との間で差は認められなかった.
哺育期間中の死亡児の剖検では,腎盂拡張が300 mg/kg群の雄で1例に認められた.
出生後4日の剖検では,足底部の赤色斑/区域が100 mg/kg群の雄および雌で6および4例に観察され,雄では対照群に比べ有意に発現数が増加した.その他,雌雄で腎盂拡張,尿管拡張,胸腺の小型,肝臓の褐色斑/区域,肝臓の結節,肝横隔膜結節,肝臓の赤色,脳の黒色斑/区域および褐色脂肪の黒色斑/区域が少数例に散見された.
1000 mg/kg群で雌雄(雄1例,雌2例)に認められた死亡動物では,雄および雌の1例で死亡日付近に瀕死状態に関連すると考えられる症状が観察された.これらの死亡動物の病理検査では死因の確定はできなかったが,1000 mg/kg群のみでの発現であることから被験物質投与の影響が疑われた.
一般状態の観察では,雌雄とも被験物質投与に関連すると考えられる症状は認められなかった.
体重および摂餌量では,雄に対しては被験物質投与の影響は認められなかった.雌に対しては,1000 mg/kg群で体重値が妊娠期間の後半から哺育期間にかけて低値傾向を,摂餌量が試験期間全般に渡って低値傾向を示し被験物質投与の影響が示唆された.
病理学検査では,雌雄とも器官重量に被験物質投与の影響は認められず,剖検で観察された所見はいずれも単発的であり,被験物質投与との関連はないと考えられた.病理組織学検査では,雄動物で精巣の精細管萎縮および前立腺の腺腔拡張の発現数が被験物質投与群で増加する傾向が認められた.精巣については300 mg/kgで精上皮空胞化,300 mg/kg以上の投与群で多核巨細胞形成も認められた.精巣上体については1000 mg/kg群で管内細胞残屑が認められた.また,1000 mg/kg群の死亡例に精巣の精細管萎縮,精巣上体の管内細胞残屑および前立腺の腺腔拡張が,300 mg/kg群の妊娠を成立させなかった雄1例に精巣の精細管萎縮および精上皮空胞化,精巣上体の管内細胞残屑が認められた.これらの精巣および精巣上体の変化は対照群では1例も認められていないことから被験物質投与の影響と考えられた.前立腺の変化については,用量に関連した増加は認められないものの300 mg/kg群で管内細胞残屑が5例中4例で観察され,被験物質投与の影響が疑われた.なお,精子形成サイクルのカウントでは,それぞれの細胞数に対照群と1000 mg/kg群で差は認められなかった.雌では被験物質投与の影響は認められなかった.
以上のように,3,3'-チオビス(プロピオン酸)の1000 mg/kg/day投与により雌雄で死亡動物が,雌では体重および摂餌量の低値傾向が認められた.雄の300 mg/kg以上の投与群では組織学検査において精巣に対する毒性変化として精細管萎縮,精上皮空胞化および多核巨細胞形成が認められ,また,用量関連性は明確ではないが前立腺に対する変化も認められた.したがって,本試験条件下における3,3'-チオビス(プロピオン酸)の親動物に対する無影響量は雄で100 mg/kg/day,雌で300 mg/kg/dayと判断された.
平均性周期日数および交尾能に被験物質投与の影響は認められず,被験物質投与による異常性周期も観察されなかった.
分娩時観察では,全例が正常に分娩し分娩状態に異常は観察されなかった.対照群および300 mg/kg群で妊娠不成立と判定された雌雄の動物について,病理学検査では雌動物に原因を示唆する所見は認められなかった.一方,300 mg/kg群の雄では,肉眼所見で両側の精巣および精巣上体の萎縮が観察され,組織学検査では精巣の精細管萎縮,精上皮空胞化および精巣上体の管内細胞残屑が観察された.300および1000 mg/kg群の妊娠を成立させた雄では精巣等の生殖関連器官に対して,組織学検査において被験物質投与の影響が認められていることを考慮すると,1例ではあるが,同様に300 mg/kg群の妊娠不成立雄動物で異常所見が認められたことから,受胎能に関する被験物質投与の影響が示唆された.
1000 mg/kg群で着床痕数,出産児数,出産生児数および分娩率が低値傾向を示したが,この群で1例が着床痕数5および出産児数4を示し,また,他の1例で着床痕数15に対し出産児数7(分娩率46.7 %)を示していたことが原因と考えられた.しかし,これらの低値は発現数から偶発的な変化と考え,被験物質投与の影響とは判断しなかった.
新生児の外表検査では,被験物質投与の影響は認められなかった.
新生児の出生後0および4日の体重値に被験物質投与群で差は認められず,出生後4日生存率にも影響は認められなかった.
哺育期間中の死亡児および出生後4日の生存児の剖検では,被験物質投与に起因すると考えられる異常は認められなかった.
その他,妊娠期間および妊娠黄体数に被験物質投与の影響は認められず,性比,出産率,着床率および出生率にも影響は認められなかった.
以上のように,3,3'-チオビス(プロピオン酸)の生殖能に及ぼす影響について,雄では300 mg/kg/day投与により受胎能に関する影響が疑われたことから,無影響量は100 mg/kg/dayと判断された.雌の生殖能に及ぼす影響および児動物の発生に及ぼす影響は認められず無影響量はいずれも1000 mg/kg/dayと判断された.
| 1) | 高橋道人(編):「精巣毒性評価のための精細管アトラス」ソフトサイエンス社,東京(1994)pp.15-20. |
| 2) | Snedecor GW, Cochran WG:メStatistical Methodsモ, 8th ed., Iowa State University Press, Ames(1989). |
| 3) | Yoshida M:Exact probabilities associated with Tukey's and Dunnett's multiple comparisons procedures in imbalanced one-way ANOVA. Japanese Soc Comp Stat, 1:111-122(1988). |
| 4) | Steel RGD:A multiple comparison rank sum test: Treatments versus control. Biometrics, 15: 560-572(1959). |
| 5) | Hollander M, Wolfe DA:Nonparametric Statistical Methods, Second edition, John Wiley & Sons, New York(1999). |
| 連絡先 | |||
| 試験責任者: | 伊藤圭一 | ||
| 試験担当者: | 岡田紗代子,鈴木友美,宮島留美子 | ||
| 7食品農医薬品安全性評価センター | |||
| 〒437-1213 静岡県磐田郡福田町塩新田字荒浜582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | |||
| Authors: | Keiichi Ito(Study director) Sayoko Okada, Tomomi Suzuki, Rumiko Miyajima | ||
| Biosafety Research Center, Foods, Drugs and Pesticides(An-pyo Center) | |||
| 582-2 Shioshinden Arahama, Fukude-cho, Iwata-gun, Shizuoka, 437-1213, Japan | |||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | ||