
被験物質に起因すると思われる変化が一般状態および胃に認められた.
一般状態では,ラッセル音が1000 mg/kg群の雄3例,雌1例で認められた.本変化は第2日までに消失した.軽度な投与後の流涎が1000 mg/kg群の雄3例,雌2例で認められた.いずれも第27および28日に発現した.
病理組織学検査では,腺胃におけるglobule leukocyteの増加と好酸球浸潤が 1000 mg/kg群の雌雄で認められた.回復期間終了後解剖動物では,これらの変化は認められなかった.
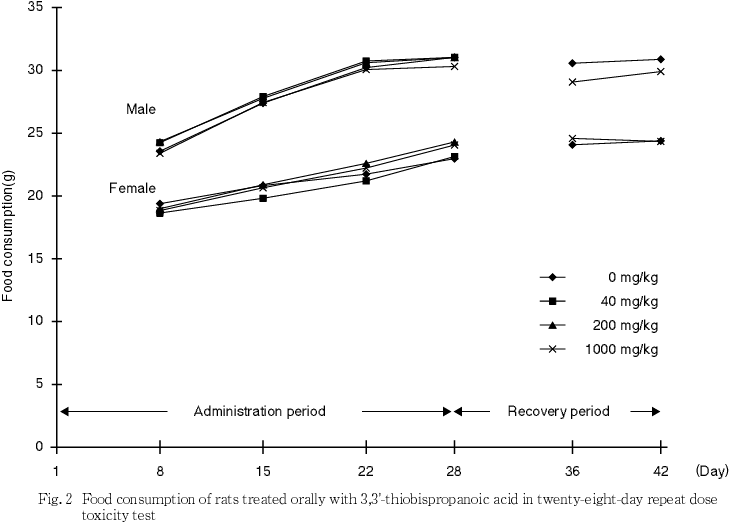
体重,摂餌量,行動検査,血液学検査,血液生化学検査,尿検査,器官重量測定,剖検所見では被験物質投与に起因すると考えられる変化は認められなかった.
以上,被験物質投与に起因すると考えられる変化が,雌雄とも1000 mg/kg群で認められたことから,本試験条件下における3,3'-チオビス(プロパン酸)の無影響量(NOEL)は,雌雄とも200 mg/kg/dayと判断した.
0.4 mg/mLの濃度は定量限界以下であったため,以下のように調製および分析を実施した.被験物質を必要量秤量し,溶媒[0.5 %CMC-Na(和光純薬工業および関東化学)水溶液]を加えながら乳鉢・乳棒で懸濁させ,メートルグラス内で十分に撹拌後定容として20,40および100 mg/mLの調製液とした.0.4 mg/mL液は40 mg/mL液を10倍希釈して調製した.0.4,20および100 mg/mLの調製液を投与に用いた.調製頻度は週1回以上とし,投与に供するまで8日間を限度に冷蔵・遮光条件下で保存した.投与液中の被験物質の均一性および冷蔵・遮光保存条件下での8日間の安定性を9.0および200 mg/mLの濃度で滴定終点検出法により確認した.また,初回調製時に200, 1000 mg/kg群の投与液および40 mg/kg群投与液の希釈原液である40 mg/mL調製液について滴定終点検出法で濃度分析を行い,設定濃度の範囲内であることを確認した.
動物入荷後,雌雄とも5日間の検疫期間後,投与開始日まで馴化した.投与開始前々日に体重層別無作為抽出法によって群分けした.投与開始時の週齢は5週齢,体重範囲は雄が143〜166 g,雌が114〜133 gであった.
検疫・馴化期間を含む全飼育期間を通じて,温度22 ± 2℃(許容範囲19.0〜25.0℃),相対湿度55 ± 15 % (許容範囲35.0〜75.0 %),換気約12回/時(オールフレッシュエアー供給),照明12時間/日(7:00-19:00)に自動調節した飼育室を使用した.
動物を滅菌済のステンレス製つり下げ型金網ケージ(トキワ科学器械)に群分け前は1ケージあたり2匹以下(同性),群分け後は,個別に収容し飼育した.
動物には,実験動物用固型飼料(MF,オリエンタル酵母工業)と,5 μmのフィルター濾過後,紫外線照射した水道水をそれぞれ自由に摂取させた.
対照群と1000 mg/kg群の雌雄各5匹に,投与期間終了後14日間の回復期間を設けた.
赤血球数(球状化処理二次元レーザーFCM法),ヘモグロビン濃度(シアンメトヘモグロビン法),ヘマトクリット値(球状化処理二次元レーザーFCM法),網赤血球数(RNA染色によるレーザーFCM法),血小板数(2角度レーザーFCM法),白血球数(酸性界面活性剤によるレーザーFCM法)を多項目自動血球分析装置(ADVIA120:バイエルメディカル)を用いて測定した.さらに平均赤血球容積(MCV),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC)を算出した.白血球百分率(ペルオキシダーゼ染色によるFCM法および酸性界面活性剤によるレーザーFCM法)を自動血球分析装置(ADVIA120:バイエルメディカル)を用いて測定した.プロトロンビン時間(PT,光散乱検出方式),活性化部分トロンボプラスチン時間(APTT,光散乱検出方式)を自動血液凝固測定装置(CA-510:シスメックス)で測定した.
凝固阻止剤としてプロトロンビン時間および活性化部分トロンボプラスチン時間の測定には,3.2 %クエン酸三ナトリウム水溶液を,その他の項目の測定には,EDTA-2 Kを用いた.
GOT(UV-rate法(JSCC改良法)),GPT(UV-rate法(JSCC改良法)),γ GT(γ-グルタミル-ρ-ニトロアニリド基質法(SSCC改良法)),ALP(ρ-ニトロフェニルリン酸基質法(JSCC改良法)),総ビリルビン(酵素法(BOD法)),尿素窒素(酵素-UV法(Urease-LEDH法)),クレアチニン(酵素法(Creatininase-POD法)),グルコース(酵素法(HK-G6PDH法)),総コレステロール(酵素法(CO-HDAOS法)),トリグリセライド(酵素法(GPO- HDAOS法),グリセリン消去法),総蛋白(Biuret法),アルブミン(BCG法),A/G比(総蛋白およびアルブミンより算出),カルシウム(OCPC法),無機リン(酵素法(PNP-XOD-POD法)),ナトリウム(イオン選択電極法),カリウム(イオン選択電極法),クロール(イオン選択電極法)を自動生化学分析装置(TBA-200FR:東芝)により測定した.
[肝臓,腎臓,副腎,精巣,精巣上体,卵巣,胸腺,脾臓,脳,心臓]
全動物の下記の器官・組織を採取し,10 %中性リン酸緩衝ホルマリン液で固定し,保存した.ただし,精巣および精巣上体はブアン液(Bouin液)で,眼球とハーダー腺はダビドソン液(Davidson液)でそれぞれ固定後,10 %中性リン酸緩衝ホルマリン液で保存した.
[脳(大脳,小脳および橋を含む部位),脊髄,胃,十二指腸,空腸,回腸(パイエル板を含む),盲腸,結腸,直腸,肝臓,腎臓,副腎,脾臓,心臓,胸腺,眼球・ハーダー腺,下垂体,甲状腺(上皮小体含む),気管および肺,精巣,卵巣,精巣上体,前立腺,子宮,膣,膀胱,下顎リンパ節,腸間膜リンパ節,坐骨神経(大腿筋に付けて採材),骨髄(大腿骨),肉眼的異常部位]
投与期間終了後解剖動物の対照群および1000 mg/kg群の雌雄全例の上記器官・組織,ならびに対照群を含む全動物の肉眼的異常部位は,常法に従ってヘマトキシリン・エオジン染色標本を作製し,鏡検した.(眼球・ハーダー腺は片側のみ標本作製し,鏡検した.) その結果,1000 mg/kg群の雌雄の胃に被験物質の影響が疑われたため,投与期間終了後解剖動物の40および200 mg/kg群の雌雄と回復期間終了後解剖動物の雌雄の胃について追加検査した.また,全試験動物の肉眼的異常部位についても併せて検査した.
その他,1000 mg/kg群の雌1例で眼球突出が第2日まで認められた.しかし,本変化は第3日以降消失したことから,被験物質投与とは関連のない変化と判断した.また,雄1例で歩行異常が第28日から39日に認められたが,本変化は動物の落下による歩行異常であった.

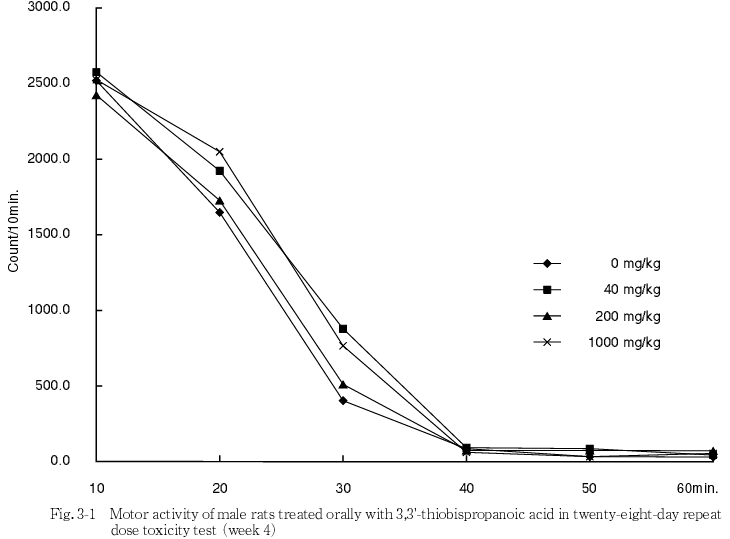
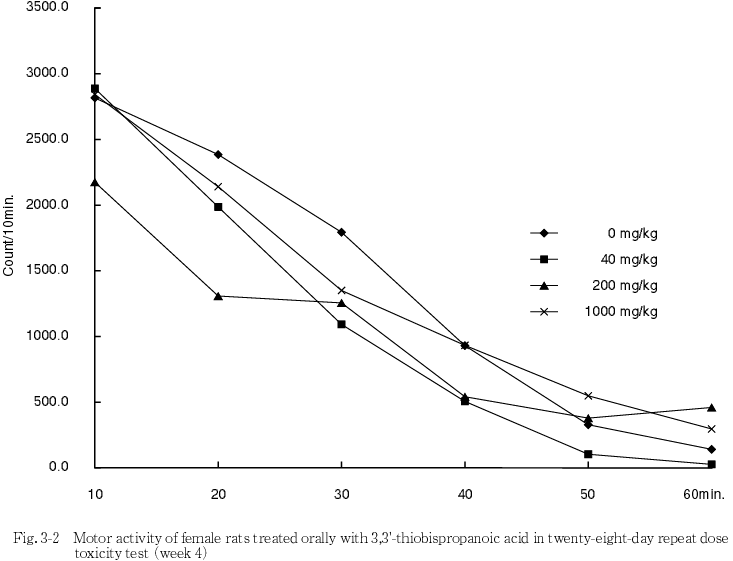
投与期間中の詳細な症状観察,機能検査および自発運動量測定の結果,いずれの検査においても,被験物質投与に起因すると思われる変化は認められなかった.

投与期間終了時の検査で,赤血球数の高値が1000 mg/kg群の雌に認められた.しかし,他の赤血球関連パラメータの変動を伴わない変動であることから,毒性学的には意義のない変化と判断した.また,回復期間終了時の検査で,赤血球数の高値,平均赤血球容積(MCV)および平均赤血球血色素量(MCH)の低値が1000 mg/kg群の雄で認められたが,いずれも投与期間終了時には認められないことや,軽微な変動であることから,被験物質投与とは関連のない偶発的変化と判断した.
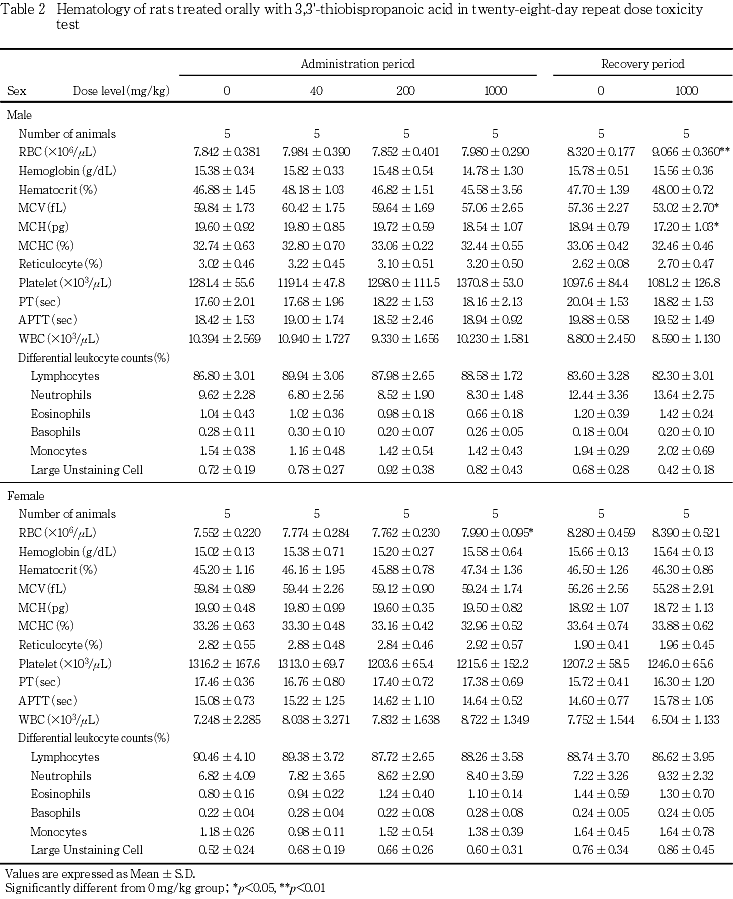
投与期間終了時の検査で,アルブミンの高値が40 mg/kg群の雄で認められた.しかし,この変化は200および1000 mg/kg群では認められず,用量との相関がないことから,被験物質投与とは関連のない偶発的変化と判断した.また,回復期間終了時の検査で,GOTの低値,グルコースおよびA/G比の高値が1000 mg/kg群の雄,無機リンの低値が1000 mg/kg群の雌で認められた.しかし,いずれも投与期間終了時には認められないことから,被験物質投与とは関連のない変化と判断した.
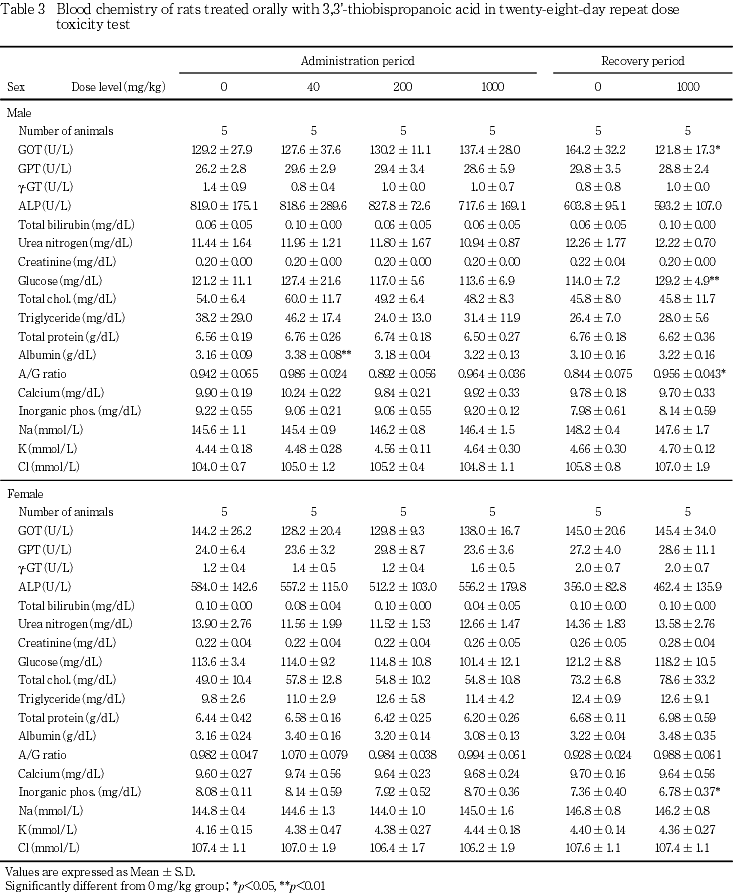
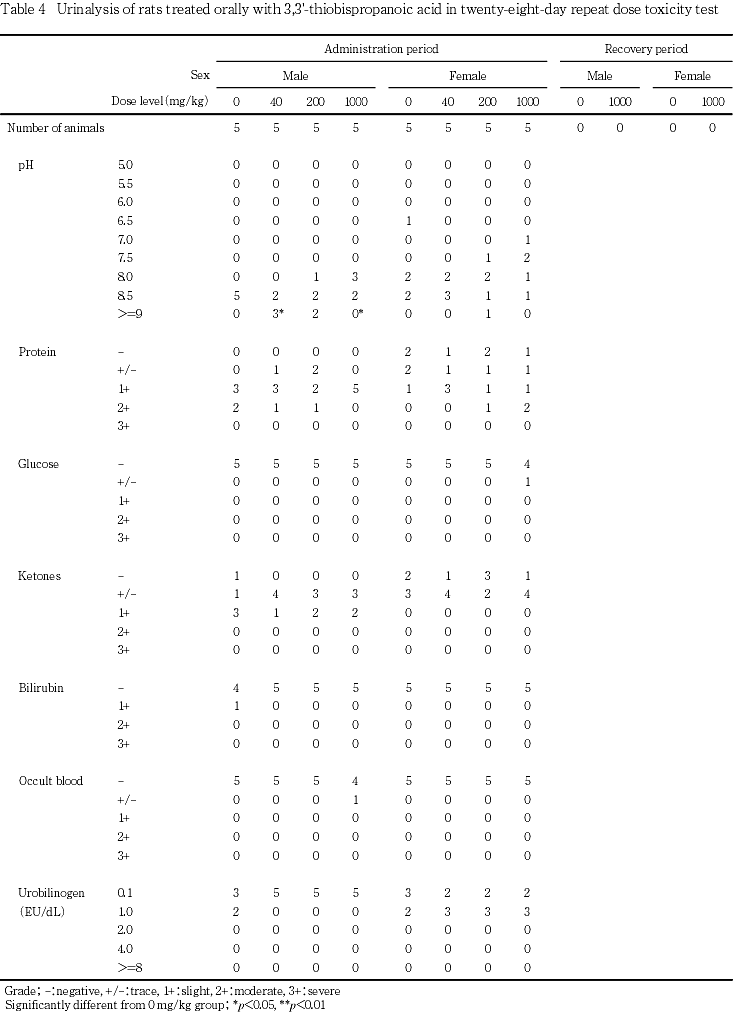
投与期間最終週の検査で,pHの高値が40 mg/kg群の雄,pHの低値が1000 mg/kg群の雄で認められた.しかし,本変化は雌では認められていないこと,雄の対照群のpH値が8.5に集中していることから,被験物質投与とは関連のない変化と判断した.
投与期間終了時の検査で,精巣の絶対重量の低値が40 mg/kg群の雄で認められた.しかし,この変化は200および1000 mg/kg群で有意差が認められず,用量との相関が無いことから,被験物質投与とは関連のない偶発的変化と判断した.また,回復期間終了時の検査で,肝臓の相対重量の低値が1000 mg/kg群の雄で認められた.しかし,本変化は投与期間終了時には認められていないことから,被験物質投与とは関連のない変化と判断した.

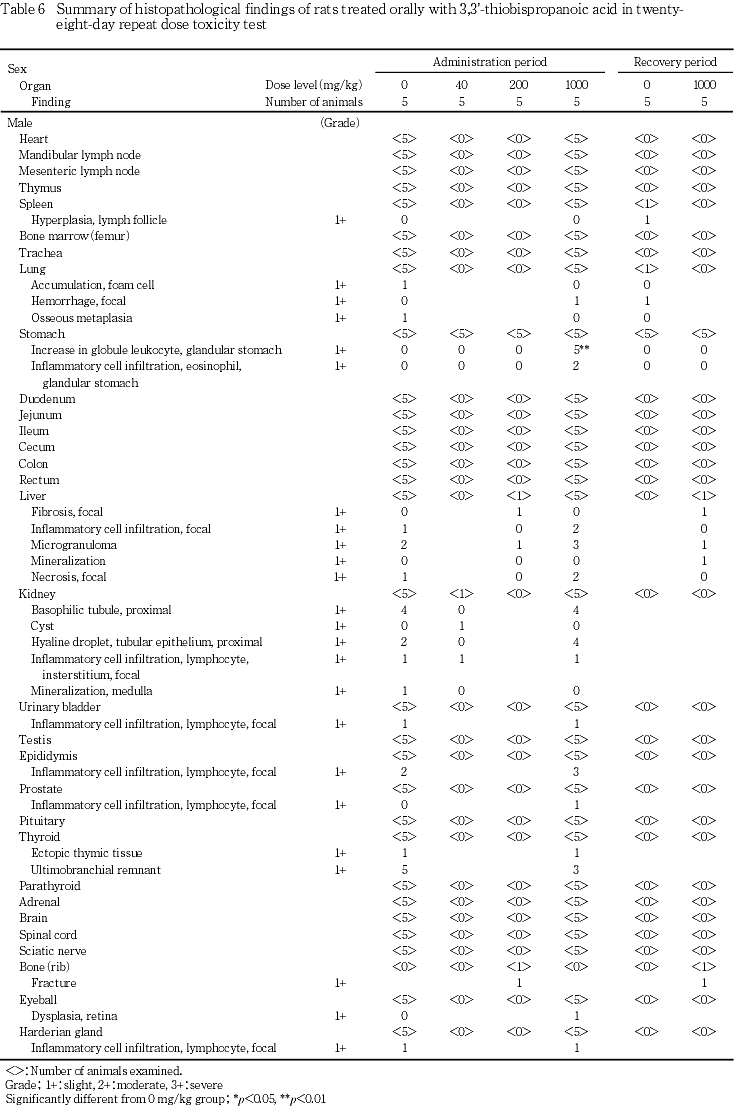
いくつかの変化が投与期間および回復期間終了後解剖動物で認められたが,被験物質投与群で多発するものはなく,いずれも偶発的所見と判断した.なお,大腿骨の骨折が1000 mg/kg群の雄1例で認められたが,本例は一般状態で歩行異常がみられた動物であった.
投与期間終了後解剖動物において,腺胃粘膜におけるglobule leukocyteの増加が1000 mg/kg群の雌雄全例,腺胃の粘膜および粘膜下織における好酸球浸潤が1000 mg/kg群の雄2例と雌全例に認められた.回復期間終了後解剖動物では,これらの変化は認められなかった.
その他に,種々の病理組織学所見が認められた.しかし,いずれもラットでは非特異的に発現する変化であり,その発現状況に明らかな群差が認められないことから,被験物質投与とは関連のない変化と判断した.
被験物質に起因すると思われる変化が一般状態及び胃に認められた.
ラッセル音が1000 mg/kg群の雌雄で認められた.本変化は第2日までに消失した.また,軽度な投与後の流涎が1000 mg/kg群の雌雄で認められ,いずれも第27および28日に発現した.被験物質は20℃飽和水溶液の場合pHが2.0を示すことから, 1000 mg/kg群の投与液も酸性が強かったと推測される.一過性のラッセル音および流涎は,被験物質の刺激性に起因する可能性が考えられる.また,流涎は翌日の投与前には消失していたことから,神経毒性に起因する継続性の流涎とは異なるものであった.
病理組織学検査の結果,腺胃におけるglobule leukocyteの増加と好酸球浸潤が1000 mg/kg群の雌雄で認められた.腺胃におけるglobule leukocyteの増加は,食品添加物である乳酸鉄をラットに混餌投与した場合に起こる好酸球性胃炎で認められることが報告されている1).今回の試験でもglobule leukocyteの増加と好酸球浸潤が併発していた.回復期間終了後解剖動物では,これらの変化は認められず,投与を中止することにより回復した.
以上,被験物質投与に起因すると考えられる変化が,雌雄とも1000 mg/kg群で認められたことから,本試験条件下における3,3'-チオビス(プロパン酸)の無影響量(NOEL)は,雌雄とも200 mg/kg/dayと判断した.
| 1) | Narama I, Ozaki K, Matsushima S, Matsuura T: Eosinophilic gastroenterocolitis in iron lactate-overloaded rats. Toxicol Pathol, 27: 318-324(1999). |
| 連絡先 | |||
| 試験責任者: | 須藤雅人 | ||
| 試験担当者: | 松本 忍,土居卓也,豊田直人, 木野本恵子 | ||
| (株)三菱化学安全科学研究所鹿島研究所 | |||
| 〒314-0255 茨城県鹿島郡波崎町砂山14 | |||
| Tel 0479-46-2871 | Fax 0479-46-2874 | ||
| Correspondence | ||||
| Authors: | Masato Sudo(Study director) Shinobu Matsumoto, Takuya Doi, Naoto Toyota, Keiko Kinomoto | |||
| Mitsubishi Chemical Safety Institute Ltd., Kashima Laboratory | ||||
| 14 Sunayama, Hasaki-machi, Kashima-gun, Ibaraki, 314-0255, Japan | ||||
| Tel +81-479-46-2871 | Fax +81-479-46-2874 | |||