 法),アルカリフォスファターゼ活性(p-ニトロフェニルリン酸基質法),GOT活性(SSCC法),GPT 活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法),A/G 比(計算)について分析した.
法),アルカリフォスファターゼ活性(p-ニトロフェニルリン酸基質法),GOT活性(SSCC法),GPT 活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法),A/G 比(計算)について分析した.
その結果,雄では, 100 mg/kg 以上の投与量は,投与後に,寄り掛かり姿勢など一般状態を変化させ,400 mg/kg投与により,投与期間初期に一過性に摂餌量および体重増加を抑制した.投与期間末期に摂餌量は高値を示したが,体重増加は軽度に抑制され,投与37日に実施した尿検査では,pHが異常な高値を示した.
42回反復投与後の剖検では,100 mg/kg以上の投与量により小葉中心性に肝細胞は肥大し,マクロファージが浸潤し,肝臓重量比体重値が増加した.さらに,400 mg/kg投与により,小葉中心性の肝細胞壊死,小葉中心部の肝細胞細胞質の均質化および小空胞化が認められ,総ビリルビン濃度および総コレステロール濃度ならびに肝臓機能の指標となる各種酵素活性が高値を示し,100 mg/kg以上の投与量のチオフェンは,肝臓毒性を示した.また,400 mg/kg投与により,小脳顆粒細胞の核濃縮あるいは壊死が1例に観察され,400 mg/kgの投与量のチオフェンは,小脳に対する軽度な毒性を現した.これらの変化に伴い,100 mg/kg以上の投与量ではブドウ糖濃度およびアルカリフォスファターゼ活性が低下し,無機リン濃度が上昇した.このほか,100 mg/kg以上の投与群において腎臓重量比体重値が増加し,400 mg/kg投与によりeosinophilic bodyがやや増加したが,腎機能の異常を示す変化は認められなかった.400 mg/kg投与群において脾臓重量が低下したが,病理組織学的異常は認められなかった.その他の器官にチオフェンの毒性を示唆する変化は認められず,25 mg/kgの投与量のチオフェンには毒性は認められなかった.
雌動物では, 100 mg/kg以上の投与量は,投与後に寄り掛かり姿勢など一般状態を変化させ,400 mg/kg投与により摂餌量および体重増加を投与期間初期に一過性に抑制し,運動失調を惹起し,1例は投与8日に瀕死状態となったため剖検した.
生存例の剖検では, 100 mg/kg以上の投与により,変化の有無に個体差はあるものの,400 mg/kg投与により雄の肝臓に惹起されたのと同質の所見が観察され,肝臓重量比体重値も増加した.また,小脳の顆粒細胞壊死が 100 mg/kg以上の投与群に観察され,400 mg/kg投与群では,大脳の脳室拡張およびその周囲の浮腫も認められた.これらのことから,100 mg/kg以上の投与量は,肝臓および小脳に障害を与える毒性量であると考えられる.これらの変化は,瀕死屠殺例にも観察され,投与期間初期から認められた.また,生存例の各所見は雄と比較してより増強されていた.100 mg/kg以上の投与により尿細管上皮の空胞変性が有意に増加し,400 mg/kg投与群において腎臓重量比体重値が高値を示した.その他の器官にチオフェンの毒性を示唆する変化は認められず,25 mg/kgの投与量のチオフェンには毒性は認められなかった.
一方,生殖発生毒性に関しては, 400 mg/kgまでの投与量は,交尾,排卵および受胎に毒性を示さなかった.また,チオフェン投与に起因する分娩異常はいずれの投与群にも認められなかった.しかし,100 mg/kg以上の投与群の小脳に所見が認められた動物の多くに,哺育行動の廃絶や,泌乳の低下が認められ,100 mg/kg以上の投与量は,母動物の哺育状態に影響を及ぼす毒性量であると考えられる.
出生日の児の生存性および性比にはチオフェン投与の影響は認められなかったが, 400 mg/kg投与群において,出生日および哺育4日の体重,ならびに新生児の4日の生存率が低値の傾向が認められた.100 mg/kg以下の投与群にチオフェン投与の影響は認められず,チオフェン投与に起因した形態異常はいずれの投与群にも観察されなかった.
これらのことから本試験条件下では,チオフェンの反復投与毒性に関する無影響量は,雌雄ともに 25 mg/kg/dayであり,生殖発生毒性に関する無影響量は,雄では,400 mg/kg/day,雌では,25 mg/kg/day,新生児では100 mg/kg/dayであると推定される.
各動物は,温度 24±1℃,相対湿度55± 5%,換気回数約15回/時間,照明12時間(午前7時〜午後7時)に条件設定された飼育室で,金属製金網床ケージ(日本ケージ)に個別に収容して飼育し,固型飼料(CA-1,日本クレア)および水道水を自由に摂取させた.妊娠18日以後の母動物には,飼育ケージの床に金属製床板を敷き,床敷として木製チップ(ホワイトフレーク(R),日本チャールス・リバー)を適宜供給した.供給した飼料,水および床敷には試験に支障を来す可能性の考えられる混入物はなかった.
その結果, 100 mg/kg以上のチオフェンは投与開始後一般状態を変化させ,14日間の反復経口投与によって肝臓重量を増加させた.さらに,400 mg/kgのチオフェンは,雌雄の体重増加および摂餌量を一過性に抑制し,雄の肝機能を変化させたことから,400 mg/kg/dayは6週間の反復投与により,何らかの毒性変化の期待される量であると考え,これを併合試験における高用量に設定した.また,低用量には毒性変化を生じないことの期待される25 mg/kg/dayを設定し,中用量には等比中項の 100 mg/kg/dayを設定した.予備試験において,いずれの検査項目についても,対照群には,呼気から排泄されたチオフェンによる暴露の影響を示唆する変化は認められなかったことから,併合試験の対照群は,チオフェン投与群と同室で飼育することとした.
雌雄とも,全例について試験期間中毎日観察した.
B. 体重
雌雄とも,全例について体重を試験期間中週 1回〔雄:投与1, 8, 15, 22, 29, 36, 42日,雌:投与1, 8, 15日〕および解剖日に測定した.投与22日までに交尾しなかった雌は,投与22日にも体重を測定した.また,交尾成立雌では,妊娠0, 7, 14, 20日,分娩した雌では,分娩後0および4日(哺育0および4日)の体重を測定した.
C. 摂餌量
雌雄とも,全例について体重測定日と同日に餌重量を測定し,測定日から次の測定日までの間の摂餌量を算定した. 2週間の交配期間中の摂餌量は測定しなかった.交尾成立雌では,妊娠0〜7,7〜14,14〜20日の,さらに,分娩した雌では,哺育0〜4日の摂餌量を測定した.
D. 尿検査
予備試験では,投与 2および9日に尿検査を実施したが,異常は認められなかった.併合試験では,尿の性状の異常の有無を確認するために,投与期間末期の投与37日に,雄の全例について尿検査を実施した.尿は,動物を4時間代謝ケージに収容して蓄尿することにより採取し,pH測定ならびに潜血,蛋白,糖,ケトン体,ウロビリノーゲンおよびビリルビンの含有の程度は試験紙法(マルティスティックス/クリニテック200(マイルス三共))により判定し,沈渣は鏡検した.
E. 交配
交配は,投与 15日(投与開始日=投与1日)の夕方から最長2週間,同一群内の雌雄を1対1で同居させて行った.交尾の確認は,毎朝,腟栓および腟垢中の精子の存在を調べることにより行い,交尾が確認された雌は,その日を妊娠0日と起算して雄から分離し,個別に飼育した.交配結果から,各群について交尾率[(交尾動物数/同居動物数)×100],受胎率[(受胎動物数/交尾動物数)×100],同居開始日から交尾確認日までの日数およびその間に回帰した発情数を求めた.
F. 分娩状態
各群とも交尾雌は,全例を自然分娩させた.分娩状態は,直接観察が可能なものについてのみ行った.
G. 分娩日の算定
分娩の確認は,午前 9時〜11時に限定し,この時間帯に分娩が完了していることを確認した動物について,その日を哺育0日,その前日を分娩日と規定した.午前11時を過ぎて分娩した動物については,翌日を分娩日とした.
分娩を確認した全例について妊娠期間 (妊娠0日〜分娩日の日数)を算定し,出産率[(生児出産雌数/受胎雌数)×100]を各群について求めた.
H. 病理組織検査
a) 雄動物
イ.剖検,器官重量および病理組織検査
最終投与日の投与終了後から絶食を開始し,翌日〔投与 43日相当日〕にペントバルビタール深麻酔下で放血・致死させて剖検した.その際,全例について肝臓,腎臓,胸腺,脾臓,甲状腺,精巣および精巣上体の重量を測定した.また,これらの器官のうち,精巣および精巣上体はブアン液に固定し,その他の器官および大脳,小脳,脊髄,心臓,肺,副腎,膀胱ならびに剖検において異常を認めた器官は,10%ホルマリンに固定した.これらの器官のうち,大脳,小脳,肝臓および腎臓は各群の全例について,その他の器官は,対照群および400 mg/kg投与群の全例について組織切片を作製し,ヘマトキシリン-エオジン染色を行って病理組織検査を行った.また,必要に応じてOil red O染色も施して観察した.なお,脾臓および甲状腺の重量測定と病理組織検査,ならびに小脳,脊髄および肺の病理組織検査は,チオフェンの毒性情報として脾臓重量の低下が報告されていること,ならびに予備試験において肝臓重量が増加して酵素誘導が疑われたことから,脾臓重量と酵素誘導の指標となる甲状腺重量を測定し,病理組織検査を実施することとした.また,チオフェンは呼吸器から吸収されることから,肺の病理組織検査を実施した.さらに,チオフェンは小脳の特定の部位に壊死性の病変を形成することが報告されているので,投与量と病変との関連性を明らかにするために小脳および脊髄の病理組織検査を実施した.
ロ.血液学検査
全例について,剖検に先立ち,ペントバルビタール麻酔下で腹部後大静脈より EDTAを抗凝固剤として採血し,赤血球数(RBC),白血球数(WBC),血色素量(Hb),平均赤血球容積(MCV),ヘマトクリット値(Ht),平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC),血小板数を多項目血液自動測定機(Coulter Counter Model S-PLUS IV)により測定し,白血球百分比は Wright-Giemsa染色を行い,光学顕微鏡下で観察して算出した.また,各群の5例については,EDTAを抗凝固剤とする採血に先立ち,クエン酸ナトリウムを抗凝固剤として採血し,血液凝固時間自動測定装置(クロテック)により,プロトロンビン時間(PT)および活性部分トロンボプラスチン時間(APTT)を測定した.
ハ.血液生化学検査
全例について,血液学検査のための採血に引き続き,ヘパリンを抗凝固剤として採血し,それぞれ血漿を分離して遠心方式生化学自動分析装置
(COBAS- FARA)および全自動電解質分析装置EA-05(A & T)を用い,総蛋白濃度(ビウレット法),アルブミン濃度(BCG法),総コレステロール濃度(COD・DAOS法),ブドウ糖濃度(グルコキナーゼG6PDH法),尿素窒素濃度(ウレアーゼGl.DH法),クレアチニン濃度(Jaff 法),アルカリフォスファターゼ活性(p-ニトロフェニルリン酸基質法),GOT活性(SSCC法),GPT 活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法),A/G 比(計算)について分析した.
法),アルカリフォスファターゼ活性(p-ニトロフェニルリン酸基質法),GOT活性(SSCC法),GPT 活性(SSCC法),総ビリルビン濃度(ビリルビン「ロシュ」キットS シリーズ),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法),A/G 比(計算)について分析した.
b) 雌動物
イ.剖検,器官重量および病理組織検査
交尾不成立雌は交配期間終了日に,交尾したが分娩しない雌は妊娠 25日相当日に,致死量のペントバルビタールを投与後に放血・致死させ,剖検した.分娩した雌は哺育4日に,また,瀕死状態と判断された動物は,そのつど剖検した.妊・不妊のいずれの例においても卵巣および子宮を摘出し,子宮については Salewski法15)を応用して着床痕を染色して着床数を確認した.卵巣はブアン液に固定して保存し,実体顕微鏡下で黄体数を数えた.不妊例および交尾不成立例の卵巣については,病理組織検査を行った.また,肝臓,腎臓および胸腺の重量を全例について測定した.これらの器官および大脳,小脳,脊髄,心臓,脾臓,肺,副腎,甲状腺,子宮,膀胱および剖検において異常を認めた器官は10%ホルマリンに固定して保存した.これらの器官のうち,大脳,小脳,肝臓,腎臓,胸腺および脾臓は各群の全例について,その他の器官は,400 mg/kg投与群および対照群の全例について組織切片を作製し,ヘマトキシリン-エオジン染色を施して病理組織検査を行った.また,必要に応じてOil red O染色を行った.なお,小脳,脊髄,脾臓,肺および甲状腺および肺の病理組織検査は,雄と同様の理由から実施した.
哺育 0日に産児数(生存児+死亡児)を調べ,児の分娩率[(産児数/着床痕数)×100および出生率[(出産生児数/着床痕数)×100]を求めた.また,産児の外表異常の有無よび性別を調べた.
B. 死亡児数の算定
死亡児数を毎日調べ,哺育 0日の生存率[(生児数/産児数)×100]および新生児の生後4日の生存率[(哺育4日の生児数/哺育0 日の生児数)×100]を求めた.死亡児は剖検し,胸腔および腹腔内の器官を除去した後,エタノールに固定して保存した.
C. 体重測定
哺育 0日および4日に一腹単位で雌雄別に体重(litter 重量)を測定し,[litter重量/測定児数]を各腹について求めた.
D. 剖検
哺育 4日に全例をエーテル吸入により致死させ,剖検した.胸腔および腹腔内の器官は一括して摘出し,一腹ごとに10%ホルマリンに固定して保存した.カーカスは,一腹ごとにエタノールに固定して保存した.
 型19)の検定を行った.有意水準は,5%および1%とした.病理組織検査結果については,Mann-WhitneyのU検定21)を用いて検定した.
型19)の検定を行った.有意水準は,5%および1%とした.病理組織検査結果については,Mann-WhitneyのU検定21)を用いて検定した.
雌では, 100 mg/kg以下の投与群では,いずれの時期の体重および摂餌量にも対照群と比較して有意差は認められなかった.400 mg/kg投与群では,交配前の投与1〜8日の摂餌量が対照群と比較して有意(p<0.01)な低値を示し,体重が減少した.投与8〜15日の摂餌量には,対照群との間に有意差は認められず,体重増加抑制も認められなくなったが,投与開始後の各時期の体重は対照群と比較して有意(p<0.01)な低値を示した.妊娠期の摂餌量には対照群との間で有意差は認められなかったが,交配前の体重が低値であったために,妊娠0〜14日の体重が対照群と比較して有意(p<0.05,p<0.01)な低値を示した.哺育期には,哺育0〜4日の摂餌量がやや低値の傾向を示したが,体重および摂餌量ともに対照群との間に有意差は認められなかった.
100 mg/kg投与群の1例の体重は,後述のII−1−2)分娩および哺育状態の項に記載した理由により評価の対象から除外した.






A. 雄〔解剖日:投与期間(42回投与)終了翌日〕
(1) 血液学検査所見(Table 7)
赤血球については, 100 mg/kg以上の投与群において血色素量および平均赤血球血色素濃度が,軽度ではあるが用量依存的に有意(p<0.05,p<0.01)に低下した.また,400 mg/kg投与群では,平均赤血球血色素量が有意(p<0.01)に減少した.ヘマトクリット値は,すべてのチオフェン投与群が対照群と比較して有意(p<0.05,p<0.01)な低値を示したが,その程度は生理的変動の範囲内であった.その他の項目については対照群とチオフェン各投与群との間に有意差は認められなかった.
白血球については,数および百分比のいずれにも対照群とチオフェン各投与群との間で有意差は認められなかった.
血液凝固に関連した検査項目では, 400 mg/kg投与群においてAPTTが有意(p<0.05)に短縮したが,PTについてはいずれのチオフェン投与群においても対照群との間に有意差は認められなかった.

(2) 血液生化学検査所見(Table 8)
対照群と比較して,
100 mg/kg以上の投与群においてブドウ糖濃度が有意(p<0.01)に減少した.また,無機リン濃度が有意(p<0.01)に増加し,アルカリフォスファターゼ活性が有意(p<0.01)に低下した.さらに,400 mg/kg投与群では,尿素窒素,総コレステロールおよび総ビリルビンの各濃度,ならびにGPT,GOTおよびγ-GTPの各活性がそれぞれ対照群と比較して有意(p<0.05,p<0.01)に上昇した.これらはいずれもチオフェンの用量に依存して変化した.このほか,ナトリウム濃度がチオフェン各投与群において,また,カリウムおよび塩素濃度が25 mg/kg投与群において有意(p<0.05,p<0.01)な高値を示したが,いずれも用量に依存した変化ではなかった.総蛋白濃度,アルブミン濃度,A/G 比,クレアチニン濃度およびカルシウム濃度については,対照群とチオフェン各投与群との間に有意差は認められなかった.

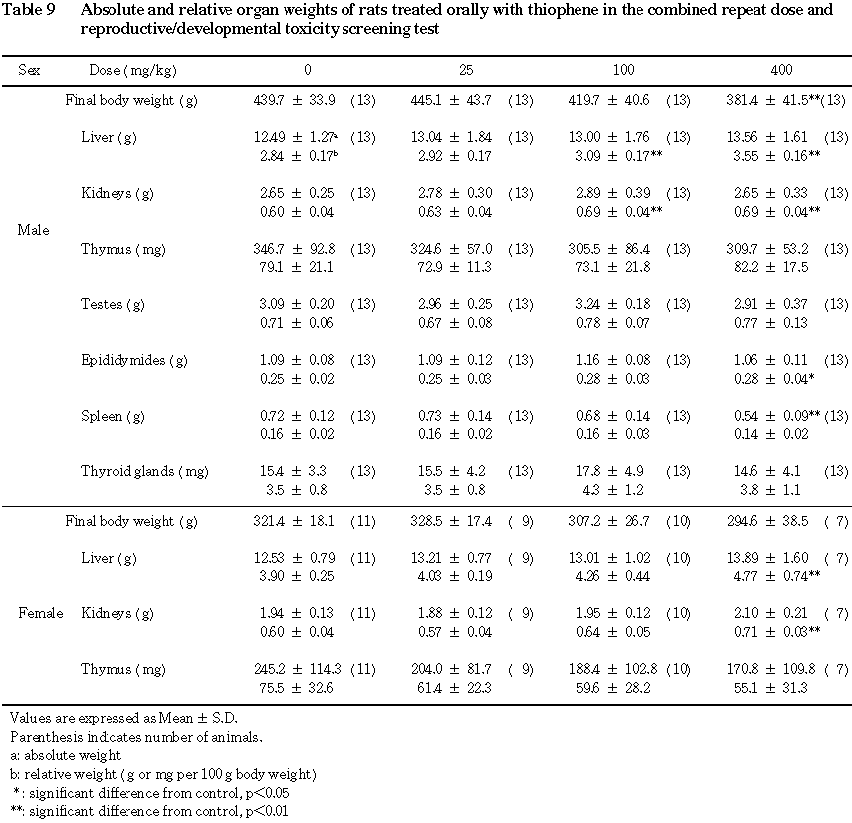
(3) 器官重量(Table 9)
25 mg/kg投与群では,重量および比体重値ともに対照群との間に有意差の認められる器官はなかった.100 mg/kg以上の投与群において肝臓および腎臓の比体重値が有意(p<0.01)な高値を示した.また,400 mg/kg投与群では,脾臓重量が有意(p<0.01)な低値を示した.400 mg/kg投与群における精巣上体重量は対照群と同様であったが,解剖時体重が対照群と比較して有意(p<0.01)な低値を示したことから,比体重値が対照群と比較して有意(p<0.05)な高値を示した.胸腺,精巣および甲状腺については,重量および比体重値ともに対照群との間で有意差は認められなかった.
(4) 剖検所見
肝臓では 400 mg/kg投与群において2例に暗赤色化が,また,1例に退色がみられた.腫大は,チオフェン各投与群の1例ずつに認められ,黄色化が,対照群の4例,25 mg/kg投与群の5例,100 mg/kg投与群の3例および400 mg/kg投与群の1例にみられた.このほか,対照群の2例,25および100 mg/kg投与群の各4例,400 mg/kg投与群の1例に肝小葉の明瞭化がみられた.
腎臓では, 400 mg/kg投与群に皮質の陥凹および退色が1例みられ,100 mg/kg投与群に腎乳頭の赤色化が1例みられた.また,25および100 mg/kg投与群の各1例,対照群の3例に腎盂の拡張が認められた.
肺では,対照群, 100,および400 mg/kg投与群の各1例に暗赤色点,対照群の2例に灰白色域,1例に白色点がみられた.
甲状腺では 100および400 mg/kg投与群の各2例に腫大,25 mg/kg投与群の1例に萎縮が認められた.
以上のほかに,対照群では胸腺の赤色点,心臓の白色点および精嚢の萎縮が各 1例にみられ,25 mg/kg投与群では副腎の腫大が2例に,100 mg/kg投与群では精巣上体の結節が1例にみられ,400 mg/kg投与群では,脾臓の萎縮を伴う退色,精巣および精巣上体の萎縮が各1例にみられた.また,100 mg/kg投与群では,水頭症が観察された.
(5) 病理組織検査所見(Table 10)
各器官における観察所見を以下に示す.
(小脳)
400 mg/kg投与群の1例に,IIIおよびVI〜X葉の顆粒細胞層に限局して,顆粒細胞の核濃縮を伴うごく軽度な壊死が認められたが,白質板および分子層に変化は認められなかった.
(肝臓)
100 mg/kg投与群において,小葉中心部の肝細胞の肥大が7例,マクロファージの浸潤が4例にみられたが,小葉中心性の肝細胞壊死は認められなかった.400 mg/kg投与群では,全例に軽度またはごく軽度な小葉中心性の肝細胞壊死と肝細胞の軽度な肥大が認められ,そのうちの11例に肝細胞細胞質の均質化または小空胞化とマクロファージの浸潤が認められた.小葉中心部の肝細胞細胞質の均質化および小空胞化が観察された例のうちの2例についてOil red O染色を行ったが,小空胞化した肝細胞には染色性を示す顆粒はほとんど認められなかった.その他,対照群およびチオフェン投与群に小肉芽腫や小葉中心性および周辺性の肝細胞の脂肪化がみられたが,対照群とチオフェン各投与群との間に頻度および程度の差は見られなかった.
(腎臓)
Eosinophilic bodyが対照群の1例,25 mg/kg投与群の8例,100 mg/kg投与群の6例および400 mg/kg投与群の5例に認められたが,400 mg/kg投与群では,他の投与群と比較してより多数のeosinophilic bodyが認められた.また,対照群では12例,25および100 mg/kg投与群では各10例および400 mg/kg投与群では7例に萎縮および再生性の尿細管がみられたが,対照群とチオフェン各投与群との間に頻度および程度の差は認められなかった.その他,腎盂の拡張が,対照群の4例ならびに,25 および100 mg/kg投与群の各1例にみられ,間質内のリンパ球の浸潤が,対照群の2例および25 mg/kg投与群の1例に認められた.また,対照群では,髄質のごく少数の尿細管内に硝子円柱が2例にみられ,皮髄境界部にごく軽度なカルシウム沈着が1例にみられた.25 mg/kg 投与群では腎盂に移行上皮の限局性の軽度な過形成が1例にみられ,100 mg/kg投与群では皮質の尿細管のごく軽度な拡張が1例にみられた.
(肺)
対照群の 4例および400 mg/kg投与群の2例の動脈壁にカルシウム沈着,対照群の9例および400 mg/kg投与群の2例に肺胞内の泡沫細胞の集簇がみられ,そのうち対照群の3例ではマクロファージ,好中球およびリンパ球の浸潤を伴う肺胞炎が認められた.
(脾臓)
対照群および 400 mg/kg投与群の全例に髄外造血および色素沈着がみられた.
(心臓)
対照群の 4例および400 mg/kg投与群の1例に限局性のごく軽度な心筋壊死がみられた.
(膀胱)
対照群の 1例および400 mg/kg投与群の2例に粘膜上皮のごく軽度なびまん性の過形成がみられた.
(精巣上体)
対照群の 1例および400 mg/kg投与群の3例にごく軽度なリンパ球の浸潤が,また,対照群の1例に軽度な精子肉芽種がみられたが,400 mg/kg投与群と対照群との間に程度および頻度の差は認められなかった.400 mg/kg投与群の1例に精細管内生殖細胞の壊死・変性が認められた.
(精巣)
400 mg/kg投与群の1例の精細管が萎縮し,生殖細胞が減少しており,間質細胞のごく軽度な過形成がみられ,その例の精巣上体では管腔内に壊死および変性した生殖細胞がみられた.
(大脳,胸腺,甲状腺,副腎および脊髄)
いずれの投与群にも変化はみられなかった.




B. 雌〔解剖日:瀕死屠殺日,哺育4日(出生児生存),哺育4日(全出生児死亡),妊娠25日相当日(不妊および全胚死亡例),交配期間終了日(交尾不成立例)〕
(1) 剖検所見
肝臓では,色調の変化がチオフェン各投与群で観察された. 25および100 mg/kg投与群では,暗赤色化が少数に観察されたが,400 mg/kg投与群では,暗赤色化が4例に観察された他に,灰白色および黄色域が3例に,また,赤色域が2例に観察された.400 mg/kg投与群の瀕死屠殺例では,前記の赤色域の他に黄色化も観察された.小葉の明瞭化も400 mg/kg投与群の瀕死屠殺例を含むチオフェン各投与群に少数例ずつ観察された.このほか,400 mg/kg投与群では腫大が1例に認められた.また,25 mg/kg投与群では横隔膜ヘルニアが1例に認められた.
胸腺では,チオフェン各投与群の分娩例および 400 mg/kg投与群の瀕死屠殺例に萎縮が観察された.25 mg/kg投与群では,2例と少なかったが,100 mg/kg投与群では4例,400 mg/kg投与群では6例と用量の増加に伴って増加した.このほか,対照群の1例に赤色点がみられた.
脾臓では 100 mg/kg投与群の1例,瀕死屠殺例を含む400 mg/kg投与群の4例に萎縮が認められ,対照群では陥凹部が,また,400 mg/kg投与群では濾胞の不明瞭化がそれぞれ1例ずつにみられた.
肺では, 25 mg/kg投与群の2例に暗赤色点が認められた.
副腎では,対照群に暗調の混濁化が,また, 100 mg/kg投与群に腫大がそれぞれ1例に認められた.
腹部および陰部の被毛の汚れは, 100 mg/kg投与群の2例および,瀕死屠殺した400 mg/kg投与群の1例に認められた.
その他,対照群では,前胃に黄色物沈着が, 25 mg/kg投与群では,膵臓の赤色化が,100 mg/kg投与群では,腎臓皮質の退色化が,それぞれ1例に認められた.また,100 mg/kg投与群の全胚死亡例では,子宮の暗赤色化および肥厚,ならびに腟に暗赤色液の貯留が認められた.400 mg/kg投与群では,甲状腺の腫大が1例に認められた.また,瀕死屠殺した400 mg/kg投与群の動物には,顎下腺の萎縮,腎臓髄質の赤色化,腺胃にヘマチンの付着,胃および腸管の内容物の著しい減少が認められた.
(2) 器官重量(Table 9)
哺育 4日出生児生存例では,100 mg/kg以下の投与群には,重量および比体重値ともに対照群と比較して有意差の認められた器官はなかった.400 mg/kg投与群では,肝臓および腎臓の比体重値が対照群と比較して有意(p<0.01)な高値を示した.しかし,胸腺重量については対照群との間に有意差は認められなかった.
瀕死屠殺,交尾不成立および不妊であったため,途中剖検した動物においても 400 mg/kg投与群では,肝臓および腎臓の比体重値が高値の傾向を示した.また,瀕死屠殺例および全出生児死亡例では,チオフェンの用量とは無関係に胸腺重量が低値の傾向を示した.
(3) 病理組織所見(Table 10)
各器官における観察所見を以下に示す.
(大脳)
400 mg/kg投与群で小脳に明らかな変化を示した例のうち,瀕死屠殺例を含む4例に脳室の軽度な拡張が,また,3例に脳室周囲のごく軽度な浮腫が認められた.
(小脳)
100 mg/kg投与群では,1例にごく軽度な顆粒細胞の壊死が認められたが,400 mg/kg投与群では,核濃縮を伴う顆粒細胞の壊死が8例に認められた.さらに,400 mg/kg投与群の顆粒細胞の壊死巣付近では,白質板の壊死が7例に,また,分子層の軽度な空胞化およびプルキンエ細胞の変性または脱落が各6例にみられ,壊死巣内および周囲では脂肪顆粒細胞の浸潤が4例に,出血が4例に,また,カルシウム沈着が3例にみられた.顆粒細胞,白質板および分子層に強い変化がみられた例の小脳核では,多数の神経細胞の空胞変性が4例に,また,軽度な浮腫が2例に認められた.顆粒細胞が著しい壊死を起こし,白質板にも明らかな壊死が認められた例の病変域はほぼ全葉に及んでおり,特に,II〜IV,IXまたはX葉の顆粒細胞層では変化が強く,IIIおよびIV葉では分子層およびプルキンエ細胞にも明らかな変化がみられた.一方,小脳の変化が軽度な例では,病変部は顆粒細胞層にほぼ限局しており,主にII,IIIまたはIX葉に変化がみられた.これらの変化は,投与8日に行った瀕死屠殺例や,不妊解剖を行った例など,試験途中で剖検した400 mg/kg投与群の非妊娠動物にも認められた.
(肝臓)
400 mg/kg投与群の瀕死屠殺例を含む5例に小葉中心性の肝細胞壊死がみられ,そのうちの瀕死屠殺例を除く4例では,壊死組織周囲にマクロファージが浸潤しており,瀕死屠殺例を含む2例では好中球の浸潤がみられた.400 mg/kg投与群の瀕死屠殺例を含む3例に出血がみられた.また,小葉中心部では全例に肝細胞の肥大が認められ,瀕死屠殺例を含む4例に肝細胞細胞質の均質化または小空胞化が認められた.また,小葉中心部にもマクロファージの浸潤がみられた.100 mg/kg投与群の小葉中心部でも11例に肝細胞の肥大が認められ,そのうち3例に肝細胞の壊死が,1例に軽度な肝細胞の均質化または小空胞化,5例にマクロファージの浸潤がみられた.小葉中心性の肝細胞の脂肪化が,対照群に5例,25 mg/kg投与群に6例,100 mg/kg投与群に9例,400 mg/kg投与群に12例みられた.肝臓に小葉中心部の肝細胞細胞質の均質化および小空胞化が観察された例のうちの2例および対照群1例についてOil red O染色を行った.その結果,小空胞化した肝細胞は瀕死屠殺した1例では小空胞とともに染色性を示す顆粒が認められたが,他の3例では染色性を示す顆粒はほとんど認められなかった.その他,小肉芽腫および小葉周辺性の脂肪化が認められたが,対照群とチオフェン各投与群との間に頻度および程度の差は認められなかった.
(腎臓)
チオフェン各投与群に尿細管上皮細胞の空胞変性が認められ, 100および400 mg/kg投与群では頻度および程度が増強した.対照群の1例および尿細管上皮細胞の空胞変性が観察された雌の例のうち1例についてOil red O染色を行った.その結果,空胞変性した尿細管上皮細胞は,まったく染色性を示さなかった.このほか,すべての投与群に萎縮または再生性の尿細管がみられたが,その頻度および程度に対照群とチオフェン各投与群との間で差はなかった.また,対照群の1例および400 mg/kg投与群の3例に髄質の尿細管の拡張,対照群および25 mg/kg投与群の各1例,および100 mg/kg投与群の2例に皮質の限局性の線維化,対照群の1例および 100 mg/kg投与群の2例にごく軽度な間質へのリンパ球の浸潤,対照群の1例および400 mg/kg投与群の2例に皮髄境界部のごく軽度なカルシウム沈着が認められた.
(胸腺)
対照群の 3例にごく軽度な萎縮がみられた.25 mg/kg投与群ではその程度が,また,100および400 mg/kg投与群では頻度および程度が増強したが,対照群との間には,頻度および程度ともに差は認められなかった.
(脾臓)
25および100 mg/kg投与群の各2例,ならびに瀕死屠殺例を含む,400 mg/kg投与群の3例にごく軽度な赤脾髄での血液量の減少がみられ,そのうち,瀕死屠殺例では濾胞の萎縮を伴っていた.また,色素沈着は全例でみられたが,25 mg/kg投与群の2例および400 mg/kg投与群の5例では程度が強かった.その他,髄外造血は各群のほぼ全例でみられ,程度および頻度についても対照群とチオフェン各投与群との間に差は認められなかった.
(肺)
対照群の 10例および400 mg/kg投与群の7例に肺胞内の泡沫細胞の集簇が,また,対照群および400 mg/kg投与群の各1例の動脈壁にごく軽度なカルシウム沈着がみられた.
(心臓)
対照群の 1例および400 mg/kg投与群の3例に限局性のごく軽度な心筋壊死がみられた.
(副腎)
400 mg/kg投与群の1例に束状帯および網状帯の広範な壊死がみられた.
(甲状腺)
対照群の 1例に異所性の胸腺組織がみられた.
(胸腺,副腎,脊髄,不妊および交尾不成立雌の卵巣)
変化はみられなかった.
1) 交配成績(Table 11)
交尾率および同居開始から交尾までに要した日数ならびにその間に回帰した発情期の回数に対照群とチオフェン各投与群との間で有意差は認められなかった.また,着床の有無を基準に妊娠の成否を判定する限りにおいては,受胎した雌の数に群間で著しい差はみられず,したがって受胎率にも対照群とチオフェン各投与群との間で有意差は認められなかった.

2) 分娩および哺育状態
観察が可能であった動物については,分娩状態の異常は観察されなかった.また,妊娠期間にも対照群とチオフェン各投与群との間で有意差は認められなかった.なお, 100 mg/kg投与群の1例は,腟栓が確認され,交尾成立が確認されてから,20日後に分娩した.しかし,出生児の体重および外表から判断された成熟度は交尾成立後22日に分娩した動物の出生児と差はなく,また,腟内に腟栓が確認された2日前に,精子は確認されなかったが,腟栓の落下が認められていたことから,この動物は交尾成立日が特定されなかったと判断して,妊娠期間ならびに妊娠期の体重および摂餌量を評価の対象から除外した.哺育状態については,児集めや児の保温を行わず,このため乳頭の突出が不良であった動物が,100 mg/kg投与群に2例,400 mg/kg投与群に1例観察された.さらに,400 mg/kg投与群では,これらの哺育行動は認められるものの,乳頭の突出が不良であった動物が1例認められた.
3) 黄体数,着床数および着床率(Table 12)
妊娠動物の黄体数,着床数および着床率に対照群とチオフェン各投与群との間で有意差は認められなかった.
4) 出産率および妊娠期間(Table 12)
出産率および妊娠期間に対照群とチオフェン各投与群との間で有意差は認められなかった.
1) 一般状態および生存性(Table 12)
対照群の出生児に一般状態の異常は観察されず,全出生児の死亡した腹もなかった. 25 mg/kg投与群では,分娩時に母動物の下腹部に被毛汚染の観察された1腹において,哺育0日に出生児の腹部に乳汁の貯留(ミルクスポット)が観察されず,哺育1日に全例が死亡した.100 mg/kg投与群では,哺育0日から,母動物の哺育不良に起因する体表温の低下や,ミルクスポットの認められない出生児が2腹に観察され,このうち1腹の出生児は,哺育2日までに全例が死亡した.他の1腹の出生児は,哺育1日には異常は観察されなくなった.400 mg/kg投与群では,哺育1日から母動物の哺育不良に起因する,出生児の体表温の低下や,ミルクスポットの無形成が1腹の出生児に観察され,哺育4日までに全例が死亡した.また,2腹の出生児は,哺育0日に異常は観察されなかったが,1腹は哺育2日から,また,他の1腹は哺育4日に,それぞれ全例の出生児の腹部にミルクスポットが認められなくなり,1腹は哺育4日までに全出生児が死亡した.なお,これら400 mg/kg投与群の3腹の母動物には,ふらつき歩行や,振戦などが観察された.
児の生存率については, 100 mg/kg以下の投与群ではいずれの時期も対照群と同様であった.400 mg/kg投与群では,分娩率,生児出産率および出生率などの出生日の生存性には投与の影響は認められなかったが,生後の死亡がやや増加し,新生児の4日の生存率が低値の傾向を示した.しかし,対照群との間に有意差は認められなかった.
性比については対照群とチオフェン各投与群との間で有意差は認められなかった.

チオフェンによる肝臓障害は,チオフェンの代謝過程で生成された活性中間体による毒性であることが明らかにされている 10).チオフェンは,肝臓のP450 monooxigenasesにより,S-oxidationを受け,その結果,反応性の非常に高いthiophene-S-oxidesに転換されることがin vitro22)でも,また,in vivo23)でも証明されている.チオフェンの主要な尿中代謝物は,メルカプト尿酸であることから,thiophene-S-oxidesの代謝には,グルタチオン付加が関与しているものと考えられている23).一方,thiophene-S-oxidesは好電子性であるため,グルタチオンのない条件では,ミクロゾーム蛋白と非可逆的に結合する22).従って,チオフェンによる肝臓障害には,thiophene-S-oxidesの生成量と,グルタチオン付加などの第2相の代謝活性が関与しているものと考えられる.本試験では雌雄ともに肝臓に同質の病理組織所見が観察されているが,雌では,所見の有無に個体差はあるものの,雄と比較すると,より低い投与量から所見が認められ,その程度も雄と比較して増強されており,チオフェンによる肝臓障害には性差があるものと考えられる.一般に,肝臓の薬物代謝酵素活性は雄の方が高いので,thiophene-S-oxidesは雄においてより多く生成されると考えられるが,雄における肝臓障害の程度がむしろ弱かったのは,第二相の代謝活性や,細胞内の求核性分子の種類あるいは濃度などに相違があったためと推測される.
雌における肝細胞壊死の個体差の成因については,本試験結果からは明らかではないが,肝細胞壊死が非妊娠動物にも分娩後の動物にも観察されていることから,動物の生理状態よりも活性中間体の第二相の代謝活性などの個体差によるものと推測される.
雌では, 400 mg/kg 投与により,投与初期から一部の動物が運動失調を呈した.また,病理組織検査では,小脳の顆粒細胞壊死があり,これに伴って小脳核神経細胞の変性が観察された.また,100 mg/kg投与によっても軽度な変化が1例に観察された.雄では,運動失調を呈する動物は無く,また,病理組織検査においても 400 mg/kg 投与群の1例に軽度な所見が観察されたのみで,小脳の変化にも性差が認められた.チオフェンの毒性変 化として小脳の顆粒細胞壊死および小脳核神経細胞の変性も,すでに報告されているが11-13),小脳に著しい変化の観察された動物には,肝細胞壊死も顕著に観察され,小脳の顆粒細胞壊死および小脳核神経細胞の変性の成因と肝細胞壊死の成因は同一であると推測される.脳においても薬物代謝酵素が合成されていることが証明されており24),小脳には,P4501A1/2や,P4502E1などの活性のあることが明らかにされている25).小脳病変の原因が,肝臓で生成されたチオフェンの活性中間体が脳血管関門を越えて小脳に流入したことにより惹起されたものか,あるいは,チオフェンが脳血管関門を越えて小脳に入り,小脳の薬物代謝酵素で代謝された結果生成された活性中間体により惹起されたものかは,さらに詳細な検討が必要であると考えられる.小脳における変性には部位特異性があり,II〜IVおよびIX葉の顆粒細胞に顕著に観察された.これは,既報12)ともほぼ一致する所見であるが,これらの葉は下小脳動脈の支配領域にあること12),また,小脳核神経細胞の分泌機能あるいは細胞間の情報伝達物質系は,小脳核神経細胞の細胞種ごとに異なること26)等から,小脳におけるチオフェンの毒性発現には,障害を受ける細胞の解剖学的および生化学的性質が関係しているものと推測される.
職業的にチオフェンを使用している労働者に腎障害が起こることが報告されているが,本試験では,腎臓重量比体重値は雌雄ともに増加した.病理組織検査では, 100 mg/kg以上の投与群の雌において尿細管上皮の空胞変性が有意に増加したが,その程度と,肝臓や小脳の病理組織変化の程度や,動物の一般状態,あるいは哺育状態との間に相関性は認められないことから,尿細管上皮の空胞変性は,チオフェン投与による変化であると考えられるが,その成因は,肝臓あるいは小脳病変の成因とは異なるものと推測される.雄の病理組織検査では,400 mg/kg投与群においてeosinophilic bodyの数の軽度な増加が認められたのみであった.血液生化学検査においても,血液尿素窒素濃度が増加したが,クレアチニン濃度には異常は認められなかったことから,少なくとも雄に腎臓機能障害はなかったものと考えられる.
チオフェンを経口投与すると,尿中にはメルカプト尿酸として排泄されることが報告されている 19).投与末期に行った尿検査では,pHがアルカリを示すものが,用量依存的に増加した.予備試験では,投与2および9日に尿検査を実施したが,pHは弱酸性から弱アルカリ性を呈していたことから,投与を反復することにより,pHが上昇したものと推測される.メルカプト尿酸は,酸性であることから,尿のpHの上昇は,少なくとも尿中に排泄されたメルカプト尿酸に起因するものではないと考えられるが,その原因については,本試験成績からは明らかにならなかった.
脾臓重量が 400 mg/kg投与群の雄で低下した.また,重量測定は行わなかったが,100 mg/kg投与群の雌で脾臓の萎縮が観察された.しかし,雌雄ともに病理組織の変化は伴っていなかった.SHR 系ラットを用いた実験13)でも,脾臓重量の低下が報告されているが,組織学的には濾胞の萎縮を伴っており,今回の結果とは異なる.このほか雌の脾臓の病理組織検査では,チオフェン各投与群において,赤脾髄の血液量の減少が観察されたが,用量に伴う変化ではなく,雄には認められなかった.
雄の血液学検査において, 100 mg/kg以上の投与群で血色素量が軽度に低下したが,肝臓機能の指標となる酵素活性や器官重量との間に相関性は認められず,また,生理的変動の範囲内であることから,毒性変化であるとは判断されない.
血液生化学検査を実施した雄の 100 mg/kg以上の投与群において,ブドウ糖濃度の減少,無機リン濃度の増加ならびにアルカリフォスファターゼ活性の低下が認められたが,いずれも軽微な変化であった.
交配成績および生殖器の病理組織検査から,チオフェンの雌雄動物の生殖能力に対する影響は認められなかった.チオフェンは,精子形成に影響を及ぼす化学物質のひとつに挙げられている 14)が,今回の試験結果からは,形態学的にも,機能の面からもチオフェンの影響は認められなかった.
チオフェンの投与量に伴う着床前死亡,胚・胎児死亡および形態異常などの増加は認められないことから, 400 mg/kgまでの投与量のチオフェンには発生毒性はないものと考えられる.
分娩に対するチオフェン投与の影響は認められなかったが, 100 mg/kg以上の投与群の少数の母動物に,児を集めたり保温したりするといった哺育行動に低下が認められた.また,400 mg/kg投与群では,母動物の哺育行動にこのような異常は認められないにもかかわらず,新生児の腹部に乳汁の貯留が認められないことから,泌乳の低下が疑われる動物が認められた.これらの動物には100 mg/kg投与群の1例を除いていずれも,小脳核神経細胞の変性が観察されており,哺育行動の低下,あるいは泌乳状態の不良は,チオフェン投与による二次的変化であると推測される.
有意差は認められなかったものの, 400 mg/kg投与群では新生児生存率が著しく低値を示した.新生児の4日の生存率の低下は,母動物の哺育行動あるいは泌乳の低下に起因すると考えられるが,本試験結果からは,活性中間体が乳汁を介して,母動物から新生児へと移行し,それが新生児に毒性を発現した可能性も否定できなかった.
これらのことから本試験条件下では,チオフェンの無影響量は,反復投与毒性に関しては,雌雄いずれに対しても 25 mg/kg/dayであり,生殖発生毒性に関しては,雄に対しては400 mg/kg/day,雌に対しては,25 mg/kg/day,新生児に対しては,100 mg/kg/dayであると推察される.
| 1) | The Merck Index, An Encyclopedia of Chemicals, Drugs, and Biologicals. S. Budavari, M. J. O'Neil, A. Smith, P. E. Heckelman, eds., Eleventh edn., Merck & CO., Inc., Rahway, N.J., U.S.A. (1989). |
| 2) | National Toxicology Program: Health and safety program for thiophene. Research Triangle Park, N.C., U.S.A.:NTP, (1986). |
| 3) | National Toxicology Program: Prechronic design for thiophene. Part of Toxicology Design Committee package. Research Triangle Park, N.C., U.S.A.: NTP (1985). |
| 4) | И.Б. Mиxaйлeц,Г. A. Mиxaйлeц, Д.Г.Лeлbц, A. B.Валиxmetoв, Gigiena Truda i Professional nye Zabolevaniia, 10, 57 (1966). |
| 5) | National Technical Information Service:AD277-689, Springfield, V.A., U.S.A. |
| 6) | J. Marhold, "Preheld Prumyslove Toxikologie," Organicke Latky, Avicenum, Praha, Checoslovakia, 1986, p.1089. |
| 7) | A.A. Nomeir, P.M. Markham, M. Chadwick, J. Toxicol. Envirn. Health, 39, 223 (1993). |
| 8) | H.G. Bray, F.M.B. Carpanini, B.D. Waters, Xenobiotica, 1, 157 (1971). |
| 9) | P.M. Dansette, C. Amar, C. Smith, C. Pons, D. Mansuy, Biochem. Pharmacol., 339, 911 (1990). |
| 10) | R.J. McMurtry, J.R. Mitchell, Toxicol. Appl. Pharmacol., 42, 285 (1977). |
| 11) | R.M. Herdon, Exp. Brain Res., 6, 49 (1968). |
| 12) | F. Mori, G. Koya, Y. Yoshida, K. Tamayama, T. Nishioka, J. Toxicol. Pathol., 5, 21 (1992). |
| 13) | F. Mori, G. Koya, Y. Yoshida, J. Toxicol. Pathol., 6, 223 (1993). |
| 14) | E. Nieschlag, Th. Schurmeyer, Arch. Toxicol., Suppl., 7, 146 (1984). |
| 15) | E. Salewski, Pharmacol., 247, 367 (1964). |
| 16) | 西村秀雄,"胎児科学," 雄鶏社, 東京, 1976, pp.115〜177. |
| 17) | 佐久間昭,"薬効評価−計画と解析," 東大出版会,東京, 1977. |
| 18) | C. W. Dunnett, Biometrics., 20, 482 (1964). |
| 19) | H. Scheff Biometrika., 40, 87 (1953). Biometrika., 40, 87 (1953). |
| 20) | W. H. Kruskal and W. A. Wallis, J. amer. Statist. Assoc., 47, 583 (1952). |
| 21) | 丹後俊郎,"医学への統計学(古川俊之 監修)," 朝倉書店, 東京, 1985. |
| 22) | A.V. Hodgson, T.B. White, J.W. White, H.W. Strobel, Mol. Cell. Biochem., 120, 171 (1993). |
| 23) | H. K. Anandatheerthavarada, J.F. Williams, L. Wecker, Biochem. Biophys. Res. Commun., 194, 312 (1993). |
| 24) | 遠山正彌,"医学のあゆみ," 170, 576 (1994). |
| 25) | D. Mansuy, P. Valadon, I. Erdelmeier, P. Lopez-Garcia, C. Amar, J.-P. Girault, P. M. Dansette, J. Am. Chem. Soc., 113, 7825 (1991). |
| 26) | P. M. Dansette, D. C. Thang, H. E. Amri, D. Mansuy, Biochem. Biophys. Res. Commun., 186, 1624 (1992). |
| 連絡先 | |||
| 試験責任者: | 長尾哲二 | ||
| 試験担当者: | 代田眞理子,森村智美, 渡辺千朗 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257 神奈川県秦野市落合729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Tetsuji Nagao (Study director), Mariko Shirota, Tomomi Morimura, Chiaki Watanabe | ||
| Hatano Research Institute, Food and Drug Safety Center | |||
| 729-5 Ochiai, Hadano, Kanagawa, 257, Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||