 法),グルタミン酸オキザロ酢酸トランスアミナーゼ(GOT:IFCC法),グルタミン酸ピルビン酸トランスアミナーゼ(GPT:IFCC法),γ-グルタミルトランスペプチダーゼ(γ-GTP:Orl
法),グルタミン酸オキザロ酢酸トランスアミナーゼ(GOT:IFCC法),グルタミン酸ピルビン酸トランスアミナーゼ(GPT:IFCC法),γ-グルタミルトランスペプチダーゼ(γ-GTP:Orl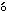 wski法)およびアルカリホスファターゼ(ALP:Bessey-Lowry改良法)をCentrifiChem ENCOREⅡ(米国ベーカー社)で測定した.
wski法)およびアルカリホスファターゼ(ALP:Bessey-Lowry改良法)をCentrifiChem ENCOREⅡ(米国ベーカー社)で測定した.
雌雄とも,400 mg/kg群で投与2週から死亡例が認められた.雄および雌の死亡例はそれぞれ投与2週で1および2例,3週で5および7例,4週で2および1例であり,死亡率は雄で80%,雌で100%であった.病理学検査の結果には死因に結びつく変化は認められなかった.
一般状態の観察では,雌雄の100 mg/kg群で縮瞳,200および400 mg/kg群で縮瞳および流涎が認められた.さらに400 mg/kg群で雌雄に被毛の汚れが,雌に振戦が認められ死に至った.雌雄で観察された症状は回復試験では観察されず,回復を示した.
体重は雄の400 mg/kg群で増加が抑制され,投与3週以降有意であった.摂餌量には,雌雄とも群間で明確な差は認められなかった.回復期間中は,雌雄とも対照群と被験物質投与群とで有意な差は認められなかった.
血液学検査の結果,雄の400 mg/kg群で投与終了時まで生存した1例でリンパ球数低値に伴う白血球数の低値が認められたが,これを除き回復期間終了時の結果を含め被験物質の投与と関連づけられる変化は認められなかった.
血液凝固能検査の結果,雄の400 mg/kg群で投与終了時まで生存した1例でフィブリノーゲン量の低値が認められたが,これを除き雌雄とも毒性学的に意義のある変化は認められなかった.
血液生化学検査の結果,雄の200 mg/kg群で総コレステロールが高値傾向を示した.回復期間終了時には,雄の200 mg/kg群でA/G比が僅かながら低値を示した.
尿検査の結果,雄の100 mg/kg群以上および雌の200 mg/kg群以上の群で尿量の増加傾向が認められた.
器官重量測定の結果,雄の200 mg/kg群で脾臓の実重量が高値,雌の200 mg/kg群で肝臓の実重量および相対重量が高値を示し,さらに,雄の400 mg/kgで脾臓の実重量ならびに胸腺の実重量および相対重量が低値傾向を示した.また,回復期間終了時,雄の200 mg/kg群で副腎の実重量および相対重量が高値を示し,さらに雄の400 mg/kgで副腎の実重量が高値傾向および精巣の実重量が低値傾向を示した.
病理学検査の結果,投与終了時に計画解剖した動物の組織所見には,被験物質投与の影響を示唆する変化は観察されなかった.死亡動物の組織所見では,肝臓の細胞質内封入体が雌雄に,副腎の皮質の空胞変性が雌に観察されたが,いずれの病変も投与終了時の計画解剖例には観察されなかった.
以上の結果,本試験条件下におけるN,N-ジメチルベンジルアミンの無影響量(NOEL)は,雌雄とも50 mg/kg/dayと考えられた.
従って,28日間反復投与毒性試験では雌雄とも確実な影響がでることが推察される400 mg/kgを最高用量に設定し,以下公比2で除し高用量を200 mg/kg,中用量を100 mg/kg,低用量を50 mg/kgとした.なお,400 mg/kg群では死亡例も出ることが予想されることから,高用量の200 mg/kg群にも回復群を設けることとした.
a.血液学検査
EDTA-3Kを添加した初血を用い,白血球数(WBC:暗視野板法),赤血球数(RBC:暗視野板法),ヘモグロビン量(HGB:シアンメトヘモグロビン法),ヘマトクリット値(HCT:RBC,MCVより算出),平均赤血球容積(MCV:暗視野板法),平均赤血球血色素量(MCH:HGB,RBCより算出),平均赤血球血色素濃度(MCHC:HGB,HCTより算出),血小板数(PLT:暗視野板法)および白血球百分率(フローサイトメトリー法)を血液自動分析装置THMS H・1E(米国マイルス社)を用いて測定した.
網赤血球(RC)率算定のため抗凝固剤添加(EDTA-3K)血液をニューメチレンブルーで染色後,塗抹標本を作製し鏡検した.
また,クエン酸ソーダ添加血液の血漿について,プロトロンビン時間(Quick1段法),活性化部分トロンボプラスチン時間(クロット法)およびフィブリノーゲン量(トロンビン時間法)を血液凝固自動測定装置KC-40(独国Amelung社)を用いて測定した.
b.血液生化学検査
血清を用いて,総蛋白(ビューレット法),アルブミン(B.C.G.法),A/G比(計算値),血糖(グルコースオキシダーゼ法),中性脂肪(酵素比色法),総コレステロール(コレステロールオキシダーゼ法),尿素窒素(BUN:ウレアーゼアンモニア指示薬法),総ビリルビン(ジアゾ法),カルシウム(アルセナゾⅢ法),無機リン(モリブデン酸青法),ナトリウム(電極法),カリウム(電極法)および塩素(電極法)をEKTACHEM 700N(米国コダック社)で,クレアチニン(Jaff 法),グルタミン酸オキザロ酢酸トランスアミナーゼ(GOT:IFCC法),グルタミン酸ピルビン酸トランスアミナーゼ(GPT:IFCC法),γ-グルタミルトランスペプチダーゼ(γ-GTP:Orl
法),グルタミン酸オキザロ酢酸トランスアミナーゼ(GOT:IFCC法),グルタミン酸ピルビン酸トランスアミナーゼ(GPT:IFCC法),γ-グルタミルトランスペプチダーゼ(γ-GTP:Orl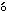 wski法)およびアルカリホスファターゼ(ALP:Bessey-Lowry改良法)をCentrifiChem ENCOREⅡ(米国ベーカー社)で測定した.
wski法)およびアルカリホスファターゼ(ALP:Bessey-Lowry改良法)をCentrifiChem ENCOREⅡ(米国ベーカー社)で測定した.
c.尿検査
血液学検査に先立ち,採尿器を用いて24時間(午前10時から翌日午前10時まで)尿を採取し,尿量,色調および濁度を検査後,尿比重計UR-S((株)アタゴ)を用いて尿比重を測定した.また,尿を遠心分離後Sternheimer変法により沈渣を染色し,鏡検した.pH,潜血,ケトン体,糖,蛋白,ビリルビンおよびウロビリノーゲンの検査は,排泄3時間以内の新鮮尿について,N-マルティスティックスSG試験紙(マイルス・三共(株))およびCLINITEK200(米国マイルス社)を用いて行った.
病理組織学検査は固定した器官・組織のうち,投与終了時および回復試験終了時に解剖した対照群と高用量群の心臓,胸腺,肝臓,脾臓,腎臓,副腎および骨髄(大腿骨)について検索した.また,雌雄の肝臓,雄の胸腺および雌の副腎について他の用量群および回復群についても実施した.なお,雌雄ともに400 mg/kg群で投与期間中に死亡例が多発したため,雌雄の200 mg/kg群を組織学検査に供した.常法に従って薄切標本を作製し,ヘマトキシリン・エオジン染色した.
有意水準は5および1%の両側検定で実施した.
回復期間中には,雌雄とも対照群,200 mg/kg群および400 mg/kg群(雄)で死亡例は認められなかった.
雌では,100,200および400 mg/kg群で投与2日から軽度の縮瞳が認められ,100 mg/kg群では5例中2例,200 mg/kg群では10例中6例,400 mg/kg群では10例中7例に観察された.また,口吻周囲が濡れる程度の流涎が200 mg/kg群では投与14日から,400 mg/kg群では投与8日から認められ,それぞれ10例中7例および全例に観察された.さらに,振戦が400 mg/kg群で投与14日から10例中7例に認められた.これらの症状はいずれも回復期間では認められなかった.その他の変化として,尿による下腹部を濡らす程度の被毛の汚れが400 mg/kg群で投与14日から8例中5例,軽度の外傷が100 mg/kg群で投与15日から1例に観察された.顎下部に認められた外傷は,投与終了時の計画解剖動物であったため回復性は明らかではなかった.なお,流涎の程度や発現時間は雄とほぼ同じであった.
雌では,投与4週までに400 mg/kg群のすべての動物が死亡した.その他の群では,投与期間および回復期間を通じて,対照群と被験物質投与群とで有意な差は認められなかった.

雌では,50 mg/kg群でヘマトクリットの低値が認められたが,用量に対応した変化ではなかった.その他の検査項目では,いずれも対照群と被験物質投与群とで差は認められなかった.
雌では,対照群に比較して200 mg/kg群で血小板数の低値が認められたが,背景値の範囲内の変化であった(背景値1103±124×10^3/mm3,n=50).その他,いずれの検査項目も対照群と被験物質投与群とで差は認められなかった.

雌では,対照群に比較して200 mg/kg群でグルコースの高値,カルシウムが低値を示した.
雌では,対照群に比較して200 mg/kg群でBUNが高値を示したが,背景値の範囲内の変化であった(背景値 16.2±4.3 mg/dl,n=69).



雌では,対照群に比較して200 mg/kg群で肝臓重量が高値を示した.
雌では,重量測定を実施したすべての器官について,対照群と被験物質投与群とで差は認められなかった.

雌では,対照群に比較して200 mg/kg群で肝臓相対重量が高値を示した.


一般状態の観察では,雌雄の100 mg/kg群で縮瞳が,200および400 mg/kg群で縮瞳および流涎が,さらに400 mg/kgで雌雄に被毛の汚れが,雌に振戦が認められた.雌雄で観察された症状は回復期間に消失が認められ,いずれも被験物質投与による変化と考えられた.
体重は雄の400 mg/kg群で増加が抑制され,投与3週以降有意であった.摂餌量は,雌雄ともすべての投与群で明確な差は認められなかった.回復期間中は,雌雄とも対照群と被験物質投与群とで有意な差は認められなかった.
血液学検査の結果,雄の400 mg/kg群の生存した1例で白血球数の低値が認められたが,リンパ球数が低値を示したことによるものであった.これを除き回復期間終了時の結果を含め被験物質の投与と関連づけられる変化は認められなかった.
血液凝固能検査の結果,雄の200 mg/kg群,雌の50および200 mg/kg群でAPTTの短縮が認められたが,僅かな変化で毒性学的に意義のある変化とは考えられなかった.また,雄の400 mg/kg群の生存例で認められたフィブリノーゲン量の低値は,同例の体重増加抑制の程度から推察し,肝臓におけるフィブリノーゲン生成の低下によるものと考えられる.
血液生化学検査の結果,雄の200 mg/kg群で総コレステロールが高値傾向を示した.さらに本試験に先立って実施した2週間投与試験(投与量:0,20,60,180 mg/kg)の結果,180 mg/kg群の雄で総コレステロールが高値を示した.このことから,総コレステロールの高値傾向は,被験物質投与による変化と考えられた.その他,200 mg/kg群の雌で認められたグルコースの高値(背景値109±13 mg/dl,n=69)およびカルシウムの低値(背景値9.71±0.28 mg/dl,n=69)はいずれも用量に対応した変化を示さず,また,背景値の範囲内の変化であり,被験物質の投与と関連づけられるものではないと考えられた.回復期間終了時には,雄の200 mg/kg群でA/G比が低値を示したが軽微な変化であった.
尿検査の結果,雄の100 mg/kg群以上および雌の200 mg/kg群以上の群で尿量の増加傾向が認められた.
器官重量測定の結果,雄の200 mg/kg群で脾臓の実重量が高値,雌の200 mg/kg群で肝臓の実重量および相対重量が高値を示した.さらに,雄の400 mg/kgで脾臓の実重量ならびに胸腺の実重量および相対重量が低値傾向を示した.また,回復期間終了時,雄の200 mg/kg群で副腎の実重量および相対重量が高値を示し,さらに雄の400 mg/kgで副腎の実重量が高値傾向および精巣の実重量が低値傾向を示した.回復期間終了時の雌の200 mg/kg群で認められた脾臓相対重量の高値は,投与終了時には認められなかった変化であり,対脳相対重量を算出した結果変化が認められないことから,体重による影響と考えられた.
病理学検査の結果,投与終了時に計画解剖した動物の組織所見からは,被験物質投与の影響を示唆する変化は観察されなかった.回復期間終了時の解剖動物の組織所見として,胸腺の出血が200 mg/kg群の雄で2例,雌で1例観察された.雌雄の死亡動物の組織所見にも胸腺に同様の変化が観察されたが,いずれも軽度な変化であった.その他,死亡動物では雌雄とも肝臓に細胞質内封入体が,また,雌で副腎の皮質の空胞変性が観察された.いずれの病変も被験物質に起因したものとも考えられたが,投与終了時の計画解剖例には観察されなかった.解剖所見で脾臓の淡色化が死亡動物の雌雄に多く観察されたが組織所見では淡色化に関連性づけられる変化は観察されなかった.
以上の結果,100 mg/kg群以上の雌雄で認められた一般状態の変化および尿量の変化が被験物質投与と関連づけられるものと考えられた.
従って,本試験条件下におけるN,N-ジメチルベンジルアミンの無影響量(NOEL)は,雌雄とも50 mg/kg/dayと考えられた.
| 1) | 佐野正樹,岡山佳弘,医薬安全性研究会会報,32,21(1990). |
| 2) | M. Yoshida, J.J. Soc. comp. Stat., 1, 111(1988). |
| 連絡先 | |||
| 試験責任者: | 庄子明徳 | ||
| 試験担当者: | 各務 進,渡 修明,廣内康彦 | ||
| (財)食品農医薬品安全性評価センター | |||
| 〒437-12 静岡県磐田郡福田町塩新田字荒浜582-2 | |||
| Tel 0538-58-1266 | Fax 0538-58-1393 | ||
| Correspondence | ||||
| Authors: | Akinori Shoji(Study director) Susumu Kakamu,Nobuaki Watari Yasuhiko Hirouchi | |||
| Biosafety Research Center,Foods,Drugs and Pesticides(An-pyo Center) | ||||
| 582-2 Shioshinden Aza Arahama,Fukude-cho,Iwata-gun,Shizuoka, 437-12,Japan | ||||
| Tel +81-538-58-1266 | Fax +81-538-58-1393 | |||