2-(ジ-n-ブチルアミノ)エタノールは,ウレタンの触媒,繊維助剤,乳化剤および染料中間体などとして使用されている化学物質であるが1),ウサギの眼刺激性試験および皮膚刺激性試験において強い刺激性を示し,角膜または皮膚の壊死が認められることが報告されている1).また,コリンエステラーゼ活性を阻害することが知られており2),ラットに腹腔内投与あるいは吸入曝露した場合,振戦や間代性痙攣が発現し,呼吸筋麻痺による死亡が認められることが報告されている3, 4).LD50としては,Sprague-Dawley系雄ラットの場合,単回経口投与では1780 mg/kg,腹腔内投与では144 mg/kgあるいは89 mg/kgという報告がある3, 4).ヒトに対する危険性としては,眼および皮膚への腐食性,蒸気による気道への刺激性が指摘されおり1),安全管理上の許容濃度として,米国産業衛生専門家会議(ACGIH)が皮膚に対する時間加重平均限界値(TLV-TWA)を0.5 ppm(3.5 mg/m3)と定めている1).
2-(ジ-n-ブチルアミノ)エタノールの28日間反復経口投与毒性試験(回復14日間)を雌雄のSprague-Dawley系ラットを用いて実施した.雌雄とも25,100および400 mg/kgの用量の被験物質投与群ならびに媒体であるコーン油を投与する対照群の計4群を設定し,各群5匹(対照群および400 mg/kg投与群は回復試験を考慮して各10匹)の動物を用いて28日間の反復強制経口投与を行った.ただし,400 mg/kg投与群の雄3例および雌5例が投与期間中に死亡したため,雌では回復試験を行わなかった.
100および400 mg/kg投与群において,投与後断続的にケージ内を舐める動作および咀嚼様動作が観察された.また,400 mg/kg投与群では,間代性痙攣,攣縮,振戦,異常発声および蒼白,喘ぎ呼吸,呼吸数減少,活動性の低下,眼球突出,腹臥位姿勢および流涎などが散見され,加えて,詳細な臨床観察では,徐脈,紅涙,軽度の立毛,痙攣後の撤去反射の低下ないし消失,探索行動の低下などが散見された.また,呼吸数減少および腹臥位姿勢を呈した動物のうち一部は死亡した.
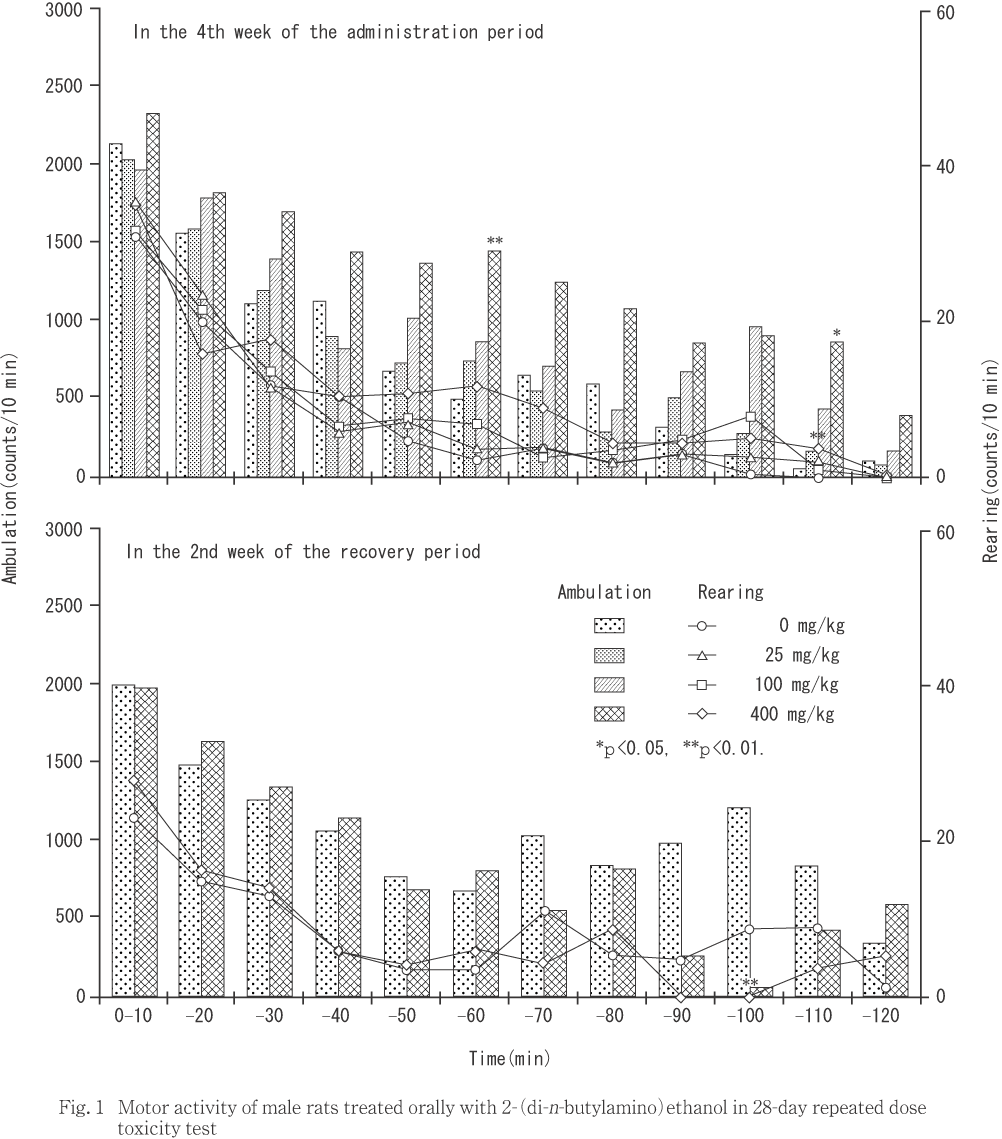
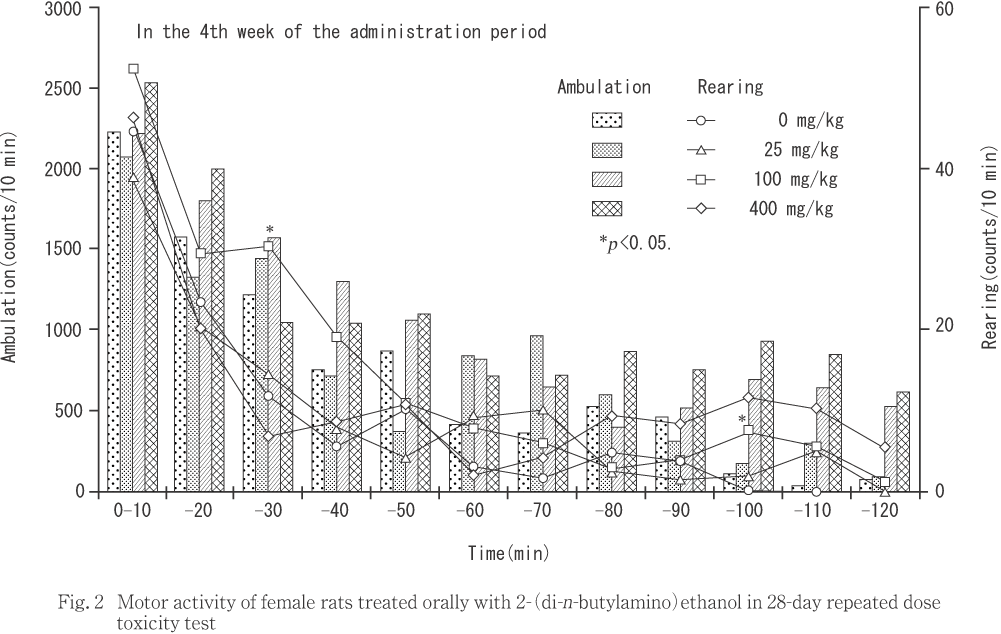
自発運動量測定において,400 mg/kg投与群では,雌雄の位置移動回数が増加し,雄の立ち上がり回数も増加した.また,100 mg/kg投与群では雌の立ち上がり回数が増加した.
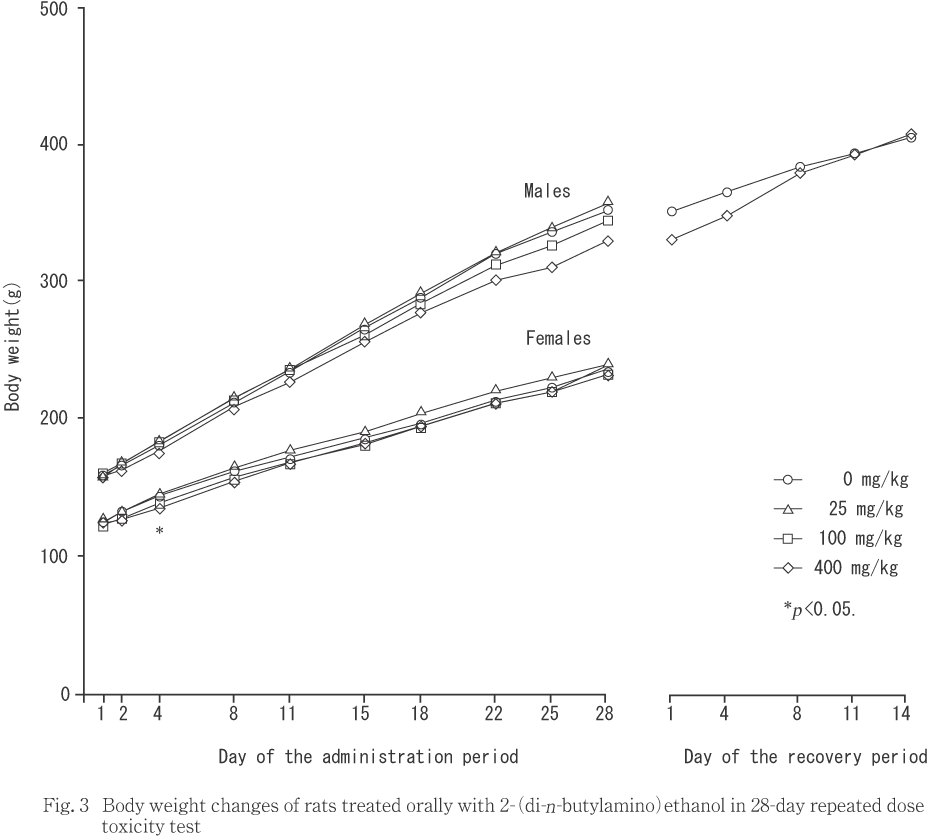
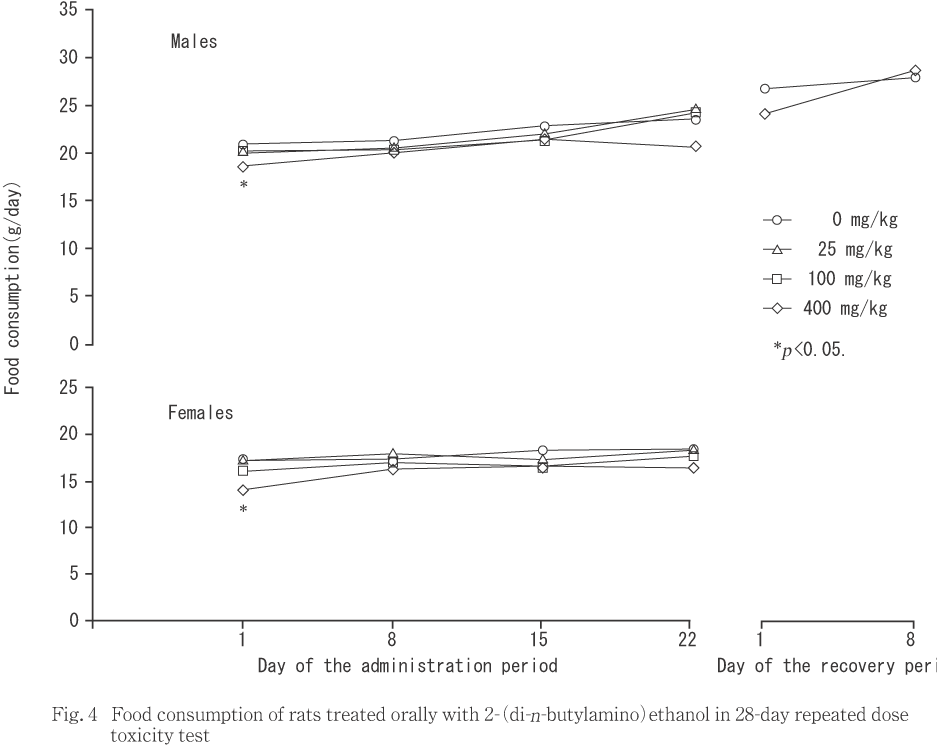
体重は,400 mg/kg投与群の雌において投与第4日に低値となり,同群の雌雄で投与第1週に摂餌量が減少した.
血液生化学検査では,投与期間終了時に400 mg/kg投与群の雌雄で塩素濃度が低下し,雄でナトリウム濃度が低下した.また,雌では,総コレステロール濃度およびブドウ糖濃度が上昇し,コリンエステラーゼ活性も低下する傾向にあった.
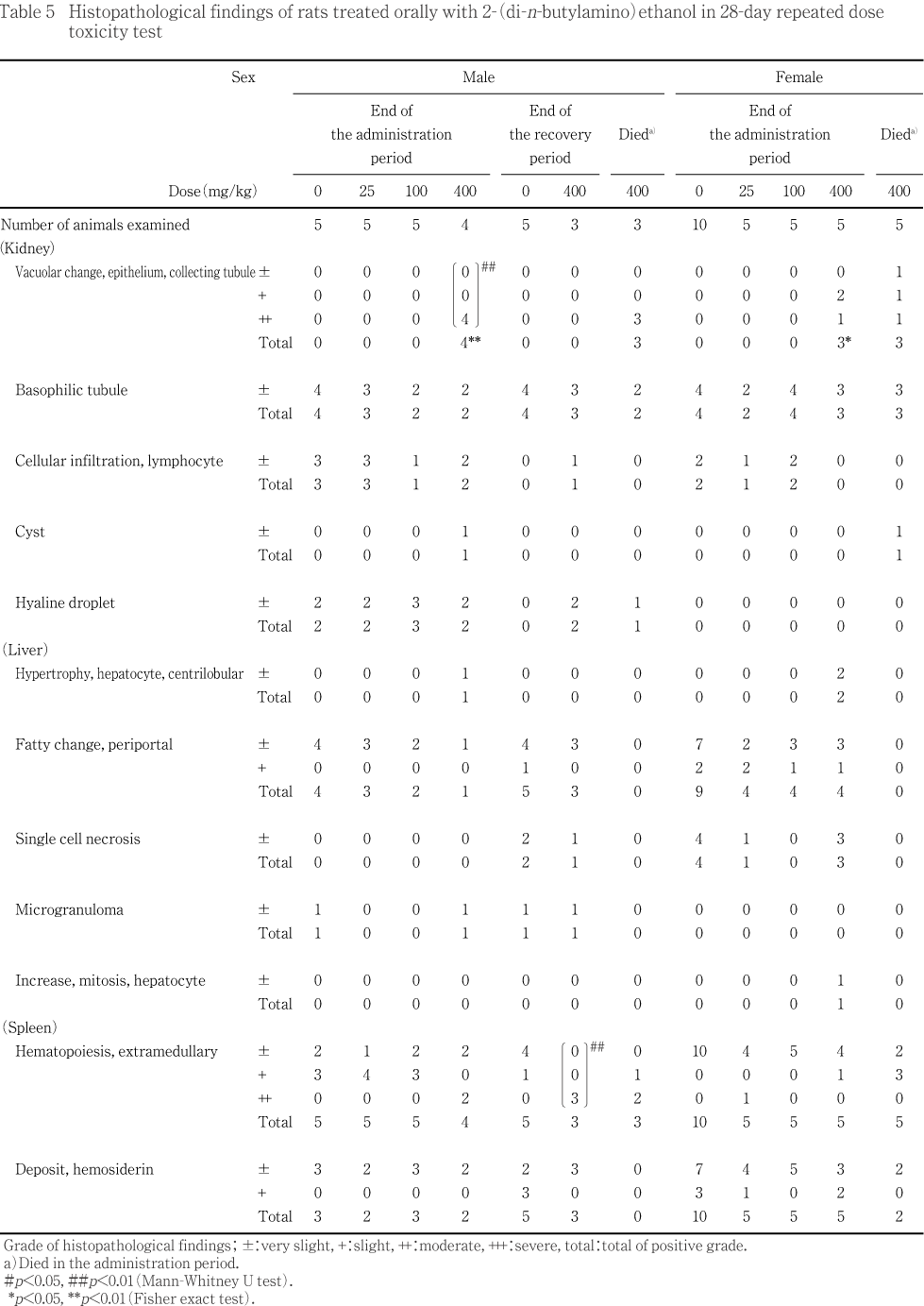
病理学検査では,400 mg/kg投与群で肝臓重量が増加し,一部の個体で軽微な小葉中心性の肝細胞肥大が観察された.同群では,雄で腎重量の増加および雌雄で集合管上皮細胞の空胞化が観察され,雌で副腎重量の増加および一部の個体で束状帯の肥大が認められた.また,死亡例では肝臓および腎臓の大型化が観察され,組織学的には投与期間終了時剖検例と同様に,雌雄の腎臓で集合管上皮細胞の空胞化が,雌の副腎で束状帯の肥大が散見された.さらに,雄1例で肺の暗赤色部および気管内の泡沫液が認められ,組織学的に肺胞出血および水腫が観察された.
以上の結果から,本試験条件下における2-(ジ-n-ブチルアミノ)エタノールの無作用量は雌雄とも25 mg/kg/ dayであると考えられた.また,標的器官は神経系,肝臓および腎臓であることが明らかとなり,被験物質投与の影響は14日間の投与中止により回復することが示唆された.
被験物質には,和光純薬工業(大阪)より提供された2-(ジ-n-ブチルアミノ)エタノール(ロット番号: WTE4254,含量99.8 %)を使用した.被験物質は入手後,密閉して高温を避けた遮光下の室温で保管した.被験物質の安定性は,本被験物質の品質試験を動物試験前後に提供元で実施することにより確認した.
投与検体は,被験物質を濃度毎に秤量し,メスシリンダーを用いて,各濃度の投与検体となるように,媒体であるコーン油(ナカライテスク)を加えて調製した.投与検体は,8日間の安定性が確認されていることから週1回以上の頻度で調製し,褐色瓶に分取して使用時まで冷蔵庫にて保管した.また,含量測定の結果,各濃度の投与検体中には所定濃度の被験物質が含まれていることが確認された.
試験には,4週齢で購入し,検疫と飼育環境への馴化を兼ねて8日間予備飼育した雌雄のSprague-Dawley 系ラット・Crj:CD(SD)IGS,SPF,日本チャールス・リバー・各30匹を使用した.
群分けは,投与開始前日の体重に基づいて体重別層化無作為抽出法により行った.各群の動物数は,雌雄とも対照群および高用量群を各10匹とし,低および中用量群を各5匹とした.
動物は,温度21.0〜25.0℃,湿度40.0〜75.0 %,換気回数約15回/時,照明12時間(7時〜19時)に設定された飼育室内で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2,日本クレア)と水道水(秦野市水道局給水)を自由に摂取させて飼育した.
投与用量は,本試験に先立って実施した予備試験の結果を基に決定した.即ち,被験物質を50,300,400,500,800 mg/kgの用量で,雌雄各群3匹のラットに7日間反復投与した結果,500 mg/kg投与群の雄1例雌2例,800 mg/kg投与群の雌雄全例が振戦,攣縮,間代性痙攣および強直性痙攣等を呈して死亡した.50 mg/kg投与群の雄および300 mg/kg以上の投与群では,咀嚼様動作およびケージ内を舐める動作が観察された.また,雌で300 mg/kg以上,雄で500 mg/kg以上を投与した群で,投与第2日に体重増加抑制ないし体重減少が認められ,その後は増加に転じた.剖検時には,死亡例で肺の退縮不全および暗赤色化,肝臓の暗色化が観察されたが,投与期間終了時に剖検した生存例では変化が認められなかった.以上の結果から,雌雄とも400 mg/kgの用量が28日間の反復投与に耐え得る最大用量であると判断して本試験の高用量を400 mg/kgに設定し,以下,公比4で除して100および25 mg/kgを中および低用量に設定することとした.
投与経路は経口とし,1日1回,28日間,ラット用胃管を用いて強制的に投与し,最終投与日翌日に剖検した.投与容量は5 mL/kg とし,雌雄とも最近時の体重を基に個体別に投与液量(mL)を算出した.なお,回復期間は14日間とした.
全例について,投与期間中は毎日投与前1回および投与後1回以上(投与後約30分の他,所見の発現状況により追加.ただし,自発運動量測定中の動物は投与後約2時間),回復期間中は1日1回,生死を含む一般状態を観察した.また,1週間に1回の頻度でスコアリング法による詳細な臨床観察を,投与期間中は投与後約30分の時点で,回復期間中は投与後約30分に相当する時刻に,いずれも供試動物の投与用量が観察者にわからない方法(ブラインド)で行った.詳細な臨床観察では,ケージ越し(ホームケージ内)に姿勢・体位,自発運動,発声,振戦,痙攣について観察した後,ケージから取り出す時(ハンドリング時)に取り出し易さ,扱い易さ,心拍動,体温,流涎,被毛,皮膚色,可視粘膜,流涙,眼球突出,瞳孔径について観察し,次いで,作業台上(オープンフィールド)に動物を移して体位,姿勢,探索行動,身づくろい,発声,挙尾反応,常同行動,奇妙な行動,歩行,振戦,痙攣,呼吸数,立毛,眼裂,排尿回数,排便回数,接触に対する反応,撤去反射,耳介反射について観察した.さらに投与第4週および回復第2週には,聴覚刺激に対する反応(驚愕反応),視覚刺激に対する反応(視覚定位,対光反射),前後肢の握力(握力計Chatillon,Columbus Instrument)および投与後2時間の自発運動量(立ち上がり回数および位置移動回数,自発運動測定装置,SUPER-MEX,室町機器)を調べるための機能検査を行った.
体重は,投与第1週には3回,その後は毎週2回の頻度で測定したほか,投与期間終了日,回復期間終了日,剖検日および死亡時にも測定した.摂餌量は,毎週1回の頻度で1日あたりの摂餌量を測定した.
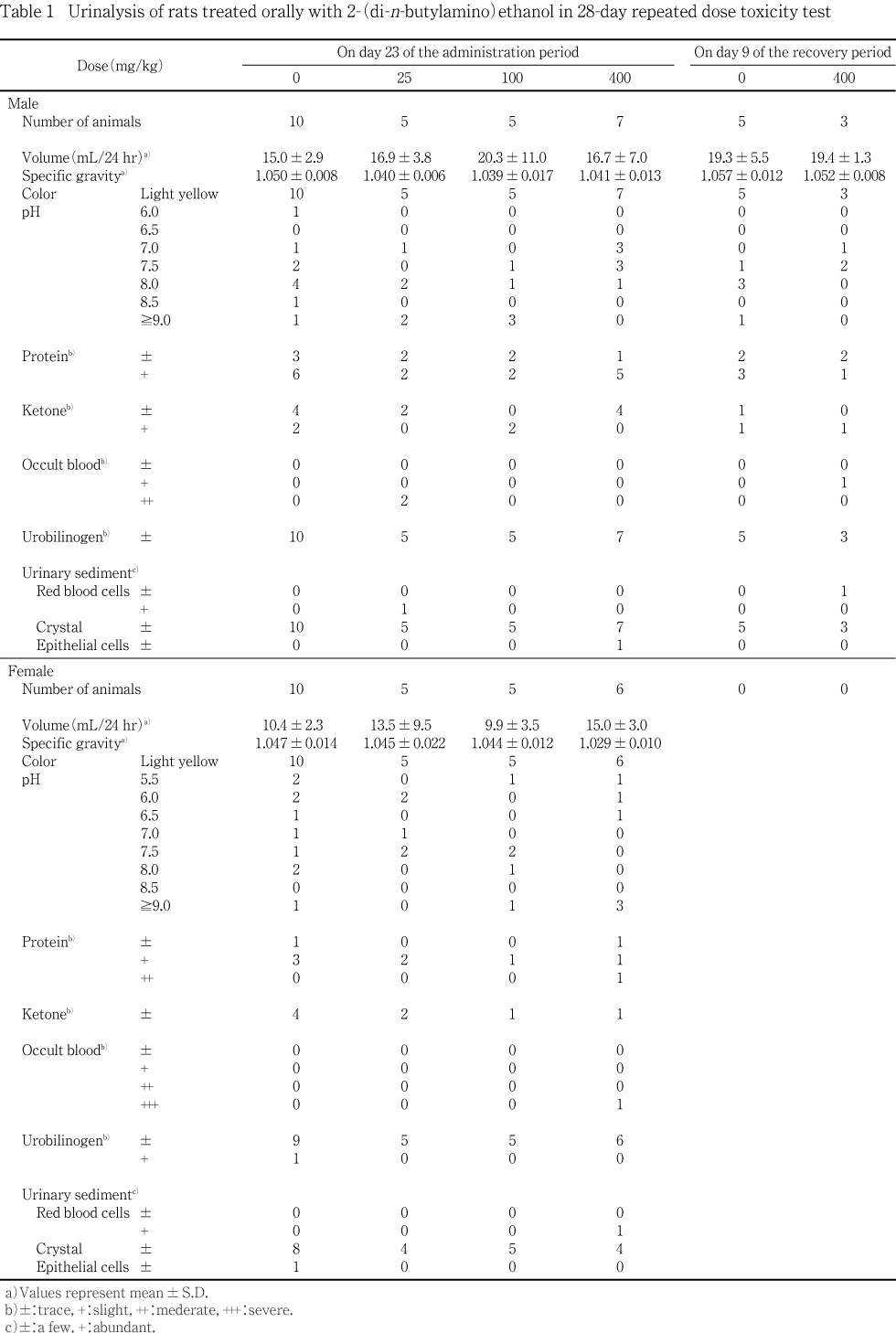
投与第4週(投与直後)および回復第2週に全例を約24時間代謝ケージに収容して蓄尿し,約4および24時間の時点で採尿した.この4時間尿を用いて試験紙法(クリニテック200+,バイエル・三共)によりpH・蛋白・ケトン体・ビリルビン・ブドウ糖・潜血・ウロビリノーゲンを,視診により色調および混濁度を,光学顕微鏡により沈渣を検査した.また,24時間尿について,尿量(天秤で重量を測定し,比重で除す)および比重(尿1 mLの重量を測定)を検査した.
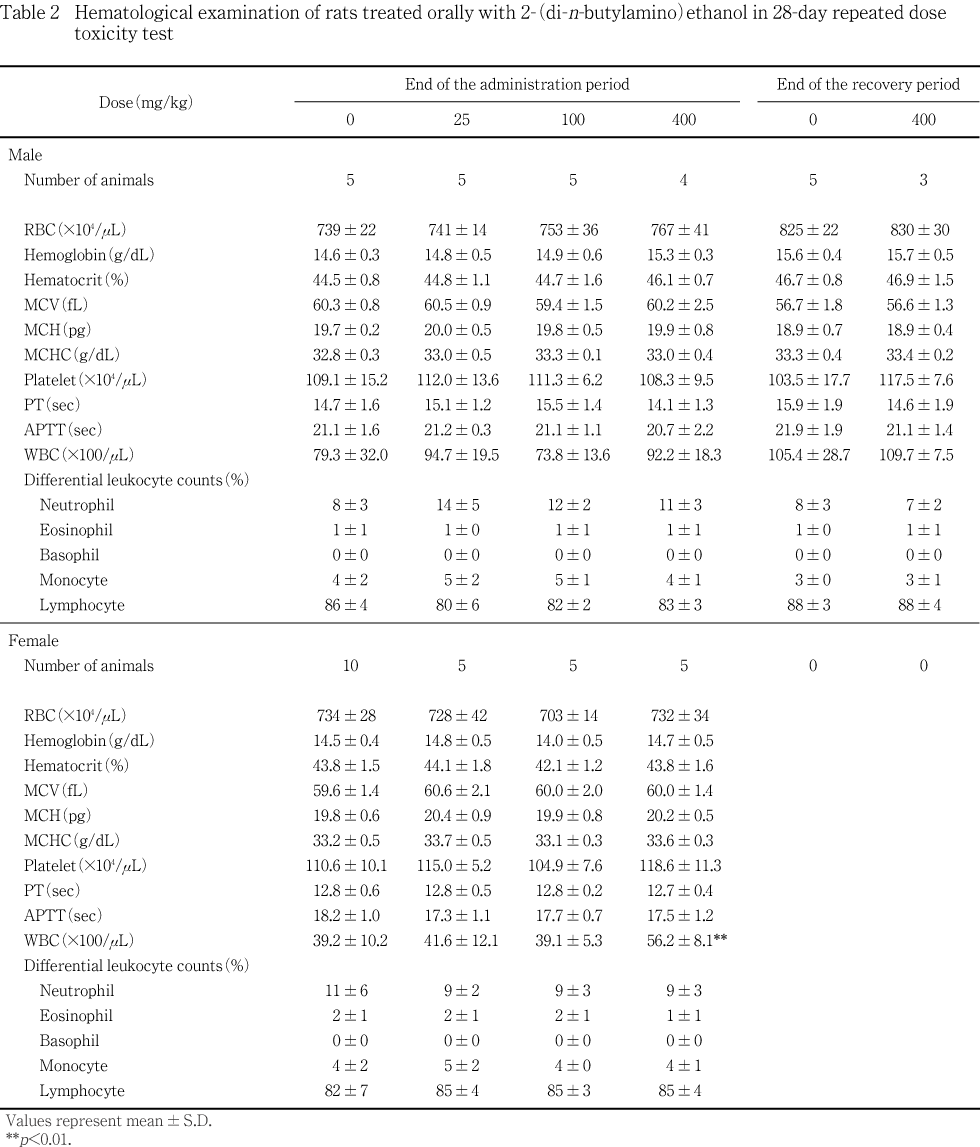
死亡例を除く動物(定期解剖例)は,投与または回復期間終了日翌日に剖検した.定期解剖例は,予め18から20時間絶食させたのち,ペントバルビタールナトリウムで麻酔し,腹部後大静脈から,抗凝固剤としてクエン酸ナトリウム(血液学検査,全自動血液凝固測定装置用),EDTA-2K(血液学検査,血液自動分析装置用)およびヘパリン(血液生化学検査,遠心方式生化学自動分析装置用)を用いて採血した.採血は,可能な限り対照群,低,中および高用量群の順序で,1匹ずつ動物番号の若い方から選択して行った.
血液自動分析装置(CELL-DYN3500SL,ダイナボット)を用いて,電気抵抗法により赤血球数,平均赤血球容積および血小板数,フローサイトメトリー・レーザー光散乱法/電気抵抗法により白血球数,フローサイトメトリー・レーザー光散乱法により白血球分類,吸光度法により血色素量を測定し,これらを基にヘマトクリット値,平均赤血球血色素量(MCH)および平均赤血球血色素濃度(MCHC)を算出した.また,全自動血液凝固測定装置(CA-1000,東亜医用電子)を用いて,光散乱検出法によりプロトロンビン時間(PT)および活性部分トロンボプラスチン時間(APTT)を測定した.
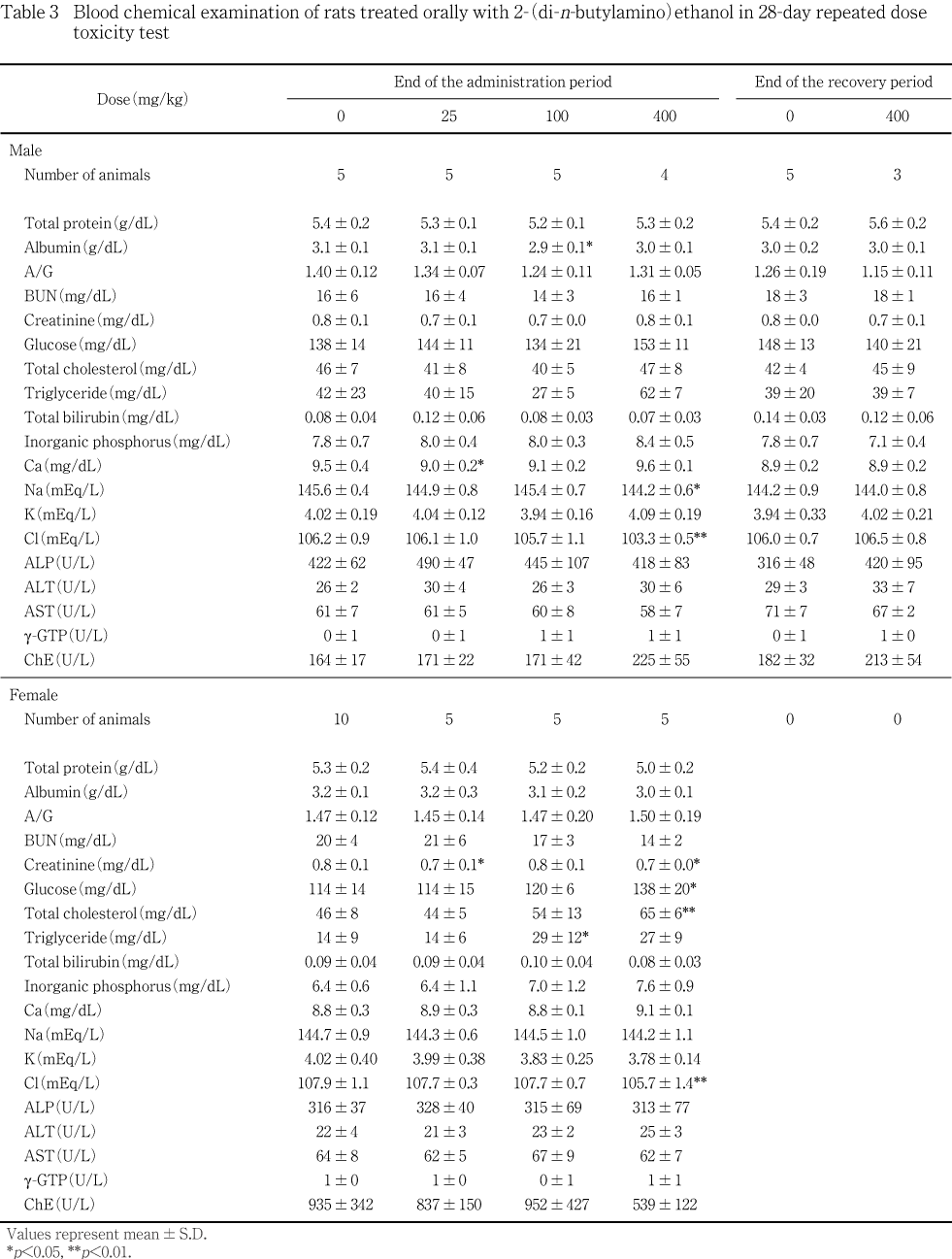
遠心方式生化学自動分析装置(COBAS-FARA,ロシュ・ダイアグノスティクス)を用いて,ビウレット法により総蛋白濃度,BCG法によりアルブミン濃度,COD・HDAOS法により総コレステロール濃度,ヘキソキナーゼ G6PDH法によりブドウ糖濃度,ウレアーゼGl.DH法により尿素窒素濃度(BUN),Jaff事@によりクレアチニン濃度,GSCC法によりアルカリ性フォスファターゼ(ALP)活性,IFCC法によりアスパラギン酸アミノトランスフェラーゼ(AST)活性,アラニンアミノトランスフェラーゼ(ALT)活性およびガンマグルタミルトランスペプチダーゼ(g-GTP)活性,ブチリルチオコリン基質法によりコリンエステラーゼ(ChE)活性,GPO・HDAOS法およびグリセリン消去法によりトリグリセライド濃度,アゾビリルビン変法により総ビリルビン濃度,モリブデン酸直接法により無機リン濃度,OCPC法によりカルシウム濃度を測定し,アルブミン/グロブリン(A/G)比を算出した.また,全自動電解質分析装置 EA05(エーアンドティ)を用いたイオン電極法によりナトリウム濃度,カリウム濃度および塩素濃度を測定した.
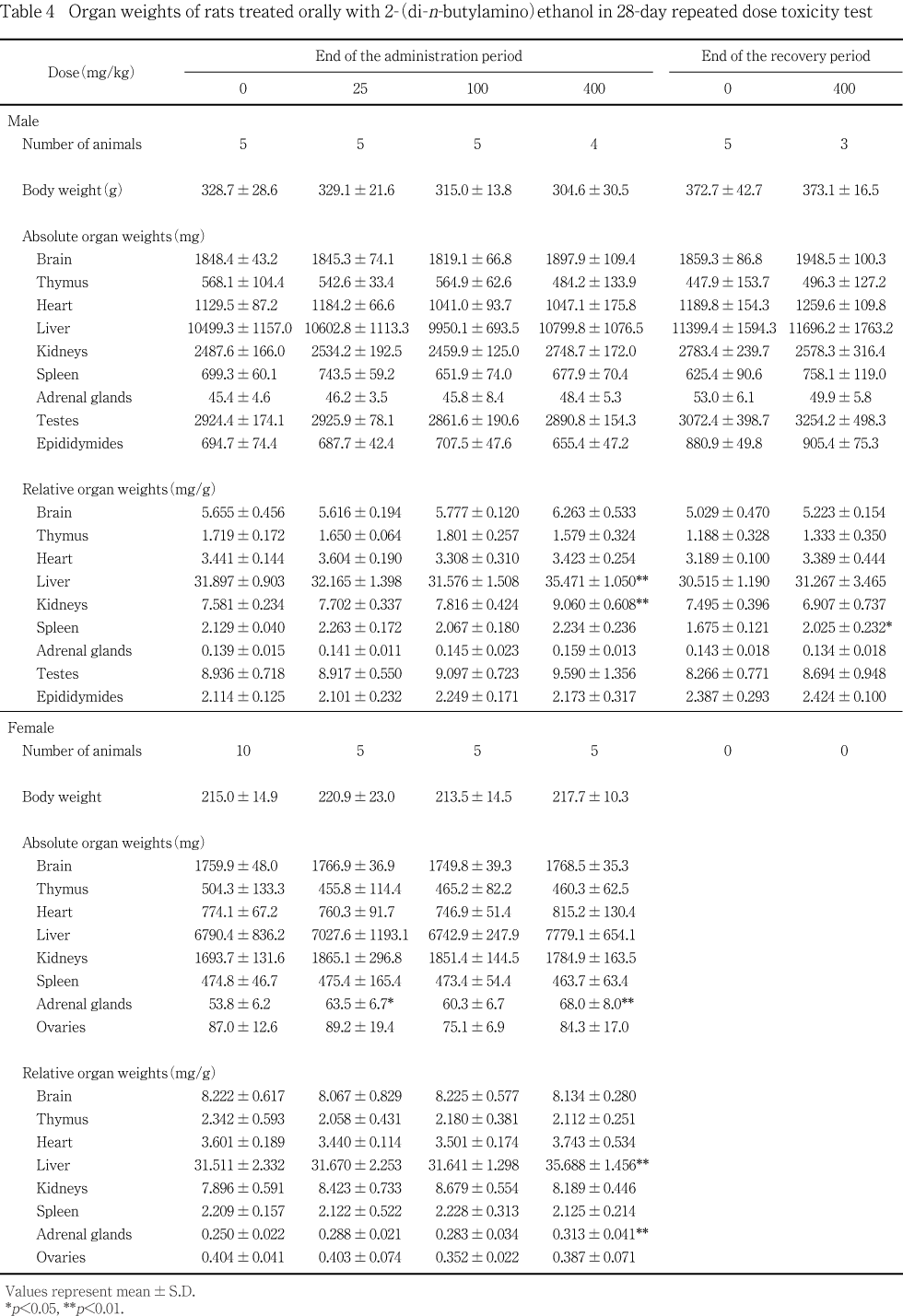
採血後,必要に応じて腋窩動脈を切断して放血屠殺し,器官および組織を肉眼的に観察した.各動物の肝臓,腎臓,副腎,精巣,精巣上体,卵巣,胸腺,脾臓,脳および心臓は重量を測定し,各器官重量を剖検日の体重で除して比体重値(相対重量)を算出した.死亡例は,発見後,速やかに剖検して肉眼的観察を実施した.剖検後,脳,脊髄,肝臓,腎臓,副腎,脾臓,心臓,胃,小腸(十二指腸,空腸,回腸),大腸(結腸,直腸),胸腺,甲状腺(上皮小体を含む),気管,肺(気管支を含む),生殖腺(精巣,卵巣),副生殖器(精巣上体,前立腺,子宮,精嚢,腟),膀胱,リンパ節(腸間膜リンパ節,下顎リンパ節),坐骨神経(腓腹筋を含む),大腿骨および骨髄,大動脈,舌,食道,膵臓,顎下腺,舌下腺および下垂体を0.1Mリン酸緩衝10 %ホルマリン溶液に,精巣および精巣上体はブアン液に浸漬固定した.次いで,固定した器官および組織(ただし,十二指腸,空腸,直腸,精嚢,腟,大動脈,舌,食道および膵臓を除く)をパラフィン包埋して薄切し,ヘマトキシリン・エオジン染色標本を作成した.組織学検査は光学顕微鏡を用い,対照群および高用量群の全標本について実施し,その結果,被験物質投与による影響が示唆された肝臓,腎臓および脾臓について,この他の群でも組織学検査を実施した.なお,腎臓および脾臓については,それぞれPAS染色およびベルリンブルー染色標本を作製して観察し,所見の記載に反映させた.
体重,摂餌量,尿量,尿比重,握力および自発運動量ならびに定期解剖例の血液学検査,血液生化学検査および器官重量の各測定値については,群ごとに平均値および標準偏差を求めた.また,投与期間に属する各値については,Bartlettの方法による分散の一様性の検定を行い,一元配置型の分散分析およびDunnett検定,またはKruskal-Wallisの順位和検定およびDunnett型の検定で多重比較を行った.回復期間に属する各値については,F検定を行い,Studentのt検定またはAspin-Welchのt検定を行った.
尿検査における試験紙を用いた検査成績,色調および濁度については,投与第4週に得られた成績は,列の累積または分割表を用いるx^2検定を行い,Dunnett型の検定法により多重比較を行った.回復第2週に得られた成績はWilcoxonの順位和検定を行った.
病理組織学検査所見のグレード分けしたデータについてはMann-WhitneyのU検定を,陽性グレードの合計値はFisherの直接確率の片側検定を行った.
なお,いずれの検定方法も有意水準は5 %とした.
400 mg/kg投与群では,投与第11日に雌1例,第15日に雄2例雌1例,第18日に雄1例雌2例,第25日に雌1例の計雄3例雌5例が死亡した.また,死亡例は,いずれも投与液量の変更日(体重測定日)に認められた.
100および400 mg/kg投与群の雌雄で,投与第1日より投与後断続的にケージ内を舐める動作および咀嚼様動作が投与後数分から認められ,投与後約2時間までに回復が確認された.400 mg/kg投与群では,雌雄で間代性ないし強直性痙攣,攣縮,振戦,異常発声および蒼白,それに続く喘ぎ呼吸,呼吸数減少および腹臥位姿勢が,雌で活動性の低下が投与第4日から散見された.これら痙攣,攣縮および振戦等は,投与後約20分から40分の間に発現し,投与後約1時間までに回復した.また,喘ぎ呼吸,呼吸数減少,活動性の低下および腹臥位姿勢等もその後速やかに回復した.この他,400 mg/kg投与群では,雌雄数例でうずくまりおよび閉眼が,雄1例で活動性亢進が,雌1ないし数例で走り回り,這いずり回り,眼球突出および紅涙が観察され,痙攣後に雄1例で歯肉の出血が,雌1例で投与前に異常呼吸音(グズグズ音)が認められた.痙攣後,呼吸数減少および腹臥位姿勢を呈した動物のうち数例が,投与後約25分から45分の間に死亡した.その他,400 mg/kg投与群の雌1例で,投与第7日の投与直後に流涎,蒼白,発声,開口呼吸,もがきながらケージ内を跳ね回る動作が観察され,投与後約30分に流涎および顎すりが認められたが,全て投与後約2時間の観察で回復が確認された.この1例の変化は,投与直後に認められたこと,本被験物質は刺激性を有するということから,被験物質の神経系に対する作用ではなく,誤嚥あるいは胃管に付着した被験物質の刺激性に起因した変化であると考えられた.
400 mg/kg投与群の雌雄では,投与第2週より,投与保定時ないし投与直後から流涎が観察された.この流涎は,多くの場合,投与後約30分までに消失し,100 mg/ kg投与群の雄1例でも認められた.一方,同群では,投与第2日より,投与直後には認められず,投与後約30分に表れる流涎も散見された.その他,25 mg/kg投与群の雄1例で投与第4週に,400 mg/kg投与群の雄1例で回復期間中に背部の皮膚に痂皮が観察されたが,背部の痂皮は,本試験に用いる同系統の動物で自然発生的に認められる変化であることから,被験物質投与に起因した変化ではないと判断した.
400 mg/kg投与群の雌雄において,一般状態観察と同様の痙攣,発声,眼球突出および流涎が認められた他,歩行不能等の歩行異常および探索行動の低下が観察され,雄で自発運動の亢進および軽度の立毛が,雌で振戦,蒼白,腹臥位姿勢,呼吸数の減少徐脈,紅涙,撤去反射の低下ないし消失,耳介反射の鈍化,接触に対する反応の低下ないし無反応,自発運動の低下ないし消失が散見された.また,100および400 mg/kg投与群の雌雄で,一般状態観察と同様の断続的なケージ内を舐める動作および咀嚼様動作が観察された.なお,400 mg/kg投与群の雌3例は,詳細な臨床観察中に痙攣が発現し,その後呼吸停止に至り死亡したため,該当観察日のデータを収集することができなかった.
回復期間も含めて,全ての動物が正常な反応を示した.
回復期間も含めて対照群と被験物質投与群との間に有意差はなかった.
投与第4週の検査では,10分間毎に比較した場合,400 mg/kg投与群の雄で投与後50および100分からの10分間で位置移動回数が増加し,100分からの10分間では立ち上がり回数も増加した.また,100 mg/kg投与群の雌で投与後20および90分からの10分間で立ち上がり回数が増加した.測定時間を前後半の60分間に区切って比較した場合,後半の60分間で400 mg/kg 投与群の雄で位置移動回数が増加し,雌でも増加する傾向にあった.同群の雄では,投与後120分間の総運動量についても位置移動回数が増加した.
回復第2週の検査では,400 mg/kg投与群の雄で,測定開始後90分からの10分間の位置移動回数が対照群と比較して低下した.通常,明期に測定機への移動と同時に運動量測定を開始した場合,時間経過に伴って運動量は減少する5).しかし,今回,対照群ではこの時間帯の位置移動回数が増加していることから,400 mg/kg投与群の位置移動回数の低下を意味するものではないと判断した.

400 mg/kg投与群の雌で,対照群と比較して投与第4日に低値となった.
400 mg/kg投与群の雌雄で,対照群と比較して投与第1週の摂餌量が減少した.
投与第4週の検査では,対照群と被験物質投与群との間に有意差はなかったが,代謝ケージに収容後,痙攣が認められた400 mg/kg投与群の雌1例では,中等度の尿蛋白および重度の潜血が認められ,沈渣中には赤血球が確認された.また,25 mg/kg投与群の雄2例で中等度の潜血となり,うち1例では沈渣中に赤血球が確認されたが,この赤血球が観察された1例は背部に痂皮が認められていたこと,25 mg/kg投与群では潜血と関連するような腎臓および血液性状の変化は認められていないことから,被験物質投与に起因した変化ではないと考えられた.
回復第2週の検査でも,400 mg/kg投与群の雄1例で軽度の潜血が認められ,沈渣中に赤血球が確認されたが,この個体も背部に痂皮が観察されていることから,被験物質投与に起因した変化ではないと考えられた.
投与期間終了時剖検例では,400 mg/kg投与群の雌において,白血球数増加が有意となった.しかし,1例を除き対照群と同程度の値を示し,この1例を含めて白血球百分比に変化はなかったため,偶発的な有意差であると判断した.
投与期間終了時剖検例では,400 mg/kg投与群の雌雄で,塩素濃度が低下した.400 mg/kg投与群では,雄でナトリウム濃度が低下し,雌では総コレステロール濃度およびブドウ糖濃度が上昇したほか,コリンエステラーゼ活性が低下する傾向にあった.また,100 mg/kg投与群の雌でトリグリセライド濃度が上昇し,400 mg/kg投与群の雌でも高い傾向にあった.
この他,25および400 mg/kg投与群の雌のクレアチニン濃度の低下,25 mg/kg投与群の雄のカルシウム濃度の低下,100 mg/kg投与群の雄のアルブミン濃度の低下にそれぞれ有意差が認められたが,いずれも用量依存的な変化ではなく,関連パラメータも変動しなかったことから,被験物質投与による影響ではないと判断した.
投与期間終了時剖検例では,400 mg/kg投与群の雌雄で肝臓の相対重量が増加し,雄で腎臓の相対重量が,雌で副腎の実重量および相対重量が増加した.この他,25 mg/kg投与群の雌でも副腎の実重量増加に有意差が認められたが,1例を除き対照群の値の範囲内にあったこと,組織学的に変化が認められなかったことから,偶発的な有意差であると判断した.
回復期間終了時剖検例では,400 mg/kg投与群の雄で,脾臓の相対重量が増加した.
投与期間終了時剖検例において,400 mg/kg投与群の雄1例で肝臓の大型化が観察され,25 mg/kg投与群の雌1例で脾臓の小型化が観察された.
400 mg/kg投与群で認められた雄3例および雌5例の死亡例では,肝臓の大型化が雄1例および雌4例で観察された他,腎臓の大型化が雄1例および雌2例に,肺の暗赤色部が雄の1例に,気管の内容物として泡沫液が雄の1例に認められた.
①投与期間終了時剖検例
腎臓では,400 mg/kg投与群において,集合管上皮細胞の空胞化が雄全例で中等度の,雌3例で軽度から中等度の変化として観察され,雄の発生頻度および変化の程度ならびに雌の発生頻度が増加した.また,400 mg/kg投与群の雄1例で髄質の嚢胞が観察されたが,今回試験に用いた系統のラットでは,自然発生的にまれに認められることが報告されていることから6),被験物質投与による変化ではないと判断した.この他,雌雄の対照群および被験物質投与群で軽微な好塩基性尿細管およびリンパ球浸潤が散見され,雄の各群で硝子滴が認められたが,対照群と被験物質投与群との間に差がなかったことから,被験物質投与に起因した変化ではないと判断した.
肝臓では,400 mg/kg投与群の雌2例および剖検時に肝臓が大型化していた雄1例において,軽微な小葉中心性の肝細胞肥大が観察され,このうち雌1例では,肝細胞の分裂像が僅かに観察された.この他,対照群を含む雌雄各群で門脈周囲性の軽微から軽度の肝細胞脂肪化が,100 mg/kg投与群を除く雌の各群で単細胞壊死が観察され,対照群および400 mg/kg投与群の雄各1例で小肉芽腫が認められたが,これらは被験物質投与群で増強していないことから,被験物質投与に起因した変化ではないと判断した.
副腎では,400 mg/kg投与群の雌2例で束状帯の軽微な肥大が観察された.
脾臓では,対照群を含む雌雄全例で髄外造血が観察され,25 mg/kg投与群の雌1例および400 mg/kg投与群の雄2例で中等度の変化であったほかは,いずれも軽微から軽度の変化であった.また,雌雄各群で軽微から軽度のヘモジデリン沈着が認められたが,対照群と被験物質投与群とで発生頻度および程度ともに差がないことから,被験物質投与に起因した変化ではないと判断した.なお,剖検時に脾臓の小型化が観察された25 mg/kg投与群の雌1例では,軽微な髄外造血およびヘモジデリン沈着以外に所見はなかった.
この他,対照群および400 mg/kg投与群では,雄の各1例で前立腺の軽微なリンパ球浸潤が観察され,雌の各1例で胸腺の軽微な出血が認められたが,どちらも対照群との間に差が認められなかったことから,被験物質投与による変化ではないと判断した.
②死亡例(400 mg/kg投与群の雄3例および雌5例)
腎臓では,集合管上皮細胞の空胞化が雄全例で中等度の,雌3例で軽微から中等度の変化として観察された.また,雌雄で軽微な好塩基性尿細管が散見されたほか,雄1例で硝子滴が雌1例で嚢胞が観察されたが,これらは投与期間終了時剖検例の対照群で認められた変化,あるいは今回試験に用いた系統のラットでは,自然発生的に認められる変化であることから,被験物質投与に起因した変化ではないと判断した.
副腎では,雌2例で束状帯の軽微な肥大が観察された.
脾臓では,雌雄全例で髄外造血が観察され,雄2例で中等度の所見であったほかは軽微から軽度の所見であった.また,雌2例で軽微なヘモジデリン沈着が認められたが,投与期間終了時剖検例の対照群でも認められたことから,被験物質投与に起因した変化ではないと判断した.
肺では,剖検時に暗赤色部および気管内泡沫液が認められた雄1例で,軽度の肺胞出血および軽微な水腫が観察された.
このほか,雄2例雌1例で胸腺の軽微ないし軽度の出血および充血が観察された.また,雄1例で軽微な精巣上体管腔内細胞残屑が認められたが,今回試験に用いた系統のラットでは,自然発生的に散見される所見であることから7),被験物質投与による変化ではないと判断した.なお,肉眼的に大型化が観察された肝臓では変化は観察されなかった.
③回復期間終了時剖検例
腎臓では,対照群および400 mg/kg投与群で軽微な好塩基性尿細管が観察されたが,対照群と被験物質投与群との間に頻度および程度とも差はなく,被験物質投与に起因した変化ではないと考えられた.また,400 mg/kg投与群の1例でリンパ球浸潤が,2例で硝子滴が認められたが,いずれも投与期間終了時剖検例の対照群および被験物質投与群で散見された所見であり,軽微な変化であることから,被験物質投与に起因した変化ではないと判断した.
肝臓では,対照群および400 mg/kg投与群において,全例で門脈周囲性の肝細胞脂肪化が観察され,単細胞壊死および微小肉芽腫が散見されたが,いずれも対照群および被験物質投与群との間に差はなく,被験物質投与に起因した変化ではないと判断した.
脾臓では,対照群および400 mg/kg投与群の全例で髄外造血が観察され,400 mg/kg投与群で程度が有意に増強した.ヘモジデリン沈着も対照群を含む全例で観察されたが,対照群と被験物質投与群との間に程度の差はなく,被験物質投与に起因した変化ではないと考えられた.
2-(ジ-n-ブチルアミノ)エタノールを25,100および400 mg/kg の用量で雌雄のSprague-Dawley 系ラットに28日間反復経口投与した結果,神経症状が観察され,主として腎臓,肝臓および副腎に変化が認められた.
400 mg/kg投与群では,雌雄で投与後約20分から40分の間に間代性痙攣,振戦および異常発声などが観察され,次いで呼吸数減少,腹臥位姿勢および活動性低下が観察された.2-(ジ-n-ブチルアミノ)エタノールは,コリンエステラーゼ(ChE)活性を阻害することが知られており1, 2, 8),末梢性および中枢性にChE活性阻害作用を示すことが確認されている2).また,2-(ジ-n-ブチルアミノ)エタノール投与によりChE活性阻害作用に起因する痙攣および呼吸抑制などの神経症状が認められることが報告されている2〜4).本試験では400 mg/kg投与群の雌でChE活性が低下しており,一方でChE合成阻害を示唆するような肝機能障害(後述)は認められていないことから,痙攣および呼吸数減少などの神経症状は,2-(ジ-n-ブチルアミノ)エタノールのChE活性阻害作用に起因した変化であると考えられた.この他,詳細な臨床観察において散見された徐脈,紅涙,眼球突出,探索行動の低下および軽度の立毛などの神経症状もChE活性阻害作用に関連した変化である可能性が考えられた.
100および400 mg/kg投与群で常同行動を示唆するケージ内を舐める動作および咀嚼様動作が観察され,400 mg/kg投与群では投与後50分以降を主とした位置移動回数の増加も認められたことから,2-(ジ-n-ブチルアミノ)エタノール投与による中枢神経系の興奮作用が示唆された.この運動量の増加は痙攣などの神経症状に比べて発現が遅かったことから,作用機序が異なる可能性がある.しかし,400 mg/kg投与群では活動性の低下などの運動量増加と相反する変化が認められていたこと,100 mg/kg投与群の雌で投与後20分から10分間の立ち上がり回数が増加したこと,ChE活性阻害作用は投与量あるいは時間経過とともに多様な神経症状を呈することから,運動量増加を含めた中枢神経系興奮様作用も,被験物質のChE活性阻害作用に関連した変化の一つであることが推測された.
400 mg/kg投与群では,痙攣後,呼吸数減少および腹臥位姿勢を呈した個体のうち,雄3例および雌5例が死亡した.死亡例では呼吸数減少および喘ぎ呼吸などの呼吸抑制が認められ,雄1例で気管内泡沫液ならびに肺胞出血および水腫が観察されたこと,肺以外に死亡例で特徴的な変化は観察されなかったこと,2-(ジ-n-ブチルアミノ)エタノールをラットに単回投与した試験では,人工呼吸により死亡が回避されていることから3),本試験の死因は呼吸抑制による窒息であることが推測された.呼吸抑制の原因としては,呼吸中枢抑制あるいは末梢性の呼吸筋抑制が考えられるが,本試験結果からはそのどちらであるか判断できなかった.また,雄2例雌1例で認められた軽度の胸腺の出血および充血は,瀕死状態下における2次的変化であると考えられた.なお,死亡例はいずれも投与液量が更新される体重測定日,即ち,投与液量が増加する日に認められたこと,予備試験では400 mg/kgを1週間投与しても痙攣などの重篤な神経症状は観察されなかったことから,400 mg/kgは最小致死量に近い値であると考えられた.
400 mg/kg投与群では,投与第2週より,投与保定時または投与直後から流涎が観察された.この流涎は,投与後約30分の観察時に多くの個体で消失したが,一部の個体では継続して,あるいは新たに流涎が観察される場合もあった.投与後約30分までに消失した流涎は,投与開始より1週間以上経過してから発現したこと,投与前の保定の段階でも観察されたこと,被験物質が刺激性を有することから,被験物質の物理的刺激による反射性の流涎であると考えられた.一方,投与後約30分に観察された流涎は,痙攣などのこの他の変化と同時間帯に観察されたこと,副交感神経興奮時にはしばしば流涎が認められることから,2-(ジ-n-ブチルアミノ)エタノールのChE活性阻害作用に関連した変化であると考えられた.
400 mg/kg投与群では,雌雄の腎臓で集合管上皮細胞の空胞化が観察され,雄で腎重量が増加した.同群の雌では,副腎重量が増加し,一部の個体で束状帯の軽微な肥大が観察された.フィゾスチグミンなどのChE活性阻害薬やカルバコールなどのコリン作動薬は,視床下部- 下垂体-副腎系を活性化し,バソプレッシン(VP)分泌および副腎皮質刺激ホルモン(ACTH)分泌を介したコルチコステロン(CORT)分泌を促すことが知られている9〜12).VPは,集合管上皮細胞では抗利尿作用による水の再吸収像としての空胞化を引き起こすことがある13).これらのことから,本試験ではVPやCORTなどの血中ホルモン濃度を測定していないが,副腎および腎臓の変化はChE活性阻害作用に関連した変化であると推測した.また,400 mg/kg投与群では血漿中の塩素濃度低下を主とした血漿電解質濃度の変動が認められ,尿検査で変化は確認されなかったが,腎臓の所見との関連性が考えられた。なお,尿検査時,代謝ケージ内で痙攣が認められた400 mg/kg投与群の雌1例において,尿蛋白および潜血が強度となり,沈渣中には赤血球が確認されたが,この例を含めて,腎障害の好発部位である近位尿細管に変化は認められず,空胞化が認められた集合管でも障害を示唆する再生像や細胞壊死などは監察されなかったことから,尿蛋白等の変化は,腎障害よりも痙攣および呼吸抑制などのストレスに起因する可能性が考えられた.
投与期間終了時剖検例の病理学検査では,400 mg/kg投与群の雌雄で肝臓重量が増加し,一部の個体で軽微な小葉中心性の肝細胞肥大が観察された.また,雌では,100および400 mg/kg投与群でトリグリセライド濃度が上昇し,400 mg/kg投与群でブドウ糖濃度および総コレステロール濃度が上昇した.VPおよびCORTは,肝臓,筋肉あるいは脂肪組織に作用し,グリコーゲンの分解,糖新生あるいは脂質代謝などに影響を及ぼすことから14〜16),血液中のブドウ糖濃度および脂質系パラメータの変化は,VPおよびCORTと関連する可能性が推測された.肝臓重量の増加もこれらホルモンの作用に関連する可能性が考えられるが,一部の動物で小葉中心性の肝細胞肥大が認められていることから,肝臓における薬物代謝経路の活性化に起因する可能性も否定できない.今回認められた肝臓の変化は被験物質投与との関連性が示唆されるものの,その成因は不明であった.なお,400 mg/kg投与群でアルブミン濃度の低下が認められず,他の検査項目でも肝機能障害あるいは肝臓の損傷を示唆するような所見は観察されなかったことから,肝臓の所見は,肝障害を示唆するような重篤な変化ではないと考えられた.
400 mg/kg投与群では,反復投与初期に雌で体重増加抑制,雌雄で摂餌量の減少が認められた.予備試験でも同様の変化が認められていることから,体重増加抑制と摂餌量減少は被験物質投与による影響であると考えられた.
今回,血漿中ブドウ糖濃度および総コレステロール濃度の増加,副腎の病理学的変化は雌でのみ認められ,腎臓に関する所見は雄で強く認められた.これまでの考察から,これらの変化とChE活性阻害作用との関連性が推測される.また,中枢でのChE活性阻害作用に起因したホルモンの分泌促進作用やレセプター発現には性差があることが報告されている9〜11).以上のことから,被験物質は,糖質および脂質代謝,副腎,腎臓に対して雌雄で異なる作用を示した訳ではなく,中枢におけるChE活性阻害作用の性差に関連して,副腎や腎臓などの所見に雌雄差が認められた可能性が考えられた.また,投与期間終了時までに認められた神経系,腎臓および肝臓に対する変化はいずれも雄の回復期間終了時には確認されなかったことから,被験物質投与による影響は,14日間の投与中止により回復することが推測された.
回復期間終了時屠殺例では,400 mg/kg 投与群の雄で脾臓の髄外造血の増強が認められ,脾臓重量も増加した.また,同群では,投与期間終了時の2例および雄の死亡例2例で,中程度の髄外造血が認められた.しかし,血液学検査結果に被験物質投与に起因すると考えられる変化は認められず,その他の関連パラメータにも変化が認められなかったため,被験物質投与による影響であるか否か判断できなかった.
以上の結果から,本試験条件下における2-(ジ--ブチルアミノ)エタノールの無作用量は雌雄とも25 mg/kg/ dayであると考えられた.また,振戦,痙攣および呼吸抑制などの神経症状,運動量増加や咀嚼様動作などの中枢神経興奮症状が表れること,肝重量の増加および肝細胞肥大ならびに腎重量の増加および集合管上皮細胞の空胞化が認められること,投与初期に摂餌量低下および体重増加抑制が,雌で副腎重量の増加,副腎束状帯の肥大が認められることなどが明らかとなった.しかし,各器官および組織に損傷性を示唆するような所見はなく,被験物質投与によると考えられる変化はいずれも14日間の投与中止により回復することが推測された.
| 1) | 2-N-butylaminoethanol. In メDocumentation of the threshold limit values for chemical substancesモ, ACGIH, 7th ed.(2001). |
| 2) | Rolf H, Herbert HC:Cholinesterase inhibition in the acute toxicity of alkyl-substituted 2-aminoethanols. Toxicol Appl Pharmacol, 12:486-494(1968). |
| 3) | Rolf H, Lester BP, Herbert HC:Convulsions induced by 2-N-di-n-butylaminoethanol. Toxicol Appl Pharmacol, 17:337-343(1970). |
| 4) | Herbert HC, Thomas D, Lee DB:Oral and Inhalation toxicity of 2-N-dibutylaminoethanol. Am Ind Hyg Associ J, Jan.-Feb.:46-51(1969). |
| 5) | 森村智美:OECD化学物質毒性試験法ガイドライン・407・28日間反復投与毒性試験における神経症状観察.秦野研究所年報,26:98-104(2003). |
| 6) | Noto T, Oishi Y, Fujihira S et al.:Spontaneous lesions in Crj:CD(SD)IGS rats versus in Jcl:SD rats used in toxicity studies-Histopathological findings. In メBiological Reference Data on CD(SD)IGS Rats-1999モ, Matsuzawa T, Inoue H(eds.), CD(SD) IGS Study Group, Yokohama(1999)pp.106-118. |
| 7) | Nagayabu T, Kitazaki T, Kandori H et al.: Background data for repeated-dose toxicity studies using Crj:CD(SD)IGS rats at the Hikari branch, Drug Safety Research Laboratories in Takeda Chemical Industries, Ltd. In メBiological Reference Data on CD(SD)IGS Rats-1999モ, Matsuzawa T, Inoue H(eds.), CD(SD)IGS Study Group, Yokohama (1999)pp.74-88. |
| 8) | 2-ジブチルアミノエタノール. In「産業中毒便覧(増補版)」第2版,後藤稠,池田正之,原一郎(編),医歯薬出版,東京(1994)pp.1238-1239. |
| 9) | Rhodes ME, O'Toole SM, Wright SL et al.:Sexual diergism in rat hypothalamic-pituitary-adrenal axis responses to cholinergic stimulation and antagonism. Brain Res Bull, 54:101-113(2001). |
| 10) | Rhodes ME, Balestreire EM, Czambel RK et al.:Estrous cycle influences on sexual diergism of HPA axis responses to cholinergic stimulation in rats. Brain Res Bull, 59:217-225(2002). |
| 11) | Rubin RT, Abbasi SA, Rhodes ME et al.:Growth hormone responses to low-dose physostigmine administration:functional sex differences (sexual diergism) between major depressives and matched controls. Psychol Med, 33:655-665(2003). |
| 12) | Imai Y, Abe K, Sasaki S et al.:Role of vasopressin in cardiovascular response to central cholinergic stimulation in rats. Hypertension, 13:549-557(1989). |
| 13) | Kirk KL:Origin of ADH-induced vacuoles in rabbit cortical collecting tubule. Am J Physiol, 254:F719- F733(1988). |
| 14) | 「医科生理学展望」原書18版,星猛,林秀生,菅野富夫(共訳),丸善,東京(1998). |
| 15) | Gary YM, Douglas AH:Inhibition of fatty acid synthesis and stimulation of glycogen breakdown by vasopressin in the perfused mouse liver. Biochem J, 152:389-392(1975). |
| 16) | Nomura H, Tachibana M, Maekawa H et al.:Effects of vasopressin, angiotensinⅡand phenylephrine on hepatic ketogenesis and fatty acid synthesis. Japan J Pharmacol, 41:525-532(1986). |
| 連絡先 | |||
| 試験責任者: | 森村智美 | ||
| 試験担当者: | 加藤博康,関 剛幸,古谷真美, 永田伴子 | ||
| 7食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| TEL 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | |||
| Authors: | Tomomi Morimura(Study Director) Hiroyasu Kato, Takayuki Seki, Mami Furuya, Tomoko Nagata | ||
| Hatano Research Institute, Food and Drug Safety Center 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | |||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | ||