 〕に溶解し,さらにこの40.0 mg/mL液を14.0および4.0 mg/mLの濃度に段階希釈した後,投与時まで冷暗所で保管した.調製された検体は,調製後6日以内に使用した.なお,調製検体の安定性試験および含量試験を実施した結果,1.00および100 mg/mLコーン油溶液の被験物質は,冷暗所で7日間は安定であり,また,投与検体中の被験物質の平均含量は,所定濃度の107〜109 %であることが確認された.
〕に溶解し,さらにこの40.0 mg/mL液を14.0および4.0 mg/mLの濃度に段階希釈した後,投与時まで冷暗所で保管した.調製された検体は,調製後6日以内に使用した.なお,調製検体の安定性試験および含量試験を実施した結果,1.00および100 mg/mLコーン油溶液の被験物質は,冷暗所で7日間は安定であり,また,投与検体中の被験物質の平均含量は,所定濃度の107〜109 %であることが確認された.雌雄とも200 mg/kg投与群の13例中8例で死亡がみられ,雄では投与第11日から,雌では投与第4日から,それぞれ投与期間終了まで断続的に認められた.雄の死亡動物のうち1例の病理組織学検査では,広汎な心筋変性がみられたが,他の死亡動物においては同様の変化はみられず,他の器官においても異常は認められなかった.
一般状態の変化として,雌雄とも200 mg/kg投与群で流涎や痙攣,姿勢の異常,散瞳,呼吸異常,異常発声等の神経症状がみられ,70 mg/kg投与群では雌雄で流涎が,雄で痙攣が認められた.これらの神経症状は投与期間の終了とともに消失した.ジシクロヘキシルアミンには,交感神経終末におけるノルアドレナリンの再吸収阻害作用が認められており1-3),本試験においてみられた一般状態の変化および死亡の原因は,交感神経の過剰な興奮によるものと推察される.
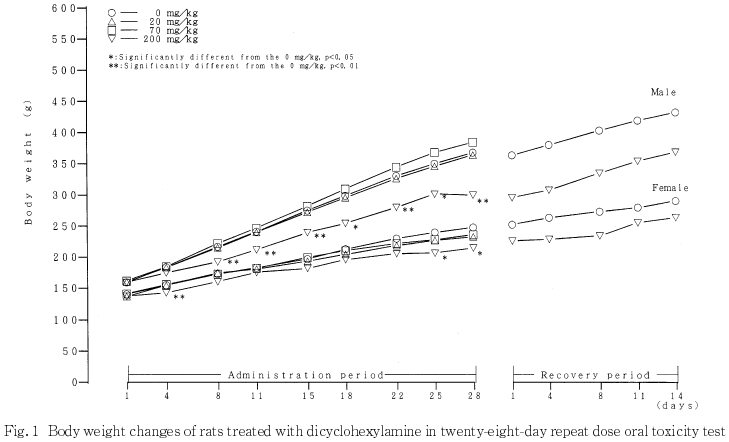
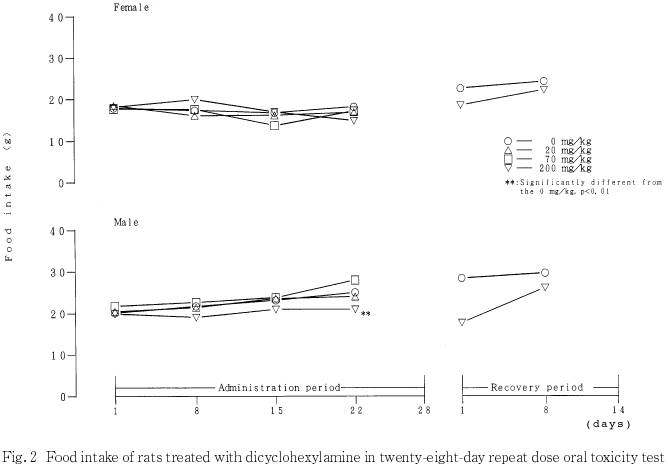
200 mg/kg投与群の雌および雄では,体重ならびに摂餌量が溶媒対照群と比較して低値を示した.体重の低値は投与期間終了後も継続したが,摂餌量は休薬とともに回復した.
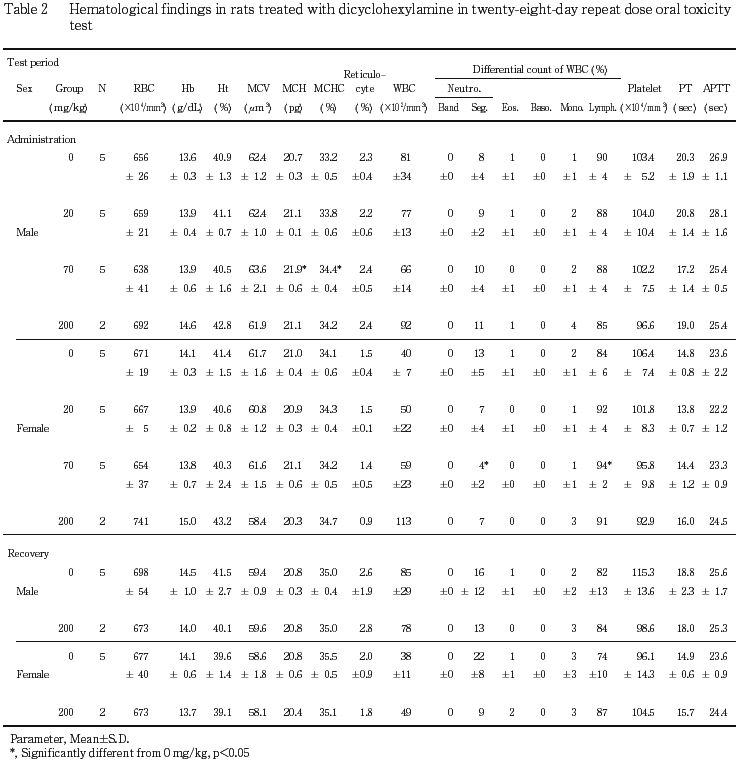
投与期間終了時の血液学検査では,200 mg/kg投与群の雌の白血球数が増加した.
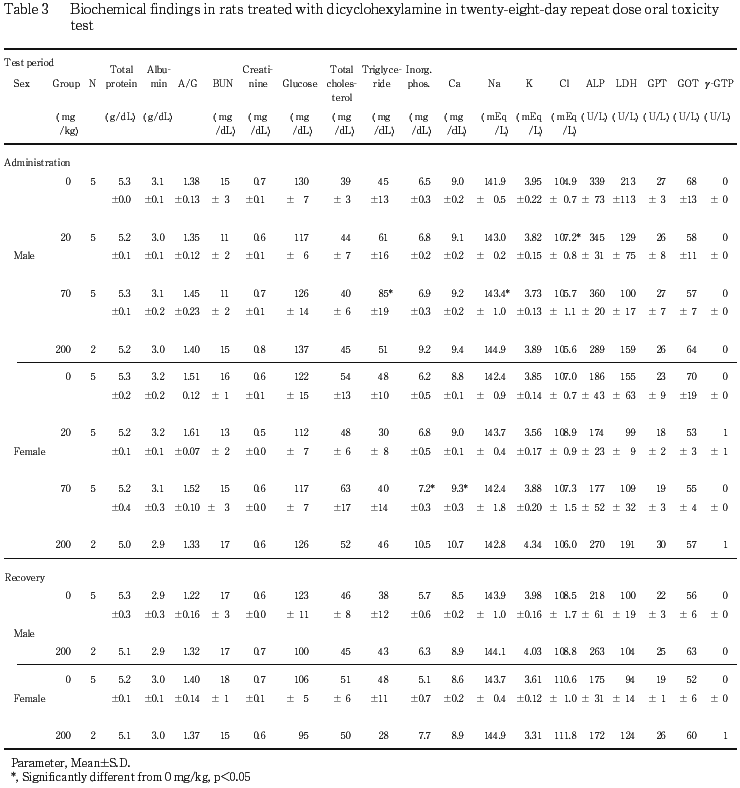
投与期間終了時の血液生化学検査では,200 mg/kg投与群の雌雄で無機リンおよびカルシウム濃度の上昇が認められ,リン・カルシウム代謝に対するジシクロヘキシルアミン投与の影響が疑われた.
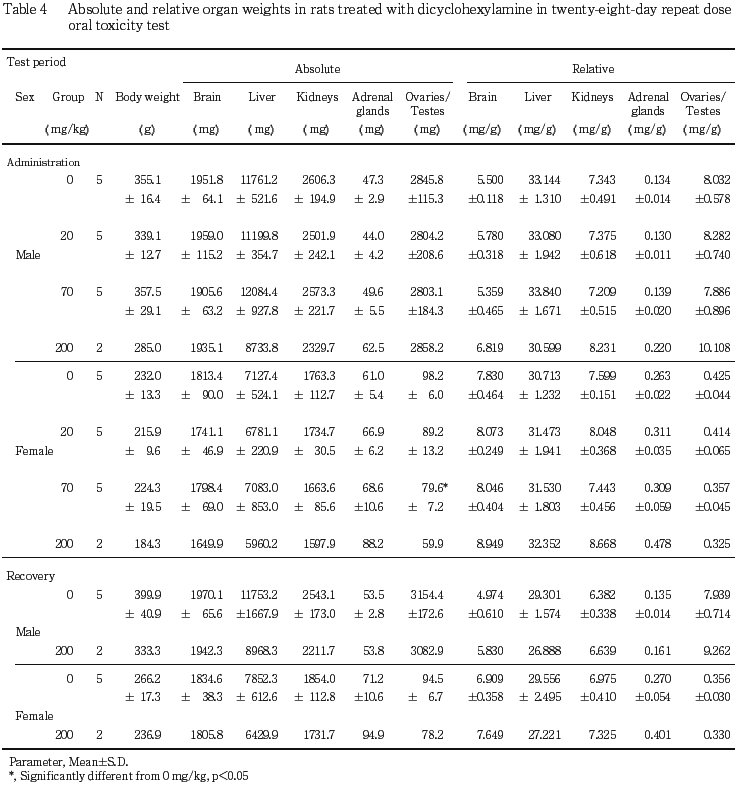
投与期間終了時の剖検において,副腎重量の増加が200 mg/kg投与群の雌雄で,卵巣重量の減少が70 mg/kg以上の投与群で観察された.200 mg/kg投与群では多数の死亡がみられ,また重度の神経症状の発現あるいは全身状態の悪化などが認められたことから,著しい症状の継続的発現によるストレス負荷により,コルチコトロンピン放出因子の分泌が増加し,これらの器官重量に変化を及ぼしている可能性が示唆された.
以上の結果,本試験条件下におけるジシクロヘキシルアミンの無影響量(NOEL)は,雌雄とも20 mg/kgであると判断した.
 より提供されたジシクロヘキシルアミン〔ロット番号:26281, 無色透明液体,融点:-0.1℃,沸点:255.8℃,純度:99.63 wt%〕を用い,入手後,遮光条件下に室温にて保管した.
より提供されたジシクロヘキシルアミン〔ロット番号:26281, 無色透明液体,融点:-0.1℃,沸点:255.8℃,純度:99.63 wt%〕を用い,入手後,遮光条件下に室温にて保管した.
被験物質を40.0 mg/mLの濃度になるよう,コーン油〔ロット番号:V6N3521,ナカライテスク 〕に溶解し,さらにこの40.0 mg/mL液を14.0および4.0 mg/mLの濃度に段階希釈した後,投与時まで冷暗所で保管した.調製された検体は,調製後6日以内に使用した.なお,調製検体の安定性試験および含量試験を実施した結果,1.00および100 mg/mLコーン油溶液の被験物質は,冷暗所で7日間は安定であり,また,投与検体中の被験物質の平均含量は,所定濃度の107〜109 %であることが確認された.
〕に溶解し,さらにこの40.0 mg/mL液を14.0および4.0 mg/mLの濃度に段階希釈した後,投与時まで冷暗所で保管した.調製された検体は,調製後6日以内に使用した.なお,調製検体の安定性試験および含量試験を実施した結果,1.00および100 mg/mLコーン油溶液の被験物質は,冷暗所で7日間は安定であり,また,投与検体中の被験物質の平均含量は,所定濃度の107〜109 %であることが確認された.
 )を9日間にわたり予備飼育した後,一般状態に異常の認められなかった雌雄各36匹を試験に供した.動物は,全飼育期間を通じて,温度24.0〜24.6℃,湿度46〜63 %,換気回数約15回/時間,照明時間12時間(7〜19時点灯)に制御された飼育室内で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2, 日本クレア
)を9日間にわたり予備飼育した後,一般状態に異常の認められなかった雌雄各36匹を試験に供した.動物は,全飼育期間を通じて,温度24.0〜24.6℃,湿度46〜63 %,換気回数約15回/時間,照明時間12時間(7〜19時点灯)に制御された飼育室内で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2, 日本クレア 製)および水道水(秦野市水道局給水)を自由に摂取させて飼育した.
製)および水道水(秦野市水道局給水)を自由に摂取させて飼育した.
群分けは,検疫期間中に異常のない動物の中から,投与開始前日の体重に基づいて,体重別層化無作為抽出法により行った.動物数は,溶媒対照群および200 mg/kg投与群では雌雄各13匹とし,20および70 mg/kg投与群では各5匹の動物を用いた.また,溶媒対照群の雌雄各5匹および200 mg/kg投与群の雌雄各2匹を,投与期間終了後,14日間の回復試験に用いた.一方,溶媒対照群および200 mg/kg投与群の各13匹中3匹を投与期間終了時に神経系の病理組織学検査を行う動物として,一般状態の観察ならびに病理組織学検査を実施した.これらの病理組織学検査対象動物のうち,投与期間中に溶媒対照群の雄の1例,200 mg/kg投与群の雌雄各2例が死亡したため,残りの動物を投与期間終了時に,0.1 Mリン酸緩衝1.25 %グルタールアルデヒド2 %パラホルムアルデヒド固定液で灌流固定し,脳,脊髄および坐骨神経の一部を電子顕微鏡用樹脂包埋し,病理組織学的に検査した.これらの神経系の病理組織学検査の結果,被験物質投与によると考えられる異常は認められなかった.
投与は,1日1回,28日間,毎日9時〜12時の間に,ラット用胃管を用いて強制的に行い,投与液量は,雌雄とも5 mL/kgとして,各投与時に最も近い時点で測定された体重に基づいて個別に算出した.
 )により測定した.
)により測定した.
 法),アルカリフォスファターゼ活性(パラニトロフェニルリン酸基質法), GOT活性(SSCC法),GPT活性(SSCC法),LDH活性(Wr
法),アルカリフォスファターゼ活性(パラニトロフェニルリン酸基質法), GOT活性(SSCC法),GPT活性(SSCC法),LDH活性(Wr blewski-La Due 法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),A/G比(総蛋白濃度およびアルブミン濃度より算出)を測定した.また,全自動電解質分析装置(EA05,A&T)により,ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法)を測定した.
blewski-La Due 法),カルシウム濃度(OCPC法),無機リン濃度(モリブデン酸直接法),トリグリセライド濃度(GPO・DAOS法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),A/G比(総蛋白濃度およびアルブミン濃度より算出)を測定した.また,全自動電解質分析装置(EA05,A&T)により,ナトリウム濃度(イオン電極法),カリウム濃度(イオン電極法),塩素濃度(イオン電極法)を測定した.
 法方法で多重比較を行った.一方,分散が一様でない場合はKruskal-Wallisの順位検定を行い,有意(有意水準:5 %)ならばDunnett型あるいはScheff
法方法で多重比較を行った.一方,分散が一様でない場合はKruskal-Wallisの順位検定を行い,有意(有意水準:5 %)ならばDunnett型あるいはScheff 法の方法で多重比較を行った.さらに,病理組織所見については,グレード分けしたデータは,Mann-WhitneyのU検定により,また,陽性グレードの合計値は,Fisherの直接確率の片側検定により,溶媒対照群と各被験物質投与群との間の有意差検定を行った(有意水準:5 %).200 mg/kg投与群の雌雄の,半定量検査を除く尿検査,血液学検査および血液生化学検査結果,器官重量測定値ならびに回復期間中の体重および摂餌量は,平均値のみを求め,検定は行わなかった.
法の方法で多重比較を行った.さらに,病理組織所見については,グレード分けしたデータは,Mann-WhitneyのU検定により,また,陽性グレードの合計値は,Fisherの直接確率の片側検定により,溶媒対照群と各被験物質投与群との間の有意差検定を行った(有意水準:5 %).200 mg/kg投与群の雌雄の,半定量検査を除く尿検査,血液学検査および血液生化学検査結果,器官重量測定値ならびに回復期間中の体重および摂餌量は,平均値のみを求め,検定は行わなかった.
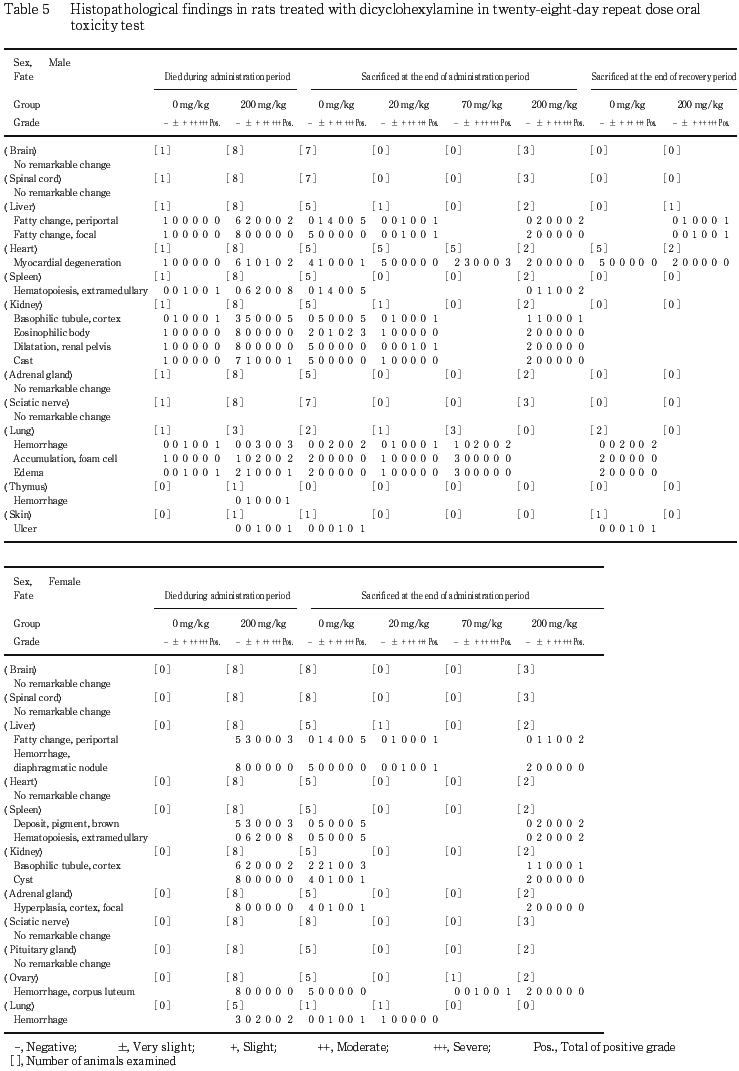
中枢神経の病理組織学的検討を実施した動物のうち,200 mg/kg 投与群の雄では流涎,痙攣,姿勢の異常,自発運動の低下,被毛の汚染および散瞳がみられ,3例のうち2例が死亡した.同群の雌では雄でみられた症状の他,振戦,紅涙および立毛がみられ,3例中2例が死亡した.溶媒対照群の雄の1例は,投与期間中に死亡したが,剖検の結果,肺全葉の暗赤色,無気域が認められ,病理組織学検査の結果,肺の出血と浮腫が認められたことから,投与過誤による死亡と判断した.
回復試験期間終了時の検査においては,トリグリセライド濃度の低下ならびに無機リン濃度の上昇が200 mg/kg投与群の雌で認められた.
回復試験期間終了時剖検において,200 mg/kg投与群では,副腎の絶対重量および相対重量の増加が雌で,肝臓の絶対重量の減少が雌雄で,卵巣の絶対重量の減少がそれぞれ認められた.また,回復試験期間中も体重増加抑制が継続したため,脳および腎臓の相対重量の増加が雌雄で,精巣および副腎の相対重量の増加が雄で認められたが,絶対重量には変化はみられなかった.
投与期間終了時剖検において,肺の暗色点または暗色領域,肺の淡色領域,腎盂の拡張,肝臓の淡色領域,肝臓の横隔膜結節,卵巣の暗色点が散見され,被毛の汚染が200 mg/kg 投与群の雌雄各1例で,痂皮の形成が溶媒対照群の雄の1例でそれぞれ認められたが,被毛の汚染を除くいずれの所見にも,用量依存性は認められないことから,被験物質投与による変化ではないと判断した.
回復試験期間終了時の剖検において,下顎リンパ節の腫大,肺の暗色点または暗色領域,肝臓の淡色領域,腹腔内器官の軽度の癒着ならびに皮膚の痂皮形成が認められたが,いずれの所見も同週齢のラットにときおり認められる所見であることから,被験物質投与によると考えられる明らかな変化ではないと判断した.
投与期間終了時剖検例における溶媒対照群と200 mg/kg投与群の比較において,肝臓では門脈周囲性の脂肪化が両群の雌雄全例で,脾臓では髄外造血が両群の雌雄全例でみられ,雌の両群全例に褐色色素沈着が認められた.また,腎臓では,雄の溶媒対照群の5例全例,雄の200 mg/kg投与群の2例中1例,雌の溶媒対照群の5例中3例,雌の200 mg/kg投与群の2例中1例で皮質の好塩基性尿細管が認められ,eosinophilic bodyが雄の溶媒対照群の5例中3例で,円柱が雌の溶媒対照群の5例中1例でそれぞれみられたが,いずれの病理組織学所見にもその発現頻度には溶媒対照群と200 mg/kg投与群の間で有意差は認められなかった.雄全例の心臓の病理組織学検査では,ごく軽度な心筋変性が溶媒対照群に1例,70 mg/kg投与群に3例みられた.
回復期間終了時剖検例には,被験物質投与の影響と考えられる病理組織学所見はみられなかった.雄全例の心臓の病理組織学検査においても,異常はみられなかった.
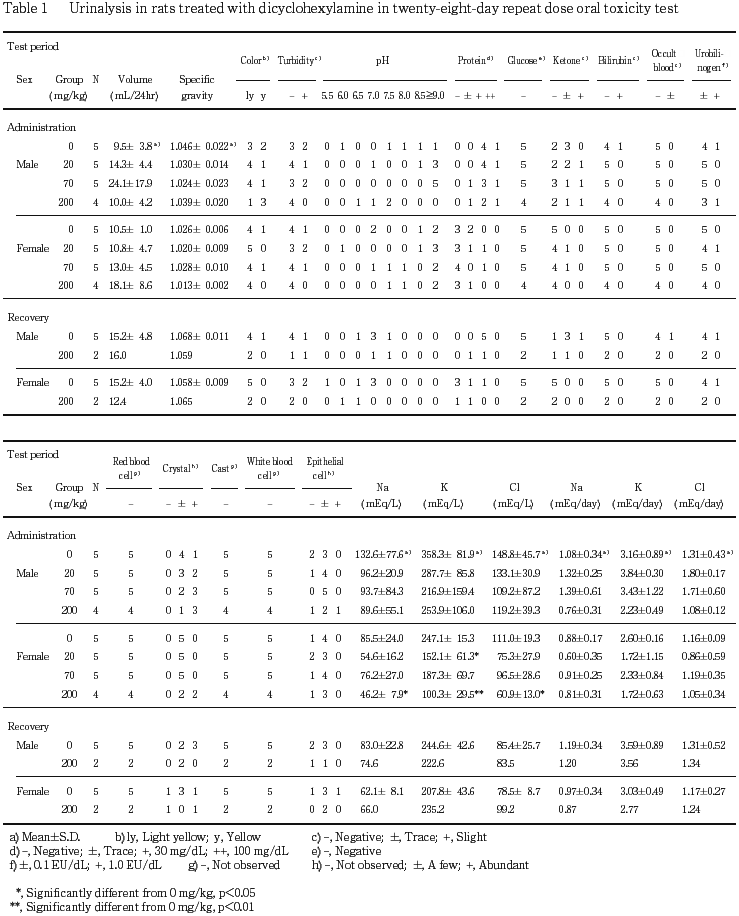
尿検査においては,溶媒対照群を含む各投与群において,雌雄とも投与期間終了週ならびに回復試験期間終了週のいずれの時期にも,蛋白,ケトン体,ビリルビンおよびウロビリノーゲンが陽性または疑陽性となる動物が認められた.しかし,これらの成績を当研究所において過去2年間に{既存化学物質の安全性点検事業}として行われた3試験の28日間反復経口投与毒性試験の対照群の結果との比較した結果,陽性および疑陽性の発現頻度ならびに程度には差が認められないことから,被験物質投与の影響はないものと判断された.また,尿沈渣中にみられた上皮細胞ならびに結晶は,いずれもラットにおいて通常観察されるものであった.
血液学検査においては,雌で白血球数の増加が200 mg/kg投与群の,投与期間終了時ならびに回復試験期間終了時の検査で認められた.このうち,回復試験期間終了時の白血球数は,先に述べた3試験の回復試験期間終了時の白血球数と比較した結果,正常値の範囲内であると判断した.一方,投与期間終了時の白血球数の増加は雄では認められないこと,雌においても白血球百分比には変化がみられないことから,被験物質投与による影響であるか否かは明らかにならなかった.
血液生化学検査では,投与期間終了時の血中塩素濃度の上昇ならびにナトリウム濃度の上昇が雄で,カリウム濃度の上昇が雌で認められた.また,尿検査においては投与期間末期の検査において,尿中カリウム濃度が雌で,ナトリウムならびに塩素濃度が雌雄でそれぞれ溶媒対照群に比較して低下した.これらのことから,ジシクロヘキシルアミン投与による水,電解質代謝に対する影響が疑われたが,これらの変化も,先に述べた3試験のデータと比較すると正常値の範囲内であると判断された.一方,無機リン濃度の上昇が200 mg/kg投与群の雄および70 mg/kg以上の投与群の雌で,カルシウム濃度の上昇が70 mg/kg以上の投与群の雌で,アルカリフォスファターゼ活性の上昇が200 mg/kg投与群の雌で認められた.また,回復試験期間終了時の検査においても,雌では無機リン濃度の上昇が認められることから,ジシクロヘキシルアミン投与によるリン・カルシウム代謝に対する影響が疑われた.これらのうち,70 mg/kg投与群の雌における変化は,先に述べた3試験における投与期間終了時の溶媒対照群の検査結果と比較して,差がないと判断されるものの,200 mg/kg投与群における変化は,アルカリフォスファターゼ活性を除いて,いずれも正常範囲を逸脱した値と考えられることから,ジシクロヘキシルアミンの200 mg/kgの反復投与は,リン・カルシウム代謝に対して影響を及ぼす可能性が示唆された.
器官重量では,投与期間終了時剖検例において,副腎重量の増加ならびに肝臓重量の減少が200 mg/kg投与群の雌雄で,卵巣重量の減少が70 mg/kg以上の投与群で認められた.ストレスに伴い視床下部からコルチコトロンピン放出因子(CRF)が分泌され,視床下部−脳下垂体−性腺系におけるエストロジェン濃度の低下が引き起こされることにより, 卵巣重量に変化が起きることが知られている4,5).本試験においては,副腎および卵巣重量に主に変化がみられた200 mg/kg投与群では,半数以上の動物に死亡が発現し,また痙攣を連日起こすなどの,かなりのストレスが負荷されたものと考えられることから,本試験における副腎ならびに卵巣重量の変化には,著しい症状の継続的発現により引き起こされたCRF分泌増加の影響が及んでいる可能性が考えられる.しかし,回復試験期間終了時剖検動物において,雄の200 mg/kg投与群の副腎重量の増加や雌の70 mg/kg投与群の卵巣重量の減少は回復傾向が認められたことから,ジシクロヘキシルアミンによる卵巣ならびに副腎に対する影響は,機能的な変化であり,可逆性を有することが明らかになった.一方,肝臓重量の減少については,病理組織学検査所見にも被験物質投与によると考えられる明らかな異常は認められず,血液生化学検査結果にも異常は認められないことから,被験物質投与による肝臓に対する影響が,いかなる機序によるものかについては明らかでなかった.しかし,回復試験期間終了時剖検動物においても,雌雄とも200 mg/kg投与群で肝臓重量の減少がみられたことから,14日間の休薬後の剖検でも回復傾向は認められないものと考えられた.ジシクロヘキシルアミンは培養細胞において,細胞の成長や分化に重要な因子である6)ポリアミン,特にスペルミジンの合成を抑制することが報告されている7).In vivoでもジシクロヘキシルアミンには,Ehrich ascites carcinomaやSacroma 180等の動物移植癌に対する抗腫瘍活性があることが明らかになっている.また,スペルミジンはラット肝臓ミトコンドリア中に,1.8 nmol/mg蛋白程度の濃度で存在することが報告されている8).スペルミジンの合成抑制が,肝臓においていかなる変化を惹起するかはなお明らかでないが,ジシクロヘキシルアミンの反復投与により,肝臓を標的とした変化が生じた可能性も考えられる.200 mg/kg投与群における体重増加の抑制が回復試験期間中も継続して認められたことからも,ジシクロヘキシルアミンの反復投与による毒性的影響は,投与終了後もかなり継続しているものと考えられた.
以上の結果,ジシクロヘキシルアミンの70 mg/kgの投与では,一般状態の観察において流涎や痙攣が認められ,被験物質による自律神経に対する毒性学的影響が疑われることから,本試験条件下におけるジシクロヘキシルアミンの無影響量は,雌雄とも20 mg/kgであると判断した.
| 1) | J.A. Hickman, D.R. Mottram, C. Kidman, Arch. int. Pharmacodyn., 228, 191(1977). |
| 2) | D.R. Mottram, J.A. Hickman, Arch. int. Pharmacodyn., 242, 50(1979). |
| 3) | C.D. Kidman, D.R. Mottram, J.A. Hickman, Arch. int. Pharmacodyn., 238, 180(1979). |
| 4) | C. Rivier, S. Rivest, Biol. Reprod., 45, 525(1991). |
| 5) | A.E. Calogero, N. Burrello, P. Negri-Cesi, et al, Endocrinology, 137, 4161(1996). |
| 6) | J. Ibrahim, A.D. Hughes, M. Schachter, P.S. Sever, Clin. Exp. Pharmacol. Physiol., 23, 410(1996). |
| 7) | H. Hibasami, M. Tanaka, J. Nagai, T. Ikeda, FEBS Letters, 116, 99(1980). |
| 8) | V. Tasani, M. Campagnolo, A. Toninello, D. Siliprandi, Biochem. Biophys. Res. Commun., 226, 850(1996). |
| 連絡先 | |||
| 試験責任者: | 大原直樹 | ||
| 試験担当者: | 高島宏昌,田中あづさ,加藤博康,関 剛幸,小島幸一,稲田浩子,安生孝子,畔上二郎,吉村愼介,三枝克彦 | ||
| (財)食品薬品安全センター 秦野研究所 | |||
| 〒257-8523 秦野市落合 729-5 | |||
| Tel 0463-82-4751 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Naoki Ohara(Study Director) Hiromasa Takashima, Azusa Tanaka, Hiroyasu Katoh, Takayuki Seki, Kohichi Kojima, Hiroko Inada, Takako Anjo, Jiro Azegami, Shinsuke Yoshimura, Katsuhiko Saegusa | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||