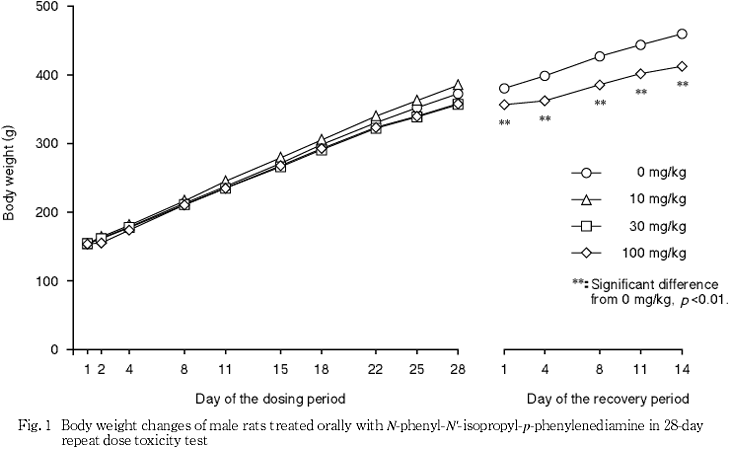
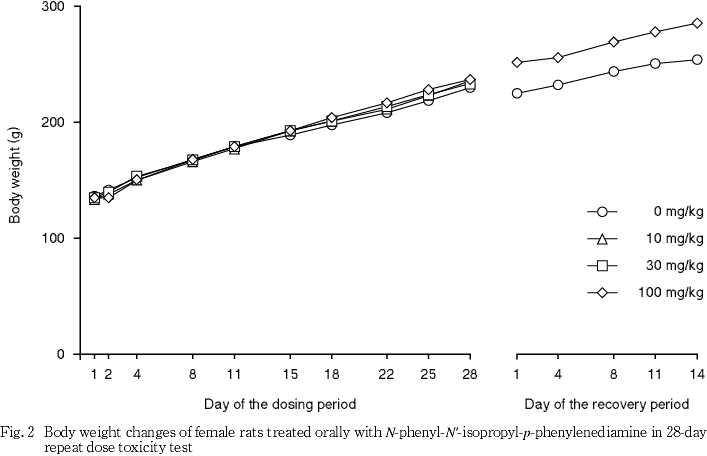
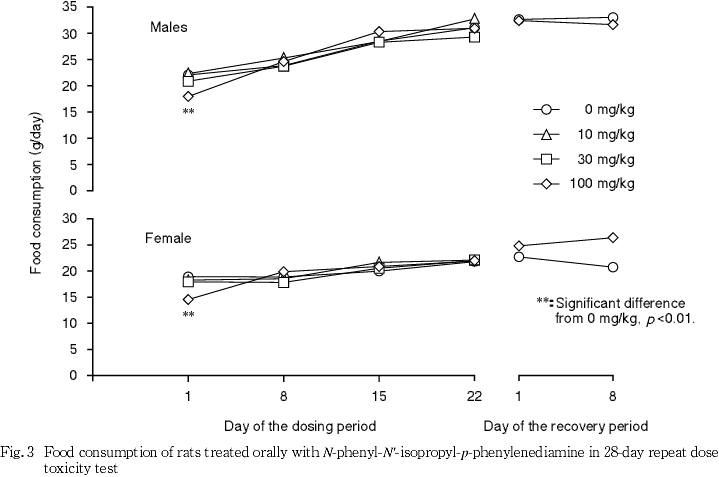
死亡例はなく,100 mg/kg投与群では流涎および淡褐色尿が観察され,投与第2日には,摂餌量の減少を伴い体重が減少ないし増加抑制された.流涎は30 mg/kg投与群の一部でも観察された.
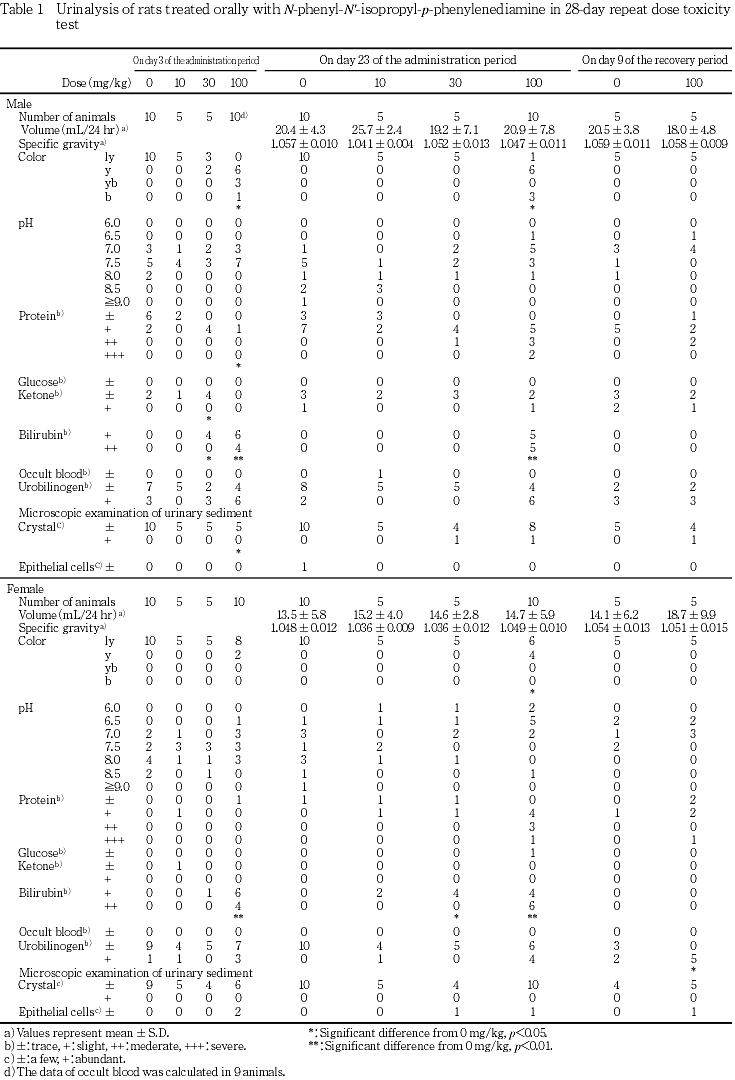
尿検査では,雌で10,雄で30 mg/kg以上を投与した群でビリルビンが陽性となった.また,30 mg/kg投与群の雄および100 mg/kg投与群の雌雄の一部で蛋白の高い個体が散見されたほか,尿が黄色ないし褐色を呈した.回復第2週の検査でも100 mg/kg投与群の雌雄で蛋白の高い個体が散見された.
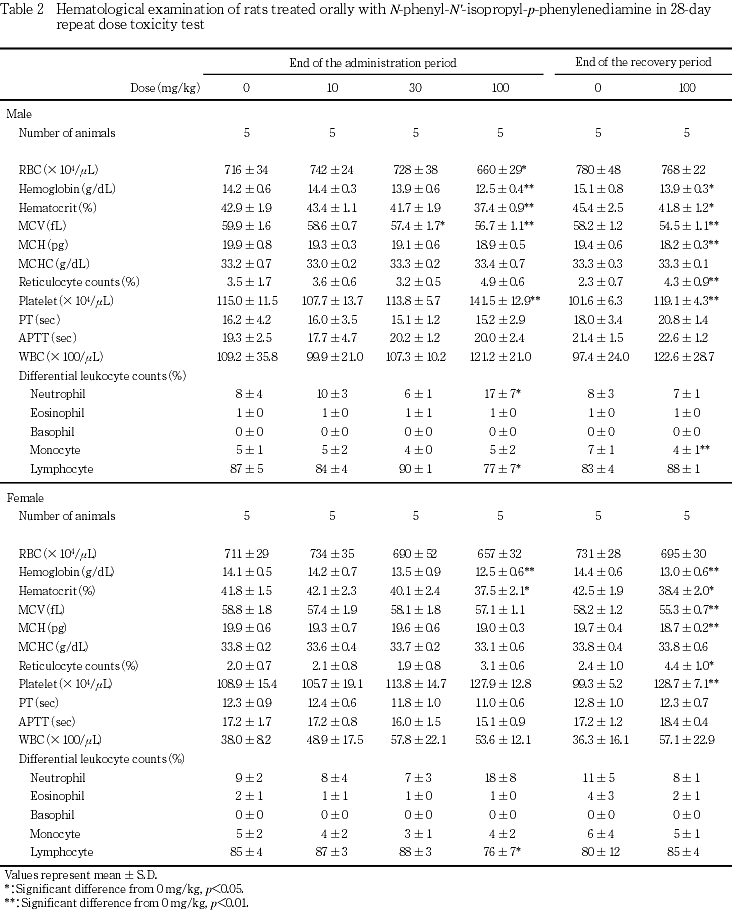
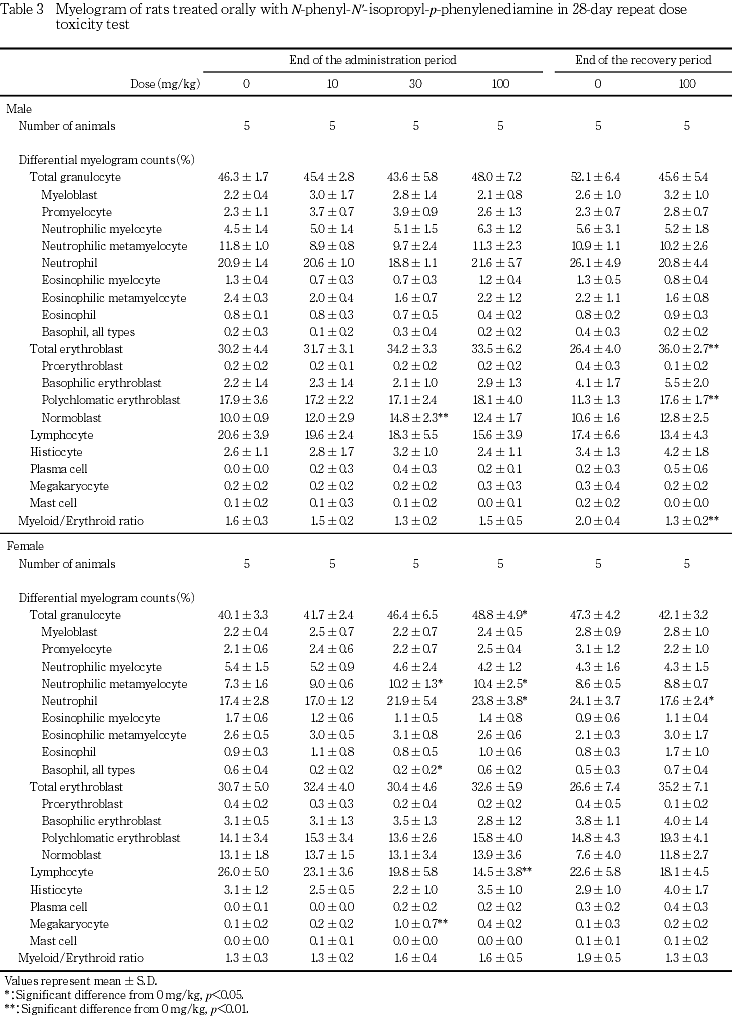
血液学検査では,100 mg/kg 投与群の雌雄で,赤血球数,血色素量およびヘマトクリット値が低下し,網状赤血球比率および血小板数が増加した.骨髄像では,30および100 mg/kg投与群の雌で顆粒球系骨髄球の比率が増加した.100 mg/kg投与群では,2週間の回復試験終了後も血色素量,ヘマトクリット値が低かったが,血小板数および網状赤血球比率が上昇したほか,骨髄像では,M/E比の減少を伴って血芽球系細胞比率が上昇した.
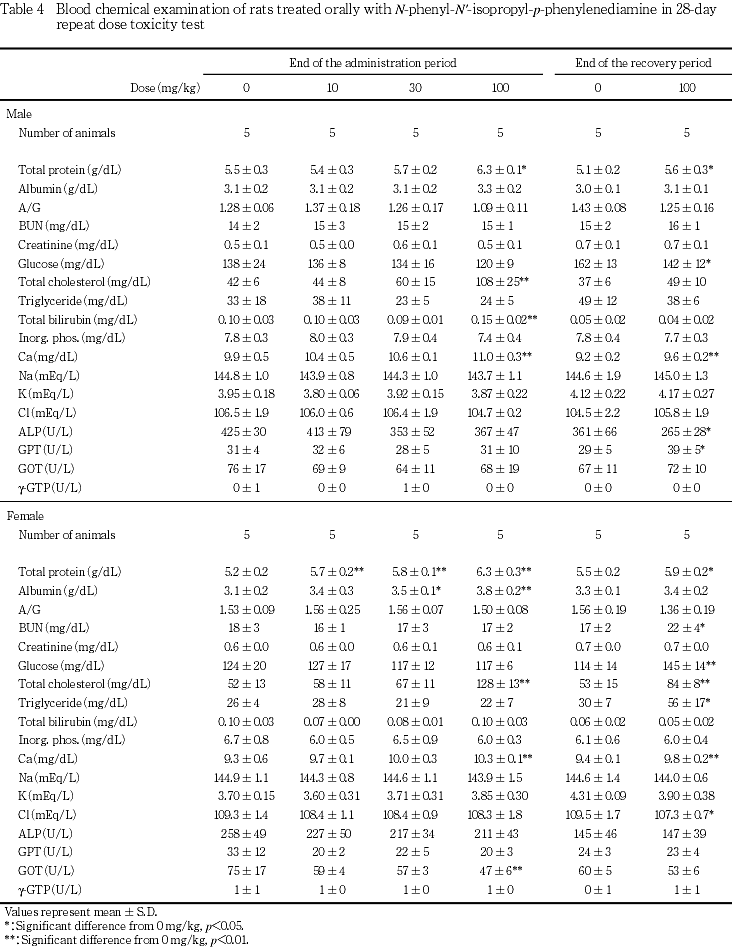
血液生化学検査では,10および30 mg/kg投与群の雌および100 mg/kg投与群の雌雄で総蛋白濃度が上昇し,30および100 mg/kg投与群の雌ではアルブミン濃度も上昇した.また,100 mg/kg投与群では,雄で総ビリルビン濃度が上昇した.
病理学的に100 mg/kg投与群では,肝臓が腫大し,好酸性肝細胞肥大,小葉中間帯の脂肪化,軽微な肝細胞の単細胞壊死が観察されたほか,脾臓が腫大し,ヘモジデリン沈着および髄外造血増加の増強が認められた.さらに,雌雄で腎重量が増加し,雄で好塩基性尿細管の増強および軽微なヘモジデリン沈着が散見された.30 mg/kg投与群でも肝臓が腫大し,雌雄で好酸性肝細胞肥大が,雄で小葉中間帯の脂肪化が観察され,雌で脾臓のヘモジデリン沈着の増強が確認された.回復試験終了後,肝臓重量の増加,好酸性肝細胞肥大および小葉中間帯の脂肪化は軽減したが,肝細胞の単細胞壊死は多数例で認められ,脾臓の腫大ならびに髄外造血の増加およびヘモジデリン沈着の増強も観察された.また,雄では,腎臓の腫大および好塩基性尿細管の増強が認められた.
以上の結果,本試験条件下におけるN-フェニル-N'-イソプロピル-p-フェニレンジアミンの無作用量は,雄で10 mg/kg,雌では10 mg/kg/day未満であると考えられた.また,被験物質の標的器官は肝臓,血液,腎臓であることが示唆され,主として肝重量の増加を伴う好酸性肝細胞肥大,小葉中間帯の脂肪化および肝細胞の単細胞壊死,溶血性貧血,腎臓重量の増加および尿蛋白の増加が生じることが明らかとなった.これらの変化の中で,肝細胞の単細胞壊死は,2週間の投与中止後も回復しなかったが,その他の変化は軽減し,回復過程にあると考えられた.
検体調製では,被験物質を粉砕後,乳鉢で磨砕し,媒体を加えて練り上げて高用量群の懸濁液を調製してから,段階希釈して他群の投与検体を調製した.媒体には,日局注射用水(ロット番号9912ST,光製薬(株))を溶媒として0.5 %に調製した日局カルメロースナトリウム(ロット番号6Z09,丸石製薬(株))水溶液を使用した.
投与検体は,8日間の安定性が確認されているため1週間に1回の頻度で調製し,使用時まで冷蔵庫にて保管した.また,含量測定および均一性試験の結果から,各濃度の投与検体中には所定濃度の被験物質が含有され,均一性も良好であることが確認された.
群分けは,投与開始前日の体重に基づいて体重別層化無作為抽出法により行った.各群の動物数は,雌雄とも対照群および高用量群を各10匹とし,低および中用量群を各5匹とした.
動物は,温度21.0〜25.0 ℃,湿度40.0〜75.0 %,換気回数約15回/時および照明12時間(7時〜19時点灯)に設定された飼育室内で,金属製金網床ケージに1匹ずつ収容し,固型飼料(CE-2,日本クレア(株))と水道水(秦野市水道局給水)を自由に摂取させて飼育した.
投与経路は経口とし,1日1回,28日間,ラット用胃管を用いて強制的に投与した.投与容量は10 mL/kgとし,雌雄とも最近時の体重をもとに個体別に投与液量(mL)を算出した.なお,回復試験期間は14日間とした.
 法,Rate),ALP活性(GSCC法),GOT活性(IFCC法),GPT活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),総ビリルビン濃度(Jendrassik/Grof法),無機リン濃度(モリブデン酸直接法)およびカルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(いずれもイオン電極法)を測定した.
法,Rate),ALP活性(GSCC法),GOT活性(IFCC法),GPT活性(IFCC法),γ-GTP活性(γ-グルタミル-3-カルボキシ-4-ニトロアニリド基質法),トリグリセライド濃度(GPO・DAOS法),総ビリルビン濃度(Jendrassik/Grof法),無機リン濃度(モリブデン酸直接法)およびカルシウム濃度(OCPC法)を測定し,A/G比を算出した.また,全自動電解質分析装置(EA05,(株)A&T)により,ナトリウム濃度,カリウム濃度および塩素濃度(いずれもイオン電極法)を測定した.
回復試験期間中,100 mg/kg投与群の雄で対照群と比較して有意に低値となった.しかし,個体別の比較から,100 mg/kg投与群の雄では,投与期間終了後,体重の比較的軽い動物が回復試験に用いられたために有意差が認められたと考えられた.この他には,対照群と被験物質投与群との間に有意な変化はなかった.

投与第4週の検査では,100 mg/kg投与群の雌雄で,尿が黄色から褐色を呈し,有意な変化となった.また,10 mg/kg投与群の雌および30 mg/kg以上を投与した雌雄各群でビリルビンが検出され,30 mg/kg投与群の雌および100 mg/kg投与群の雌雄で有意な変化となった.この他,有意差は認められなかったが,30 mg/kg投与群の雄1例および100 mg/kg投与群の雄5例雌4例で尿蛋白が中等度(++)以上となった.また,24時間尿について色調を確認した結果,100 mg/kg投与群の雌雄全例および30 mg/kg投与群の雌2例で上層部が暗紫色を呈した.
回復第2週の検査では,100 mg/kg投与群の雌でウロビリノーゲンが有意に増加した.この他には,いずれの項目でも対照群と被験物質投与群との間に有意差はなかったが,100 mg/kg投与群の雄2例雌1例で尿蛋白が中等度(++)以上となった.
回復試験終了時屠殺例では,100 mg/kg投与群の雌雄で,血色素量,ヘマトクリット値,平均赤血球容積および平均赤血球血色素量が有意に減少し,血小板数および網状赤血球比率が有意に上昇した.100 mg/kg投与群の雄では,単球比率が有意に低下したが,投与期間中には低下しておらず,同系統同週齢の動物のコントロールデータ6, 7)と比較すると対照群の単球比率が高かったことから,被験物質投与による変化ではないと判断した.骨髄像検査では,100 mg/kg投与群の雌雄で多染性赤芽球比率および総赤芽球比率の上昇ならびにM/E比の低下が認められ,雄で有意な変化となった.また,雌では,好中球比率が有意に低下した.
この他には,雌雄各被験物質投与群とも対照群と比較して有意な変化はなかった.
回復試験期間終了時に屠殺例した100 mg/kg投与群では,雌雄で総蛋白濃度およびカルシウム濃度が,雌で尿素窒素濃度,ブドウ糖濃度,総コレステロール濃度およびトリグリセライド濃度がそれぞれ有意に上昇した.また,雄のブドウ糖濃度とALP活性の低下およびGPT活性上昇,雌の塩素濃度の低下がそれぞれ有意な変化となったが,いずれも投与期間終了時には認められていない変化であり,関連項目も変化していないため,被験物質投与による影響ではないと判断した.
この他の検査項目には,対照群と被験物質投与群の間に有意差は認められなかった.
回復試験期間終了時屠殺例では,100 mg/kg投与群の雌雄で肝重量が増加し,雌雄の相対重量および雌の実重量が有意な増加となった.また,雄では,脾臓の実重量および相対重量ならびに腎臓の相対重量が有意に増加した.この他,雄では脳の相対重量が有意に増加したが,投与期間終了時に認められなかった変化であり,剖検時体重が対照群と比較して低かったことも考慮して,被験物質投与あるいは投与中止による変化ではないと判断した.
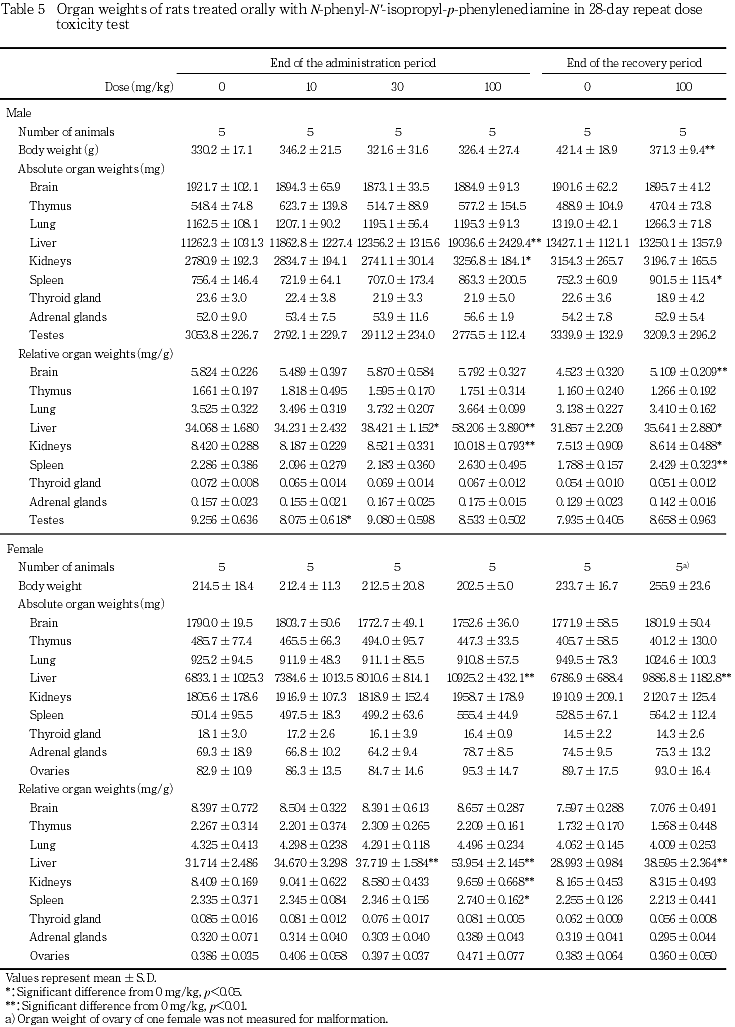
回復試験期間終了時屠殺例では,100 mg/kg投与群の雄雌で肝臓の腫大および脾臓の腫大が,雄で腎臓の腫大が散見された.その他,雌雄各群とも変化は観察されなかった.
肝臓では,30および100 mg/kg投与群の雌雄で,好酸性を示す肝細胞の肥大が観察され,30 mg/kg投与群の雄および100 mg/kg投与群の雌雄で変化の程度および発生頻度が有意に増加した.また,小葉中間帯の脂肪化が,30 mg/kg投与群の雄および100 mg/kg投与群の雄雌で観察され,雄では変化の程度および発生頻度が用量依存的に増加し,いずれも有意な変化となった.さらに,雄では100 mg/kg投与群の全例で軽微な肝細胞の単細胞壊死が認めれ,変化の程度および発生頻度が有意に増加した.雌では,100 mg/kg投与群の3例で認められたが,対照群でも1例みられたため,増加したものの有意差はなかった.この他,対照群を含む雌雄各群で門脈周囲の脂肪化が多数例で観察されたが,用量依存的な変化ではなかったため,被験物質投与による変化ではないと判断した.
脾臓では,対照群の雄1例を除く雌雄全例でヘモジデリン沈着が認められたが,30 mg/kg投与群の雌および100 mg/kgの雌雄で程度が増強され,100 mg/kg投与群の雌で有意となった.また,髄外造血の増加は対照群を含めて雌雄全例で観察されたが,100 mg/kg投与群の雌雄でやや程度が強い傾向にあり,100 mg/kg投与群の雌で有意な増強となった.この他,脾臓では,急性のうっ血が,対照群の雌および100 mg/kg投与群の雌雄で散見されたが,対照群と被験物質投与群との間に差がなく,被験物質投与による影響ではないと判断した.
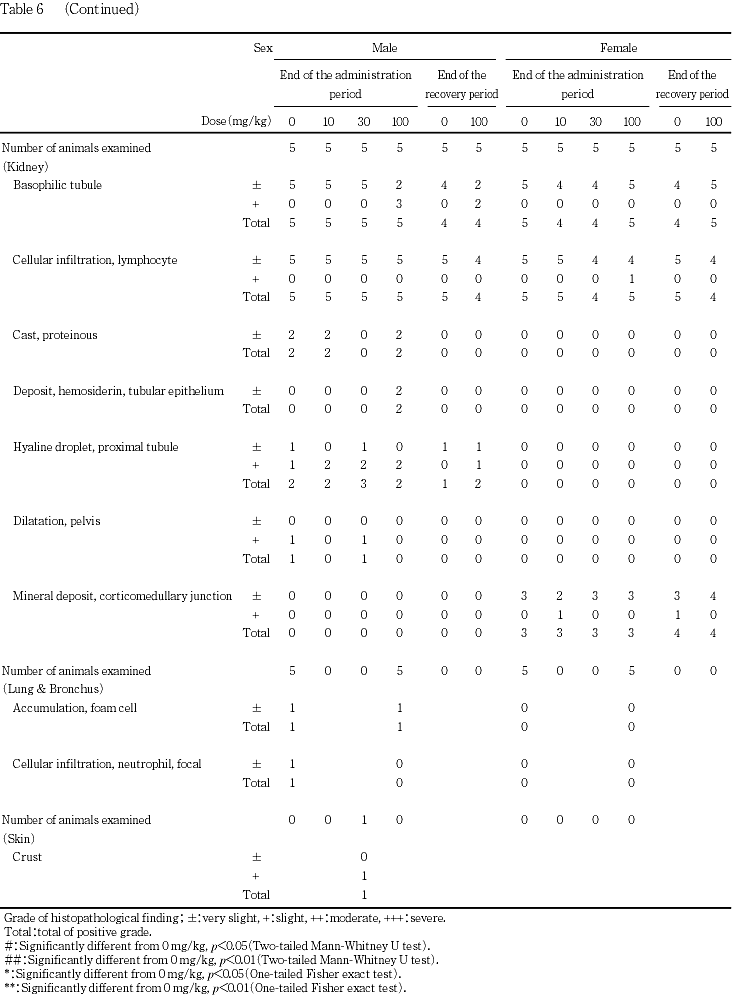
腎臓では,10および30 mg/kg投与群の雌各1例を除く雌雄全例で,好塩基性尿細管が観察されたが,100 mg/kg投与群の雄3例で他よりやや強い軽度な変化であったほかは,いずれも軽微な変化であった.この軽度な好塩基性尿細管が観察された100 mg/kg投与群の雄3例中2例では,軽微なヘモジデリン沈着も認められた.この他,腎臓では,多数例でリンパ球浸潤が観察され,雄で硝子滴,蛋白円柱および腎盂の拡張が,雌で皮髄境界部の鉱質沈着が散見されたが,いずれも対照群と被験物質投与群との間で変化がなかったことから,被験物質投与による所見ではないと判断した.剖検時に腎臓の腫大が認められた30 mg/kg投与群の雄1例では他の個体と組織学的に異なる所見は観察されず,腎重量の増加も僅かであったため明瞭な被験物質投与による変化ではないと判断した.
この他,肺では,雄の対照群および100 mg/kg投与群の各1例で泡沫細胞の集簇巣が観察され,対照群の雄1例で限局性の好中球浸潤が認められたが,いずれの変化も,被験物質投与群で増強していないことから,被験物質投与による影響ではないと判断した.また,剖検時に皮膚に痂皮が認められた30 mg/kg投与群の雄1例の皮膚では,痂皮以外に変化は認められず,30 mg/kg投与群の雄1例にのみ認められた変化であったことから,偶発的な変化であると判断した.
その他,組織学的検査を行った胃,脳,心臓,副腎,甲状腺,精巣および卵巣には変化が認められなかった.
回復試験期間終了時屠殺例では,組織学的検査を行った肝臓,脾臓および腎臓で次に示すような変化が観察された.
肝臓では,100 mg/kg投与群の雄全例で,単細胞壊死および小葉中間帯の脂肪化が認められ,変化の程度および発生頻度とも有意な増加となった.雌では,単細胞壊死が対照群の1例および100 mg/kg投与群の4例で,小葉中間帯の脂肪化が100 mg/kg投与群の2例で観察され,いずれも対照群と比較して発生頻度は増加する傾向にあったが,有意差は認められなかった.この他,門脈周囲性の脂肪化が対照群を含む多数例で観察された.
脾臓では,対照群を含む雌雄全例でヘモジデリン沈着および髄外造血の増加が観察されたが,100 mg/kg投与群の雌雄で変化の程度が強い傾向にあり,雄のヘモジデリン沈着および雌の髄外造血の増加が,それぞれ有意な増強となった.
腎臓では,好塩基性尿細管が対照群を含む各群の多数例で観察されたが,100 mg/kg投与群の雄2例で軽度な変化であった他は,いずれも軽微な変化であった.この他,対照群を含む雌雄多数例でリンパ球浸潤が観察され,雄で硝子滴が,雌で皮髄境界部の鉱質沈着が散見されたが,いずれも対照群と被験物質投与群との間に差がなかったことから,被験物質投与による変化ではないと判断した.
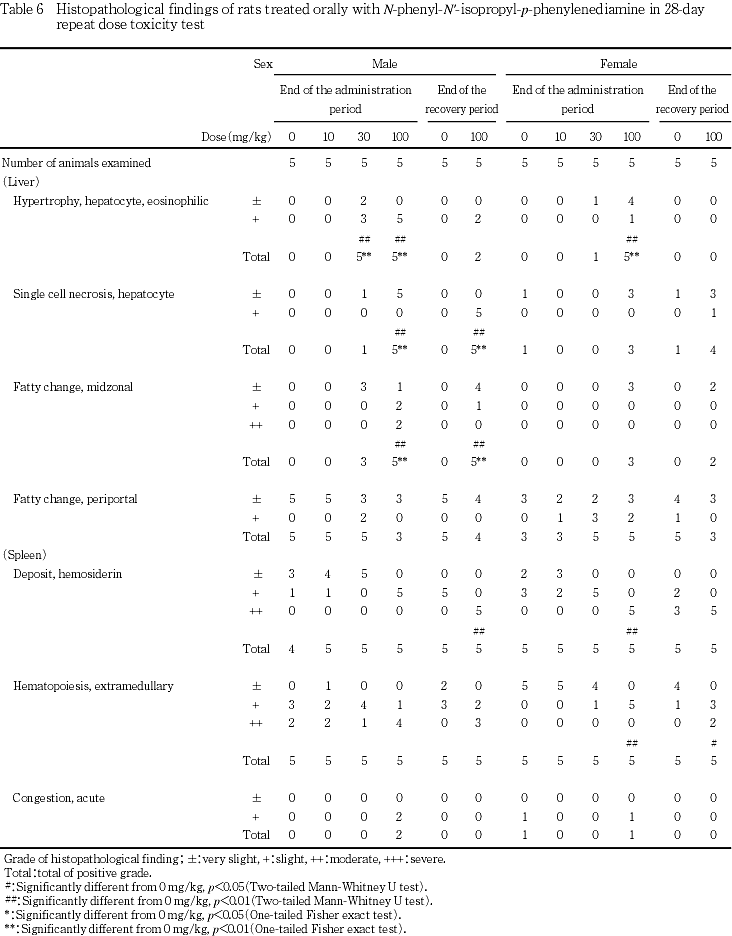
肝臓では,30および100 mg/kg投与群で,重量の増加および腫大,好酸性肝細胞肥大,小葉中間帯の脂肪化が認められ,100 mg/kg投与群では肝細胞単細胞壊死が観察された.被験物質の急性経口毒性試験(未公刊)では肝障害が示唆されており,本試験でも肝臓が標的器官であると考えられた.吸収されたN-フェニル-N'-イソプロピル-p-フェニレンジアミンは一部肝臓で代謝されてグルクロン酸抱合体となり,未変化体とともに尿中および胆汁中に排泄されること,腸肝循環ならびに脂肪組織および肝臓中への蓄積により,長時間残存する可能性の高い物質であることが報告されている8).肝細胞の単細胞壊死は酵素誘導後の退行性変化である可能性もあるが,今回,2週間の投与中止後も肝細胞の単細胞壊死が認められ,他の毒性変化も軽減したが引き続き観察されたことについて,毒性変化の可逆性を考察する際には,被験物質の残留性についても考慮する必要があると思われた.この他,100 mg/kg投与群の雌雄で総蛋白濃度およびカルシウム濃度の上昇が認められ,雌では,10および30 mg/kg投与群も含めて,アルブミン濃度の上昇を伴って総蛋白濃度が上昇し,被験物質投与による変化であると考えられた.アルブミン濃度上昇を伴うカルシウム濃度の上昇は肝障害時認められることがあるが,本試験結果からは,肝毒性に起因したものであるのか判断できなかった.さらに,100 mg/kg投与群では,雌雄で総コレステロール濃度が上昇し,雄では小葉中間帯の肝細胞脂肪化の程度と個体別に一致した.しかし,雌では一致しなかったことから,総コレステロール濃度の上昇と被験物質投与との関連は示唆されるものの,肝臓との関連は不明であった.また,回復試験終了時に雌で認められたトリグリセライド濃度の上昇は被験物質投与に起因した変化であるのか否か判断できなかった.
100 mg/kg投与群の雌雄および30 mg/kg投与群の雄で尿が黄色から褐色を呈した.しかし,投与中止翌日には回復したこと,尿検査時に潜血反応が陰性であったこと,尿中にN-フェニル-N'-イソプロピル-p-フェニレンジアミンあるいはその代謝産物が排泄されるということ8-10),本被験物質は紫褐色を呈し,24時間尿の上層部は暗紫色を示したことから,溶血による褐色化ではなく,尿中に排泄された被験物質あるいはその代謝物に由来する変化であると考えられた.また,100 mg/kg投与群の雄で観察された緑色調の便も被験物質もしくはその代謝産物に由来する可能性が示唆された.なお,これら色調の変化は雄で強く認められたが,代謝の性差によるものであるのかは判断できず,肝臓の好酸性肝細胞肥大,肝小葉中間帯の脂肪化,血漿総蛋白濃度の上昇などいくつかの項目で認められた雌雄差も,明瞭なものではなかった.
100 mg/kg投与群では雌雄で,赤血球数,血色素量およびヘマトクリット値が低下し,貧血が示唆された.さらに,雌雄で尿中にビリルビンが検出され,雄で血中ビリルビン濃度が上昇したこと,組織学的に雌雄で,脾臓のヘモジデリン沈着がやや程度が強い傾向にあったこと,貧血に伴って網状赤血球比率が上昇したことから溶血性貧血が示唆された.なお,回復試験後も,血色素量,ヘマトクリット値,平均赤血球容積および平均赤血球血色素量が低い状態にあったが,網状赤血球比率の上昇,骨髄像における赤芽球系細胞比率の上昇,脾臓重量の増加,脾臓における髄外造血の増加が認められたため,貧血は回復過程にあると考えられた.また,回復試験期間中の尿検査でビリルビンが検出されなかったことから溶血は投与中止により停止することが示唆された.この他,100 mg/kg投与群では,雌雄で血小板数の増加,好中球比率の上昇およびリンパ球比率の低下が認められ,骨髄像でも,雌で顆粒球系細胞比率および巨核球比率が上昇し,雌雄でリンパ球比率が低下した.貧血時に骨髄の造血機能が亢進した場合,二次的に末梢の血小板および顆粒球系白血球が増加することが知られており11, 12),本試験でも被験物質投与による貧血の結果,二次的に血小板および好中球が増加したことが推測された.なお,10 mg/kg投与群の雌および30 mg/kg投与群の雌雄でも尿中ビリルビンが検出され,30 mg/kg投与群の雄で平均赤血球容積が減少し,雌で骨髄像が変化した.尿中ビリルビンは肝障害を反映している可能性もあり,いずれも被験物質投与による変化であると判断した.
腎臓では,100 mg/kg投与群の雌雄で器官重量が増加したが,雄3例で好塩基性尿細管の僅かな増強が認められ,この雄3例中2例で軽微なヘモジデリン沈着が認められた以外には被験物質投与に起因すると考えられる明らかな病理学的変化はなかった.しかし,投与第4週および回復試験終了時に,100 mg/kg投与群ではこの雄3例を含む雌雄数例で中等度以上尿蛋白が検出され,被験物質の急性経口毒性試験では,死亡例で近位尿細管上皮の変性あるいは壊死が認められ,腎障害が示唆されているため,本試験でも尿細管上皮細胞に変性ないし壊死が生じた可能性がある.また,これらの変化は投与中止により回復しなかったものの,程度は軽減する傾向にあり,回復性が示唆された.この他,投与第3日の尿検査では100 mg/kg投与群の雌雄で沈渣中の結晶陰性例が増加する傾向にあった.沈渣中の結晶は,尿のpHあるいは尿量などに左右されるが,投与第3日には尿量を測定しておらず,pHは対照群と比較して大差がなかったことから,結晶の変化が被験物質投与に起因する可能性は否定できないもののその原因は不明であった.
30および100 mg/kg投与群の雌雄で投与保定時から流涎が観察され,100 mg/kg投与群の雌1例では,投与を伴わない取扱い時にも流涎が認められた.刺激性物質の経口投与に際しては,しばしば反射性の流涎が観察され,100 mg/kg投与群の雌雄各1例で認められたような前胃粘膜の肥厚が生じることが知られている13).また,被験物質の単回経口毒性試験(未公刊)では,被験物質の刺激性が示唆されていることから,流涎は被験物質の刺激性に由来する可能性が示唆された.
この他,摂餌量の減少に伴って投与第1日から2日にかけて100 mg/kg投与群の雌雄で体重の増加が抑制され,被験物質投与による影響であると考えられるが,摂餌量減少を示唆するような一般状態の変化は観察されず,成因は明らかとはならなかった.
以上の結果から,本試験条件下におけるN-フェニル-N'-イソプロピル-p-フェニレンジアミンの無作用量は雄で10 mg/kg,雌では10 mg/kg未満であると考えられた.また,被験物質の標的器官は肝臓,血液,腎臓であることが示唆され,主として肝重量の増加を伴う好酸性肝細胞肥大および小葉中間帯の脂肪化,溶血性貧血,尿蛋白の上昇が生じることが明らかとなった.2週間の投与中止によって,溶血は終息して貧血は回復過程にあり,好酸性肝細胞肥大および小葉中間帯の脂肪化は軽減したが,肝細胞の単細胞壊死は明らかな回復性を示さなかった.
| 1) | 櫻本裕助,高分子加工,438(1977). |
| 2) | 鹿庭正昭ら,衛生化学,28(3),137(1982). |
| 3) | S. E. Feinman, J. Toxicol. -Cut. & Ocular Toxicol., 6(2), 117(1987). |
| 4) | Y. Ikarashi, et al., Contact Dermatitis, 28, 77(1993). |
| 5) | J. Momma, et al., Toxicol., 126, 75(1998). |
| 6) | T. Matsuzawa, H. Inoue ed., "Biological Reference Data on CD(SD)IGS Rats-1998," CD(SD)IGS Study Group, Yokohama, 1998. |
| 7) | T. Matsuzawa, H. Inoue ed., "Biological Reference Data on CD(SD)IGS Rats-1999," CD(SD)IGS Study Group, Yokohama, 1999, p. 49, 111. |
| 8) | 斉藤浩司ら,薬学雑誌,100(2), 126(1980). |
| 9) | G. Scansetti, et al., Int. Arch. Occup. Environ. Health, 59, 537(1987). |
| 10) | G. Scansetti, et al., Med. Lav., 74, 464(1983). |
| 11) | C. Jackson, et al., J. Lab. Clin. Med., 84(3), 357(1974). |
| 12) | 谷本義文,"血液学―ヒトと動物との接点―,"清至書院,東京,1982. |
| 13) | 高橋道人監訳,"毒性病理学の基礎,"ソフトサイエンス社,東京,1992. |
| 連絡先 | |||
| 試験責任者: | 森村智美 | ||
| 試験担当者: | 一原佐知子,加藤博康,関 剛幸,古谷真美,永田伴子 | ||
| (財)食品薬品安全センター秦野研究所 | |||
| 〒257-8523 神奈川県秦野市落合729-5 | |||
| Tel 0463-76-8033 | Fax 0463-82-9627 | ||
| Correspondence | ||||
| Authors: | Tomomi Morimura(Study Director) Sachiko Ichihara, Hiroyasu Kato, Takayuki Seki, Mami Furuya, Tomoko Nagata | |||
| Hatano Research Institute, Food and Drug Safety Center | ||||
| 729-5 Ochiai, Hadano-shi, Kanagawa, 257-8523, Japan | ||||
| Tel +81-463-82-4751 | Fax +81-463-82-9627 | |||